Aktualizovaná doporučení ASAS‑EULAR pro léčbu axiální spondyloartritidy z roku 2016 – komentář
Souhrn:
Axiální spondyloartritida (axSpA) je chronické zánětlivé onemocnění, které postihuje páteřní struktury, ale může se projevovat i v oblasti periferních kloubů a entezí a dále v podobě mimokloubních manifestací. Nová doporučení pro léčbu axSpA byla prezentována na kongresu Americké revmatologické společnosti (ACR) ve Washingtonu v roce 2016 a publikována v roce 2017. Zatímco starší doporučení byla vytvořena pracovní skupinou Evropské ligy proti revmatismu (EULAR), při tvorbě nových guidelines spolupracovala skupina Mezinárodní společnosti pro hodnocení spondyloartritid (ASAS). Další změnou oproti starším doporučením je fakt, že zatímco předchozí se týkají pouze ankylozující spondylitidy, nová vycházejí z nového konceptu axSpA. Podle něj se axSpA dělí na tzv. radiografické SpA, u nichž mají pacienti průkaznou sakroiliitidu na RTG a splňují tak tzv. newyorská klasifikační kritéria pro ankylozující spondylitidu, a dále na skupinu tzv. non‑radiografických SpA, kdy je sakroiliitida prokazatelná na MR nebo pacienti splňují další kritéria pro tuto formu onemocnění. Doporučení pro léčbu axSpA obsahují pět nadřazených principů a 13 následných doporučení. Nový koncept pro celou skupinu axSpA tak umožňuje časné stanovení diagnózy a rychlé zahájení léčby. Při vedení terapie jsou také uplatňovány nové strategie, především princip léčby k cíli (treat-to-target).
Key words: axial spondyloarthritis, ankylosing spondylitis, guidelines, treatment.
Summary:
Axial spondyloarthritis (axSpA) is a chronic inflammatory disorder affecting the spinal structures. However, it can also manifest in peripheral joints or entheses and in extra‑articular tissues. New guidelines for the treatment of axSpA were presented at the meeting of American College of Rheumatology (ACR) in Washington in 2016 and they were published in 2017. While the older guidelines were created by a working group of European League against Rheumatism (EULAR), the new ones were formulated in cooperation with a group of Assessment of SpondyloArthritis international Society (ASAS). Another change consists of the fact that while the older guidelines only deal with ankylosing spondylitis, the new ones are based on the concept of axSpA. According to this concept, axSpA can be divided into so called radiographic SpA, formed by patients with radiographically proven sacroiliitis thus fulfilling co called New York classification criteria, and non‑radiographic SpA with sacroiliitis only detectable by MR or through the fulfillment of other criteria. Guidelines for the treatment of axSpA contain 5 basic principles and 13 subsequent recommendations. The new concept for the entire axSpA group makes it possible to diagnose and treat the corresponding illness in a timely manner. Novel strategies are also implemented during the therapy, including the treat‑to‑target principle.
Úvod
Axiální spondyloartritida (axSpA) je chronické zánětlivé onemocnění, které postihuje páteřní struktury ve smyslu sakroiliitidy a spondylitidy, kromě toho lze jeho projevy nalézt i v oblasti periferních kloubů a entezí. Může mít rovněž celou řadu mimokloubních manifestací v oblasti očí, kůže, gastrointestinálního traktu, srdce, plic atd. Jedná se tedy o systémové zánětlivé revmatické onemocnění. Axiální spondyloartritida dnes zahrnuje široké spektrum pacientů, přičemž u některých jedinců se může projevovat pouze mírnými potížemi při žádné nebo minimální léčbě, na druhé straně se u některých pacientů manifestuje jako chronické invalidizující onemocnění, které kromě bolestí a ztuhlosti páteře vede často k těžkému funkčnímu postižení.
Evropská liga proti revmatismu
(European League Against Rheumatism, EULAR) vydává své guidelines
pro léčbu nejčastějších revmatických onemocnění v intervalu
3‒5 let, neboť při rychlém rozvoji znalostí o podstatě
chorob i při vývoji nových léčiv se průběžně mění
názory na terapeutické strategie. Doporučení EULAR pro léčbu
ankylozující spondylitidy (AS) byla vydána v roce 2006
a jejich inovace v roce 2011. Česká revmatologická
společnost ČLS JEP vydala doporučení pro léčbu AS v roce
2012 [1]. Nová doporučení pro léčbu axSpA byla prezentována
na kongresu Americké revmatologické společnosti (American
College of Rheumatology, ACR) ve Washingtonu v roce
2016 a publikována v roce 2017 [2]. Zatímco starší
doporučení byla vytvořena pracovní skupinou EULAR, při tvorbě
nových doporučení spolupracovala skupina Mezinárodní společnosti
pro hodnocení spondyloartritid (Assessment of SpondyloArthritis
international Society, ASAS), což je akademické sdružení předních
odborníků věnujících se výzkumu SpA. Další změnou oproti
starším doporučením je fakt, že zatímco předchozí se týkají
pouze AS, nová vycházejí z nového konceptu axSpA. Podle ASAS
dělíme aktuálně axSpA na skupinu tzv. radiografických SpA,
u nichž mají pacienti průkaznou sakroiliitidu na RTG
a splňují tak tzv. newyorská klasifikační kritéria pro AS,
a dále na skupinu tzv. non radiografických SpA, kdy
je sakroiliitida prokazatelná na MR nebo pacienti splňují
kritéria pro tuto formu onemocnění [3] (obr. 1). Dlouhodobě je vedena diskuse o tom, zda uvedené
jednotky jsou dvě různé choroby, v poslední době se však
odborníci kloní k názoru, že se jedná o dvě stadia
jednoho onemocnění [4‒6]. Studie s biologickými léky
prokázaly jejich obdobnou účinnost u obou forem onemocnění,
takže nová doporučení jsou společná pro obě jednotky.
onemocnění [3] (obr. 1). Dlouhodobě je vedena diskuse o tom, zda uvedené
jednotky jsou dvě různé choroby, v poslední době se však
odborníci kloní k názoru, že se jedná o dvě stadia
jednoho onemocnění [4‒6]. Studie s biologickými léky
prokázaly jejich obdobnou účinnost u obou forem onemocnění,
takže nová doporučení jsou společná pro obě jednotky.
Guidelines pro léčbu axSpA obsahují pět nadřazených principů a 13 následných doporučení (tab. 1).
Nadřazené principy
První nadřazený princip poukazuje na to, že axSpA je závažné onemocnění, které může mít řadu projevů v oblasti pohybového aparátu i v oblasti extraartikulárních manifestací, vyžaduje proto multidisciplinární přístup.
Druhý
nadřazený princip hovoří o tom, že primárním cílem léčby
axSpA je zlepšení kvality života pacienta, tedy terapie má
především zmírňovat symptomy a potlačovat zánět, dále
má zkvalitňovat, nebo alespoň udržovat funkční schopnost
pacienta a zachovat tak jeho zapojení ve společenském
životě. V neposlední řadě má léčba vést i k zamezení
strukturálního poškození, ačkoliv v případě anti TNFα
(tumor nekrotizující faktor alfa) terapie klinické studie
prokazují zpomalení rentgenové progrese až po několika
letech podávání. Nadějné jsou v tomto směru výsledky
studií s inhibitory interleukinu 17 (IL 17) [7].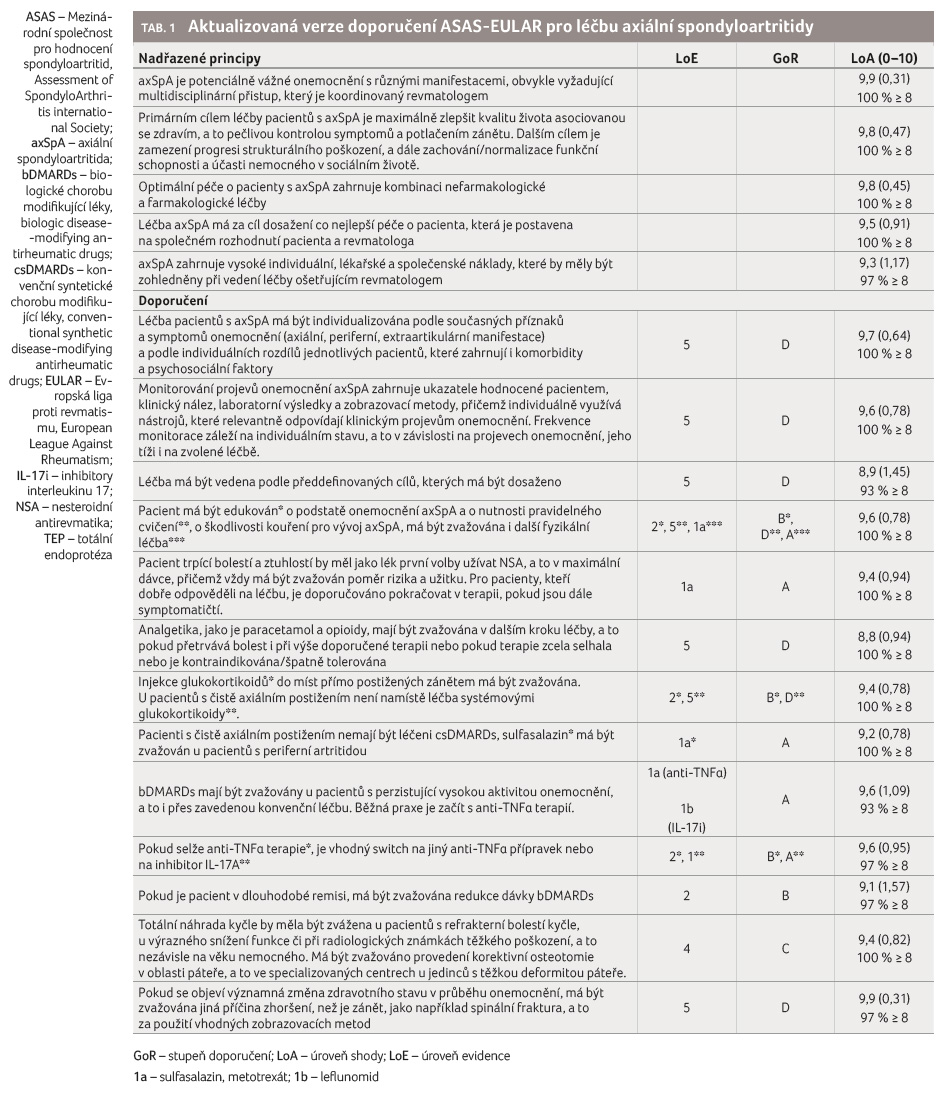
Třetí nadřazený princip zdůrazňuje nutnost kombinovat nefarmakologickou i farmakologickou léčbu. Pravidelné cvičení a rehabilitace jsou základem terapie každé axSpA, a měly by proto být součástí první linie léčby [8‒9].
Čtvrtý nadřazený princip hovoří o tom, že pacientům by měla být poskytnuta nejlepší dostupná péče, a to včetně biologické terapie, pokud je tato indikována. Léčba má být vždy vedena na základě sdíleného rozhodnutí o terapii mezi pacientem a lékařem.
Pátý nadřazený princip se zabývá problematikou velkých medicínských i společenských investic, které musejí být vynakládány při terapii pacientů s axSpA [10]. To by mělo být zohledněno například při výběru biologického přípravku, kdy může být volen levnější biosimilární lék namísto dražšího originálního biologika.
Doporučení
Doporučení 1 se zabývá tím, že léčba pacientů s axSpA by měla být individualizována podle toho, zda nemocný trpí čistě axiálním postižením, nebo zda má i projevy ve smyslu periferní artritidy, entezitidy či daktylitidy. Například u pacientů s periferní artritidou je indikováno podávání sulfasalazinu, zatímco u pouze axiálního postižení je léčba sulfasalazinem neúčinná [11]. Účinnost metotrexátu v terapii periferní SpA nebyla nikdy prokázána [12]. U jedinců se současným postižením ve smyslu idiopatického střevního zánětu je indikováno podávání protilátek proti TNFα, zatímco etanercept jakožto blokátor receptoru pro TNFα je pro pacienty se střevním postižením nevhodný. Také nesteroidní antirevmatika (NSA), která jsou u jinak zdravých jedinců indikována jako lék první volby, jsou v případě pacientů s kardiálním postižením nebo při léčbě antikoagulancii kontraindikována. Podobně anti TNFα terapie není vhodná u nemocných s kardiálním selháním III.‒IV. stadia.
Doporučení
2 zdůrazňuje nutnost monitorace aktivity axSpA, a tím
i hodnocení výsledků terapie. Monitorace by měla vždy
zahrnovat jak ukazatele hodnocené pacientem (bolest, ztuhlost,
celkový pocit zdraví), tak i laboratorní vyšetření
a zobrazovací metody. Frekvence monitorace závisí na fázi
onemocnění, je častější u pacientů s vysokou
aktivitou a tam, kde je léčba zahajována nebo měněna. Pro
hodnocení aktivity užíváme různé dotazníky (BASDAI –
Bath Ankylosing Spondylitis Disease Activity Index), nověji
i složitější skóre ASDAS (Ankylosing Spondylitis Disease
Activity Score) (obr. 2).
Dále jsou důležité dotazníky hodnotící kvalitu života
(EuroQol, HAQ). Rentgenové hodnocení není nutné provádět
častěji než ve dvouletých intervalech.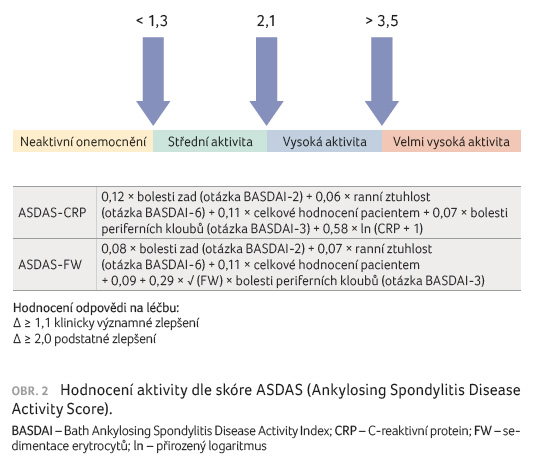
Doporučení 3 hovoří o tom, že léčba axSpA by měla vždy směřovat k předem stanovenému cíli. Jedná se o tzv. princip léčby k cíli (treat-to-target, T2T). Cíl by měl být stanoven před zahájením terapie na podkladě dohody mezi pacientem a lékařem. Aktivita axSpA by měla být hodnocena v pravidelných intervalech podle vybraných indexů (BASDAI, ASDAS), a pokud není dosaženo terapeutického cíle, měla by být léčba adjustována. Remise axSpA nebyla zatím přesně definována ‒ cílem dosaženého stavu tedy může být například ASDAS < 1,3 (nízká aktivita) [13].
Doporučení 4 zdůrazňuje důležitost edukace pacientů. Na prvním místě je zdůrazňována motivace pacienta ke každodennímu cvičení, přičemž vhodná je kombinace cvičení domácího a skupinového. Nebylo dosud prokázáno, že by měl větší efekt pohyb ve vodě v porovnání s pohybem na suchu. V doporučení se dále zdůrazňuje nutnost zanechat kouření. V několika studiích bylo prokázáno, že kouření je jedním z důležitých rizikových faktorů při progresi axSpA [14].
Doporučení 5 se zabývá bolestí a ztuhlostí u nemocných s axSpA. Lékem první volby jsou NSA, která by v případě potřeby měla být aplikována v maximální možné dávce, přičemž vždy musejí být zohledněny rizikové faktory, především gastrointestinální a kardiální. U každého pacienta musí být zvažován poměr účinku a rizika podávání. V případě rizika vzniku NSA gastropatie mají být podávány inhibitory protonové pumpy. Starší studie prokazovaly, že kontinuální podávání NSA zpomaluje rentgenovou progresi [15], novější studie toto ovšem nepotvrzují [16]. Nicméně v současnosti se doporučuje, aby pacienti, kteří dobře odpovídají na léčbu NSA, avšak zůstávají symptomatičtí, uvedenou léčbu užívali kontinuálně. U nemocných s nižší aktivitou choroby je doporučeno podávat NSA dle potřeby.
Doporučení 6 hovoří o užívání analgetik (například paracetamolu) nebo opioidů při léčbě reziduální bolesti po selhání léčby NSA, a/nebo pokud je tato kontraindikována. Slabá i silná analgetika se doporučují i v případě, pokud příčinou bolesti není pouze zánět, ale i jiný důvod (například kompresivní fraktura nebo mechanická bolest). V případě potřeby je možno k zesílení účinku analgetika s NSA kombinovat.
Doporučení 7 se zabývá použitím glukokortikoidů (GK) u axSpA. Glukokortikoidy je doporučováno podávat pouze lokálně do místa zánětu (enteze, šlachy, ev. klouby). Nebyl nikdy prokázán efekt systémového podávání GK při výhradně axiálním postižení, naopak jejich užívání vede vzhledem k nežádoucím účinkům k poškozování pacienta (např. akcentace vzniku osteoporózy). Připouští se pouze krátkodobé podávání systémových GK u aktivní periferní polyartritidy.
Doporučení 8 se nemění oproti doporučením z dřívějších let, neboť nebylo dosud prokázáno, že by jakýkoliv konvenční syntetický chorobu modifikující lék (synthetic disease modifying antirheumatic drug, sDMARD) byl účinný v léčbě čistě axiální SpA, a to včetně metotrexátu. Sulfasalazin lze použít u forem s periferní artritidou. Nebylo prokázáno ani to, že by kombinace konvenčního chorobu modifikujícího léku (conventional synthetic disease modifying antirheumatic drug, csDMARD) s biologickým chorobu modifikujícím lékem (biologic disease modifying antirheumatic drug, bDMARD) byla účinnější než monoterapie pomocí bDMARD. Přesto například ze záznamů registru biologické léčby v ČR ATTRA vyplývá, že kombinací csDMARD a bDMARD je při zařazení do tohoto registru léčena téměř polovina pacientů.
Doporučení 9 se týká případů, kdy selhala konvenčně zavedená léčba NSA, ev. v případě periferní artritidy byla nedostatečně účinná léčba sulfasalazinem, přičemž tento by měl být podáván alespoň tři měsíce v dávce 3 g denně. V doporučení týkajícím se použití biologické léčby ještě zaznívá, že lékem první volby jsou inhibitory anti TNFα. V době tvorby doporučení ještě nebyly zveřejněny výsledky studií, které prokazují efekt léčby inhibitorem IL 17A (sekukinumabem) u biologicky naivních pacientů [17,18], v současnosti je však dle SPC terapie tímto přípravkem možná již v první linii.
Doporučení 10 se zabývá případy, u nichž došlo k selhání biologické léčby. Z lékových studií a registrů vyplývá, že při podávání biologické léčby v první linii je dosaženo odpovědi u 70‒80 % pacientů. Účinnost druhého přípravku anti TNFα je dobrá, avšak o něco horší než při podávání prvního přípravku anti TNFα. Také u sekukinumabu byla prokázána účinnost léčby v druhé linii. Doporučení České revmatologické společnosti jsou naopak o něco přísnější v porovnání s doporučeními EULAR v tom, že při zahájení podávání bDMARD vyžadují při definici aktivity vedle přítomnosti BASDAI > 4 rovněž současnou hodnotu C reaktivního proteinu > 10 mg/l [1].
Doporučení 11 se věnuje problematice strategie léčby u pacientů, u nichž při ní bylo dosaženo dlouhodobé remise onemocnění nebo stavu nízké aktivity choroby. Termín dlouhodobá remise je definován jako remise zachycená ve dvou následujících vyšetřeních, která mají mezi sebou odstup alespoň půl roku. Obecně se nedoporučuje ukončení podávání biologické léčby, neboť u značné části pacientů dochází po jejím přerušení k reaktivaci onemocnění. Naopak bylo prokázáno, že snížení dávky nebo prodloužení intervalu při aplikaci biologické léčby vede u značné části nemocných k udržení remise [19].
Doporučení 12 se zabývá chirurgickou léčbou u pacientů s AS, přičemž indikace k provedení totální náhrady kyčelního kloubu byla již v minulosti přesně definována. V doporučení se zdůrazňuje, že pro tuto indikaci není žádné věkové omezení. Nově je zmiňována spinální osteotomie, která by ovšem vzhledem k náročnosti výkonu měla být prováděna pouze ve speciálních centrech. Je určena především pro pacienty, kteří mají omezený výhled před sebe z důvodu rozsáhlé kyfotické deformity páteře.
Doporučení 13 hovoří o situacích, kdy dojde u pacienta k náhlému prudkému zhoršení bolestí páteře. V tomto případě je nutné myslet především na nově vzniklou frakturu obratlů, neboť u nemocných s axSpA je riziko vzniku fraktury zvýšeno vzhledem k chronickému zánětlivému stavu a ke snížené mobilitě, proto tito jedinci často trpí osteoporózou. U pacientů s axSpA je nedostatečné vylučovat frakturu provedením pouhého standardního RTG snímku, ale je nutné využívat podrobnější zobrazovací metody, jako je CT nebo MR.
Závěr
Zatímco předcházející doporučení z roku 2011 se týkala pouze léčby AS, nově publikované postupy jsou rozšířeny na celou skupinu axSpA. Nový koncept pro komplex axSpA tak umožňuje časné stanovení diagnózy a rychlé zahájení léčby. Při vedení terapie jsou také uplatňovány nové strategie léčby [13,20,21], především princip léčby k cíli. V případě této strategie je využívána též nová definice cílů léčby pomocí kritéria ASDAS. Od posledních doporučení jsou k dispozici výsledky klinických studií a zejména data z registrů biologické léčby, která potvrzují dlouhodobou účinnost biologik při terapii axSpA. Nově jsou při léčbě axSpA používány kromě inhibitorů TNFα i biologické léky s jiným mechanismem účinku, konkrétně inhibitor IL 17A.
Seznam použité literatury
- [1] Pavelka K. Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy. Čes Revmatol 2012; 20: 4‒11.
- [2] van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS‑EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76: 78‒91.
- [3] Rudwaleit M, Landewé R, van der Heijde D, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part I): classification of paper patients by expert opinion including uncertainty appraisal. Ann Rheum Dis 2009; 68: 770–776.
- [4] Poddubnyy D, Sieper J. Similarities and differences between nonradiographic and radiographic axial spondyloarthritis: a clinical, epidemiological and therapeutic assessment. Curr Opin Rheumatol 2014; 26: 377‒383.
- [5] Poddubnyy D, Rudwaleit M, Heibel H, et al. Effect of non‑steroidal anti‑inflammatory drugs on radiographic spinal progression in patients with axial spondyloarthritis: result from the German Spondyloarthritis Inception Cohort. Ann Rheum Dis 2012; 71: 1616‒1622.
- [6] Sieper J, van der Heijde D. Review: nonradiographic axial spondyloarthritis: new definition of an old disease? Arthritis Rheum 2013; 65: 543‒551.
- [7] Braun J, Baraliakos X, Deodhar S, et al. Effect of secukinumab on clinical and radiographic outcomes in ankylosing spondylitis: 2‑year results from the randomised phase III MEASURE 1 study. Ann Rheum Dis 2017; 76: 1070‒1077.
- [8] Stasinopoulus D, Papadopoulus K, Lamnisos D, Stergioulas A. LLLT for the management of patients with ankylosing spondylitis. Lasers Med Sci 2016; 31: 459‒469.
- [9] Sile Karamanglioglu D, Aktas I, Ozkan FU, et al. Effectiveness of ultrasound treatment applied with exercise therapy on patients with ankylosing spondylitis: a double‑blind, randomised, placebo controlled trial. Rheumatol Int 2016; 36: 653‒651.
- [10] Kasselheim AS, Avorn J, Sarpatwari A. The high cost of precription drugs in the United States: origins and prospects for reform. JAMA 2016; 316: 858‒871.
- [11] Chen J, Liu C. Sulfasalazine for ankylosing spondylitis. Cochrane Database Syst Rev 2005; 2: CD004800.
- [12] Chen J, Liu C. Methotrexate for ankylosing spondylitis. Cochrane Database Syst Rev 2006; 4: CD004524.
- [13] Smolen JS, Schöls M, Braun J, et al. Treating axial spondyloarthritis and peripheral spondyloarthritis especially psoriatic arthritis to target: 2017 update of recommendations by an international task force. Ann Rheum Dis 2018; 77: 3‒17.
- [14] Deminger A, Klingberg E, Geijer M, et al. A five‑year prospective study of spinal radiographic progression and its predictors in men and women with ankylosing spondylitis. Arthritis Res Ther 2018; 20: 162.
- [15] Wanders A, van der Heijde D, Landewé R, et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomised clinical trials. Arthritis Rheum 2005; 52: 1756‒1765.
- [16] Sieper J, Listing J, Poddubnyy D, et al. Effect of continuous versus on‑demand treatment of ankylosing spondylitis with diclofenac over 2 years on radiographic progresion of the spine: result from a randomised multicentre trial (ENRADAS). Ann Rheum Dis 2016; 75: 1438‒1443.
- [17] Baeten D, Sieper J, Braun J, et al. Secukinumab, an Interleukin‑17A Inhibitor, in Ankylosing Spondylitis. N Engl J Med 2015; 373: 2534‒2548.
- [18] Baraliakos X, Borah B, Braun J. Long‑term effects of secukinumab on MRI findings in relation to clinical efficacy in subjects with active ankylosing spondylitis: an observational study. Ann Rheum Dis 2016; 75: 408‒412.
- [19] Závada J, Uher M, Sisol K, et al. A tailored approach to reduce dose of anti‑TNF drugs may be equally effective, but substantially less costly than standard dosing in patients with ankylosing spondylitis over 1 year: a propensity score‑matched cohort study. Ann Rheum Dis 2016; 75: 96‒102.
- [20] van Mens L, Marleen GH, van de Sande, Baeten D. New treatment paradigms in spondyloarthritis. Curr Opin Rheumatol 2018; 30: 79‒86.
- [21] Terenzi R, Monti S, Tesei G, Carli L. One year in review 2017: spondyloarthritis. Clin Exp Rheumatol 2018; 36: 1‒14.