Algoritmus léčby chronické hepatitidy C
Souhrn:
Významný pokrok v léčbě chronické virové hepatitidy C v posledních letech odstartoval převratnou, novou éru léčby tohoto onemocnění a umožnil zhruba po dvou desetiletích opustit injekční aplikaci interferonu a posléze pegylovaného interferonu s novou možností plně perorální léčby. Tato léčba má oproti předchozí terapii minimální množství nežádoucích účinků, je daleko lépe snášena, umožňuje kratší dobu podávání, a především vede k signifikantnímu zvýšení šance na vyléčení, která v současné době již u většiny testovaných a nyní používaných režimů přesahuje 90 %. Klíčovými faktory, které rozhodují o typu a délce trvání léčby a její účinnosti, jsou nyní především stadium jaterní fibrózy (či přítomnost cirhózy), genotyp viru a eventuálně typ předchozí neúspěšné léčby. Další výhodou je možnost neinvazivní detekce stadia jaterní cirhózy (sérologicky či elastograficky) bez nutnosti provedení jaterní biopsie. Nezbytným předpokladem úspěšného boje s tímto onemocněním s následným pozitivním ovlivněním morbidity a mortality na jaterní onemocnění je kromě vysoce účinné léčby také důsledný screening rizikových skupin a aktivní vyhledávání infikovaných pacientů.
Key words:
hepatitis C – cirrhosis – direct acting antivirals – simeprevir – sofosbuvir – daclatasvir – paritaprevir – dasabuvir – ombitasvir – ritonavir – interferon-free treatment.
Summary:
Significant development in the treatment of chronic virus hepatitis type C in the last years has started a new revolutionary era of therapy and made it possible – after some two decades – to give up the injection application of interferon or pegylated interferon, replacing these with fully oral treatment. The current therapy, as compared to the former one, has minimum side effects, is tolerated much better, can be used for a shorter period of time and, last but not least, hugely increases the chances at cure. In most tested and already used therapeutic regimens, the likelihood of cure is over 90 per cent. Key factors guiding decisions about the type and length of therapy as well as its effectiveness are the stage of liver fibrosis (or cirrhosis), genotype of the virus, and – possibly – the type of previous unsuccessful treatment. Another advantage corresponds to the possibility of non invasive detection of liver cirrhosis stage (using serology or elastography), not requiring liver biopsy. The prerequisites of successful fight against this disease and of positive shifts in morbidity and mortality are not only the highly effective therapy but also meticulous screening in at risk groups and active search for infected patients.
Úvod
Globálně je virem hepatitidy C (hepatitis C virus, HCV) infikováno asi 170 milionů osob, tedy zhruba 3 % populace, a komplikace spojené s hepatitidou C jsou zodpovědné za 500 000 úmrtí ročně [1]. V Evropě se počet nemocných odhaduje na 2–5 milionů HCV pozitivních osob s prevalencí 0,5–1,5 % [2]. V České republice se odhaduje prevalence na 0,6 % populace, což činí minimálně 60 000 pacientů [2]. V současné době se počet nově hlášených případů infekce HCV pohybuje kolem 800–880 nemocných ročně [3].
Virus hepatitidy C má několik genotypů, které se označují čísly 1–6, některé z nich se dále dělí do subtypů (např. 1a, 1b). Jednotlivé genotypy mají odlišnou geografickou distribuci, především však mají odlišnou citlivost na protivirovou léčbu [4]. V České republice se vyskytují v podstatě dva genotypy viru HCV, a to genotyp 1 a genotyp 3 [2].
Výskyt genotypu viru HCV (počet infikovaných v %) [5]:
- Genotyp 1 (GT1): 66 %
- Subtyp 1a: 30 %
- Subtyp 1b: 70 %
- Genotyp 2 (GT2): 1 %
- Genotyp 3 (GT3): 31 %
Klinický význam HCV a význam eradikace viru
U 70–80 % infikovaných osob přechází onemocnění do chronicity a vede k rozvoji chronické hepatitidy C, která u části nemocných vede po určité době (většinou asi 20 let) k jaterní cirhóze s rizikem rozvoje portální hypertenze, hepatocelulárního karcinomu a jaterního selhání s nutností transplantace jater [5] (graf 1). V charakteru a rychlosti progrese onemocnění hrají zásadní roli faktory virové (genotyp viru) i faktory pacienta (vyšší rychlost progrese při abúzu alkoholu, obezitě, metabolickém syndromu, vyšším věku v době infik![Graf 1 Algoritmus infekce HCV; podle [5] – Barrera, et al., 1995.](https://www.remedia.cz/photo-a-30514---.jpg) ace) [6,7]. Průměrná doba progrese onemocnění do vzniku cirhózy je zhruba 20 let a odhadovaný počet pacientů s cirhózou po dvaceti letech je 16 % [8]. Od rozvoje cirhózy jater dosahuje pětileté riziko jaterní dekompenzace 18 % a riziko vzniku hepatocelulárního karcinomu (HCC) 7 % [9]. Po první atace dekompenzace jaterní cirhózy (ascites, krvácení při portální hypertenzi, jaterní encefalopatie, ikterus) činí riziko úmrtí v následujícím roce 15–20 % [10].
ace) [6,7]. Průměrná doba progrese onemocnění do vzniku cirhózy je zhruba 20 let a odhadovaný počet pacientů s cirhózou po dvaceti letech je 16 % [8]. Od rozvoje cirhózy jater dosahuje pětileté riziko jaterní dekompenzace 18 % a riziko vzniku hepatocelulárního karcinomu (HCC) 7 % [9]. Po první atace dekompenzace jaterní cirhózy (ascites, krvácení při portální hypertenzi, jaterní encefalopatie, ikterus) činí riziko úmrtí v následujícím roce 15–20 % [10].
Chronická virová hepatitida C představuje v současné době jediné plně vyléčitelné chronické virové onemocnění (primární cíl léčby HCV). Za plné vyléčení označujeme stav tzv. setrvalé virologické odpovědi (sustained viral response, SVR), což znamená negativní viremii (měřeno metodou PCR HCV RNA – detekce RNA viru hepatitidy C pomocí polymerázové řetězové reakce) 12 týdnů (SVR12), resp. 24 týdnů (SVR24) po léčbě. Jednoznačným cílem je tedy eradikace viru a jeho eliminace z organismu. V současné době by minimálním standardem [11,12] měla být léčba trojkombinací zahrnující pegylovaný interferon (PEG‑IFN) s ribavirinem (RBV) a přímo působící antivirotikum (direct acting antiviral, DAA).
Eradikace HCV (dosažení SVR) vede k zásadnímu snížení rizika jaterní dekompenzace a HCC a dále k regresi fibrózy a cirhózy a k významnému zlepšení prognózy pacientů, kdy se celkové přežití vyléčených cirhotiků velmi blíží životní prognóze běžné populace [13,14]. Naprosto zásadně se po dosažení SVR mění prognóza pacientů s pokročilou jaterní fibrózou či s cirhózou. Riziko úmrtí z jaterních příčin je po pěti letech sledování u pacientů se SVR 4 %, zatímco u pacientů bez setrvalé virologické odpovědi (non‑SVR) dosahuje 12,9 %, riziko rozvoje jaterní insuficience představuje mezi těmito dvěma skupinami nemocných poměr 0 % vs. 13,3 % a riziko rozvoje HCC 9,2 % vs. 13,1 %; SVR je spojena s regresí jaterní cirhózy v 50–60 % případů [15–18].
Screening nemocných s virovou hepatitidou C
V době vysoce účinné léčby, jejíž účinnost přesahuje 90 % vyléčených, je šance na kompletní eradikaci infekce HCV v populaci vysoká. V současnosti s![Graf 2 Počet infi kovaných, diagnostikovaných a léčených pacientů ve vybraných zemích EU v roce 2011; podle [19] – Brown, 2013.](https://www.remedia.cz/photo-a-30515---.jpg) e však zdá, že hlavním problémem dosažení tohoto cíle (kromě finančních nákladů) je efektivní identifikace HCV pozitivních pacientů. Jak vyplývá z analýzy dat z vybraných evropských zemí i z USA z roku 2011 (graf 2) [19], chronická infekce je diagnostikována asi u 20 % všech infikovaných pacientů a posléze je léčena zhruba u 25 % z těchto pacientů (to odpovídá i rozdílu mezi odhadovanou prevalencí a skutečně diagnostikovanými případy infekce HCV). Celkem je tedy léčeno kolem 5–10 % všech infikovaných. K dosažení kontroly nad infekcí tedy nestačí pouze implementovat vysoce účinnou léčbu do klinické praxe, je nutné rovněž vyvinout velkou snahu v oblasti diagnostiky pacientů. Základní příčinou omezené diagnostiky HCV je dlouhodobé (několik desetiletí trvající) bezpříznakové obd
e však zdá, že hlavním problémem dosažení tohoto cíle (kromě finančních nákladů) je efektivní identifikace HCV pozitivních pacientů. Jak vyplývá z analýzy dat z vybraných evropských zemí i z USA z roku 2011 (graf 2) [19], chronická infekce je diagnostikována asi u 20 % všech infikovaných pacientů a posléze je léčena zhruba u 25 % z těchto pacientů (to odpovídá i rozdílu mezi odhadovanou prevalencí a skutečně diagnostikovanými případy infekce HCV). Celkem je tedy léčeno kolem 5–10 % všech infikovaných. K dosažení kontroly nad infekcí tedy nestačí pouze implementovat vysoce účinnou léčbu do klinické praxe, je nutné rovněž vyvinout velkou snahu v oblasti diagnostiky pacientů. Základní příčinou omezené diagnostiky HCV je dlouhodobé (několik desetiletí trvající) bezpříznakové obd obí po nákaze a dále fakt, že hlavní cestou přenosu HCV v současnosti je parenterální aplikace drog, přičemž většina aktivních uživatelů drog není v době jejich abúzu motivována k vyšetření.
obí po nákaze a dále fakt, že hlavní cestou přenosu HCV v současnosti je parenterální aplikace drog, přičemž většina aktivních uživatelů drog není v době jejich abúzu motivována k vyšetření.
V roce 2014 byla publikována studie [20], která analyzovala vývoj počtu nových případů infekce HCV do roku 2030, morbidity a mortality na infekci HCV v případě a) aktuální epidemiologické a léčebné situace, b) pouhé implementace vysoce účinné léčby do klinické praxe, c) kombinace výrazně vyššího záchytu nových případů a účinné léčby. Pro ČR je zřejmé, že při účinné léčbě dojde k velmi mírnému poklesu počtu nových případů HCV, ale mortalita a morbidita na HCV bude do roku 2030 dále výrazně narůstat (cca o 50–60 %). K tomu, aby se tento trend obrátil a mortalita klesla o 80 %, je podle této analýzy nutné učinit následující opatření:
- zvýšit počet ročně diagnostikovaných případů z 800 na 4 050 do roku 2030;
- zvýšit počet ročně léčených pacientů z 880 na 3 700 do roku 2030;
- umožnit účinnou léčbu bez omezení (věkem, stupněm fibrózy).
Kromě dostupnosti účinné léčby je nutné vyvinout maximální snahu při diagnostice nových případů HCV. Především je nutné sérologicky (anti‑HCV protilátky) vyšetřit všechny osoby z rizikových skupin (tab. 1) a vždy vyšetřit anti‑HCV protilátky u pacienta s jakoukoliv (i s velmi mírně) zvýšenou aktivitou aminotransferáz.
Vyšetření pacienta před léčbou
Je nezbytné potvrdit přítomnost virové hepatitidy C (pozitivní PCR HCV RNA) a určit genotyp viru (rozhoduje stále o typu léčby, o její délce, o šanci na dosažení SVR). V interferonové éře představovala řada konkomitantních onemocnění potenciální či absolutní kontraindikaci léčby s využitím interferonu (IFN), a bylo tedy nutné pečlivé anamnestické a klinické (laboratorní) vyšetření s ohledem na podání IFN. Toto stále platí v případě, že uvažujeme o trojkombinační léčbě s využitím IFN, RBV a DAA. Nutná vyšetření přehledně ukazuje tab. 2.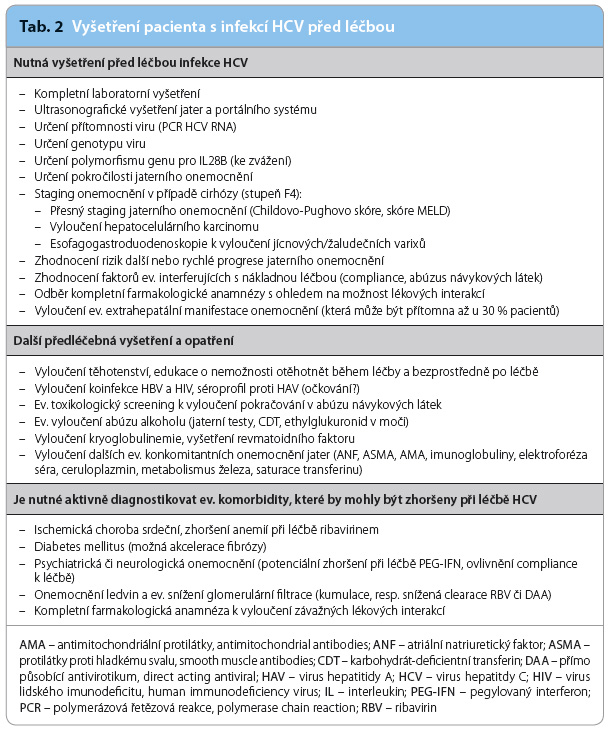
Genotyp viru určuje i v současné době typ a délku léčby. V době interferonových režimů léčby byl genotyp 1 považován za nejobtížněji léčitelný s nejnižší šancí na SVR (byl pokládán za negativní prognostický faktor před léčbou). Většina současných léčebných režimů bez využití interferonu (tzv. IFN‑free) dosahuje při léčbě pacientů s genotypem 1 viru HCV vysokých SVR (více než 90 %). V současné době se jeví jako velmi problematický a závažný genotyp 3 viru HCV (jehož incidence má v ČR navíc vzestupnou tendenci), neboť vede k rychlé progresi fibrózy a cirhózy a k vyššímu riziku rozvoje HCC a je hůře léčitelný podáváním přípravků ze skupiny DAA než ostatní genotypy [21,22].
Léčba infekce HCV novými IFN‑free režimy je velmi nákladná. Na druhou stranu se při použití této léčby výrazně zjednodušuje celý předléčebný algoritmus vyšetření, monitorace a opatření během léčby (která je významně kratší), což naopak vede k úspoře finančních nákladů. V případě IFN‑free léčby HCV je nutno pouze:
- přesně diagnostikovat HCV,
- určit genotyp viru,
- přesně stanovit klinické stadium (staging) jaterní fibrózy a případně stadium jaterní cirhózy,
- zhodnotit compliance pacienta k léčbě,
- vyloučit graviditu,
- odebrat přesnou farmakologickou anamnézu s ohledem na lékové interakce.
- vyšetřovat polymorfismus genu pro interleukin IL28B, který kóduje IFNλ‑3,
- extenzivně dovyšetřovat ev. komorbidity (léčba DAA nemá v podstatě kontraindikace) [11],
- aktivně řešit řadu nežádoucích účinků během léčby (DAA prakticky nemají závažnější nežádoucí účinky),
- monitorovat dynamiku viremie během léčby (není nutné znovu PCR HCV RNA).
Staging jaterní fibrózy
Zásadní součástí vyšetření před léčbou HCV je stanovení klinického stadia jaterní fibrózy. Stadium jaterní fibrózy, ev. přítomnost cirhózy, rozhoduje jak o indikaci, tak i o typu léčby (jak o typu IFN léčby a její délce, tak i o typu IFN‑free léčby a její délce a o nutnosti ev. přidání RBV do léčebné kombinace). Přítomnost či nepřítomnost cirhózy stále rozhoduje u řady léčebných režimů o šanci na vyléčení (SVR). V neposlední řadě slouží stanovení pokročilosti jaterního onemocnění k upřednostnění vysoce účinné (a v současnosti velmi nákladné, a tedy zatím paušálně nedostupné) léčby pro nemocné s pokročilou fibrózou či cirhózou.
Při stagingu jaterní fibrózy je možné uplatnit řadu kritérií či skórovacích systémů. Ve snaze maximálně zjednodušit tyto systémy byl do praxe zaveden skórovací systém METAVIR, který je v současné době (především v oblasti virových hepatitid) široce používán [23]. Tento systém rozděluje stadium fibrózy do pěti stupňů označovaných jako METAVIR F0–F4, přičemž stupeň F0 znamená nález bez fibrózy, stupeň F3 pokročilou (bridging) fibrózu a stupeň F4 jaterní cirhózu. V současné době je preferovanou metodou určení stupně jaterní fibrózy její neinvazivní detekce.
V minulosti využívaná jaterní biopsie má ve srovnání s neinvazivními metodami řadu nevýhod:
- invazivní procedura spojená s diskomfortem a bolestí,
- definované riziko komplikací (krvácení, pneumothorax, punkce jiných orgánů),
- odlišné hodnocení vzorku jednotlivými patology (interobserver variability),
- nedostatečná velikost vzorku,
- chybný odběr vzorku (sampling error) v důsledku ne zcela rovnoměrného rozložení fibrózních změn v jaterním parenchymu,
- nemožnost opakovaného a dynamického sledování vývoje jaterního onemocnění.
Uvedené nevýhody a rovněž snaha zajistit možnost monitorace vývoje jaterního onemocnění vedly k rozvoji metod neinvazivní detekce stanovení jaterní fibrózy. Tyto metody představují jednak sérové testy, které se dělí na dvě skupiny, a jednak přístrojová vyšetření. První typ sérových testů se zaměřuje na specifické laboratorní odchylky doprovázející jaterní cirhózu, např. APRI index využívající hodnot aspartátaminotransferázy (AST) a trombocytů nebo Forns index vyhodnocující věk, hodnoty gamaglutamyltransferázy (GGT), cholesterolu a trombocytů [24]. Sérové testy druhého typu využívají specifických substancí, jejichž obrat se při progresi fibrózy mění, resp. stoupá (např. kyselina hyaluronová, fragmenty kolagenu, metaloproteinázy, inhibitory metaloproteináz); jako příklad uveďme Fibrotest®, který je asi nejužívanější a nejvíce validovaný [24].
Druhou možností jsou přístrojová vyšetření, která využívají faktu, že v průběhu fibrózy dochází ke změně elasticity jater (játra jsou „tužší“), a vyšetřují tedy tzv. elasticitu jater metodou elastografie. Do jater je vysílán akustický či mechanický impuls a měří se rychlost prostupu těchto vln játry (a platí, že čím jsou játra tužší, tím je rychlost vyšší). Výhody těchto vyšetření představují:
- rychlost vyšetření (minuty),
- vysoká přesnost vyšetření,
- tzv. bed‑side vyšetření (okamžitě, dle potřeby, u lůžka pacienta),
- možnost libovolného opakování vyšetření a sledování vývoje onemocnění.
Aktuálně jsou dostupné následující možnosti elastografie: Fibroscan®, ARFI elastografie Siemens®, ShearWave ElastographyTM (SWE – AixplorerTM).
Tyto metody se liší v klinickém užití, ve využitelnosti v pokročilých či v alternativních situacích (obezita, ascites) a v jednotkách, kterými hodnotí elasticitu (jednotky kPa nebo m/s).
Stanovení pokročilosti jaterní fibrózy některou z vyjmenovaných validovaných metod a určení stadia jaterní fibrózy je naprosto nezbytnou součástí stanovení diagnózy a vyžadují jej plátci zdravotní péče, přičemž akceptují uvedené neinvazivní metody. Vzhledem k výše řečenému došlo k výraznému poklesu počtu invazivních jaterních biopsií [25].
Určení polymorfismu genu pro interleukin IL28B
V éře dvojkombinační terapie (PEG‑IFN + RBV) bylo důležité provést odhad úspěšnosti léčby na základě identifikace jejích prediktorů. Zřejmě nejsilnější postavení mělo vyšetření jednonukleotidového polymorfismu pro gen IL28B, který mohl mít formu CC/CT/TT. Detekce polymorfismu genu pro IL28B pomocí metody PCR se využívá jako prognostický faktor ve smyslu reakce HCV pozitivních pacientů k léčbě interferonem a k dosažení SVR. Pacienti s genotypem CC vykazují nejvyšší senzitivitu vůči IFN, a tedy nejvyšší šanci na vyléčení [26]. Tento test má nyní smysl především tehdy, pokud jedinou dostupnou variantu léčby představuje kombinace PEG‑IFN + RBV v oblastech s limitovanými finančními zdroji.
Léčba chronické virové hepatitidy C
V oblasti léčby HCV se v průběhu posledních 3–5 let odehrála farmakologická revoluce nevídaná v jiných oborech interní medicíny (graf 3). Nové algoritmy léčby umožňují během relativně krátké doby (většinou 12 týdnů, ale ev. i 8 týdnů trvání terapie), v podstatě bez nežádoucích účinků, s jednoduchým dávkováním (1–2 tablety denně) dosáhnout vysoké účinnosti (SVR > 90 % je standardem) u většiny nemocných.![Graf 3 Šance na dosažení SVR dle typu léčby; podle [31,32,50] – Jacobson, et al., 2014, Manns, et al., 2014, Webster, et al., 2015. DAA – přímo působící antivirotikum, direct acting antiviral; IFN – interferon; PEG-IFN – pegylovaný interferon; RBV – ribavirin; SMV – simeprevir; SVR – setrvalá virologická odpověď, sustained viral response; T – týden](https://www.remedia.cz/photo-a-30518---.jpg)
Rozdělení přímo působících antivirotik
Přímo působící antivirotika se dělí dle místa působení přípravku na virový cyklus, resp. dle místa, kde tento cyklus interferují či inhibují. V současné době jsou k dispozici (buď již schválené regulačními autoritami, či těsně před schválením) následující molekuly:
- inhibitory proteázy NS3/4A (přípona “‑ previr“): simeprevir, telaprevir, boceprevir, paritaprevir, asunaprevir, grazoprevir;
- inhibitory polymerázy NS5B (přípona “‑ buvir“): sofosbuvir, dasabuvir, beclabuvir;
- látky interferující s replikačním komplexem NS5A (přípona “‑ asvir“): daclatasvir, ledipasvir, veltapasvir, ombitasvir, elbasvir.
Základním principem IFN‑free léčby je kombinace minimálně dvou přípravků z různých skupin.
Dlouhou dobu byla jedinou možností léčby pacientů s HCV dvojkombinační léčba PEG‑IFN + RBV, jejíž účinnost byla u pacientů s genotypem 1 kolem 50 %, s řadou závažných a nepříjemných nežádoucích účinků [27].
První molekuly, které odstartovaly převratnou éru DAA v roce 2011, byly proteázové inhibitory boceprevir a telaprevir kombinované s původní dvojkombinační léčbou, použitelné pouze pro genotyp 1 [28,29]; účinnost léčby pacientů infikovaných genotypem 1 zvýšily přibližně na 70–75 %. Hlavní limitací této první generace proteázových inhibitorů byla řada nežádoucích účinků. Zhruba 25 % pacientů předčasně ukončilo léčbu a u 1–2 % pokročilých cirhotiků (nižší hladina trombocytů a albuminu) došlo k úmrtí na jaterní selhání [30].
Od roku 2013 je k dispozici proteázový inhibitor druhé generace simeprevir a první nukleotidový inhibitor polymerázy NS5B sofosbuvir. Tyto přípravky mají oproti původním proteázovým inhibitorům zcela zásadní výhody:
- kratší trvání léčby,
- lepší bezpečnostní profil,
- vyšší účinnost,
- sofosbuvir je účinný i proti jiným genotypům HCV.
Poté následovalo již období, kdy se objevila řada dalších přímých antivirotik včetně nových a velmi účinných kombinací, které umožnují zcela nahradit IFN v léčbě HCV.
Léčba tzv. IFN‑free režimy (kombinace různých léčiv ze skupiny DAA) je v současné době vysoce nákladná a v podstatě žádná země neumožňuje z ekonomických důvodů zcela volný přístup k této terapii. Léčeni jsou prioritně pacienti s pokročilým onemocněním jater a pacienti s kontraindikací interferonové léčby. Určitý mezistupeň představuje léčba trojkombinací PEG‑IFN + RBV + DAA. V době přípravy tohoto textu byly v ČR registrovány a mají stanovenu úhradu tyto přípravky: simeprevir, boceprevir a telaprevir (který je v praxi nahrazen proteázovým inhibitorem druhé generace simeprevirem). Od začátku roku 2016 je v ČR registrována i tzv. 3D kombinace ombitasvir a paritaprevir/ritonavir a dasabuvir. Řada dalších přípravků se v současnosti nachází ve fázi správního řízení o stanovení úhrady a režimu jejich preskripce.
Indikace k léčbě (koho léčit)
Dle doporučených postupů jsou k léčbě indikováni všichni pacienti s chronickou hepatitidou C [11,12]. Prioritně, bezodkladně a nejúčinnější léčbou by měli být léčeni tito pacienti [12]:
- s pokročilou fibrózou či cirhózou (stupeň F3, F4),
- s koinfekcí HIV (human immunodeficiency virus) nebo HBV (hepatitis B virus),
- indikovaní k transplantaci jater či s HCV po transplantaci jater,
- před transplantací solidních orgánů,
- se signifikantní extrahepatální manifestací HCV včetně těžké únavy,
- osoby představující vysoké epidemiologické riziko (narkomani, osoby uplatňující rizikové sexuální praktiky, ženy před otěhotněním, hemodialyzovaní pacienti).
- s minimální fibrózou (stupeň F0–F1),
- bez signifikantních extrahepatálních komplikací.
- trojkombinační léčbu PEG‑IFN + RBV +DAA,
- IFN‑free režim kombinací léčiv ze skupiny DAA.
Dvojkombinační léčba PEG‑IFN + RBV již není doporučena ve standardním postupu léčby chronické HCV. U pacientů s genotypem 1 dosahovala účinnost této dvojkombinace pouze 40–60 % a u pacientů s genotypem 3 (bez cirhózy) kolem 80 % [11].
Léčba využívající jakýkoliv přípravek z oblasti DAA je zásadně závislá na třech ukazatelích, jimiž jsou:
- genotyp (subtyp) viru,
- stupeň jaterního postižení (především bez cirhózy, cirhóza a dekompenzovaná cirhóza),
- naivní pacient (dosud neléčený) či selhání předchozí protivirové léčby (typ selhání léčby).
Další přehled se zabývá pouze pacienty infikovanými HCV genotypu 1 a 3 (ostatní genotypy HCV jsou v ČR vzácné).
Pacienti infikovaní
genotypem 1 HCV
Kombinace PEG‑IFN + RBV + simeprevir
Tato kombinace je v současné době aktivně používána a představuje velmi efektivní léčbu, pokud se vezme do úvahy cena a účinnost. Léčba trojkombinací je podávána po 12 týdnů. Poté následuje ještě 12 týdnů dvojkombinační léčby PEG‑IFN + RBV. Pacienti, kteří neodpověděli na předchozí léčbu dvojkombinací (kromě těch, u nichž došlo k relapsu onemocnění), a kompenzovaní cirhotici (Childovo‑Pughovo skóre A) by měli být léčeni celkem 48 týdnů. Simeprevir je podáván v dávce jedna tobolka ráno s jídlem. Tato léčba je vyhrazena pro pacienty infikované genotypem 1, resp. 1b. Pacienti se subtypem 1a by měli mít vyšetřenu přítomnost mutace Q80K (její přítomnost snižuje významně účinnost léčby) a pozitivní pacienti by měli být léčeni jinou alternativou (boceprevir nebo telaprevir). Účinnost této léčebné varianty se pohybuje v rozmezí 80–85 %, ale u pacientů s mutací Q80K dosahuje účinnost pouze 58 %. Tato léčba je vhodnější pro pacienty s nižším stupněm fibrotického postižení, neboť její účinnost je u pacientů s jaterní cirhózou (stupeň F4) nižší (cca 60 %) [31,32]. Naopak u naivních pacientů s genotypem 1b a s příznivými vstupními parametry (stupeň fibrózy F0–F2, ženské pohlaví, věk ≤ 45 let, BMI < 25 kg/m3, vstupní HCV RNA ≤ 800 tisíc IU/ml, počet trombocytů > 150 tisíc/mm3) byla celková SVR 90–100 % [32,33].
Kombinace PEG‑IFN + RBV + sofosbuvir
Doba podávání této léčebné kombinace je 12 týdnů a je použitelná v léčbě všech genotypů HCV. Celková SVR dosahuje 89 %, u pacientů s jaterní cirhózou 80 % [33]. Na druhé straně data z běžné klinické praxe (studie Target a Trio) ukazují lehce nižší účinnost – shodně u cirhotiků kolem 70–80 % a u opakovaně léčených cirhotiků kolem 60 % [34].
Kombinace ombitasvir + paritaprevir/ritonavir + dasabuvir (tzv. léčba 3D)
Tato kombinace léčiv využívá s výhodou blokádu všech tří míst replikačního cyklu viru HCV (obsahuje přípravky ze všech tří skupin). V některých případech se ještě kombinuje s RBV. Pacienti s genotypem 1b bez cirhózy jsou léčeni po dobu 12 týdnů, pacienti s genotypem 1a bez cirhózy by měli být léčeni 12 týdnů kombinací s RBV, pacientům s genotypem 1b a s cirhózou by měla být léčba s RBV podávána 12 týdnů a pacienti s genotypem 1a trpící cirhózou by měli být léčeni kombinací 3D + RBV po dobu 24 týdnů [12]. Účinnost této kombinační léčby dosahuje ve všech skupinách více než 91 % (u dosud neléčených pacientů s genotypem 1a 95 % a s genotypem 1b 98–99 %, u pacientů v minulosti neúspěšně léčených dosahuje 95–100 %). U pacientů s kompenzovanou cirhózou je účinnost 92–96 % [35–38].
Kombinace sofosbuvir + ledipasvir
Tato kombinační léčba je podávána jako fixní dávka v jedné tabletě. Účinnost této léčby je vysoká, a to i u pacientů s kompenzovanou jaterní cirhózou, kdy SVR činí 97–99 %; k léčbě není nutno přidávat RBV a léčbu stačí podávat 12 týdnů [39]. Účinnost u pacientů s cirhózou a bez cirhózy je podobná, při zkrácené osmitýdenní léčbě dosahuje u dosud neléčených pacientů 93–94 % [40]. Hlavní výhodou této kombinace je její jednoduchá a dobrá použitelnost u pacientů, kteří byli neúspěšně léčeni již přípravky první generace DAA (tedy boceprevirem či telaprevirem). Účinnost u těchto pacientů je 94 % po 12 týdnech léčby a 99 % po 24 týdnech léčby [41]. V jiné studii, kde byla testována tato kombinace u pacientů s nejméně příznivými faktory (cirhóza a neúčinná předchozí léčba telaprevirem či boceprevirem), bylo dosaženo SVR 96–97 % [42].
Další varianty, které jsou uváděny v doporučených postupech: kombinace sofosbuvir + daclatasvir a sofosbuvir + simeprevir zatím nelze využít, protože jejich cena je vyšší. Řada dalších možných kombinací se nachází ve fázi před schválením (např. grazoprevir + elbasvir).
Pacienti infikovaní genotypem 3 HCV
Při léčbě pacientů infikovaných genotypem 3 HCV máme k dispozici méně přípravků či kombinací než pro pacienty s infekcí genotypem 1. Zdá se, že pacienti infikovaní genotypem 3 trpící cirhózou jsou v současné době nejobtížněji léčitelnými nemocnými. Problémem aktuálně dostupných studií jsou relativně malé počty zařazených pacientů (desítky). Typ léčby zde závisí především na přítomnosti cirhózy a na typu předchozí (neúspěšné) léčby.
Kombinace PEG‑IFN + RBV + sofosbuvir
Délka podávání této léčebné kombinace (pokud pacienti nejsou kontraindikováni k léčbě IFN) je 12 týdnů; SVR12 bylo dosaženo u 83–91 % léčených.
Kombinace sofosbuvir + ribavirin
SVR bylo po 12 týdnech léčby touto kombinací dosaženo u 61 % pacientů, u cirhotiků jen ve 21 % [43]. V případě již neúspěšně léčených pacientů bylo dosaženo SVR u 30 %, resp. u 62 % pacientů po 12 či 16 týdnech léčby a jen u 19 % cirhotiků léčených 12 týdnů [44]. V případě léčby trvající 24 týdnů dosáhlo SVR kolem 85 % pacientů. Již neúspěšně léčení cirhotici dosahují i přes toto prodloužení SVR pouze v 62 % [43,44]. Délka léčby by tedy měla být 24 týdnů. Zdá se, že účinnost této léčby je podobná jako u původní léčby kombinací PEG‑IFN + RBV (ale s nižším výskytem nežádoucích účinků) a jistě nižší než při podávání kombinace PEG‑IFN + sofosbuvir + RBV.
Kombinace sofosbuvir + daclatasvir
Tato léčebná kombinace dosahuje SVR u 92–98 % pacientů bez cirhózy, ale u pacientů s cirhózou dosahuje účinnosti 58–70 % [34]. Léčba by měla být podávána 12 týdnů a pacienti s cirhózou či nemocní neúspěšně léčení v minulosti by měli být léčeni 24 týdnů [12], nejspíše v kombinaci s RBV [45,46].
Z předběžných výsledků pilotních studií (ledipasvir/sofosbuvir + RBV, grazoprevir + elbasvir + sofosbuvir) [47,48] vyplývá vyšší účinnost těchto kombinací u pacientů (cirhotiků) s genotypem 3, kterou ale bude nutno dále ověřit.
Lékové interakce
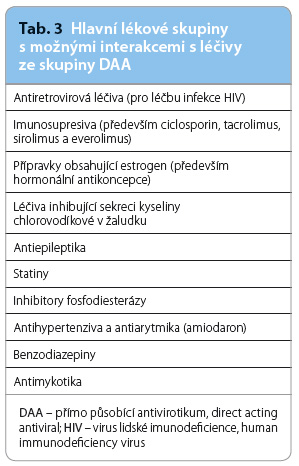 Nové protivirové léky přinášejí množství lékových interakcí. Hlavním mechanismem těchto lékových interakcí je kompetice metabolismu léčiv v oblasti cytochromu P450, především isoenzymu 3A4, který je zodpovědný za oxidaci celé řady látek a léčiv. Podávání jak inhibitorů, tak induktorů tohoto enzymu (v případě DAA jsou možné obě varianty) mění rychlost metabolismu ostatních substrátů, a tedy zvyšuje či snižuje sérové koncentrace a tím snižuje účinnost, či naopak zvyšuje jejich toxicitu. Dalším místem možných interakcí je glykoprotein P. Právě většina nových léčiv pro léčbu infekce HCV je primárně metabolizována v těchto místech [49].
Nové protivirové léky přinášejí množství lékových interakcí. Hlavním mechanismem těchto lékových interakcí je kompetice metabolismu léčiv v oblasti cytochromu P450, především isoenzymu 3A4, který je zodpovědný za oxidaci celé řady látek a léčiv. Podávání jak inhibitorů, tak induktorů tohoto enzymu (v případě DAA jsou možné obě varianty) mění rychlost metabolismu ostatních substrátů, a tedy zvyšuje či snižuje sérové koncentrace a tím snižuje účinnost, či naopak zvyšuje jejich toxicitu. Dalším místem možných interakcí je glykoprotein P. Právě většina nových léčiv pro léčbu infekce HCV je primárně metabolizována v těchto místech [49].
Eventuální lékové interakce s některým z přípravků ze skupiny DAA je nutné zvažovat u následujících skupin léků (tab. 3) [12,49].
Seznam potenciálních interakcí může být dlouhý a je specifický vždy pro každý přípravek ze skupiny DAA. Je proto nutné:
- vždy pečlivě odebrat farmakologickou anamnézu,
- zkontrolovat eventuální možnost vzniku a závažnosti interakcí (s výhodou na webových stránkách
www.hep‑druginteractions.org), - pacienta o interakcích poučit a doporučit konzultaci každého nově užívaného léku během léčby HCV.
Závěr
V současné době je možné vyléčit většinu pacientů s infekcí HCV. Účinnost aktuálně dostupných režimů běžně překračuje 90 %, a to i u pacientů s pokročilou cirhózou. Léčba je významně kratší, a především nejsou přítomny původně obávané nežádoucí účinky. Hlavními problémy, kterým bude péče o pacienty s chronickou infekcí HCV čelit v blízké či vzdálenější budoucnosti, jsou omezená účinnost léčby u pacientů infikovaných genotypem 3 HCV trpících cirhózou, vysoká cena nových přípravků a nutnost odhalit a diagnostikovat větší počet pacientů, kteří o svém onemocnění zatím nevědí.
Tento článek vznikl s podporou společnosti Janssen‑Cilag s.r.o.
Seznam použité literatury
- [1] Wandeler G, Dufour JF, Bruggmann P, et al. Hepatitis C: a changing epidemic. Swiss Med Wkly 2015; 145: w14093.
- [2] Bruggmann P, Berg T, Ovrehus AL, et al. Historical epidemiology of hepatitis C virus (HCV) in selected countries. J Viral Hepat 2014; 21 (Suppl 1): 5–33.
- [3] www.szu.cz/publikace/data/vybrane infekcni nemoci v cr v letech 2003 2012 absolutne. SZU 2014.
- [4] Simmonds P, Bukh J, Combet C, et al. Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes. Hepatology 2005; 42: 962–973.
- [5] Barrera JM, Bruguera M, Ercilla MG, et al. Persistent hepatitis C viremia after acute self limiting posttransfusion hepatitis C. Hepatology 1995; 21: 639–644.
- [6] Grebely J, Page K, Sacks Davis R, et al. The effects of female sex, viral genotype, and IL28B genotype on spontaneous clearance of acute hepatitis C virus infection. Hepatology 2014; 59: 109–120.
- [7] Everhart JE, Lok AS, Kim HY, et al. Weight related effects on disease progression in the hepatitis C antiviral long term treatment against cirrhosis trial. Gastroenterology 2009; 137: 549–557.
- [8] Thein HH, Yi Q, Dore GJ, et al. Estimation of stage specific fibrosis progression rates in chronic hepatitis C virus infection: a meta analysis and meta regression. Hepatology 2008; 48: 418–431.
- [9] Fattovich G, Giustina G, Degos F, et al. Morbidity and mortality in compensated cirrhosis type C: a retrospective follow up study of 384 patients. Gastroenterology 1997; 112: 463–472.
- [10] Westbrook RH, Dusheiko G. Natural history of hepatitis C. J Hepatol 2014; 61 (1 Suppl): S58–S68.
- [11] Urbánek P, Husa P, Šperl J. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C. Gastroent Hepatol 2015; 69: 455–471.
- [12] EASL. EASL Recommendations on Treatment of Hepatitis C 2015. J Hepatol 2015; 63: 199–236.
- [13] van der Meer AJ, Wedemeyer H, Feld JJ, et al. Life expectancy in patients with chronic HCV infection and cirrhosis compared with a general population. JAMA 2014; 312: 1927–1928.
- [14] Aleman S, Rahbin N, Weiland O, et al. A risk for hepatocellular carcinoma persists long term after sustained virologic response in patients with hepatitis C associated liver cirrhosis. Clin Infect Dis 2013; 57: 230–236.
- [15] Poynard T, McHutchison J, Manns M, et al. Impact of pegylated interferon alfa 2b and ribavirin on liver fibrosis in patients with chronic hepatitis C. Gastroenterology 2002; 122: 1303–1313.
- [16] Mallet V, Gilgenkrantz H, Serpaggi J, et al. Brief communication: the relationship of regression of cirrhosis to outcome in chronic hepatitis C. Ann Intern Med 2008; 149: 399–403.
- [17] D‘Ambrosio R, Aghemo A, Rumi MG, et al. A morphometric and immunohistochemical study to assess the benefit of a sustained virological response in hepatitis C virus patients with cirrhosis. Hepatology 2012; 56: 532–543.
- [18] Poynard T, Moussalli J, Munteanu M, et al. Slow regression of liver fibrosis presumed by repeated biomarkers after virological cure in patients with chronic hepatitis C. J Hepatol 2013; 59: 675–683.
- [19] Brown S. AVNR. Declining HCV Treatment Rate in the USA, AASLD conference 2013, Nov 5, 2013, abstract ID 2213.
- [20] Wedemeyer H, Duberg AS, Buti M, et al. Strategies to manage hepatitis C virus (HCV) disease burden. J Viral Hepat 2014; 21 (Suppl 1): 60–89.
- [21] Kanwal F, Kramer JR, Ilyas J, et al. HCV genotype 3 is associated with an increased risk of cirrhosis and hepatocellular cancer in a national sample of U.S. Veterans with HCV. Hepatology 2014; 60: 98–105.
- [22] Schinazi R, Halfon P, Marcellin P, et al. HCV direct acting antiviral agents: the best interferon free combinations. Liver Int 2014; 34 (Suppl 1): 69–78.
- [23] XY. Intraobserver and interobserver variations in liver biopsy interpretation in patients with chronic hepatitis C. The French METAVIR Cooperative Study Group. Hepatology 1994; 20 (1 Pt 1): 15–20.
- [24] Castera L. Noninvasive methods to assess liver disease in patients with hepatitis B or C. Gastroenterology 2012; 142: 1293–1302.
- [25] Sharma S, Khalili K, Nguyen GC. Non invasive diagnosis of advanced fibrosis and cirrhosis. World J Gastroenterol 2014; 20: 16820–16830.
- [26] Thompson AJ, Muir AJ, Sulkowski MS, et al. Interleukin 28B polymorphism improves viral kinetics and is the strongest pretreatment predictor of sustained virologic response in genotype 1 hepatitis C virus. Gastroenterology 2010; 139: 120–129.
- [27] Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa 2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347: 975–982.
- [28] Poordad F, McCone J, Jr., Bacon BR, et al. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med 2011; 364: 1195–1206.
- [29] Jacobson IM, McHutchison JG, Dusheiko G, et al. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med 2011; 364: 2405–2416.
- [30] Hezode C, Fontaine H, Dorival C, et al. Triple therapy in treatment experienced patients with HCV cirrhosis in a multicentre cohort of the French Early Access Programme (ANRS CO20 CUPIC) – NCT01514890. J Hepatol 2013; 59: 434–441.
- [31] Jacobson IM, Dore GJ, Foster GR, et al. Simeprevir with pegylated interferon alfa 2a plus ribavirin in treatment naive patients with chronic hepatitis C virus genotype 1 infection (QUEST 1): a phase 3, randomised, double blind, placebo controlled trial. Lancet 2014; 384: 403–413.
- [32] Manns M, Marcellin P, Poordad F, et al. Simeprevir with pegylated interferon alfa 2a or 2b plus ribavirin in treatment naive patients with chronic hepatitis C virus genotype 1 infection (QUEST 2): a randomised, double blind, placebo controlled phase 3 trial. Lancet 2014; 384: 414–426.
- [33] Lawitz E, Mangia A, Wyles D, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med 2013; 368: 1878–1887.
- [34] Nelson DR, Cooper JN, Lalezari JP, et al. All oral 12 week treatment with daclatasvir plus sofosbuvir in patients with hepatitis C virus genotype 3 infection: ALLY 3 phase III study. Hepatology 2015; 61: 1127–1135.
- [35] Poordad F, Hezode C, Trinh R, et al. ABT 450/r ombitasvir and dasabuvir with ribavirin for hepatitis C with cirrhosis. N Engl J Med 2014; 370: 1973–1982.
- [36] Feld JJ, Kowdley KV, Coakley E, et al. Treatment of HCV with ABT 450/r ombitasvir and dasabuvir with ribavirin. N Engl J Med 2014; 370: 1594–1603.
- [37] Zeuzem S, Jacobson IM, Baykal T, et al. Retreatment of HCV with ABT 450/r ombitasvir and dasabuvir with ribavirin. N Engl J Med 2014; 370: 1604–1614.
- [38] Forns X, Poordad F, Pedrosa M, et al. Ombitasvir/paritaprevir/r, dasabuvir and ribavirin for cirrhotic HCV patients with thrombocytopaenia and hypoalbuminaemia. Liver Int 2015; 35: 2358–2362.
- [39] Afdhal N, Zeuzem S, Kwo P, et al. Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection. N Engl J Med 2014; 370: 1889–1898.
- [40] Kowdley KV, Gordon SC, Reddy KR, et al. Ledipasvir and sofosbuvir for 8 or 12 weeks for chronic HCV without cirrhosis. N Engl J Med 2014; 370: 1879–1888.
- [41] Afdhal N, Reddy KR, Nelson DR, et al. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection. N Engl J Med 2014; 370: 1483–1493.
- [42] Bourliere M, Bronowicki JP de Ledinghen V, et al. Ledipasvir sofosbuvir with or without ribavirin to treat patients with HCV genotype 1 infection and cirrhosis non responsive to previous protease inhibitor therapy: a randomised, double blind, phase 2 trial (SIRIUS). Lancet Infect Dis 2015; 15: 397–404.
- [43] Jacobson IM, Gordon SC, Kowdley KV, et al. Sofosbuvir for hepatitis C genotype 2 or 3 in patients without treatment options. N Engl J Med 2013; 368: 1867–1877.
- [44] Zeuzem S, Dusheiko GM, Salupere R, et al. Sofosbuvir and ribavirin in HCV genotypes 2 and 3. N Engl J Med 2014; 370: 1993–2001.
- [45] Foster GR, McLauchlan J, Irving W. Treatment of decompensated HCV cirrhosis in patients with diverse genotypes: 12 weeks of sofosbuvir and NS5A inhibitors with/without ribavirin is effective in HCV genotypes 1 and 3. Presented at the 50th Annual Meeting of the European Association for the Study of the Liver (EASL), Vienna Austria, April 22 26, 2015. Abstract O002.
- [46] Poordad F, Schiff ER, Verling JM, et al. Daclatasvir, sofosbuvir, and ribavirin combination for HCV patients with advanced cirrhosis or post transplant recurrence: ALLY 1 phase 3 study. Presented at the 50th Annual Meeting of the European Association for the Study of the Liver (EASL), Vienna Austria, April 22 26, 2015.
- [47] Gane EJ, Hyland RH, An D. High efficacy of LDV/SOF regimens for 12 weeks for subjects with HCV genotype 3 or 6 infection (Abstract LB11) 65th Annual Meeting of the American Association for the Study of Liver Diseases (AASLD). Boston, MA, November 7 11, 2014.
- [48] Poordad F, Lawitz E, Gutierrez JA, et al. C SWIFT: Grazoprevir / elbasvir + sofosbuvir in cirrhotic and noncirrhotic, treatment naive patients with hepatitis C virus genotype 1 infection, for durations of 4, 6, or 8 weeks and genotype 3 infection for durations of 8 or 12 weeks. (Abstract O006), 50th Annual Meeting of the European Association for the Study of the Liver (EASL), Vienna, Austria, April 22 26, 2015.
- [49] Dick TB, Lindberg LS, Ramirez DD, et al. A clinician‘s guide to drug drug interactions with direct acting antiviral agents for the treatment of hepatitis C viral infection. Hepatology 2016; 63: 634–643.
- [50] Webster DP, Klenerman P, Dusheiko GM. Hepatitis C. Lancet 2015; 385: 1124–1135.