Alopecie a možnosti farmakoterapie
Souhrn:
Alopecie jsou rozsáhlou skupinou chorob se ztrátou vlasů. Postihují ženy i muže, děti i dospělé. Mají nejrůznější příčiny od geneticky podmíněných po příčiny dosud neznámé. Základní rozlišení přináší nález jizvení. Pokud je jizvení přítomno, může se jednat o proces postihující primárně vlasový folikul, nebo je nejprve poškozena kůže. Alopecie bez jizvení probíhají difuzně nebo se jedná o výpad ložiskový. Skupina difuzního výpadu se často rozlišuje podle typu ztracených vlasů na alopecie anagenní a alopecie telogenní. Do skupiny telogenního výpadu se řadí také nejčastější typ výpadu vlasů vůbec – androgenetická alopecie. Autoimunitní choroba alopecia areata patří k ložiskovým alopeciím. Terapie obou posledních zmiňovaných diagnóz je rozebrána podrobněji.
Key words: alopecia − cicatricial alopecia − non‑cicatricial alopecia − diffuse hair loss − localized hair loss – treatment.
Summary:
Alopecia represents an extensive group of hair loss diseases. It affects both women and men, children and adults. They have all sorts of causes from genetic to unknown causes. The first distinction is scarring process. If scarring is present, it can be a process that primarily affects the hair follicle or the first damage is in the skin. Alopecia without scarring takes place diffusely or the hair loss is localized. The diffuse hair loss pattern is often differentiated according to the type of hair lost to anagen and telogen effluvium. The most common type of hair loss ever – androgenetic alopecia – belongs to the group of telogen effluvium. Autoimmune disease alopecia areata is a kind of localized hair loss. The therapy of the two last mentioned diagnoses is discussed in more detail.
Alopecie představují velkou skupinu chorob, kterou spojuje snížení hustoty (respektive vymizení) vlasů či chlupů na místech obvykle ovlasených (ochlupených). Může se jednat o genetické poruchy nebo o získaná onemocnění bez genetických souvislostí, o procesy difuzní či ložiskové, trvalého či přechodného charakteru. Klasické dělení rozlišuje alopecie jizvící a nejizvící.
Jizvící alopecie
Jizvící alopecie (cicatricial alopecia, CA) představují skupinu zánětlivých chorob, pro které je v závěru procesu charakteristická trvalá destrukce vlasových folikulů a jejich nahrazení fibrózní, jizevnatou tkání. Některé původně nejizvící alopecie mohou v pozdních fázích také vykazovat trvalou ztrátu vlasů − označují se jako bifázické alopecie.
Primární jizvící alopecie
Jizvící alopecie mohou být primární
(primary cicatricial alopecia, PCA), kde hlavním cílem
destruktivního, zánětlivého procesu jsou vlasové folikuly. Buňky
zánětlivé fáze ničí kmenové buňky oblasti „bulge“
vlasového folikulu a dochází k ireverzibilní ztrátě
vlasů. Etiologie je různá, především se jedná o autoimunitní
procesy [1]. Další dělení PCA je obvykle založeno na typu
dominujícího zánětlivého infiltrátu (tab. 1).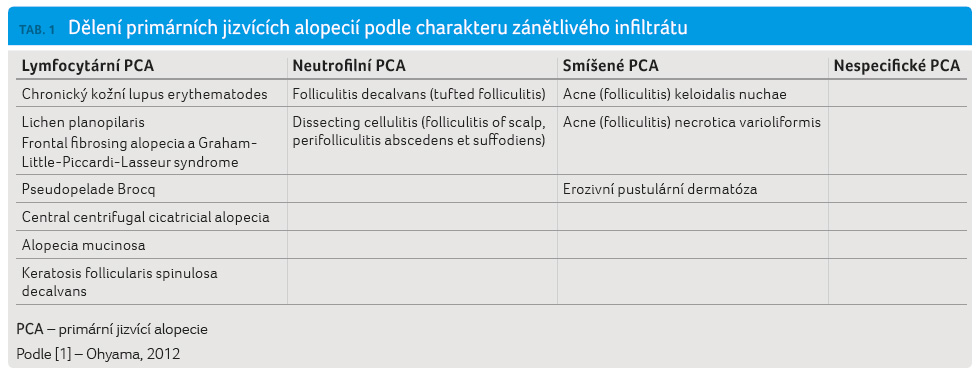
Nespecifická PCA je charakterizována jako idiopatické jizvení s neprůkazným klinickým a histologickým nálezem. Do této kategorie spadá řada PCA v jejich konečném stadiu vývoje, kdy jsou klinicky i histologicky stěží odlišitelné. Diagnostika i léčba přísluší do rukou dermatovenerologa a histopatologa, podrobnější popis přesahuje rozsah článku.
Obecně se v terapii lymfocytárních PCA uplatňují imunosupresiva a u neutrofilních PCA antimikrobiální látky nebo dapson [2].
Sekundární jizvící alopecie
Sekundární jizvící alopecie (secondary cicatricial alopecia, SCA) představují onemocnění, kde zánětlivý proces probíhá v kůži mimo vlasový folikul a folikulární jednotka je postižena až druhotně, nespecificky, v rámci své přítomnosti v postižené oblasti kůže. Dojde ke zničení kmenových buněk a tím k vyčerpání kapacity vlasového folikulu regenerovat prostřednictvím těchto kmenových buněk.
Příčinami SCA jsou traumata (popáleniny, radiace, trakce), jakýkoliv typ infiltrativního procesu (sklerodermie, sarkoidóza, neoplazie) a infekce (bakteriální, plísňové, virové, mykobakteriální). Obecně je cílem léčby zpomalit nebo zastavit progresi zánětlivé fáze a jizvení v časných fázích postižení.
Hereditární jizvící alopecie
Asi nejznámější z těchto vrozených alopecií je aplasia cutis congenita. Jedná se o skupinu chorob charakteristických solitárním nebo mnohočetným chyběním části kůže při narození. Nejčastěji bývá postižena kštice, ale může být postižena kterákoliv oblast těla. Při narození mohou být tyto oblasti v různém stupni hojení, až i úplně zhojené bezvlasou, atrofickou jizvou. Aplasia cutis congenita může být spojena s dalšími malformacemi. Terapie směřuje ke zhojení. Chirurgické postupy se uplatňují ojediněle u větších defektů.
Nejizvící alopecie
Pokud se u nejizvících alopecií jedná o difuzní výpad, obvykle se rozlišují alopecie anagenního (resp. dystroficko anagenního) typu, telogenního typu a androgenetická alopecie (jako zvláštní forma telogenního výpadu).
Ve zjednodušení je růstový cyklus vlasového folikulu možno popsat jako pravidelné, cyklické střídání aktivní růstové – anagenní – fáze, krátké degenerační – katagenní – fáze a 2−3 měsíce trvající klidové – telogenní – fáze (obr. 1). Za fyziologických podmínek se u dospělých nachází ve kštici 80−90 % vlasů v anagenní fázi, 10−20 % v telogenní a 2−3 % v katagenní fázi. Choroby spojené se zvýšeným výpadem vlasů mohou zasahovat do kterékoliv z částí vlasového cyklu a mohou toto procentuální rozložení měnit. Například u telogenní alopecie prokazujeme při vyšetření vyšší procentuální zastoupení vlasů v telogenní fázi. Působící noxa předčasně ukončila anagenní fázi a větší množství vlasových folikulů se přesunulo do normální katagenní a telogenní fáze. U dystroficko anagenního výpadu zase nacházíme větší množství anagenních poškozených (dystrofických) vlasů.
Alopecie anagenního (dystroficko anagenního) typu
U této skupiny nejizvících alopecií se obvykle rozlišují dva typy: běžné dystrofické anagenní effluvium a tzv. loose anagen syndrom.
Dystrofické anagenní effluvium
Běžné dystrofické anagenní effluvium je charakterizováno náhlým výpadem vlasů, které jsou v růstové, anagenní fázi. Vzniká po působení noxy, která zastaví nebo poškodí mitotické či metabolické pochody vlasového folikulu a způsobí různý stupeň dystrofie folikulu. Obvykle je tento typ výpadu spojován s chemoterapií (chemotherapy induced hair loss, CIA). Celková incidence CIA se odhaduje na 65 %. Například při aplikaci topoizomerázových inhibitorů (mezi nimi doxorubicin) se pohybuje kolem 60−100 %, u alkylujících látek (např. cyklofosfamid) dosahuje více než 60 % [3].
Výpad vlasů nastává za jeden až tři týdny po působení noxy. Vzhledem k tomu, že ve kštici je kolem 80−90 % vlasů v anagenní fázi, bývá výpad velmi výrazný. Pokud je ale chemoterapie aplikována ve vyšších dávkách, po dostatečně dlouhou dobu, resp. v opakovaných cyklech, může dojít k výpadu i v dalších ochlupených oblastech (vousy, obočí, řasy atd.). Protože jsou postiženy jen proliferující buňky, relativně klidové kmenové buňky v oblasti „bulge“ jsou zachovány a za několik týdnů po skončení působení noxy začne vlasový folikul nový normální cyklus. Vlasy pak začnou být viditelné během 1−3 měsíců.
Anagenní alopecie se dále může objevit v souvislosti s radioterapií oblasti hlavy a krku, u těžké proteinové malnutrice, při vystavení toxickým látkám, jako jsou měď, bor, thalium. Z léků to vzácně může být cyklosporin, levodopa, kolchicin. Také choroby jako pemphigus vulgaris a systémové choroby s peribulbárním zánětem (jako je systémový lupus erythematodes, sekundární syfilis a další) mohou vést k zastavení anagenu.
Terapie CIA je zaměřena jednak na to, aby se toxická látka nedostala k vlasovému folikulu, a jednak na ochránění buněk vlasového folikulu před jejich poškozením, resp. zničením. Nejpoužívanější a nejvíce studovanou je povrchová hypotermie oblasti kštice (chlazení pomocí speciálních čepic). Někdy se také využívá komprese, někdy kombinace hypotermie a komprese. Stále diskutované je riziko možných metastáz do oblasti kštice. Běžně používaným přípravkem je minoxidil, který sice nedokáže zabránit vzniku CIA, ale urychluje nový nárůst vlasů.
V testování je celá řada látek včetně protilátek specifických pro chemoterapeutikum, modifikátorů vlasového růstového cyklu, cytokinů a růstových faktorů, antioxidantů, inhibitorů apoptózy, látek ovlivňujících proliferaci či buněčný cyklus. Jako slibný se jeví inhibitor CDK2 (cyklin dependentní kináza 2), který nabízí možnou cestu k zastavení buněčného cyklu.
Většina CIA je sice reverzibilních, nicméně přibývá zpráv o vzniku permanentní alopecie nejen jako následku vysoce dávkované terapie busulfanem a cyklofosfamidem před transplantací kostní dřeně, ale i při aplikaci jiných chemoterapeutik. To ukazuje na nutnost dalšího výzkumu terapie [4].
Loose anagen hair syndrome
Loose anagen hair syndrome (LAHS) je relativně vzácné onemocnění charakterizované volně zakotvenými vlasy v anagenní fázi, které mohou být jednoduše a bezbolestně vytaženy ze kštice. Onemocnění může být součástí některých vzácných syndromů. V současnosti není k dispozici žádná specifická léčba. Je vhodná co nejšetrnější péče o kštici, možné je zkusit aplikovat 5% minoxidil. Onemocnění je pouze kosmeticky problematické (pokud není součástí syndromů) a zmírňuje se samovolně s věkem, zvláště po pubertě.
Alopecie telogenního typu
Telogenní effluvium (TE) je charakterizováno narušením vlasového cyklu se zvýšeným výpadem normálních telogenních vlasů. Vlasový folikul reaguje stejným způsobem (předčasným ukončením anagenní fáze a přechodem do fáze telogenní) na různé podněty. Jak výrazný výpad bude, závisí více na síle a době působení noxy než na konkrétním typu vyvolávající příčiny. Podstatná je také individuální citlivost k jednotlivým noxám.
Akutní telogenní effluvium
Akutní telogenní effluvium začíná náhle, za 2−4 měsíce po působení noxy, a až v 95 % se během několika měsíců upravuje. Typický je tento typ výpadu po porodu (třetina až polovina žen), kde vlivem hormonů v graviditě dochází k prodloužení anagenní fáze. Po porodu velké množství vlasů přechází synchronně do telogenní fáze a následuje zvýšený výpad. Podobný stav nastává po vysazení hormonální antikoncepce. Také po zahájení terapie minoxidilem, kdy jsou folikuly stimulovány k rychlému vstupu do anagenní fáze (a ke zkrácení telogenu), dochází k velkému výpadu telogenních vlasů. Z dalších příčin to může být velké krvácení, operace, horečnaté stavy, jiné závažné choroby, velký stres, rychlé diety, těžké kovy (arsen, thalium, selen), vystavení velké dávce slunečního či UV záření, kontaktní alergická reakce (obvykle barvy na vlasy).
Chronické telogenní effluvium
Chronické telogenní effluvium trvá déle než šest měsíců a je vyloučena androgenetická alopecie. Má celou řadu možných příčin, z nichž na prvním místě jmenujme endokrinní poruchy − hypertyreoidismus (50 % pacientů), hypotyreoidismus (30 %), hyperprolaktinemie –, a dále pak léky − retinoidy per os (etretinat, acitretin, isotretinoin), cytotostatika, perorální antikoncepce, antityreoidální látky, antiepileptika, antikoagulancia, hypolipidemika, betablokátory, inhibitory angiotenzin konvertujícího enzymu, amfetaminy, lithium. K dalším příčinám vzniku chronického telogenního effluvia patří náhlé ukončení léčby minoxidilem (výpadu vlasů nedokáže zabránit ani užívání finasteridu v dávce 1 mg/den) [5] a chronické choroby – choroby pankreatu, jaterní choroby a chronické ledvinné selhávání, pokročilé malignity, m. Hodgkin a infekce HIV. Ve výčtu těchto chorob je třeba uvést rovněž syfilis (sekundární), systémový lupus erythematodes, dermatomyositis. Mezi nutriční příčiny řadíme chronické hladovění, rychlé diety, anorexia nervosa, hypoproteinemii, anémii z deficitu železa, deficit železa bez anémie (kontroverzní příčina TE), acrodermatitis entheropathica, získaný deficit zinku (dlouhodobá parenterální terapie bez doplňování), nedostatek biotinu, nedostatek esenciálních mastných kyselin (dlouhodobá parenterální výživa bez obsahu lipidů), nedostatek selenu; zdá se, že může hrát roli i snížená koncentrace vitaminu D3 [6].
V terapii je na prvním místě indentifikace a vyloučení/omezení vyvolávajících příčin. Na základě patogeneze telogenního výpadu je možné lokálně zkusit aplikaci minoxidilu. Co se týče výživy a výživových doplňků, zdá se, že nejdůležitější je vyvážená dieta a stabilní tělesná hmotnost. Pokud je prokazatelný nebo na základě anamnézy alespoň předpokládatelný deficit některého z nutrientů, které mohou způsobit výpad vlasů, pak je namístě deficit doplnit. Stále nejednotné jsou názory na doplňování železa u pacientů se sníženými hodnotami železa, ale bez anémie. Jisté je, že pacienti se suplementací železa by měli být monitorováni pro možnou toxicitu (hemochromatóza), stejně tak při suplemetaci zinku [7]. V současné době ale nejsou žádné vitaminy nebo suplementy s průkazným efektem pro některou formu výpadu vlasů (pokud není zřejmý deficit). Stejně tak u lidí dosud nebyl prokázán žádný efekt antioxidantů ani zeleného čaje (obsahujícího polyfenoly).
Androgenetická alopecie
Androgenetická alopecie (AGA) je nejčastějším typem výpadu vlasů u mužů i žen. Obvykle dochází k výpadu vlasů v určitých oblastech kštice, proto se onemocnění označuje u mužů jako male pattern hair loss (MPHL) nebo male androgenetic alopecia (MAGA) a u žen jako female pattern hair loss (FPHL) nebo female androgenetic alopecia (FAGA). Hlavní patologické změny jsou u obou pohlaví stejné. Zkracuje se anagenní fáze a prodlužuje se fáze telogenní. Histologicky vlasový folikul prochází procesem postupné miniaturizace, až zanikne. Dalším znakem je zánět.
U mužů je jasný vliv androgenů, stejně tak genetická vazba. U žen není etiologie zcela jasná, kromě androgenů se uplatňují jiné mechanismy. I když většina žen s FAGA má plazmatické koncentrace androgenů v normě, je třeba pátrat po možných dalších známkách nadbytku androgenů (např. hirsutismus atd.), u těchto žen identifikovat zdroj nadprodukce androgenů (ovariální/adrenální) a příslušnou hormonální poruchu řešit.
Terapii je třeba zahájit co nejdříve. Zdá se, že ve chvíli, kdy dojde k odloučení primárního vlasového folikulu od musculus arrector pili, k jeho degeneraci a náhradě tukovou tkání (po oddělení a miniaturizaci všech sekundárních folikulů ve folikulární jednotce), je ztráta vlasu nevratná [8].
Pro léčbu AGA schválil americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) jen lokálně aplikovaný minoxidil (pro muže v 2% a 5% koncentraci, pro ženy v 2% koncentraci) a pro muže celkově podávaný finasterid v dávce 1 mg/den.
Léčba androgenetické alopecie
Minoxidil
Minoxidil otevírá ATP senzitivní draslíkové kanály v buňkách folikulů. Účinnost minoxidilu byla ověřena v řadě klinických studií. Bylo zjištěno, že je schopen zastavit ztrátu vlasů až u 80−90 % léčených a u 50 % začaly být vlasy hustší. Jak přesně minoxidil ovlivňuje vlasový folikul, není dosud plně objasněno. Jedním z jeho účinků je vazodilatace, nicméně ta zřejmě není hlavním mechanismem účinku, kterým minoxidil indukuje růst vlasu. Další, patrně významnější mechanismy, zahrnují zvýšenou expresi mRNA pro vaskulární endoteliální růstový faktor (VEGF) v dermální papile, tedy indukci angiogeneze v papile. Dále vlivem minoxidilu dochází k aktivaci cytoprotektivní prostaglandin syntázy 1 (enzymu, který stimuluje růst vlasu) a prokázána byla i zvýšená exprese mRNA pro růstový faktor hepatocytů (HGF), což je další z faktorů, který podporuje růst vlasu.
Nejčastěji je minoxidil aplikován ve 2% nebo 5% koncentraci. Pro muže s AGA se doporučuje lokální aplikace 2% nebo 5% minoxidilu v roztoku v dávce 1 ml dvakrát denně. U mužů byla prokázána vyšší účinnost při aplikaci 5% roztoku [9]. Pro ženy se doporučuje aplikace 2% roztoku, zatím není dostatek důkazů pro lepší efekt 5% koncentrace. Minoxidil je kontraindikován v graviditě i v době kojení.
Hodnotit účinnost je vhodné až po šesti měsících aplikace a pro udržení efektu je pak třeba v léčbě pokračovat dlouhodobě. Obvykle po třech měsících od ukončení léčby nastává výpad znova. Aplikace bývá dobře tolerována. Někdy se na začátku léčby může objevit mírné svědění, které ale s pokračující aplikací ustupuje. Nejčastějšími nežádoucími účinky jsou výraznější svědění, šupení a erytém kůže. Jedná se obvykle o iritační reakci na alkohol nebo propylenglykol obsažené v roztoku nebo o zhoršení seboroické dermatitidy, méně často o kontaktní alergickou reakci (ta vzniká častěji na propylenglykol než na minoxidil) [10].
V takových případech je možné zvážit podání jiných aplikačních forem přípravku, např. pěny (bez propylenglykolu). Účinnost těchto aplikačních forem se zdá být srovnatelná s klasickým roztokem. Dalším nežádoucím účinkem může být hypertrichóza, a to jak v místech nechtěné aplikace (např. na čele), tak někdy i ve vzdálenějších oblastech (např. na pažích).
Aminexil je derivát minoxidilu, vazodilatátor s podobnými vlastnostmi. Hlavním uváděným účinkem je zlepšení perifolikulární vaskularizace. Je určen pro lokální aplikaci ve formě šamponu či jako roztok v ampulkách. Bohužel ale není k dispozici dostatek klinických studií dokumentujících jeho účinky.
Inhibitory 5α reduktázy
Finasterid je selektivní inhibitor 5α reduktázy typu II, nejedná se o antiandrogen. Tento enzym přeměňuje testosteron na silnější androgen dihydrotestosteron, který se váže na receptory pro androgeny ve vlasovém folikulu. U mužů s AGA byl finasterid testován v různých dávkách od 0,2 do 5 mg/den. Jako optimální se jeví dávka 1 mg/den. V této dávce podobně jako minoxidil zastavuje výpad vlasů u 80−90 % pacientů a u 50 % léčených jsou vlasy viditelně hustší. Nebyl zjištěn žádný rozdíl v účinnosti mezi dávkou 1 mg a 5 mg [11].
Doporučuje se dlouhodobé podávání. Nežádoucí účinky včetně sexuálních dysfunkcí (erektilní dysfunkce, snížení libida, anorgasmie) jsou málo časté, po vysazení léčby obvykle dochází k jejich vymizení. Nicméně se objevily zprávy o trvalých sexuálních dysfunkcích a dalších nežádoucích účincích (únava, deprese, anxieta, citlivost prsů a karcinom prsu u mužů), které vedly až ke vzniku pojmu „postfinasteridový syndrom“. Skutečný výskyt, ověřený spolehlivými studiemi, dosud není znám. Pacienty je ale jistě vhodné o situaci informovat [12].
Zkouší se i lokální užití finasteridu obvykle v roztoku, často v kombinaci s minoxidilem, a také aplikace ve formě mezoterapie (přímé injekční vpravení finasteridu do kůže) – zatím však není k dispozici dostatek informací.
U žen nebyl při stejné dávce finasteridu prokázán žádný efekt. Jen v ojedinělých studiích byl doložen pozitivní účinek podávání vyšších dávek – 2,5 mg/den, resp. 5 mg/den. Zdá se, že není rozdíl v účinku u žen pre nebo postmenopauzálních. Další studie pro použití u žen jsou nutné. Kromě toho je finasterid teratogenní, u žen ve fertilním věku je nutná spolehlivá antikoncepce.
Dutasterid je inhibitor 5α reduktázy typu I a II, ve srovnání s finasteridem je třikrát silnější v inhibici enzymu typu II a stokrát silnější u typu I. Dal by se tedy předpokládat lepší efekt v léčbě MAGA, což některé studie potvrzují [13]. Podávání dutasteridu v dávce 0,5 mg/den bylo provázeno obdobnými nežádoucími účinky jako podávání finasteridu v dávce 1 mg/den. Nicméně je třeba dalších ověření.
U žen některé studie ukazují lepší účinek dutasteridu než finasteridu, zvláště u žen ve věku nad 50 let. Aplikována byla denní dávka 0,5 mg, ale také 0,15 mg. Dutasterid je rovněž teratogenní a o nežádoucích účincích u žen je málo informací.
Kombinovaná perorální kontraceptiva
U žen trpících FAGA ve fertilním věku (pokud nejsou kontraindikace) je další možností léčby podávání vhodné kombinované perorální antikoncepce (combined oral contraceptive pill, COC). Volí se přípravky s obsahem ethinylestradiolu a antiandrogenně působícího gestagenu. Nejsilněji působí cyproteron acetát, asi o polovinu slabší je dienogest, z dalších to jsou drospirenon a chlormadinon acetát.
Systémové antiandrogeny
Perorální antiandrogeny jsou u mužů kontraindikovány pro feminizační efekt. U žen fertilního věku je nutná COC pro možné riziko feminizace plodu při případné graviditě. Cyproteron acetát je progestin (syntetický hormon) s antiandrogenním účinkem. V dávce 2 mg s 35 μg ethinylestradiolu je k dispozici jako COC. Pokud není dávka dostačující, je možné přidat samotný cyproteron acetát v dávce 25–50 (až 100) mg denně podávaných 1.−10. (15.) den menstruačního cyklu. U žen po menopauze se cyproteron acetát podává kontinuálně nejčastěji v dávce 25 mg/den. Nežádoucí účinky léčby zahrnují deprese, nárůst tělesné hmotnosti, citlivost prsů a snížení libida. Nutné jsou kontroly jaterních funkcí. U pacientek užívajících COC obsahující cyproteron acetát je vyšší riziko vzniku tromboembolie než při podávání jiných perorálních kontraceptiv.
Spironolakton je kalium šetřící diuretikum, které má také antiandrogenní efekt. Jednak kompetitivně blokuje androgenní receptory a také snižuje tvorbu androgenů v nadledvinách. Známé nežádoucí účinky léčby představují elektrolytová dysbalance, hypotenze, zvracení, průjem, únava, spavost, citlivost prsů, nepravidelnosti menstruačního cyklu a hematologické změny. V důsledku toho je třeba alespoň první měsíce sledovat krevní tlak a hodnoty elektrolytů. Dávka pro léčbu FAGA je v rozmezí 50−200 mg/den.
Flutamid je nesteroidní antiandrogen. Dávka 250 mg/den byla u pacientek s hyperandrogenní FAGA účinnější než finasterid 5 mg/den i cyproteron acetát 50 mg/den [14]. Jeho limitací je hepatotoxicita.
Lokální antiandrogeny
Fluridil je nesteroidní antiandrogen, který je metabolizován lokálně, bez systémové absorpce a antiandrogenní aktivity. Při aplikaci u mužů s MAGA bylo zjištěno vyšší zastoupení anagenních vlasů, maximálního efektu bylo dosaženo za 90 dnů. Nebyly zaznamenány žádné nežádoucí účinky na sexuální funkce, ale zatím neexistuje dostatek spolehlivých studií. Stejně tak není dostatek důkazů pro užití fluridilu u FAGA.
Analoga prostaglandinu
Latanoprost, bimatoprost, travoprost byla původně léčiva pro terapii glaukomu. Při lokální aplikaci byl zaznamenán růst řas a obočí. Pravděpodobně ovlivněním dermální papily působí tato léčiva navození anagenní fáze v telogenním folikulu. Zkouší se i injekční aplikace do kůže kštice. Uplatnění je zatím v terapii alopecia areata (viz dále).
Lokální antimykotika a antibiotika
Při použití ketokonazolu v šamponu byl prokázán zvýšený růst vlasů ve srovnání s placebem. Zdá se, že ketokonazol může být vhodným doplňkem léčby AGA díky svým protizánětlivým a antiandrogenním účinkům. Kromě toho má efekt na seboroickou dermatitidu.
Perorálně podávaný ketokonazol vykazoval efekt u léčby hirsutismu, ale má výrazné nežádoucí účinky.
Růstové faktory, cytokiny
Řada růstových faktorů a cytokinů reguluje vývoj vlasového folikulu a jeho cyklickou aktivitu. Výzkum se zaměřuje na tyto látky aplikované lokálně nebo subkutánně, jedná se například o follistatin, růstový faktor pro keratinocyty (keratinocyte growth factor, KGF), VEGF. Díky obsahu růstových faktorů a stimulačních mediátorů se testuje také plazma bohatá na destičky, výsledky jsou zatím slibné.
Různé
Lokální retinoidy ovlivňují proliferaci a diferenciaci keratinocytů, mají protizánětlivý efekt a mohou stimulovat vaskulární proliferaci. V kombinaci s minoxidilem je diskutována také lepší absorpce minoxidilu. V provedených studiích jsou ale výsledky při kombinované léčbě minoxidilem s tretinoinem nejednotné.
Kofein – uvádí se – zastavuje progresi AGA a navozuje nový růst vlasů. Studie prokazující tyto účinky ale nejsou k dispozici.
Lokální aplikace melatoninu v koncentraci 0,1 % po dobu 6 měsíců v ojedinělé studii prokázala zvýšené množství anagenních vlasů v trichogramu u žen s FAGA nebo s difuzním effluviem. Další studie ale nejsou k dispozici.
Nefarmakologické možnosti
Pozitivní efekt přináší také aplikace různých druhů laserů či jiných světelných zdrojů. A samostatnou kapitolou jsou chirurgické výkony zahrnující vlasovou transplantaci a redukční výkony nebo kombinace obou možností.
Pokud je u nejizvících alopecií výpad ložiskový, je hlavní jednotkou alopecia areata.
Alopecia areata
Alopecia areata (AA) je tkáňově specifická autoimunitní choroba vlasového folikulu, která je zřejmě spouštěna zevními faktory u geneticky vnímavých jedinců. Etiopatogeneze není zcela objasněna. V histologickém obraze je charakteristický lymfocytární zánětlivý infiltrát lokalizovaný peri a intrabulbárně, který se připodobňuje k rojům včel. Tento zánět ovlivňuje aktivitu folikulu, což vede k tvorbě tenkého, dystrofického vlasu s miniaturizací folikulu [15].
Terapie alopecia areata
Vzhledem k tomu, že během jednoho roku dochází ke spontánní remisi až u 80 % pacientů [16] s ložiskovou, lokalizovanou AA, je jednou z možností jen observace stavu. Nicméně je k dispozici řada různých terapeutických možností a výběr se obvykle řídí podle rozsahu výpadu, aktivity choroby, doby trvání onemocnění, věku a jistě i podle přání pacienta.
Kortikoterapie
Již klasickou možností terapie jsou kortikosteroidy pro jejich protizánětlivý efekt. Lokální aplikace kortikosteroidů je sice široce užívanou metodou, ale její účinnost je stále kontroverzní. Používány jsou různé druhy kortikosteroidů, převážně ze skupiny silně účinných látek, např. 0,1% betametason valerát, 0,05% betametason dipropionát, 0,05% klobetasol, s různým efektem léčby (od 28,5 do 61 %). Relapsy se vyskytují u 37,5 % léčených. U dětí se volí středně silné kortikosteroidy.
Lokální kortikosteroidy mohou obtížně pronikat do hloubky vlasového bulbu, proto jsou obvykle aplikovány pod okluzí, která ale také může zhoršovat míru nežádoucích účinků. Z těch je nejčastější folikulitida, atrofie, teleangiektazie. V prevenci atrofie je možné kortikosteroidy aplikovat každý druhý den. Ve studiích byl potvrzen efekt léčby 0,05% klobetasol propionátem bez systémových nežádoucích účinků [17].
Intralezionální aplikace kortikosteroidů je vhodnou modalitou léčby pro dospělé pacienty s ložiskovou AA, s postižením kštice menším než 50 %. Pozitivní efekt je doložen u 60−75 % léčených. Obvykle je doporučován triamcinolon acetonid v různých koncentracích. Pro kštici v koncentraci 10 mg/ml, pro obočí a obličej v koncentraci 2,5 mg/ml. Aplikuje se do horní subcutis v řadě vpichů vzdálených od sebe 1 cm, v množství 0,1 ml každých 4−6 týdnů. Maximální dávka nemá přesáhnout 20 mg na aplikaci. Růst vlasů bývá patrný po čtyřech týdnech. Pokud se účinek neprojeví do 6 měsíců, má být aplikace ukončena.
Častým nežádoucím účinkem, obvykle ale jen dočasným, je atrofie. Riziko lze minimalizovat vyvarováním se povrchové aplikace, minimalizováním objemu a koncentrace kortikosteroidů a distribucí vpichů. Další nežádoucí účinky představují hypopigmentace a teleangiektazie.
Dalším používaným kortikosteroidem je betametason dipropionát, jehož účinnost i nežádoucí účinky v koncentraci 1,25 mg/dl byly hodnoceny jako nejlepší pro léčbu lokalizované AA u dospělých [18].
Perorální kortikosteroidy jsou podávány v různých schématech každý den, jednou za týden a také v měsíčních pulzech. Obecně vyšší účinnost prokazují u časných projevů AA než u projevů chronických. Mají řadu kontraindikací a nežádoucích účinků a relapsy jsou uváděny u 14−100 % léčených.
Minoxidil
Minoxidil měl v některých studiích dobrou účinnost, v jiných nikoliv. V 5% koncentraci při aplikaci 2× denně byl tento přípravek účinnější než při podání ve 2% koncentraci. Účinnější byla i kombinace minoxidilu s lokálními nebo intralezionálními kortikosteroidy či s anthralinem.
Anthralin
Anthralin (dithranol) je dráždivá látka. Cílem aplikace je mírná iritační reakce. Obvykle bývá používán v nižších koncentracích (0,5−1% krém), ale jsou zprávy také o dobrém efektu vyšší, 3% koncentrace anthralinu.
Kontaktní senzibilizátory
V lokální imunoterapii pomocí kontaktních senzibilizátorů se využívá schopnosti silných kontaktních alergenů navodit a opakovaně vyvolat alergickou kontaktní dermatitidu v oblasti postižené AA. Původně používaný dinitrochlorobenzen se pro mutagenní efekt přestal užívat (ačkoliv některé nové výzkumy jeho kancerogenitu zpochybňují). Používají se difenylcyklopropenon (difencypron) a dibutylester kyseliny squarové, které jsou nemutagenní, mají srovnatelnou účinnost (kolem 50−60 %) i podobné procento relapsů. V klinické studii s difenylcyklopropenonem z roku 2010 byla prokázána excelentní účinnost (88−100 %) u pacientů s ložiskovou AA, u rozsáhlých forem kolem 60 % a 17 % u pacientů s alopecia totalis nebo s alopecia universalis [19].
Fototerapie
PUVA (psoralen and ultraviolet A) terapie je léčba, která kombinuje UV záření s látkou, jež zvýší citlivost kůže k ultrafialovému záření. Její efekt se u AA projeví díky snížení perifolikulárního zánětlivého infiltrátu. Některé studie prokázaly vynikající účinnost až u 85 % pacientů [20]. Takzvaná turban PUVA (varianta koupelové PUVA terapie pro oblast kštice, ručník nasáklý roztokem 8 methoxypsoralenu) a turban PUVASOL (psoralen a sluneční světlo) byly také účinné.
Další možností v terapii AA je excimerový laser 308 nm. Studie prokazují pozitivní efekt při terapii ložisek AA ve kštici, ev. v oblasti vousů, špatný efekt u ložisek na končetinách [21]. Pozitivní výsledky (zárůst 60 % ložisek ve kštici) byly prokázány také u dětí [22].
Analoga prostaglandinů
První studie s latanoprostem a bimatoprostem nepřinesly dobré výsledky, ale zprávy z poslední doby prokázaly pozitivní efekt v terapii růstu řas u alopecia universalis. Bimatoprost v koncentraci 0,03 % byl aplikován na okraje víček a u 43,2 % pacientů s alopecia universalis došlo ke kosmeticky dobrému růstu řas. Od roku 2008 je americkým FDA schválen 0,03% roztok bimatoprostu k prodloužení, zesílení a ztmavnutí řas u pacientů s hypotrichózou řas nebo z kosmetických důvodů.
Další zkoušené látky
Lokální inhibitory kalcineurinu takrolimus a pimekrolimus byly neúčinné.
Systémová terapie
Cyklosporin A je imunosupresivní látka, která inhibuje Th lymfocyty a tlumí produkci interferonu gama. Výsledky léčby AA nejsou jednotné, s efektem 25−76,7 %. Použití cyklosporinu je omezené z důvodu velkého množství nežádoucích účinků (nefrotoxicita, imunosuprese, hypertenze) a vysokého procenta relapsů. Byl zkoušen i lokální 10% cyklosporin, který nebyl účinný. Podávání metotrexátu v dávce 15−25 mg/týden, někdy v kombinaci s prednisonem (10−20 mg/den), mělo efekt na růst u 57 % (resp. 63 %) pacientů s AA. Růst vlasů byl pozorován za tři měsíce. K relapsu došlo u 80 % sledovaných [23].
Terapie azathioprinem v denní dávce 2 mg/kg po dobu 6 měsíců vedla ke zvýšení růstu vlasů u 52,3 % léčených.
U biologických léčiv (infliximab, etanercept, adalimumab, efalizumab) nebyl efekt léčby prokázán.
Na základě nových poznatků v patogenezi onemocnění se, zatím v malých studiích, osvědčily modality léčby, které ovlivňují specifické cílové molekuly, jako jsou inhibitory Janusových kináz, abatacept, interleukin 2, Hu Mik β1, interferonγ, plazma bohatá na destičky [24].
Alopecia syphilitica
Alopecia syphilitica je méně častým projevem sekundárního stadia syfilis (3−11 % pacientů). Nejčastěji se jedná o ložiskovou alopecii, která se přirovnává k „vykousání od molů“, méně často jde o difuzní prořídnutí nebo o kombinaci obou. Kromě kštice mohou být postiženy i ostatní ochlupené oblasti těla. Často jsou přítomny další kožní nebo slizniční změny sekundárního stadia syfilis, ale alopecie může být i jen jediným projevem.
Léčba spočívá v aplikaci 2,4 MIU benzatin penicilinu G intramuskulárně. Výpad vlasů je reverzibilní a zastavuje se do tří měsíců od léčby.
Trakční alopecie
Trakční alopecie je způsobena dlouhodobým, opakovaným tahem za vlasy způsobeným různými účesy (např. velmi utažený vyčesaný culík). Nejčastěji se vytváří v oblasti frontální a temporální. V počátečních stadiích je výpad reverzibilní, pokud ale tah trvá dlouhodobě, může dojít k poškození vlasového folikulu a k permanentní alopecii. V léčbě je nejdůležitější eliminovat tah vyvíjený na vlasy. V časných stadiích se aplikují lokální či intralezionální kortikoidy a lokální či systémová antibiotika k potlačení zánětu. Někteří autoři doporučují lokální aplikaci minoxidilu [25]. Pro řešení rozsáhlé trakční alopecie lze použít chirurgické metody.
Trichotillomania
Trichotillomania je obsedantně kompulzivní porucha s chronickým nutkavým vytrháváním vlasů/chlupů, která obvykle vzniká jako reakce na stres nebo jako projev psychiatrické choroby. Léčba zahrnuje psychologické či psychiatrické konzultace, behaviorální terapii, případně psychotropní medikaci, jako je sertralin nebo klomipramin. Nově byl zjištěn efekt podávání N acetylcysteinu.
Tinea capitis
Tinea capitis je povrchová infekce keratofilními plísněmi – dermatofyty. Nejčastěji se vyskytuje u dětí ve věku od šesti měsíců do puberty. V našich zeměpisných oblastech je nejčastějším vyvolavatelem zoofilní Microsporum canis. Nutná je léčba celkově podávanými antimykotiky. V doporučeních uváděný griseofulvin u nás není registrován. Pokud je vyvolavatelem Trichophyton spp., obvykle bývá citlivý na terbinafin a postačující dobou terapie jsou 2−4 týdny. Pokud je vyvolavatelem Microsporum canis, bývá zjišťována vyšší citlivost na itrakonazol (event. flukonazol) a léčba často musí trvat déle (4−6 týdnů). Lokální terapie je jen podpůrná. Lokální antimykotikum má být jiného typu než celkové.
Závěr
Ačkoliv terapeutických možností pro jednotlivé typy alopecií přibývá, ne vždy léčba přináší žádoucí efekt nebo má závažné nežádoucí účinky. Stále zůstává základním požadavkem edukace pacienta, vysvětlení příčin, průběhu léčby a nastavení reálných očekávání. Každý nový objev jistě otevírá novou cestu, ale pohovor s pacientem s cílem zmírnit jeho obavy je naprosto nenahraditelný. Stejně tak je ale pro lékaře nezbytné vyrovnat se s pocitem, že ne vždy může naplnit představy pacienta a přijmout jeho někdy negativní reakci na informace o možnostech a výsledcích léčby.
Seznam použité literatury
- [1] Ohyama M. Primary cicatricial alopecia: recent advances in understanding and management. J Dermatol 2012; 39: 18–26.
- [2] Harries MJ, Sinclair RD, Donald‑Hull M, et al. Management of primary cicatricial alopecias: Options for treatment. Br J Dermatol 2008; 159: 1−22.
- [3] Trüeb R. Chemotherapy‑induced Hair Loss. Skin Therapy Lett 2010; 15: 5−7.
- [4] Yeager CE, Olsen EA. Treatment of chemotherapy‑induced alopecia. Dermatol Ther 2011; 24: 432–442.
- [5] Tosti A, Misciali C, Piraccini BM, et al. Drug induced hair loss and hair growth. Drug Saf 1994; 10: 310−317.
- [6] Nayak K, Garg A, Mithra P, Manjrekar P. Serum Vitamin D3 Levels and Diffuse Hair Fall among the Student Population in South India: A Case‑Control Study. Int J Trichology 2016; 8: 160−164.
- [7] Guo EL, Katta R. Diet and hair loss: effects of nutrient deficiency and supplement use. Dermatol Pract Concept 2017; 7: 1−10.
- [8] Sinclair R, Torkamani N, Jones L. Androgenetic alopecia: newinsights into the pathogenesis and mechanism of hair loss. F1000Res 201519; 4 (F1000 Faculty Rev): 585.
- [9] Olsen EA, Dunlap FE, Funicella T, et al. A randomized clinical trial of 5% topical minoxidil versus 2% topical minoxidil and placebo in the treatment of androgenetic alopecia in men. J Am Acad Dermatol 2002; 47: 377–385.
- [10] Friedman ES, Friedman PM, Cohen DE, Washenik K. Allergic contact dermatitis to topical minoxidil solution: etiology and treatment. J Am Acad Dermatol 2002; 46: 309−312.
- [11] Roberts JL, Fiedler V, Imperato‑McGinley J, et al. Clinical dose ranging studies with finasteride, a type 2 5alpha‑reductase inhibitor, in men with male pattern hair loss. J Am Acad Dermatol 1999; 41: 555−563.
- [12] Fertig R, Shapiro J, Bergfeld W, Tosti A. Investigation of the Plausibility of 5‑Alpha‑Reductase Inhibitor Syndrome. Skin Appendage Disord 2017; 2: 120–129.
- [13] Shanshanwal SJ, Dhurat RS.Superiority of dutasteride over finasteride in hair regrowth and reversal of miniaturization in men with androgenetic alopecia: A randomized controlled open‑label, evaluator‑blinded study. Indian J Dermatol Venereol Leprol 2017; 83: 47−54.
- [14] Carmina E, Lobo RA. Treatment of hyperandrogenic alopecia in women. Fertil Steril 2003; 79: 91–95.
- [15] Wang E, McElwee KJ. Etiopathogenesis of alopecia areata: Why do our patients get it? Dermatol Ther 2011; 24: 337−344.
- [16] Ito T. Advances in the management of alopecia areata. J Dermatol 2012; 39: 11–17.
- [17] Tosti A, Piraccini BM, Pazzaglia M, Vincenzi C. Clobetasol propionate 0.05% under occlusion in the treatment of alopecia totalis/universalis. J Am Acad Dermatol 2003; 49: 96−98.
- [18] Ustuner P, Balevi A, Özdemir M. Best dilution of the best corticosteroid for intralesional injection in the treatment of localized alopecia areata in adults. J Dermatolog Treat 2017; 30: 1−9.
- [19] Singh G, Lavanya M. Topical immunotherapy in alopecia areata. Int J Trichology 2010; 2: 36−39.
- [20] Mohamed Z, Bhouri A, Jallouli A, et al. Alopecia areata treatment with a phototoxic dose of UVA and topical 8‑methoxypsoralen. J Eur Acad Dermatol Venereol 2005; 19: 552−555.
- [21] Al‑Mutarini N. 308‑nm excimer laser for the treatment of alopecia areata. Dermatol Surg 2007; 33: 1483−1487.
- [22] Al‑Mutarini N. 308‑nm excimer laser for the treatment of alopecia areata in children. Pediatr Dermatol 2009; 26: 547−550.
- [23] Shapiro J. Current treatment of alopecia areata. J Investig Dermatol Symp Proc 2013; 16: 42−44.
- [24] Trink A, Sorbellini E, Bezzola P, et al. A randomized, double‑blind, placebo and active‑controlled, half‑head study to evaluate the effects of platelet rich plasma on alopecia areata. Br J Dermatol 2013; 169: 690−694.
- [25] Khumalo NP, Ngwanya RM. Traction alopecia: 2% topical minoxidil shows promise. Report of two cases. J Eur Acad Dermatol Venereol 2007; 21: 433–434.