Ankylozující spondylitida
Ankylozující spondylitida (Bechtěrevova nemoc) je poměrně časté chronické zánětlivé revmatické onemocnění ze skupiny spondylartritid. Je příčinou časté disability a invalidity svých nositelů a vede k významnému snížení kvality jejich života. Relativně pozdní výskyt radiografických známek sakroiliitidy vedl ke zpoždění v diagnostice ankylozující spondylitidy. Proto byla vyvinuta nová kritéria pro tzv. axiální spondylartritidu, při jejíž diagnostice využíváme mimo jiné i magnetickou rezonanci. Léčebné možnosti ankylozující spondylitidy byly před nástupem biologické léčby zcela omezené, neboť důkazy účinnosti terapie u tohoto onemocnění existovaly pouze pro dlouhodobou rehabilitaci a cvičení, pro nesteroidní antirevmatika, lokálně aplikované kortikosteroidy a sulfasalazin podávaný při periferních formách s artritidou periferních kloubů. Biologická léčba je tak velkým pokrokem v terapii ankylozující spondylitidy, neboť je první účinnou léčbou, která působí nejen symptomaticky, ale také rychle a efektivně snižuje hladinu reaktantů akutní fáze a současně i intenzitu zánětu na magnetické rezonanci, má vliv na výskyt extraartikulárních manifestací, vede ke zlepšení funkčních schopností a rovněž zlepšuje kvalitu života i práceschopnost nemocných. V současné době je pro léčbu ankylozující spondylitidy v Evropě i v USA schváleno pět léčivých přípravků: monoklonální chimérická protilátka infliximab, dvě plně humánní monoklonální protilátky adalimumab a golimumab, a dále plně humánní dimerický fúzovaný protein etanercept a nově certolizumab, což je rekombinantní humanizovaný Fab fragment protilátky proti tumor nekrotizujícímu faktoru alfa konjugovaný s polyethylenglykolem.
Úvod
Ankylozující spondylitida (AS) neboli Bechtěrevova nemoc je chronické zánětlivé onemocnění nejasné etiologie, které patří do skupiny spondylartritid (SpA). Je charakterizované zánětlivou bolestí zad, sakroiliitidou, spondylitidou, artritidou intervertebrálních kloubů a tvorbou syndesmofytů (přemosťující kostěná spojka mezi obratli). Všechny tyto změny mohou vést až k ankylóze. Diagnóza AS se dosud opírá o tzv. newyorská diagnostická kritéria z roku 1984, podle nichž musí být k jejímu stanovení splněno kromě klinický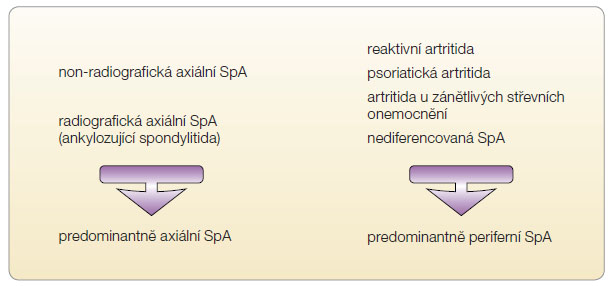 ch kritérií (bolest, zkrácení distancí či zkrácení dýchacích exkurzí) i kritérium radiologické (nález sakroiliitidy na rentgenu). Tato podmínka však vede ke značnému zpoždění v diagnóze AS, neboť rentgenové známky sakroiliitidy se mohou projevit až po několika letech od doby, kdy se objeví první potíže.
ch kritérií (bolest, zkrácení distancí či zkrácení dýchacích exkurzí) i kritérium radiologické (nález sakroiliitidy na rentgenu). Tato podmínka však vede ke značnému zpoždění v diagnóze AS, neboť rentgenové známky sakroiliitidy se mohou projevit až po několika letech od doby, kdy se objeví první potíže.
Je známo, že celosvětově je stanovení diagnózy AS od výskytu prvních projevů tohoto onemocnění zpožděno v průměru o sedm až devět let. Důvodem tohoto zpoždění je jednak stále malé povědomí nerevmatologů o AS i ostatních SpA a také relativně pozdní výskyt radiografických známek sakroiliitidy [1]. Mezinárodní skupina expertů ASAS (Assessment of SpondyloArthritis International Society) proto v posledních letech vytvořila novou k![Obr. 2 Klasifikační kritéria ASAS pro axiální spondylartritidu; podle [3] – Rudwaleit, et al., 2009. ASAS – Assessment of SpondyloArthritis International Society; CRP – C-reaktivní protein; HLA – human leukocyte antigen; NSA – nesteroidní antirevmatika; SpA – spondylartritida](https://www.remedia.cz/photo-a-29523---.jpg) oncepci celé skupiny SpA (obr. 1); byla vyvinuta nová klasifikační kritéria pro tzv. non-radiografickou axiální SpA, která umožňují stanovit diagnózu již v časnějších stadiích onemocnění (obr. 2) [2, 3].
oncepci celé skupiny SpA (obr. 1); byla vyvinuta nová klasifikační kritéria pro tzv. non-radiografickou axiální SpA, která umožňují stanovit diagnózu již v časnějších stadiích onemocnění (obr. 2) [2, 3].
Důležitou zobrazovací metodou, která se stala nezbytnou při diagnóze časných stadií SpA, je magnetická rezonance. Ta pomáhá diagnostikovat akutní zánětlivé změny, především v oblasti sakroiliakálních kloubů a páteře (výpotek, edém kostní dřeně), ale i chronické strukturální změny (eroze, kostní můstky atd.). Byla vypracována nová modifikovaná kritéria pro hodnocení zánětlivé páteřní bolesti, která s poměrně vysokou specificitou umožňují včas identifikovat pacienty se suspekcí na SpA. Skupina expertů také pracuje na vytvoření strategií, které by poskytovaly návody pro praktické lékaře i ostatní specialisty ohledně určení termínu, kdy je třeba odeslat pacienta k revmatologovi [4].
Cíle léčby u pacientů s AS
Účinná léčba AS by měla samozřejmě na prvním místě odstranit subjektivní potíže nemocného, tedy zánětlivou páteřní bolest, která je spojena s výraznou ranní ztuhlostí. Léčba by měla ovlivňovat i bolesti vycházející z mimopáteřních postižených struktur (periferní klouby a enteze), dále systémové příznaky onemocnění (výrazná únava, případné subfebrilie, úbytek hmotnosti atd.); terapie by měla působit i na extraartikulární manifestace onemocnění (uveitidy, nespecifické kolitidy atd.). V neposlední řadě by terapie měla také pomoci udržovat pohyblivost páteře, eventuálně přispět i ke zlepšení její flexibility. Ideální léčba by samozřejmě měla zastavit, nebo alespoň výrazně zpomalit rentgenovou progresi onemocnění. Konečným cílem léčby je pak zlepšení kvality života nemocných a umožnění setrvávat v pracovním procesu, případně se do něj navrátit.
Dosavadní konvenční terapie AS
Evr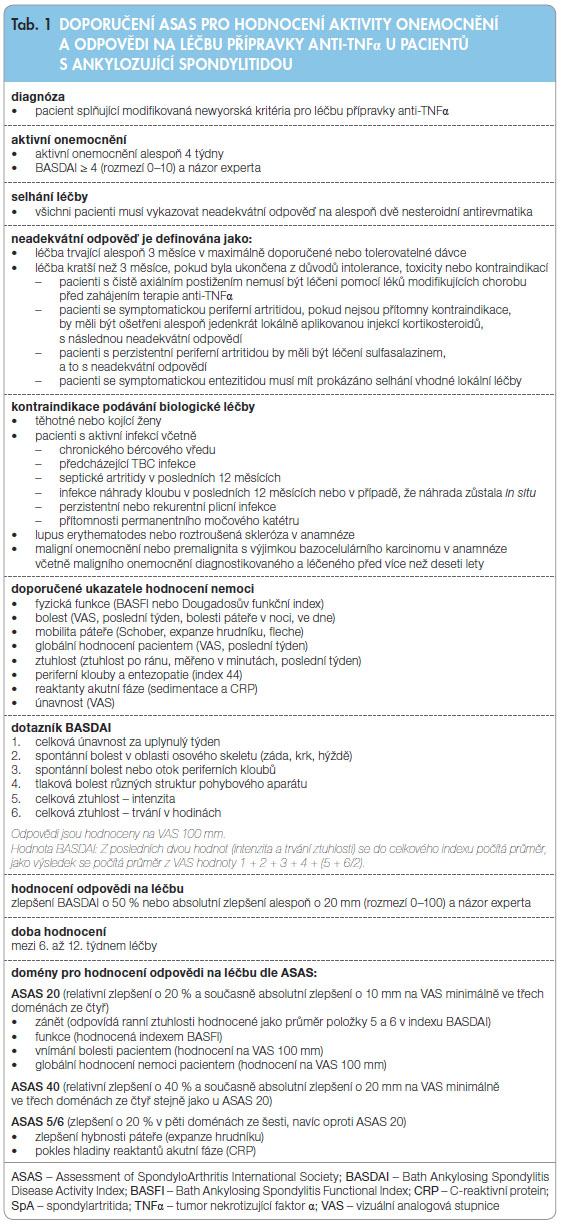 opská liga proti revmatismu (EULAR) publikovala doporučení pro léčbu AS [2, 3, 5]. Byla určena pravidla, dle kterých je indikováno podávání léčiv blokujících TNFα (tumor nekrotizující faktor α) u pacientů s AS, včetně toho, že byly definovány ukazatele hodnocení aktivity onemocnění (tab. 1). Je totiž nutné odlišit hodnocení aktivity, které se soustřeďuje na intenzitu zánětu a symptomů, od hodnocení strukturální progrese, jehož těžiště spočívá v zobrazovacích metodách.
opská liga proti revmatismu (EULAR) publikovala doporučení pro léčbu AS [2, 3, 5]. Byla určena pravidla, dle kterých je indikováno podávání léčiv blokujících TNFα (tumor nekrotizující faktor α) u pacientů s AS, včetně toho, že byly definovány ukazatele hodnocení aktivity onemocnění (tab. 1). Je totiž nutné odlišit hodnocení aktivity, které se soustřeďuje na intenzitu zánětu a symptomů, od hodnocení strukturální progrese, jehož těžiště spočívá v zobrazovacích metodách.
V minulosti byl vyvinut speciální index hodnotící aktivitu onemocnění – BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) [6], což je pacientem vyplněný dotazník. Tento index se stal součástí doporučení ASAS k hodnocení aktivity onemocnění stejně jako index pro hodnocení fyzických funkcí nemocného – BASFI (Bath Ankylosing Spondylitis Functional Index) [7], který vyplňuje pacient sám (tab. 1). Nově byl skupinou ASAS vyvinut index ASDAS (Ankylosing Spondylitis Disease Activity Score), což je nový kompozitní index zahrnující také hodnotu CRP (C-reaktivní protein) nebo sedimentace [7]. Tato skupina také navrhla definici léčebné odpovědi (tab. 1). Pravidla pro indikace pacientů s AS vhodných pro tuto léčbu a hodnocení léčebné odpovědi vydala také Česká revmatologická společnost [9], její doporučení je také založeno na doporučení ASAS.
Spolehlivá evidence účinnosti léčby u AS existuje pouze pro dlouhodobou rehabilitaci a cvičení, nesteroidní antirevmatika (NSA), lokálně aplikované kortikosteroidy a sulfasalazin u periferních forem s artritidou periferních kloubů. Byla provedena řada studií se sulfasalazinem sledujících jeho účinek na axiální i periferní symptomatologii. Dvě studie, které se zaměřily přímo na hodnocení účinku sulfasalazinu na axiální bolest, zjistily statisticky významné zlepšení na VAS (vizuální analogová stupnice) v porovnání s placebem (9 mm vs. 6,9 mm, p < 0,005, a 24,3 mm vs. 5,6 mm, p < 0,05) [10, 11]. Metaanylýza studií se sulfasalazinem však neprokázala signifikantní vliv na bolesti páteře u AS v porovnání s placebem (p = 0,06) [12]. Nebyla prokázána účinnost ani u ostatních léků modifikujících chorobu (DMARDs, disease modifying anti-rheumatic drugs) používaných například u revmatoidní artritidy, a to včetně methotrexátu i leflunomidu; účinné nejsou ani systémově podávané kortikosteroidy.
Základem dosavadní terapie AS tedy zůstávají NSA a soustavné cvičení zaměřené na prevenci vzniku ankylóz. V posledních letech bylo také prokázáno, že kouření je spojeno s časnějším výskytem a těžším průběhem onemocnění, stejně jako i s rychlejší radiologickou progresí u pacientů s AS. Mezinárodní sdružení pacientských organizací ASIF (Ankylosing Spondylitis International Fedaration) vydalo v tomto roce doporučení pro chování a režimová opatření u pacientů s AS; dodržování těchto režimových opatření představuje základ terapie AS [13]. Konvenční léčba tak může příznivě ovlivnit bolest a ranní ztuhlost a dále do jisté míry zlepšuje pohyblivost páteře, není však schopna ovlivnit přirozený průběh onemocnění a účinně zastavit, nebo alespoň výrazně snížit aktivitu zánětlivého procesu.
Biologická léčba AS
V posledních deseti letech byla do terapie AS zavedena biologická léčba, a to v podobě přípravků blokujících TNFα (terapie anti-TNFα). V současné době jsou pro léčbu AS v Evropě i v USA schváleny čtyři léčivé přípravky: monoklonální chimérická protilátka infliximab, která je podávána intravenózně v podobě infuzí v dávce 3–5 mg/kg každých 6–8 týdnů, dále plně humánní monoklonální protilátka adalimumab podávaná v dávce 40 mg subkutánně jedenkrát za dva týdny, plně humánní protilátka golimumab aplikovaná podkožně v dávce 50 mg 1krát měsíčně a plně humánní dimerický fúzovaný protein etanercept, složený z extracelulární části humánního proteinu p75kD receptoru pro TNFα a Fc části humánního IgG1 (imunoglobulinu G1). Tento je podáván v dávce 50 mg subkutánně 1krát týdně.
Úspěch terapie anti-TNFα u SpA pravděpodobně představuje tzv. class-effect celé této skupiny léčiv. Existují důkazy, že tato léčba působí u SpA dokonce lépe než u revmatoidní artritidy. Bylo zjištěno, že tzv. přežívání na biologické léčbě, tedy doba, po kterou není biologická léčba přerušena z důvodů nežádoucích účinků či nedostatečné účinnosti, je delší u pacientů s AS a psoriatickou artritidou než u nemocných s revmatoidní artritidou.
Předvídat, u kterých pacientů bude podávání blokátorů TNFα účinné, je obtížné, nicméně v současnosti existuje shoda, že by to měli být především pacienti s časným stadiem onemocnění, pacienti mladšího věku, s vysokou hodnotou CRP a s pozitivním nálezem zánětu na MRI (magnetic resonance imaging) nebo jedinci s menším strukturálním postižením [14–16]. V tomto ohledu se dnes klade důraz na včasnou diagnostiku AS a u aktivních forem i na včasné zahájení léčby, a to dříve, než dojde k nezvratným strukturálním změnám.
V několika studiích bylo prokázáno, že terapie přípravky anti-TNFα má dobrý účinek i u non-radiografické axiální SpA, tedy ve stadiu onemocnění, kdy pacient ještě nemusí splňovat kritéria pro AS [17, 18]. Adalimumab byl až do současnosti jedi-
ným přípravkem, který bylo možné v Evropě podávat v léčbě non-radiografické SpA, nově lze dle Evropské lékové komise EMA (European Medicines Agency) v této indikaci podávat i certolizumab. Současně ale bylo prokázáno, že anti-TNFα léčba je účinná i u pacientů, kteří trpí pokročilou formou onemocnění [19, 20]. Dosud se neprokázalo, že by některý přípravek blokující TNFα byl účinnější než ostatní [21].
Infliximab
Vysoká a rychlá účinnost stejně jako i bezpečnost infliximabu v terapii AS byla doložena řadou klinických i randomizovaných studií. V nich bylo prokázáno, že infliximab významně ovlivňuje aktivitu AS, a to kloubní i mimokloubní formy, přispívá ke zlepšení funkčních schopností pacientů a významně zvyšuje kvalitu jejich života. U řady nemocných pak infliximab vede k navození úplné remise onemocnění.
V loňském roce byly zveřejněny výsledky již desetiletého sledování úspěšnosti léčby infliximabem, kdy z původně 69 zařazených pacientů setrvalo v užívání 42 pacientů (60,8 %) po dobu pěti let a 29 pacientů (42,2 %) po dobu celých deseti let [22]. Již po dvanácti týdnech podávání léčby výrazně poklesly hodnoty ASDAS a tento významný pokles trval po celou dobu, tj. po celých deset let podávání. Nutné je zdůraznit, že nejčastějším důvodem ukončení tohoto dlouhodobého sledování byl výskyt nežádoucích účinků (infuzní reakce, elevace jaterních testů a další); nedostatečná účinnost byla důvodem k ukončení terapie pouze u tří (4,3 %) jedinců, což potvrzuje dlouhodobý a přetrvávající efekt infliximabu v léčbě AS.
Také ve studii ASSERT byla hodnocena účinnost infliximabu podávaného v dávce 5 mg/kg každých 6 týdnů pacientům s AS [23]. Do této randomizované dvojitě slepé studie bylo zařazeno celkem 279 nemocných. Klinická odpověď byla velmi rychlá, nástup účinku se objevil během dvou týdnů a účinnost byla stálá po celou dobu sledování (tj. 24 týdnů). Odpovědi ASAS 40 dosáhlo ve skupině léčené infliximabem 47 % pacientů, zatímco ve skupině dostávající placebo to bylo 12 % pacientů. Ve studii byla také zobrazením na MRI prokázána významná redukce zánětu v oblasti páteře, kdy došlo k výraznému poklesu tzv. MRI skóre aktivity u pacientů léčených infliximabem.
Po 24 týdnech léčby ve studii ASSERT přestoupili všichni pacienti do otevřené fáze sledování, kde dostávali infliximab v dávce 5 mg/kg. Stejná redukce zánětu byla na MRI pozorována i v týdnu 102 trvání studie. Na rozdíl od revmatoidní artritidy však nebylo dosud v žádné prospektivní studii prokázáno zpomalení rentgenové progrese, a to u žádného z přípravků anti-TNFα. Pouze Konsta a kol. ve své studii zjistili, že podáním infliximabu je možné zpomalit radiografickou progresi koxitidy [24].
Účinnost infliximabu byla prokázána i u non-radiografické axiální SpA. Do studie INFAST bylo zahrnuto 156 pacientů s non-rad![Graf 1 Studie INFAST: procento pacientů léčených infliximabem v kombinaci s naproxenem a naproxenem podávaným s placebem, kteří dosáhli parciální remise; dle [18] – Sieper, et al., 2013. Parciální remise bylo dosaženo, pokud hodnoty nebyly vyšší než 2 v následujících doménách: pacientovo globální hodnocení, bolest, funkce a zánět.](https://www.remedia.cz/photo-a-29525---.jpg) iografickou axiální SpA, kteří splňovali nová vstupní kritéria pro axiální SpA a dosud nebyli léčeni NSA nebo nereagovali dostatečně na submaximální dávku NSA [18]. Pacienti byli ve studii léčeni buď infliximabem podávaným v dávce 5 mg/kg společně s naproxenem v dávce 500 mg 2krát denně, nebo naproxenem v dávce 2krát denně 500 mg společně s placebem. Ve 28. týdnu dosáhlo parciální remise 61 % pacientů léčených kombinací infliximab plus naproxen, zatímco při léčbě samotným naproxenem dosáhlo remise 36,3 % pacientů (p = 0,0021). Při podávání kombinace byly výsledky signifikantně lepší již od druhého týdne léčby (graf 1).
iografickou axiální SpA, kteří splňovali nová vstupní kritéria pro axiální SpA a dosud nebyli léčeni NSA nebo nereagovali dostatečně na submaximální dávku NSA [18]. Pacienti byli ve studii léčeni buď infliximabem podávaným v dávce 5 mg/kg společně s naproxenem v dávce 500 mg 2krát denně, nebo naproxenem v dávce 2krát denně 500 mg společně s placebem. Ve 28. týdnu dosáhlo parciální remise 61 % pacientů léčených kombinací infliximab plus naproxen, zatímco při léčbě samotným naproxenem dosáhlo remise 36,3 % pacientů (p = 0,0021). Při podávání kombinace byly výsledky signifikantně lepší již od druhého týdne léčby (graf 1).
Druhá část studie (INFAST2) byla pak pokračovací pro pacienty, kteří dosáhli parciální remise onemocnění ve 28. týdnu [25]. Tito nemocní pak byli sledováni dalších šest měsíců a po tuto dobu dostávali buď naproxen v dávce 500 mg 2krát denně nebo placebo. Bylo zjištěno, že nízká aktivita nemoci a nízký počet vzplanutí onemocnění přetrvávaly po celou dobu sledování v obou skupinách, a to jak u pacientů dostávajících naproxen, tak i u pacientů bez pokračovací terapie.
Etanercept
V letošním roce byly publikovány výsledky studií sledujících účinnost a bezpečnost podávání etanerceptu u pacientů, kteří jím byli léčeni po dobu sedmi let v dávce 25 mg 2krát denně, a to bez souběžně podávaných DMARDs nebo steroidů. Z celkového počtu 26 pacientů dokončilo dvouleté sledování 26 (81 %) pacientů a 16 (62 %) pacientů dokončilo sedmileté období sledování; 31 % pacientů dosáhlo parciální remise dle kritérií ASAS v sedmém roce, zatímco u 44 % sledovaných byla prokázána inaktivita dle kritérií ASDAS. Průměrná hodnota BASDAI, která dosahovala při zahájení léčby hodnoty 6,3 ± 0,9, prokazovala konstantní snížení a zůstala dlouhodobě nízká: 3,1 ± 2,5 ve druhém roce a 2,5 ± 2,2 v roce sedmém. Hodnoty ASDAS se také výrazně zlepšily (3,9 ± 0,7 v úvodu studie, 1,8 ± 0,9 ve druhém roce a 1,6 ± 0,8 v sedmém roce sledování, ve všech případech p < 0,001). Z deseti případů přerušení léčby ji pouze pět pacientů ukončilo k![Graf 2 Studie ASCEND: porovnání účinnosti etanerceptu a sulfasalazinu u pacientů s AS; primární cíl: podíl pacientů, kteří dosáhli odpovědi ASAS 20 v šestnáctém týdnu; dle [27] – Braun, et al., 2011.](https://www.remedia.cz/photo-a-29526---.jpg) vůli výskytu nežádoucích účinků. Pacienti, kteří dokončili sedmý rok léčby, měli v úvodu nižší hodnotu BASFI [26].
vůli výskytu nežádoucích účinků. Pacienti, kteří dokončili sedmý rok léčby, měli v úvodu nižší hodnotu BASFI [26].
Zajímavé bylo i zveřejnění výsledků studie ASCEND, která porovnávala účinnost etanerceptu s účinností sulfasalazinu u pacientů s AS. Po dobu 16 týdnů bylo sledováno celkem 379 pacientů léčených etanerceptem aplikovaným podkožně v dávce 50 mg 1krát týdně a 187 pacientů léčených sulfasalazinem v dávce maximálně 3 g denně. Zlepšení dle ASAS 20 dosáhlo v 16. týdnu 75,9 % pacientů léčených etanerceptem v porovnání s 52,9 % pacientů léčených sulfasalazinem; parciální remise dosáhlo 33,3 % oproti 15,5 % pacientů (graf 2) [27].
Jiná studie sledovala vliv léčby etanerceptem u pokročilé formy AS (studie SPINE). Po 12 týdnech léčby měl etanercept lepší účinek na zmírnění symptomů u pokročilé AS. Po 12 týdnech podávání byl zaznamenán významnější pokles BASDAI u pacientů léčených etanerceptem v porovnání s placebem (-26,4 ± 19,7 vs. -14,4 ± 19,7; p = 0,008), u celkové bolesti zad (-29,2 ± 24,0 vs. -14,9 ± 24,0; p = 0,010), BASFI (-21,7 ± 17,6 vs. -10,1 ± 17,6; p = 0,004), BASMI (-0,6 ± 0,6 vs. -0,2 ± 0,6; p = 0,011), CRP (-15,7 ± 14,2 vs. -1,3 ± 14,2; p < 0,001). Po 12 týdnech dvojitě slepé studie následovalo 12týdenní prodloužení v podobě otevřené fáze klinického sledování. I v této části došlo k rychlému zmírnění symptomů a zánětlivých známek brzy po začátku podávání etanerceptu, nicméně ke zmírňování symptomů a zlepšování zdravotního stavu pacientů docházelo nejen po celou dobu studie, ale i po ukončení 24týdenního sledování [20].
Adalimumab
Účinnost adalimumabu v léčbě AS byla ověřena během tříletého sledování, kdy z původního počtu 315 pacientů jich bylo léčeno po dobu tří let celkem 82 %. Průměrné změny hodnot od zahájení léčby byly signifikantně významné pro BASDAI (změna skóre: -3,9, p < 0,001), BASFI (změna skóre: -29,6, p < 0,001), SF-36 PCS (Short Form, Physical Component Summary; změna skóre +11,6, p < 0,001) a fyzické funkce (změna skóre +23,3, p < 0,001) [28]. Mezi sledovanými nemocnými bylo i 12 pacientů s totální spinální ankylózou. Ve dvanáctém týdnu sledování dosáhlo 50 % těchto pacientů léčených adalimumabem ASAS 20, 33 % pacientů splnilo kritéria ASAS 40, ASAS 5/6 a BASDAI 50.
Bylo také prokázáno, že adalimumab významně snižuje známky zánětu zobrazené na MRI v oblasti páteře i sakroiliakálních kloubů u pacientů s aktivní AS [29, 30]. K významnému snížení zánětlivých známek dle MRI došlo již po 12 týdnech léčby a toto zlepšení bylo pozorováno po celých 52 týdnů léčby. Za použití skórovacího systému SPARCC (Spondyloarthritis Research Consortium of Canada) bylo prokázáno, že SPARCC skóre se zvýšilo u pacientů léčených placebem průměrně o 9,4 % v porovnání s průměrným snížením skóre o 53,6 % u pacientů léčených adalimumabem.
Adalimumab byl prvním přípravkem, který ve studii prokázal účinnost i u non-radiografické axiální SpA. Ve studii ABILITY-1 bylo prokázáno, že ve 12. týdnu statisticky více pacientů léčených adalimumabem splnilo kritéria zlepšení ASAS 40 (35 % u adalimumabu vs. 15 % u placeba, p < 0,001). Byl doložen i ústup zánětlivých změn na MRI páteře i sakroilia-
kálních kloubů u pacientů léčených adalimumabem, přičemž mladší věk, kratší doba trvání choroby, vyšší CRP v úvodu choroby a vyšší hodnota SPARCC MRI na sakroiliakálních kloubech byly asociovány s lepší odpovědí na adalimumab ve dvanáctém týdnu [17].
Golimumab
Účinnost a bezpečnost golimumabu byla hodnocena v multicentrické randomizované, dvojitě zaslepené, placebem kontrolované klinické studii GO-RAISE, do níž bylo zahrnuto 356 pacientů s aktivní AS [31]. Pacienti byli opět randomizováni do tří větví, podle toho, zda dostávali subkutánní injekce placeba (n = 78), nebo 50 mg golimumabu (n = 138) nebo 100 mg golimumabu (n = 140) každé čtyři týdny. Primárním cílem bylo zjistit, jaký podíl pacientů dosahuje klinické odpovědi ASAS 20 ve čtrnáctém týdnu. Odpovědi ASAS 20 dosáhlo v tomto týdnu 59,4 % pacientů ve skupině léčené golimumabem (v dávce 50 mg podané 1krát měsíčně), 60,0 % pacientů ve skupině léčené golimumabem (v dávce 100 mg 1krát měsíčně) a 21,8 % pacientů ze skupiny kontrolní (p < 0,001 pro obě porovnání). Setrvalý klinický účinek byl pozorován po celé dva roky klinického sledování. Hodnocení ASAS 40, ASAS 5/6 a ASAS parciální remise dosáhl větší podíl pacientů léčených golimumabem v porovnání s placebovou skupinou. Ostatní parametry posuzující aktivitu nemoci (BASDAI), fyzické funkce (BASFI) a kvalitu života (SF-36) byly po podávání golimumabu v porovnání s placebem také významně zlepšeny.
V letoš![Graf 3 Výsledky studie GO-RAISE: procento pacientů dosahujících kritéria ASAS 20 po pěti letech podávání (golimumab 50 mg 1krát měsíčně, 100 mg 1krát měsíčně a placebo); dle [32] – Deodhar, et al., 2013.](https://www.remedia.cz/photo-a-29527---.jpg) ním roce byly na kongresu EULAR prezentovány výsledky pětiletého sledování, které prokázalo setrvalý efekt působení golimumabu v dávce 50 mg i 100 mg po 256 týdnů podávání (graf 3) [32]. Studie potvrdila tento účinek na zlepšení symptomů, funkce i rozsahu pohybů po celou dobu sledování. Nebyl prokázán signifikantní rozdíl v počtu výskytů nežádoucích účinků mezi oběma dávkami golimumabu.
ním roce byly na kongresu EULAR prezentovány výsledky pětiletého sledování, které prokázalo setrvalý efekt působení golimumabu v dávce 50 mg i 100 mg po 256 týdnů podávání (graf 3) [32]. Studie potvrdila tento účinek na zlepšení symptomů, funkce i rozsahu pohybů po celou dobu sledování. Nebyl prokázán signifikantní rozdíl v počtu výskytů nežádoucích účinků mezi oběma dávkami golimumabu.
Další potenciálně využitelná biologická agens v léčbě AS
V současné době probíhají studie hodnotící efekt certolizumabu v léčbě AS a non-radiografické axiální SpA; výsledky zatím svědčí pro jeho rychle nastupující a dobrý účinek (graf 4) [33]. Ve 24. týdnu byl v kombinované větvi pacientů léčených certolizumabem zjištěn signifikantní rozdíl v porovnání s placebem v hodnotách změn BASFI (-2,28 vs. -0,40), BASDAI (-3,05 vs. -1,05) a BASMI (-0,52 vs. -0,07, p < 0,001). EMA nyní schválila užívání certolizumabu v léčbě axiální SpA radiografické i non-radiografické a v současné době se čeká na sjednání úhrady pojišťovnami. ![Graf 4 Účinnost certolizumabu (procento pacientů dosahujících kritéria ASAS 20) v porovnání s placebem v léčbě axiální spondylartritidy včetně ankylozující spondylitidy – týden 24; dle [33] – Landewé, et al., 2013.](https://www.remedia.cz/photo-a-29528---.jpg)
V posledních letech proběhla u pacientů s AS řada klinických studií s dalšími biologickými léky, které působí na jiném principu než inhibitory TNFα. Je známo, že u axiální SpA dosud nebyla prokázána účinnost žádných DMARDs a že u části pacientů nedojde po podávání anti-TNFα k navození remise. Snahou proto je vyvinout další biologická léčiva, která by prokazovala dobrou účinnost v léčbě SpA [34].
Klinickému zkoušení byla podrobena řada přípravků. Vzhledem k tomu, že v kloubech pacientů s AS postižených zánětem byl prokázán zvýšený počet buněk CD20+B, předpokládalo se, že rituximab bude účinný i v léčbě SpA. Byla provedena 24týdenní studie s rituximabem u pacientů s AS, kde byl rituximab podáván nejen pacientům, u nichž selhala léčba TNFα, ale i TNFα-naivním jedincům. Po podání prvního cyklu rituximabu byla navozena parciální remise u 30 % jedinců a 50 % léčených pacientů odpovědělo zlepšením podle kritérií ASAS 20. Pacientům, u kterých došlo ke zlepšení a následně ke znovuvzplanutí choroby, byl podáván druhý cyklus léčby rituximabem, kdy bylo zaznamenáno znatelnější zlepšení než v případě prvního cyklu podávání [35, 36].
Celkově lze ovšem říci, že rituximab nepřináší vyšší efekt než léčba anti-TNFα. V další klinické studii byl podáván abatacept celkem patnácti TNFα-naivním pacientům s aktivní AS a dalším patnácti pacientům, u nichž nenastala adekvátní odpověď na léčbu TNFα. Účinnost byla sledována ve 24. týdnu podávání. Bylo zjištěno, že odpovědi dle kritérií ASAS 40 bylo dosaženo pouze u 13 % TNFα-naivních jedinců. Z výsledků studie je tedy jasné, že abatacept je v léčbě AS neúčinný [37]. U pacientů s AS byla zkoušena také monoklonální protilátka proti receptoru pro IL-6 (tocilizumab). Po podávání tocilizumabu se významně snížily hodnoty sedimentace erytrocytů i CRP, nedošlo však k signifikantnímu zmírnění ani axiálních ani periferních projevů AS [38, 39].
Naopak dobré výsledky ukazují zatím malé studie, které byly provedeny při podávání inhibitoru IL-17 (secukinumab) [40]. Přestože u této látky nebyla prokázána účinnost u pacientů s revmatoidní artritidou, zatím se zdá, že secukinumab dobře působí v léčbě psoriázy. Byla provedena malá studie u 30 pacientů s aktivní AS. V šestém týdnu léčby bylo dosaženo zlepšení ASAS 20 u 61 % pacientů léčených secukinumabem v porovnání se 17 % pacientů, kteří byli léčeni placebem [41]. V podstudii s MRI bylo zjištěno podstatné snížení radiologického skóre, k němuž došlo již v šestém týdnu podávání, a toto zlepšení bylo setrvalé až do 28. týdne studie [42]. Nyní probíhají další klinická hodnocení ověřující účinnost této protilátky v léčbě AS.
Také monoklonální protilátka proti podjednotce p40 interleukinů IL-12/IL-23 (ustekinumab) a perorálně podávaný inhibitor fosfodiesterázy 4 (apremilast) vykazují zatím dobrý účinek v léčbě psoriázy a psoriatické artritidy [34]. Jedna malá pilotní studie s apremilastem podávaným pacientům s AS ukázala, že by apremilast mohl mít dobrý efekt v léčbě AS [43]. V současnosti probíhají další studie, které se zabývají účinností apremilastu v léčbě AS.
Vliv biologické terapie na pracovní schopnost pacientů s AS
Kvůli AS mají pacienti výrazně nižší schopnost pracovat. Údaje z různých populačních studií se liší; jasné ale je, že přibližně jedna třetina až polovina pacientů s AS je postižena nějakým stupněm invalidity [44, 45]. Bylo prokázáno, že léčba anti-TNFα zvyšuje funkční schopnost nemocného, a tedy zvyšuje i jeho produktivitu v pracovním procesu [46]. Observační studie vycházející z registru pacientů léčených biologickou léčbou ve Velké Británii prokázala, že léčba přípravky blokujícími TNFα zvyšuje u pacientů s AS schopnost pracovat, a to tak, že snižuje počet pacientů neschopných plně nebo částečně pracovat; u zaměstnaných pak snižuje počet dnů pracovní neschopnosti [47]. Ke stejným závěrům dospěla také studie švédských autorů [48], která prokázala snížení pracovní neschopnosti a invalidity na polovinu po dvanácti měsících od zavedení léčby.
Registry
Také zprávy z registrů hovoří o tom, že podávání anti-TNFα má dlouhodobý a trvalý efekt v léčbě AS. Procento pacientů, kteří neodpovídají na léčbu, je dokonce nižší, než je tomu u revmatoidní artritidy [49]. U pacientů, kteří z nějakého důvodu museli být převedeni na léčbu jiným přípravkem blokujícím TNFα, se setkáváme s dobrou a trvalou odpovědí na tuto terapii. Zprávy vycházející z národních registrů svědčí o tom, že výskyt nežádoucích účinků léčby anti-TNFα je nízký [50, 51].
Léčba přípravky anti-TNFα a rentgenová progrese
V porovnání s revmatoidní artritidou, kde blokátory TNFα vedou ke snížení vzniku erozí, tedy ke zpomalení strukturální progrese, nebylo dosud bezpečně prokázáno, že by léčba anti-TNFα vedla ke zpomalení strukturálního poškození u pacientů s AS.Dodnes není jasné, jaká by měla být doba sledování, během níž by účinek léčby anti-TNFα na strukturální progresi u pacientů s AS mohl být evidentní; není jasný ani skórovací systém a metoda, která by zpomalení vývoje strukturálních změn mohla bezpečně prokázat. Na rozdíl od revmatoidní artritidy, kdy známkou progrese onemocnění je vývoj erozí na rentgenu, hlavní známkou pokračování strukturálních změn u AS je osteoproliferace a ankylóza [52].
Při hodnocení strukturálních změn na rentgenu u pacientů s AS bylo vytvořeno několik skórovacích systémů. V současné době je všeobecně uznáváno, že nejcitlivěji zaznamenává progresi strukturálních změn systém tzv. mSASSS (modifikovaný Stoke Ankylosing Spondylitis Spine Score). Tento skórovací systém je však zaměřen především na vývoj nových a růst již existujících syndesmofytů a na vývoj ankylózy. Erozivní změny jsou v tomto skórovacím systému také zaznamenávány, hrají však minoritní roli v celkovém mSASSS. Signifikantní změny u osteoproliferace nejsou detekovatelné dříve než během dvouletého sledování [53]. Po tak dlouhou dobu není samozřejmě možné porovnávat skupiny ve studiích kontrolovaných placebem, a tedy za kontrolní skupinu jsou většinou považováni pacienti z různých dlouhodobých observačních studií. Je možné, že interval dvouletého sledování není dostatečně dlouhý k tomu, aby v něm bylo možné změny navozené biologickou terapií zachytit.
Zajímavé jsou výsledky recentně publikované observační studie, která posuzovala vliv terapie anti-TNFα na radiografickou progresi [54]. Bylo sledováno celkem 334 jedinců, kde se časový interval porovnávaných snímků lišil (interval se pohyboval od 1,5 roku do 9 let, průměr byl 2,9 ± 1,2 roku). Autoři označili pacienty, u nichž představovala změna mSASSS jednu jednotku za rok, jako pacienty s progresí. Tato studie prokázala, že hodnota mSASSS v úvodu sledování (odds ratio – OR = 1,06; konfidenční interval – 95% CI = 1,04–1,08), CRP/sedimentace (OR = 1,02; 95% CI = 1,01–1,04) a kouření (OR = 1,05; 95% CI = 1,01–1,09) jsou prediktory radiografické progrese, zatímco terapie anti-TNFα snižuje progresi více než o 50 % (OR = 0,47; 95% CI = 0,24–0,94; p = 0,02). V této studii nebyl prokázán vliv NSA na vývoj radiografických změn. Současně bylo zjištěno, že minimální doba sledování, po kterou bylo prokázáno zpomalení radiografické progrese po podání léčby anti-TNFα, je 3,9 roku. Jedná se tak o první studii, která prokázala protektivní účinek inhibitorů TNFα na radiografickou progresi u pacientů s AS. Pacienti s pozdním zahájením této léčby (více než 10 let prodlení) měli rychlejší radiografickou progresi v porovnání s těmi, u nichž bylo s léčbou započato časněji (OR = 2,4; 95% CI = 1,09–5,3; p = 0,03).
Závěr
Zavedení anti-TNFα do léčby AS znamenalo velký pokrok. Blokátory TNFα jsou první účinnou léčbou, která působí nejen symptomaticky, ale rychle a efektivně snižuje hladinu reaktantů akutní fáze, ovlivňuje výskyt extraartikulárních manifestací a snižuje intenzitu zánětu na MRI. Předpokládá se, že tato léčba také zpomaluje strukturální poškození vyvolané AS. Vzhledem k tomu, že proces osteoproliferace u AS následuje po zánětem indukovaném strukturálním postižení chrupavky a přilehlé kosti, pacienti s AS by měli být diagnostikováni a efektivně léčeni ještě předtím, než k destruktivnímu poškození chrupavky a kosti dojde. Proto se v současné době klade důraz na včasné stanovení diagnózy u pacientů s AS a u vysoce aktivních pacientů na brzké zahájení biologické terapie. Bylo prokázáno, že léčba anti-TNFα může výrazně redukovat ekonomické náklady spojené s onemocněním a zvyšuje také schopnost postižených pacientů účastnit se v pracovním procesu.Dle recentních doporučení ASAS/EULAR pro léčbu AS všechny současně dostupné blokátory TNFα zůstávají vhodnou léčbou aktivní AS [55]. První studie prokazují obdobný efekt i u non-radiografické axiální SpA. Nebyl zjištěn rozdíl v účinnosti ani bezpečnosti jednotlivých přípravků v léčbě základních symptomů axiální SpA.
Podpořeno výzkumnými záměry MZ ČR No: 00023728.
Seznam použité literatury
- [1] Sieper J, Appel H, Braun J, Rudwaleit M. Critical apprraisal of assessment of structural damage in ankylosing spondylitis. Arthritis Rheum 2008; 58: 649–656.
- [2] Zochling J, van der Heijde D, Vargas RB, et al. ASAS/EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis 2006; 65: 442–452.
- [3] Rudwaleit M, Landewé R, van der Heijde D, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part I): classification of paper patients by expert opinion including uncertainty appraisal. Ann Rheum Dis 2009; 68: 770–776.
- [4] Sieper J, Srinivasan S, Zamani O, et al. Comparison od two referral strategies for diagnosis of axial spondylarthritis: the Recognising and Diagnosing Ankylosing spondylitis Reliably (RADAR) study. Ann Rheum Dis 2012; 0: 1–7.
- [5] Braun J, Davis J, Dougados M, et al. First update of international ASAS consensus statement for the use of anti-TNF agents in patients with ankylosing spondylitis. Ann Rheum Dis 2006; 65: 316–320.
- [6] Garrett S, Jenkinson T, Kennedy G, et al. A new approach to define disease status in ankylosing spondylitis: The Bath ankylosing spondylitis disease activity index. J Rheumatol 1994; 21: 2286–2291.
- [7] Calin A, Garrett S, Whitelock H, et al. A new approach to defining functional ability in ankylosing spondylitis: the development of the Bath Ankylosing Spondylitis Functional Index. J Rheumatol 1994; 21: 2281–2285.
- [8] van der Heijde D, Lie E, Kvien TK, et al. A highly discriminatory ASAS-endorsed disease activity score in patients with ankylosing spondylitis. Ann Rheum Dis 2009; 68: 1811–1818.
- [9] Pavelka K. Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy. Čes Revmatol 2012; 20: 4–11.
- [10] Dougados M, Boumier P, Amor B. Sulphasalazine in ankylosing spondylitis: a double blind controlled study in 60 patients. Br Med J (Clin Res Ed) 1986; 293: 911–914.
- [11] Taylor HG, Beswick EJ, Dawes PT. Sulphasalazine in ankylosing spondylitis. A radiological, clinical and laboratory assessment. Clin Rheumatol 1991; 10: 43–48.
- [12] Steiman AJ, Pope JE, Thiessen-Philbrook H, et al. Non-biologic disease-modifying antirheumatic drugs (DMARDs) improve pain in inflammatory arthritis (IA): a systematic literature review of randomized controlled trials. Rheumatol Int 2013; 33: 1105–1120.
- [13] Feldtkeller E, Lind-Albrecht G, Rudwaleit M. Core set of recommendation for patients with ankylosing spondylitis concerning behaviour and environmental adaptations. Rheumatol Int 2013; publikováno online.
- [14] Rudwaleit M, Listing J, Brandt J, et al. Prediction of a major clinical response (BASDAI 50) to tumour necrosis factor alpha blockers in ankylosing spondylitis. Ann Rheum Dis 2004; 63: 665–670.
- [15] Rudwaleit M, Schwarzlosse S, Hilgert ES, et al. MRI in predicting a major clinical response to anti-tumour necrosis factor treatment in ankylosing spondylitis. Ann Rheum Dis 2008; 67: 1276–1281.
- [16] Rudwaleit M, Claudepierre P, Wordsworth P, et al. Effectiveness, Safety, and Predictors of Good Clinical Response in 1250 Patients Treated with Adalimumab for Active Ankylosing Spondylitis. J Rheumatol 2009; 36: 801–808.
- [17] Sieper J, van der Heijde D, Dougados M, et al. Efficacy and safety of adalimumab in patients with non-radiographic axial spondyloarthritis: results of a randomised placebo-controlled trial (ABILITY-1). Ann Rheum Dis 2013; 72: 815–822.
- [18] Sieper J, Lenaerts J, Wollenhaupt J, et al.; on Behalf of All INFAST Investigators. Efficacy and safety of infliximab plus naproxen versus naproxen alone in patients with early, active axial spondyloarthritis: results from the double-blind, placebo-controlled INFAST study, Part 1. Ann Rheum Dis 2013, publikováno on-line.
- [19] van der Heijde D, Pangan AL, Schiff MH, et al. Adalimumab effectively reduces the sign and symptoms of active ankylosing spondylitis in patients with total spinal ankylosis. Ann Rheum Dis 2008; 67: 1218–1221.
- [20] Dougados M, Braun J, Szanto S, et al. Continuous efficacy of etanercept in severe and advanced ankylosing spondylitis: results from a 12-week open-label extension of the SPINE study. Rheumatology (Oxford) 2012; 51: 1687–1696.
- [21] Furst DE, Breedveld FC, Kalden JR, et al. Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2007. Ann Rheum Dis 2007; 66: iii2–iii22.
- [22] Baraliakos X, Listing JC, Fritz C, et al. Clinical efficacy and safety of infliximab – first results after decade of continuous treatment in ankylosing spondylitis. Ann Rheum Dis 2012; 7 (Suppl 3): 252.
- [23] Smolen JS, Emery P. Infliximab: 12 years experience. Arth Res Ther 2011; 13 (Suppl): 12–18.
- [24] Konsta M, Sfikakis PP, Bournia VK, et al. Absence of radiographic progression of hip arthritis during infliximab treatment for ankylosing spondylitis. Clin Rheumatol 2013; 32: 1229–1232.
- [25] Sieper J, Lenaerts J, Wollenhaupt J, et al.; on Behalf of All INFAST Investigators Maintenance of biologic-free remission with naproxen or no treatment in patients with early, active axial spondyloarthritis: results from a 6-month, randomised, open-label follow-up study, INFAST Part 2. Ann Rheum Dis 2013, publikováno on-line.
- [26] Baraliakos X, Haibel H, Fritz C, et al. Long-term outcome of patients with active ankylosing spondylitis with etanercept-sustained efficacy and safety after seven years. Arthritis Res Ther 2013; 15: R67.
- [27] Braun J, van der Horst-Bruinsma IE, Huang F, et al. Clinical efficacy and safety of etanercept versus sulfasalazine in patients with ankylosing spondylitis: a randomized, double-blind trial. Arthritis Rheum 2011; 63: 1543–1551.
- [28] van der Heijde DM, Revicki DA, Gooch KL, and ATLAS Study Group Physical function, disease activity, and health-related quality-of-life outcomes after 3 years of adalimumab treatment in patients with ankylosing spondylitis. Arthritis Res Ther 2009; 11: R124.
- [29] Haibel H, Rudwaleit M, Brandt J, et al. Adalimumab reduces spinal symptoms in active ankylosing spondylitis: clinical and magnetic resonance imaging results of a fifty-two-week open-label trial. Arthritis Rheum 2006; 54: 678–681.
- [30] Lambert RG, Salonen D, Rahman P, et al. Adalimumab significantly reduces both spinal and sacroiliac joint inflammation in patients with ankylosing spondylitis: a multicenter, randomised, double-blind, placebo controlled study. Arthritis Rheum 2007; 56: 4005–4014.
- [31] Braun J, Deodhar A, Inman RD, et al. Golimumab administered subcutaneously every 4 weeks in ankylosing spondylitis: 104-week results of the GO-RAISE study. Ann Rheum Dis 2012; 71: 661–667.
- [32] Deodhar A, Braun J , Inman R, et al. Long-term safety and efficacy of golimumab in the treatment of ankylosing spondylitis: results through 5 years of the GO-RAISE trial. Ann Rheum Dis 2013; 72 (Suppl 3): 283.
- [33] Landewé R, Braun J, Deodhar A, et al. Efficacy of certolizumab pegol on signs and symptoms of axial spondyloarthritis including ankylosing spondylitis: 24-week results of a double-blind randomised placebo-controlled Phase 3 study. Ann Rheum Dis 2013; publikováno on-line.
- [34] Her M, Kavanaugh A. Treatment of spondyloarthropathy: the potential for agents other than TNF inhibitors. Curr Opin Rheumatol 2013; 25: 455–459.
- [35] Song H, Heldmann F, Rudwaleit M, et al. Different response to rituximab in tumor necrosis factor blocker-naive patients with active ankylosing spondylitis and in patients in whom tumour necrosis factor blocker have failed: a twenty-four week clinical trial. Arthritis Rheum 2010; 62: 1290–1297.
- [36] Song H, Heldmann F, Rudwaleit M, et al. One-year follow-up of ankylosing spondylitis patients responding to rituximab treatment and re-treated in case of a flare. Arthritis Rheum 2013; 72: 305–306.
- [37] Song H, Heldmann F, Rudwaleit M, et al. Treatment of active ankylosing spondylitis with abatacept: an open-label twenty-four week pilot study. Ann Rheum Dis 2011; 70: 1108–1110.
- [38] Sieper J, Porter-Brown B, Thompson L, et al. Tocilizumab not ineffective for the treatment of ankylosing spondylitis: results od phase 2, international, multicentre, randomised, double blind, placebo controlled trial. Ann Rheum Dis 2012; 71 (Suppl 3): 110.
- [39] Sieper J, Inman RD, Badalementi S, et al. Sarilumab for the treatment of ankylosing spondylitis: results od phase 2, international, multicentre, randomised, double blind, placebo controlled international study. Ann Rheum Dis 2012; 71 (Suppl 3): 111.
- [40] Patel DD, Lee DM, Kolbinger F, Antoni C. Effect of IL-17A blockade with secukinumab in autoimmune diseases. Ann Rheum Dis 2013; 72 (Suppl 2): ii116–123.
- [41] Baeten D, Sieper J, Emery P, et al. The anti-IL17A monoclonal antibody secukinumab (AIN 457) showed good safety and efficacy in the treatment of active ankylosing spondylitis. Ann Rheum Dis 2011; 70 (Suppl 3): 127.
- [42] Baraliakos X, Braun J, Laurent DD, et al. Interleukin-17 blockade with secukinumab reduces spinal inflammation in patients with ankylosing spondylitis as early as week 6, as detected by magnetic resonance imaging (abstract). Ann Rheum Dis 2011; 63 (Suppl 10): 24860.
- [43] Pathan E, Abraham S, Van Rossen E, et al. Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in ankylosing spondylitis. Ann Rheum Dis 2013; 72: 1475–1480.
- [44] Barlow JH, Wright CC, Williams B, Keat A. Work disability among people with ankylosing spondylitis. Arthritis Rheum 2001; 45: 424–429.
- [45] Forejtova S, Mann H, Stolfa J, et al. Factors influencing health status and disability of patients with ankylosing spondylitis in the Czech Republic. Clin Rheumatol 2008; 27: 1005–1013.
- [46] van der Heijde D, Han C, Nevlam K, et al. Infliximab improves productivity and reduces workday loss in patients with ankylosing spondylitis: results from a randomised, placebo controlled trial. Arthritis Rheum 2006; 55: 569–574.
- [47] Keat AC, Gaffney K, Gilbert AK, Hartus C, Leader J. Influence of biologic therapy on return to work in people with work disability due to ankylosing spondylitis. Rheumatology 2008; 47: 481–483.
- [48] Kristensen LE, Petersson IF, Geborek P, et al. Sick leave in patients with ankylosing spondylitis before and after anti-TNF therapy: a population-based cohort study. Rheumatology (Oxford) 2012; 51: 243–249.
- [49] Coates LC, Cawkwell LS, Ng NWF, et al. Real life experience confirms sustained response to long-term biologics and switching in ankylosing spondylitis. Rheumatology 2008; 47: 897–900.
- [50] Konttinen L, Tuompo R, Uusitalo T, et al. Anti-TNF therapy in the treatment of ankylosing spondylitis: the Finnish experience. Clin Rheumatol 2007; 26: 1693–1700.
- [51] Pavelka K, Forejtová S, Stolfa J, et al. Anti-TNF therapy of ankylosing spondylitis in clinical practice. Results from the Czech national registry ATTRA. Clin Exp Rheumatol 2009; 27: 958–963.
- [52] van der Heijde D, Landewé R, Einstein S, et al. Radiographic progression of ankylosing spondylitis after up to two years of treatment with etanercept. Arthritis Rheum 2008; 58: 1324–1331.
- [53] Wanders AJ, Landewé RB, Spoorenberger A, et al. What is the most appropriate radiographic scoring metod for ankylosing spondylitis? A comparison of the available methods based on the Outcome Measures in Rheumatology Clinical Trials filter. Arthritis Rheum 2004; 50: 2622–2632.
- [54] Haroon N, Inman RD, Learch TJ, et al. The Impact of TNF-inhibitors on radiographic progression in Ankylosing Spondylitis. Arthritis Rheum 2013, publikováno on-line.
- [55] Baraliakos X, van den Berg R, Braun J, van der Heijde D. Update of the literature review on treatment with biologics as a basis for the first update of the ASAS/EULAR management recommendations of ankylosing spondylitis. Rheumatology (Oxford). 2012; 51: 1378–1387.