Antiagregancia a antikoagulancia v prevenci a v léčbě cévních mozkových příhod
Cílem antiagregační a antikoagulační terapie je dosažení účinné prevence recidivy mozkového infarktu nebo tranzitorní ischemické ataky. Text se zaměřuje především na recentní poznatky o duální antiagregační terapii a na indikace k antikoagulační terapii. Antikoagulační terapie (warfarinem) je doporučována u pacientů s kardioembolickým iktem. U pacientů s nekardioembolickým iktem upřednostňujeme léčbu antiagregační. Jako výhodná se ukázala kombinace kyseliny acetylsalicylové a dipyridamolu ve srovnání s podáváním kyseliny acetylsalicylové samotné.
Úvod
Ischemické cévní mozkové příhody (CMP) jsou onemocněním s vysokou incidencí, dle údajů databáze IKTA byla v roce 2000 incidence mozkového infarktu (MI) či tranzitorní ischemické ataky (TIA) v ČR 250 případů na 100 000 obyvatel.
Pacient po tranzitorní ischemické atace (TIA) je v následujících 90 dnech ohrožen až 10% rizikem recidivy ischemické CMP, přičemž polovina recidiv vznikne v prvních dvou dnech [1]. Pacienti s mozkovým infarktem mají 90denní riziko recidivy až 7,4 % a v průběhu 5 let je toto riziko udáváno v rozmezí 20–40 % [2, 3].
Antiagregancia se uplatňují v sekundární prevenci iktů arteriálního původu, antikoagulancia v případě iktů kardioembolických, event. při disekci tepny, při hyperkoagulačních stavech a při trombóze splavů.
Antiagregační terapie v sekundární prevenci mozkového infarktu
Dlouhodobým působením rizikových faktorů dochází k patologickým změnám stěny mozkových tepen, z nichž nejvýznamnější je aterosklerotické (AS) posti-žení. Eroze či ruptura AS plátu stimulují krevní destičky k agregaci s tvorbou trombu (aterotrombóza). Tromby mohou vést k uzávěru tepny nebo být zdrojem embolizace do periferních větví. Proto hlavním těžištěm antiagregační terapie jsou ikty arteriálního původu.
Léčba kyselinou acetylsalicylovou (ASA) vede k roční absolutní redukci rizika recidivy mozkového infarktu/úmrtí asi o 1–2 % [4]. Je tedy potřeba léčit 100 pacientů pomocí ASA, abychom zabránili jedné příhodě navíc oproti placebu (tento parametr označujeme jako „number needed to treat" – NNT). Podávání tiklopidinu vedlo ve studii TASS (Ticlopidin Aspirin Stroke Study) k redukci absolutního rizika fatálního i nefatálního infarktu oproti ASA o 2,6 % (11,2 % vs. 13,8 %). Průměrná doba sledování činila 2,3 roku, NNT/rok bylo 90 [5]. Klopidogrel (v dávce 75 mg denně) byl poprvé testován proti ASA (325 mg denně) ve studii CAPRIE (Clopidogrel versus Aspirin in Patient at Risk of Ischemic Events). Absolutní roční riziko vzniku mozkového infarktu bylo ve srovnání s terapií ASA sníženo o 0,5 %, NNT/rok je dle této studie 220. Efekt podávání klopidogrelu byl vyšší u pacientů s přídatnými vaskulárními rizikovými faktory – diabetem, předchozím akutním mozkovým či srdečním infarktem [6].
Z výše uvedeného vyplývá, že účinnost jednotlivých léčiv není v monoterapii vysoká. Logickým postupem ve snaze dosáhnout lepších výsledků je kromě použití nových antiagregačních léčiv i vzájemná kombinace těch, jež v současnosti používáme. Na výsledky studií s novými látkami bude třeba počkat ještě několik roků (např. studie PERFORM srovnávající účinnost terutrobanu oproti ASA). Z nedávno publikovaných studií MATCH, CHARISMA a ESPRIT nicméně máme nové údaje o účinnosti i nežádoucích účincích kombinace ASA s dipyridamolem (DP) a ASA s klopidogrelem. Výsledky těchto studií budou zmíněny v následující části textu.
Duální antiagregační terapie kyselinou acetylsalicylovou a dipyridamolem
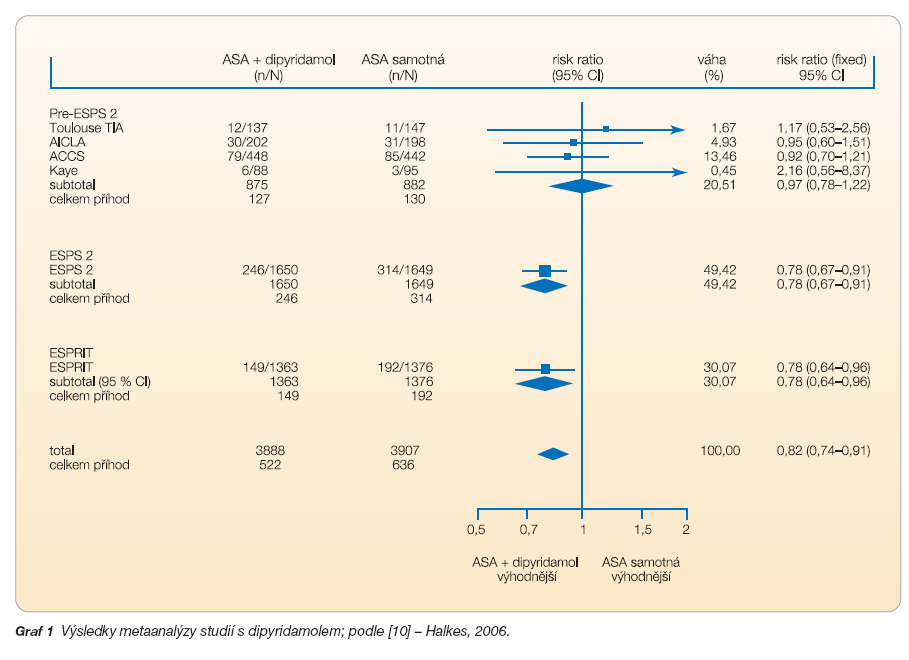
Vyšší účinnost kombinace DP/ASA oproti ASA samotné ukázala studie ESPS 2 (The European Stroke Prevention Study) publikovaná v roce 1996 [7]. Z výsledků 24měsíčního sledování 6602 pacientů vyplývá, že DP i ASA samotné jsou signifikantně účinnější než placebo a kombinace ASA/DP je účinnější než ASA či DP samotné. Absolutní roční redukce rizika ASA/DP oproti ASA je 1,5 % s NNT 66. V praxi to znamená, že musíme převést 66 pacientů z léčby ASA na léčbu kombinací ASA/DP, abychom ročně zabránili jedné cévní příhodě navíc. ASA, DP nebo ASA/DP byly stejně účinné u pacientů s postižením jak velkých, tak malých te-pen (lakunární infarkty) [8]. Efekt kombinace ASA/DP oproti samotné ASA byl vyšší u vysoce rizikových pacientů [9].
Definitivní důkaz prospěchu této duální terapie přinesla nezávislá studie ESPRIT (European/Australasian Stroke Prevention in Reversible Ischaemia Trial), která byla ukončena v roce 2005. Studie srovnávala efekt ASA proti ASA/DP u pacientů s TIA či s malým mozkovým infarktem v předchozích 6 měsících. Zařazeno bylo 2739 pacientů s průměrnou dobou sledování 3,5 roku. Výskyt vaskulárního úmrtí, nefatálního infarktu mozkového i srdečního byl 13 % ve skupině léčené ASA/DP oproti 16 % ve skupině léčené ASA samotnou s redukcí absolutního rizika o 3 % ve prospěch duální terapie. Roční absolutní redukce rizika činila tedy 1 % a roční NNT 104 [10]. Bezpečnostní profil ASA/DP byl obdobný jako ve studii ESPS 2.
Studie ESPRIT tak potvrzuje výsledky studie ESPS 2. Metaanalýza všech studií s DP, která zahrnuje i studii ESPRIT, prokazuje signifikantně vyšší účinnost duální terapie ASA/DP oproti ASA samotné (viz graf 1).
Data ze studií (ESPS 2, PISA) ani z metaanalýz neprokázala v případě užívání dipyridamolu signifikantně vyšší riziko kardiálních příhod (angina pectoris, infarkt myokardu) [11, 12]. Ve studii ESPRIT byla incidence srdečního infarktu nebo úmrtí v důsledku srdečního onemocnění 3,2 % u pacientů léčených duální terapií oproti 4,4 % u pacientů léčených samotnou ASA. Užívání duální terapie je tedy u pacientů s ICHS považováno za bezpečné.
Na základě výsledků studií ESPS 2 a ESPRIT se domníváme, že iniciální terapií u všech pacientů po prodělané TIA nebo mozkovém infarktu bez závažnějšího neu-rologického deficitu (skóre mRS ≤ 3) by měla být kombinace ASA a dipyridamolu. Kromě důvodů medicínských jsou zde důvody ekonomické, protože podle dosavadních analýz léčba samotnou ASA oproti duální terapii nevede ke snížení celkových finančních nákladů [13].
Duální antiagregační terapie kyselinou acetylsalicylovou a klopidogrelem
Poprvé byla kombinace ASA/klopidogrel testována v kardiologii ve studii CURE (Clopidogrel in Unstable Angina to Prevent Recurrent Events). Ta prokázala vyšší účinnost této kombinace oproti monoterapii v prevenci závažných ischemických příhod u pacientů s nestabilní anginou pectoris nebo s non-Q infarktem myokardu.
Studie MATCH (Management of ATherothrombosis with Clopidogrel in High-risk patients with recent TIA or ischemic stroke) prokázala u vysoce rizikových pacientů po mozkovém infarktu či TIA, že léčba kombinací ASA/klopidogrel nesignifikantně snížila incidenci mozkového infarktu, infarktu myokardu či vaskulární smrti o 1 % (15,7 vs. 16,7 %) oproti léčbě klopidogrelem samotným. Tento pozitivní trend byl ale zcela neutralizován skutečností, že duální terapie signifikantně zvyšovala riziko výskytu život ohrožujících krvácení o 1,3 % (dvojnásobně ve srovnání se samotným klopidogrelem) [14].
Studie CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management and Avoidance) publikovaná na jaře 2006 zahrnovala pacienty s vícečetnými rizikovými faktory (asymptomatické) nebo s prokázanou ICHS, CMP či s postižením periferních tepen (symptomatické) a randomizovala je k užívání kombinace ASA/klopidogrel proti samotné ASA. Studie neprokázala signifikantně vyšší účinnost duální terapie v redukci výskytu srdečního či mozkového infarktu a úmrtí z kardiovaskulárních příčin (6,8 % vs. 7,3 %). Subanalýza ukázala hraniční prospěch u pacientů symptomatických, nicméně tato skutečnost musí být potvrzena [15].
Účinnost a bezpečnost kombinace ASA/klopidogrel versus ASA testují v současnosti další studie, jako např. FASTER (Fast Assessment of Stroke and TIA to prevent Early Recurrence), ATARI (Antithrombotic Therapy in Acute Recovered cerebral Ischaemia) a ARCH (Aortic arch Related Cerebral Hazard). Zdali je duální terapie ASA/DP účinnější než léčba klopidogre-lem samotným, je předmětem probíhající studie PROFESS (Prevention Regimen For Effectively avoiding Second Strokes).
V současnosti na základě výsledků studií MATCH a CHARISMA není dlouhodobá duální terapie kombinací ASA/klopidogrel u pacientů s rizikovými faktory CMP nebo po proběhlé CMP indikována.
Antikoagulační terapie v sekundární prevenci mozkového infarktu
Hlavní indikací k antikoagulační terapii je prevence recidivy kardioembolického iktu. Této problematice bude věnována velká část následujícího textu. Na závěr budou uvedeny výsledky studií testujících antikoagulancia v léčbě pacientů s příhodami arteriálního původu a krátce zmíněna bude i problematika antikoagulační terapie v akutní terapii mozkových příhod.
V současnosti nejužívanějším perorálním antikoagulanciem je kumarinový derivát warfarin. Warfarin interferuje s metabolismem vitaminu K, jehož redukovaná forma je nezbytná pro karboxylaci vitamin K-dependentních koagulačních faktorů (II, VII, IX, X). Kromě toho snižuje karboxylaci i dalších proteinů, jako je protein C a S. Jeho biologická dostupnost je asi 95 %, vrchol plazmatické koncentrace je dosažen kolem 90. minuty po podání a má poločas 36–42 hodin [16]. Při užívání warfarinu je nutná přísná monitorace koagulačních parametrů (INR, Quickův test), neboť efekt dávky je rozdílný v důsledku individuálních farmakokinetických i farmakodynamických faktorů. Metabolismus warfarinu je zprostředkován cytochromem P-450, existuje řada lékových i potravinových interakcí. Antidotem při předávkování je vitamin K a koncentráty koagulačních faktorů (mražená plazma, protrombinový komplex), dávky i způsob podání se odvíjejí od aktuálního INR i případných krvácivých projevů.
Novým antikoagulanciem je přímý inhibitor trombinu ximelagatran. Jeho výhodou je farmakokinetika nezávislá na cytochromu P-450 a malý potenciál potravinových a lékových interakcí. Na rozdíl od warfarinu není nutné monitorovat koagulační parametry. Jeho efekt byl testován oproti warfarinu u pacientů s INR 2–3 ve studiích SPORTIF III a SPORTIF V (Stroke Prevention Using the Oral Direct Thrombin Inhibitor Ximelagatran in Patients With Atrial Fibrillation) u vysoce rizikových pacientů s fibrilací síní. V obou studiích dosáhl ximelagatran v dávce 36 mg 2krát denně obdobného efektu jako warfarin, a to s menším počtem hemoragických komplikací (31,7 % vs. 38,7 %) [17]. Pro riziko závažného postižení jater, ke kterému může dojít i po ukončení terapie (referováno ve studii EXTEND), byl v únoru 2006 ximelagatran stažen z trhu. Aktuálně probíhají testy s chemicky pozměněnou substancí, která není hepatotoxická.
Perorální antikoagulancia a kardioembolický iktus
Embolizace do mozkové cirkulace ze srdce je příčinou asi 20–30 % mozkových infarktů [18]. Přehled srdečních poruch asociovaných s mozkovou embolizací je uveden v tab. 1.
Nejčastěji k embolizaci dochází na podkladě nonvalvulární fibrilace síní (NVAF), ischemické choroby srdeční, nerevmatických a revmatických chlopenních vad [19].
Fibrilace síní
Prevalence fibrilace síní se zvyšuje s věkem (2 % v běžné populaci, 5 % v populaci starších 65 let a 10 % u lidí starších 75 let). Rozlišujeme izolovanou („lone") fibrilaci síní, nerevmatickou fibrilaci síní (NVAF) a fibrilaci síní asociovanou s revmatickou vadou. Izolovaná fibrilace síní („lone" AF) je definována jako AF bez detekovatelného srdečního onemocnění.
Mezi pacienty s fibrilací síní je průměrné riziko vzniku iktu asi 5 % ročně. Riziko závisí na příčině arytmie (asociované kardiální onemocnění) a přítomnosti dalších rizikových faktorů. Kumulativně vzrůstá se zvyšujícím se věkem, předchozími atakami TIA či iktem (na 15–20 %!), hypertenzí, diabetem, poruchou funkce levé komory a zvětšenou levou síní. Naopak mladí pa-cienti (< 60 let) s NVAF a paroxysmální AF mají riziko iktu nízké (< 1 % ročně).
V pěti studiích věnovaných primární prevenci bylo prokázáno, že u pacientů s chronickou AF sníží warfarin riziko iktu asi o dvě třetiny, z přibližně 4,5 % na 1,4 % ročně, s mírně vyšším rizikem intrakraniální hemoragické příhody (warfarin 0,2–0,4 %, kontrola 0,1 % ročně) [20]. To znamená, že warfarin zabrání 30 ischemickým iktům u 1000 pacientů s AF ročně (kyselina acetylsalicylová zabrání 15 iktům) a součas-ně dojde k nejméně dvěma závažným hemoragickým mozkovým příhodám, a to i navzdory důslednému výběru vhodných pacientů. Riziko hemoragií při antikoagulační terapii je zvyšováno závažnou komorbiditou a špatně kontrolovanou hypertenzí a nadměrnou antikoagulací (tab. 2).
Vyšší účinnost warfarinu oproti ASA v rámci sekundární prevence po proběhlém iktu či TIA při AF byla prokázána ve studii EAFT (European Atrial Fibrilation Trial) [21]. U pacientů s AF je tedy v rámci sekundární prevence indikována antikoagulační terapie s cílovým INR 2,0–3,0 (třída I, úroveň důkazů A) [21, 22].
V rámci primární prevence je antiko-agulační terapie zvažována dle individuálního rizika. U pacientů s nízkým rizikem (věk < 65 let, absence dalších rizikových faktorů) postačí ASA v dávce 300 mg denně, u pacientů se středním a vysokým rizikem podáváme warfarin s cílovým INR 2–3. V případě kontraindikace antikoagulační terapie podáváme ASA v dávce 300 mg denně (tab. 3).
Antikoagulační terapie vedoucí k hodnotám INR < 2 je neúčinná, studie SPAF III (Stroke Prevention in Atrial Fibrillation) také neprokázala vyšší účinnost nízkodávko-vaného warfarinu (INR 1,2–1,5) v kombinaci s ASA oproti samotnému warfarinu s cílovým INR 2–3 [23].
Otázkou, která není zcela uspokojivě vyřešena, je načasování antikoagulační terapie po proběhlém iktu u pacientů s AF. Je nutno vycházet z míry rizika recidivy tromboembolické příhody na straně jedné a rizika hemoragické transformace malacie na straně druhé. Riziko časné recidivy není tak vysoké, jak se původně předpokládalo. Dle studií IST, TOAST a FISS se 2týdenní riziko recidivy pohybuje mezi 1–4,7 % [24, 25]. Riziko hemoragické transformace je asi 1–2 %, což je signifikantně vyšší než v případě antiagregační terapie [24, 26]. Riziko je navíc vyšší v prvních 14 dnech po příhodě, u rozsáhlejších infarktů s těžkým deficitem a u pacientů s nekontrolovanou hypertenzí [27]. Běžně proto terapii zahajujeme antiagregancii (v případě trombolýzy s odstupem 24 hodin, jinak ihned), často v kombinaci s malou dávkou nízkomolekulárního heparinu jakožto prevencí hluboké žilní trombózy (miniheparinizace). Warfarinizaci pak zahajujeme v závislosti na výše uvedených faktorech mezi 3.–14. dnem po příhodě.
Ostatní kardioembolické příčiny
• Nejvyšší riziko kardioembolizace je u mechanických chlopní, INR zde proto udržujeme v rozmezí 2,5–3,5. Pokud při této terapii dojde k iktu či systémové embolizaci, je možno přidat 75–100 mg ASA denně (třída IIa, úroveň důkazů B) [22].
• U pacientů s aortální chlopenní vadou s normální velikostí levé síně a sinusovým rytmem je riziko kardioembolizace mírné a lze ponechat antiagregační terapii (třída IIb, úroveň důkazů C) [22]. Riziko se zvyšuje v případě současné AF nebo rozšíření levé síně a v tom případě je indikována antikoagulace s cílovým INR 2–3.
• U pacientů s revmatickou mitrální vadou (ať už s AF či bez ní) je indikována antikoagulační terapie s cílovým INR 2–3 (třída IIa, úroveň důkazů C). Pokud při této terapii dojde k embolizaci, je doporučeno přidat 75 mg ASA denně (třída IIa, úroveň důkazů C) [22].
• U pacientů s dilatační kadiomyopatií lze podávat jak warfarin (cílové INR 2–3), tak antiagregancia (třída IIb, úroveň důkazů B) [22].
• U pacientů s akutním srdečním infarktem může až ve 12 % případů dojít k systémové embolizaci. V případě echokardiograficky prokázaného trombu v levé komoře je indikována antikoagulační terapie s cílovým INR 2–3 po dobu 3 mě-síců až 1 roku (třída IIa, úroveň důkazů B). Při současné ischemické chorobě srdeční podáváme současně ASA do dávky 162 mg denně (třída IIa, úroveň důkazů A) [22].
• Další možnou příčinou kardioembolizace je paradoxní embolizace při perzistujícím foramen ovale (PFO). Diskutována je skutečná klinická významnost tohoto defektu. Konzervativní postup je identický se sekundární prevencí nekardiogenních iktů. Nebyla prokázána vyšší účinnost antikoagulační terapie oproti terapii antiagregační, přičemž ASA je statisticky signifikantně bezpečnější z hlediska výskytu hemoragických komplikací léčby [28]. Jako bezpečná metoda se ukazuje endovaskulární uzávěr PFO pomocí okludéru. Ten je v USA schválen FDA (Food and Drug Association) k po-užití u pacientů s recidivujícím kryptogenním ischemickým iktem způsobeným pravděpodobnou paradoxní embolizací přes PFO, a to v případech, kde selhala medikamentózní terapie [29].
Akutní antikoagulace v prevenci časné recidivy iktu
Antikoagulancia jsou v terapii akutního mozkového infarktu používána již déle než 50 let. Dostupná data však ukazují, že heparin a nízkomolekulární hepariny (LMWH) v akutním stadiu buď nesnižují riziko časné recidivy iktu vůbec (včetně iktů kardioembolických), nebo je jejich efekt neutralizován vyšším výskytem hemoragických komplikací [24, 25, 30, 31].
U pacientů s akutním mozkovým infarktem tedy není dle aktuálních doporučení antikoagulační léčba k prevenci časné recidivy doporučena (třída III, úroveň důkazů A) [22].
Perorální antikoagulancia a nekardioembolické ikty
Bylo uskutečněno několik randomizovaných studií, jejichž cílem bylo posoudit efekt antikoagulancií u pacientů s aterosklerózou velkých tepen, intrakraniálními stenózami či arteriolopatií.
Studie SPIRIT (The Stroke Prevention In Reversible Ischemia Trial) byla předčasně ukončena pro vysoké riziko krvácivých komplikací ve skupině pacientů léčených antikoagulancii (s cílovým INR 3–4,5) ve srovnání se skupinou léčenou 30 mg ASA denně [32].
Studie WARSS (Warfarin Aspirin Recurrent Stroke Study) srovnávala účinnost warfarinu s cílovým INR 1,4–2,8 oproti ASA v dávce 325 mg denně. Randomizováno bylo 2206 pacientů s nekardioembolickým iktem. Tato studie neprokázala vyšší účinnost warfarinu oproti ASA v prevenci recidivy iktu a úmrtí (17,8 % vs. 16 %). Výskyt hemoragických komplikací se v obou skupinách signifikantně nelišil (2,2 % warfarin vs. 1,5 % ASA) [33].
Ve studii WASID byla testována účinnost warfarinu s cílovým INR 2–3 oproti ASA u pacientů s angiograficky prokázanou intrakraniální stenózou větší než 50 %. Studie byla předčasně ukončena z bezpečnostních důvodů pro velký výskyt krvácivých komplikací ve skupině pacientů léčených antikoagulancii. Primárního výstupního kritéria bylo dosaženo v obou větvích přibližně u 22 % pacientů [34].
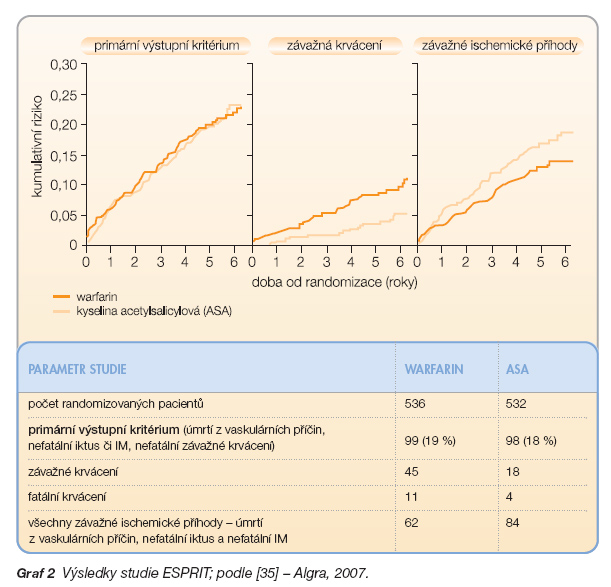
Recentně byly publikovány výsledky části studie ESPRIT (European/Austral-asian Stroke Prevention in Reversible Ischaemia Trial), která srovnávala účinnost warfarinu s INR 2–3 (n = 536) oproti 30–325 mg ASA (n = 532) v sekundární prevenci u pacientů s TIA či mozkovým infarktem s předpokládaným arteriálním původem (graf 2).
Primárním výstupním kritériem bylo úmrtí z vaskulárních příčin, nefatální iktus, nefatální infarkt myokardu, závažné krvácivé komplikace. Průměrná doba sledování byla 4,6 roku. Primárního výstupního kritéria dosáhlo 19 % pacientů dostávajících antikoagulační terapii a 18 % nemocných léčených ASA. Vyšší účinnost antikoagulační terapie oproti ASA v prevenci ischemických příhod (závažné ischemické příhody 62 vs. 84) byla neutralizována vyšším výskytem závažnějších krvácení (45 vs. 18) [35].
Na základě výsledků uvedených studií není u pacientů s iktem arteriálního původu antikoagulační terapie indikována. Podání warfarinu lze zvážit pouze v případě selhání veškeré antiagregační terapie [36].
Závěr
U pacientů s kardioembolickým iktem je plně indikována antikoagulační terapie. V případě mechanické chlopně je cílové INR 2,5–3,5, u ostatních srdečních onemocnění (fibrilace síní, chlopenní vady, dilatační kardiomyopatie) udržujeme INR v rozmezí 2–3. V případě kontraindikace antikoagulační terapie podáváme antiagregancia.
U pacientů s nekardioembolickým iktem je v sekundární prevenci preferována antiagregační terapie před terapií antikoagulační. Pokud není kontraindikována (např. po podání trombolýzy), antiagregancia podáváme u akutního mozkového infarktu ihned. Iniciace podávání ASA v prvních 48 hodinách snižuje časnou mortalitu i morbiditu (ve studii CAST nezávislost po 6 měsících vzrostla z 36,5 % na 38,8 %) [37]. Poslední doporučení American Stroke & Heart Association z roku 2006 uvádí, že ASA, kombinace ASA a dipyridamolu s pomalým uvolňováním i klopidogrel jsou akceptovatelnou volbou pro iniciální terapii. Na základě recentních výsledků studie ESPRIT se domníváme, že iniciální terapií u všech pacientů po prodělané TIA nebo mozkovém infarktu bez závažnějšího neurologického deficitu (skóre mRS ≤ 3) by měla být kombinace ASA s dipy-ridamolem. U pacientů, kde tato kombinační terapie není možná (např. z důvodu alergie, nestabilní anginy pectoris), je lékem volby klopidogrel (v současnosti však není v této indikaci hrazen pojišťovnami v ČR). Rutinní dlouhodobé užívání kombinace ASA/klopidogrel není doporučeno, neboť nepřináší vyšší efekt v redukci rizika recidivy mozkového infarktu než monoterapie, a navíc je spojeno s vyšším rizikem intracerebrálních krvácení.
Není prokázáno, že by pacienti s recidivou iktu při užívání ASA profitovali ze zvýšení její dávky. Je proto vhodná záměna ASA za duální terapii ASA/dipyridamol, event. za klopidogrel. Tento postup se však neopírá o medicínu založenou na důkazech, neboť žádné z těchto léčiv (v monoterapii či v kombinaci) nebylo testováno v sekundární prevenci u pacientů, kteří prodělali TIA nebo mozkový infarkt během užívání ASA. V případě selhání veškeré anti-agregační terapie lze zvážit podání warfarinu i při arteriálním původu iktu.
Seznam použité literatury
- [1] Johnston SC, Gress DR, Browner WS, Sidney S. Short-term prognosis after emergency department diagnosis of TIA. Jama 2000; 284: 2901–2906.
- [2] Moroney JT, Bagiella E, Paik MC, et al. Risk factors for early recurrence after ischemic stroke: the role of stroke syndrome and subtype. Stroke 1998; 29: 2118–2124.
- [3] The European Stroke Prevention Study (ESPS). Principal end-points. The ESPS Group. Lancet 1987; 2: 1351–1354.
- [4] United Kingdom transient ischaemic attack (UK-TIA) aspirin trial: interim results. UK-TIA Study Group. Br Med J (Clin Res Ed) 1988; 296: 316–320.
- [5] Bellavance A. Efficacy of ticlopidine and aspirin for prevention of reversible cerebrovascular ischemic events. The Ticlopidine Aspirin Stroke Study. Stroke 1993; 24: 1452–1457.
- [6] A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996; 348: 1329–1339.
- [7] Diener HC, Cunha L, Forbes C, et al., European Stroke Prevention Study. 2. Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke. J Neurol Sci 1996; 143 (1–2): 1–13.
- [8] Ariesen, MJ, Algra A, Kappelle LJ. Antiplatelet drugs in the secondary prevention after stroke: differential efficacy in large versus small vessel disease? A subgroup analysis from ESPS-2. Stroke 2006; 37: 134–138.
- [9] Sacco RL, Sivenius J, Diener HC. Efficacy of aspirin plus extended-release dipyridamole in preventing recurrent stroke in high-risk populations. Arch Neurol 2005; 62: 403–408.
- [10] Halkes PH, van-Gijn J, Kappelle LJ, et al. Aspirin plus dipyridamole versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial. Lancet 2006; 367: 1665–1673.
- [11] Picano E, on behalf of the PISA (Persantin In Stable Angina) study group. Dipyridamole in chronic stable angina pectoris; a randomized, double blind, placebo-controlled, parallel group study. Eur Heart J 2001; 22: 1785–1793.
- [12] Gibbons RJ, Abrams J, Chatterjee K, et al. ACC/AHA 2002 guideline update for the management of patients with chronic stable angina–summary article: a report of the American College of Cardiology/American Heart Associa-tion Task Force on practice guidelines (Committee on the Management of Patients With Chronic Stable Angina). J Am Coll Cardiol 2003; 41: 159–168.
- [13] Shah H, Gondek K. Aspirin plus extended-release dipyridamole or clopidogrel compared with aspirin monotherapy for the prevention of recurrent ischemic stroke: a cost-effectiveness analysis. Clin Ther 2000; 22: 362–370; discussion 360–361.
- [14] Diener HC, Bogousslavsky J, Brass LM, et al. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo-controlled trial. Lancet 2004; 364: 331–337.
- [15] Bhatt DL, Fox KA, Hacke W, et al. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006; 354: 1706–1717.
- [16] Hirsh J, Dalen JE, Anderson DR, et al. Oral anticoagulants. Mechanism of action, clinical effectiveness, and optimal therapeutic range. Chest 1995; 108 (Suppl. 4): 231S–246S.
- [17] Halperin JL. Ximelagatran compared with warfarin for prevention of thromboembolism in patients with nonvalvular atrial fibrillation: Rationale, objectives, and design of a pair of clinical studies and baseline patient characteristics (SPORTIF III and V). Am Heart J 2003; 146: 431–438.
- [18] Manning WJ. Role of transesophageal echocardiography in the management of thromboembolic stroke. Am J Cardiol 1997; 80 (4C): 19D–28D; discussion 35D–39D.
- [19] McNamara RL, JAC Lima, Whelton PK, et al. Echocardiographic identification of cardiovascular sources of emboli to guide clinical management of stroke: a cost-effectiveness analysis. Ann Intern Med 1997; 127: 775–787.
- [20] Koudstaal PJ, Primary and secondary prevention of stroke in patients with nonrheumatic atrial fibrillation. Eur Neurol 1994; 34: 61–63.
- [21] Besson G, Bogousslavsky J. European atrial fibrillation trial (EAFT). Secondary prevention with anticoagulants and aspirin in patients with non-valvular atrial fibrillation having suffered a transient ischemic attack or a regressive vascular accident. Rev Med Suisse Romande 1991; 111: 49–55.
- [22] Adams HP Jr, Adams R, Del Zoppo G, et al. Guidelines for the early management of adults with ischemic stroke: a guideline from the American Heart Association/American Stroke Association Stroke Council, Clinical Cardiology Council, Cardiovascular Radiology and Intervention Council, and the Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in Research Interdisciplinary Working Groups: the American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists. Stroke 2007; 38: 1655–1711.
- [23] Cowburn P, Cleland JG. SPAF-III results. Eur Heart J 1996; 17: 1129.
- [24] The International Stroke Trial (IST): a randomised trial of aspirin, subcutaneous heparin, both, or neither among 19435 patients with acute ischaemic stroke. International Stroke Trial Collaborative Group. Lancet 1997; 349: 1569–1581.
- [25] Low molecular weight heparinoid, ORG 10172 (danaparoid), and outcome after acute ischemic stroke: a randomized controlled trial. The Publications Committee for the Trial of ORG 10172 in Acute Stroke Treatment (TOAST) Investigators. Jama 1998; 279: 1265–1272.
- [26] Jaillard A, Cornu C, Durieux A, et al. Hemorrhagic transformation in acute ischemic stroke. The MAST-E study. MAST-E Group. Stroke 1999; 30: 1326–1332.
- [27] Hart RG. Cardiogenic embolism to the brain. Lancet 1992; 339: 589–594.
- [28] Homma S, Sacco RL, Di Tullio MR, et al. Effect of medical treatment in stroke patients with patent foramen ovale: patent foramen ovale in Cryptogenic Stroke Study. Circulation 2002; 105: 2625–2631.
- [29] Homma S, Sacco RL. Patent foramen ovale and stroke. Circulation 2005; 112: 1063–1072.
- [30] Roden-Jullig A, Britton M. Effectiveness of heparin treatment for progressing ischaemic stroke: before and after study. J Intern Med 2000; 248: 287–291.
- [31] Kay R, Wong KS, Yu YL, et al. Low-molecular-weight heparin for the treatment of acute ischemic stroke. N Engl J Med 1995; 333: 1588–1593.
- [32] A randomized trial of anticoagulants versus aspirin after cerebral ischemia of presumed arterial origin. The Stroke Prevention in Reversible Ischemia Trial (SPIRIT) Study Group. Ann Neurol 1997; 42: 857–865.
- [33] Mohr JP, Thompson JLP, Lazar RM, et al. A comparison of warfarin and aspirin for the prevention of recurrent ischemic stroke. N Engl J Med 2001; 345: 1444–1451.
- [34] Chimowitz MI, Lynn MJ, Howlett-Smith H, et al. Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis. N Engl J Med 2005; 352: 1305–1316.
- [35] Algra A, the ESPRIT Study Group. Medium intensity oral anticoagulants versus aspirin after cerebral ischaemia of arterial origin (ESPRIT): a randomised controlled trial. Lancet Neurol 2007; 6: 115–124.
- [36] Prognosis of patients with symptomatic vertebral or basilar artery stenosis. The Warfarin-Aspirin Symptomatic Intracranial Disease (WASID) Study Group. Stroke 1998; 29: 1389–1392.
- [37] Barer D. Interpretation of IST and CAST stroke trials. International Stroke Trial. Chinese Acute Stroke Trial. Lancet 1997; 350: 440; author reply 443–444.