Antiagregancia v sekundární prevenci cévních mozkových příhod
Cévní mozkové příhody (CMP) mají vysoké riziko rekurence. Jsou v rozvinutých zemích třetí nejčastější příčinou úmrtí a jednou z nejčastějších příčin závažné morbidity a invalidity. Riziko opakované ischemické CMP lze významně snížit protidestičkovou léčbou. V mnoha randomizovaných klinických studiích protidestičkové léčby v sekundární prevenci CMP se ukázaly jako účinné látky kyselina acetylsalicylová (ASA), klopidogrel a kombinace nízké dávky ASA s dipyridamolem s prodlouženým uvolňováním (ERDP). V přímém srovnání ve studii CAPRIE byl klopidogrel v prevenci aterotrombotických příhod o něco účinnější než ASA. Ve starší studii ESPS-2 a v novější, ale velmi kontroverzní studii ESPRIT byla významně účinnější kombinace malé dávky ASA s ERDP než samotná ASA. Proto stávající oficiální doporučení sekundární prevence CMP preferují kombinaci ASA/ERDP před samotnou ASA. Kombinace klopidogrelu s ASA neosvědčila v sekundární prevenci vyšší účinnost než samotný klopidogrel (studie MATCH a CHARISMA), zůstává proto vyhrazena jen pro speciální situace (např. pro nemocné s CMP, kteří nedávno prodělali akutní koronární syndrom a/nebo koronární intervenci s implantací stentu).
Na základě nepřímých srovnání výsledků provedených studií a jejich síťové metaanalýzy se předpokládalo, že kombinace malé dávky ASA s ERDP je také významně účinnější než monoterapie klopidogrelem. Nedávno publikované výsledky velké klinické studie PRoFESS, která přímo proti sobě testovala účinnost kombinace ASA/ERDP proti monoterapii klopidogrelem, však tento předpoklad nepotvrdily. Kombinace ASA/ERDP i klopidogrel snížily výskyt rekurujících CMP naprosto stejně (HR = 1,01), rozdíl nebyl zjištěn ani v ovlivnění kombinovaného sekundárního klinického ukazatele – součtu kardiovaskulárních úmrtí + nefatálních CMP + nefatálních IM (HR = 0,99). Při kombinované protidestičkové léčbě byl ale zaznamenán trend k vyššímu výskytu závažných krvácení (HR = 1,15), včetně krvácení intrakraniálních (HR = 1,42).
Je proto jasné, že tato nová fakta změní stávající doporučení. Kombinace ASA/ERDP není superiorní k monoterapii klopidogrelem, není proto důvod ji preferovat. Po prodělané ischemické CMP nebo tranzitorní ischemické atace (TIA) je nejdůležitějším krokem protidestičkovou léčbu vůbec zahájit. Při výběru protidestičkového léku nemůže hrát roli pouze jeho účinnost, v úvahu musí být brána také snášenlivost, riziko krvácení a v neposlední řadě také cena léčby.
Úvod
Cévní mozkové příhody (CMP) jsou v rozvinutých zemích Evropy a Severní Ameriky jednou z vedoucích příčin závažné morbidity, třetí nejčastější příčinou úmrtí a nejčastější příčinou závažné dlouhodobé invalidizace. V USA prodělá CMP každým rokem takřka 800 000 lidí. Přibližně u 10 % z nich se jedná o CMP hemoragickou (intracerebrální nebo subarachnoidální krvácení), u zbývajících 90 % nemocných jde o CMP ischemického původu [1]. Ischemické CMP se obecně rozdělují podle své patogeneze na kardiogenní a nekardiogenní
Kardiogenní (kardioembolizační) CMP vznikají uvolněním a embolizací krevních trombů, které se tvoří v srdci při některých kardiovaskulárních onemocněních a stavech, jako jsou např. fibrilace síní, chlopenní srdeční vady (získané i vrozené), poinfarktové výdutě levé komory a těžká systolická dysfunkce levé komory jakékoliv etiologie. Uvolněné tromby ochotně a často embolizují do mozku, okludují intrakraniální tepny a vedou k mozkové ischémii. Nekardiogenní CMP a tranzitorní ischemické ataky jsou způsobeny týmž aterotrombotickým mechanismem, který vede v koronárních tepnách ke vzniku infarktu myokardu. Nestabilní aterosklerotické pláty, ať již na extrakraniálních nebo na intrakraniálních tepnách, mohou prasknout, tím se obnaží smáčivé subendoteliální struktury, zejména kolagenní vlákna, na nichž dochází postupně k aktivaci, adhezi a agregaci destiček. Vzniká intraarteriální destičkový trombus, který se postupně vazbou fibrinu mění na trombus smíšený. Prasklý aterosklerotický plát s nasedlým intraarteriálním trombem může uzavřít tepnu lokálně, nebo se trombus může trhat a embolizovat distálně do periferních intracerebrálních tepének.
Nemocní, kteří prodělají ischemickou CMP nebo TIA, mají vysoké kardiovaskulární riziko a vysoký výskyt následných rekurujících příhod, ať již cerebrovaskulárních nebo aterotrombotických v jiných částech tepenného řečiště. Přirozená mortalita po první ischemické CMP je 7 % do 7. dne, 10–15 % do 30. dne, 20 % do půl roku. Recidiva ischemické CMP postihne 2 % nemocných do 7. dne, 4 % do 30. dne, 12 % do 1 roku a 30 % do 5 let. Pravděpodobnost recidivy CMP zvyšuje především vyšší věk, diabetes mellitus, hypertenze, chlopenní vada, srdeční insuficience a infarkt myokardu [2]. Opačně, u takřka 25 % nemocných, kteří prodělají ischemickou CMP, jde o rekurující CMP. Jde tedy o velmi závažné onemocnění, u něhož sekundární prevence hraje velmi důležitou roli. Tak jako u klinických manifestací aterosklerózy a aterotrombotických příhod v jiných oblastech tepenného řečiště (koronární, periferní) je i u nemocných po prodělané CMP základem sekundárně preventivních opatření důsledná a razantní intervence všech ovlivnitelných rizikových faktorů aterosklerózy včetně intervencí famakologických. Důležitá je především účinná léčba a kontrola hypertenze, co nejlepší kompenzace diabetu mellitu, léčba dyslipidémií, abstinence od kouření cigaret, snížení tělesné hmotnosti a zvýšení fyzické aktivity.
Protidestičková léčba
Velký význam v prevenci rekurence CMP i v prevenci výskytu jiných závažných aterotrombotických kardiovaskulárních příhod (např. infarktu myokardu, periferních cévních uzávěrů a kardiovaskulárních úmrtí) u nemocných, kteří CMP prodělali, má dlouhodobá léčba antiagregačními (lépe protidestičkovými) léky. Její účinnost v prevenci byla jednoznačně prokázána mnoha randomizovanými klinickými studiemi i jejich metaanalýzami. V klinických studiích prokázaly svoji prospěšnost následující látky: kyselina acetylsalicylová (ASA), thienopyridinové blokátory destičkových receptorů pro ADP – tiklopidin a klopidogrel, a konečně dipyridamol. Vzhledem k tomu, že každá z těchto tří alternativ blokuje funkce trombocytů, zejména jejich schopnost agregovat se jiným mechanismem a na jiném místě, je logické, že se předpokládalo, že jejich kombinace bude účinnější než monoterapie. V klinických studiích byly úspěšně vyzkoušeny dvojkombinace ASA s klopidogrelem a malé dávky ASA s dipyridamolem. Výzkum protidestičkových léků však zažil také velká zklamání. Snad největším byly perorálně použitelné blokátory glykoproteinových destičkových receptorů IIb/IIIa (fibrinových receptorů), tzv. fibany. Teoreticky bylo dobře zdůvodněno, že tyto látky, blokující společný konečný stupeň agregace destiček – glykoproteinový receptor IIb/IIIa –, budou účinné v dlouhodobé prevenci aterotrombotických kardiovaskulárních příhod. Nicméně klinické studie, které měly tuto hypotézu potvrdit, dopadly přesně opačně. Na rozdíl od jednorázově nebo krátkodobě podávaných parenterálních blokátorů receptorů IIb/IIIa (abciximab, tirofiban a eptifibatid) perorální fibany při dlouhodobém podávání nejenže nepomáhaly, ale morbiditu a mortalitu dokonce ještě zvyšovaly. Klinický výzkum a vývoj nových protidestičkových léků je velmi dynamický, v současnosti se v pokročilé fázi klinického zkoušení nachází hned několik nových léčiv.
Kyselina acetylsalicylová
Kyselina acetylsalicylová (ASA) je v sekundární prevenci naprosto dominujícím protidestičkovým lékem. Platí to nejenom pro prevenci kardiovaskulárních, ale i cerebrovaskulárních příhod, jako jsou ischemické CMP a TIA. Bylo s ní provedeno nejvíce klinických studií, je relativně bezpečná a velmi levná. Inhibuje ireverzibilně enzym cyklooxygenázu, tím brání tvorbě prostaglandinů, zejména tvorbě protrombogenního tromboxanu A2. Výsledky mnoha klinických studií s ASA v prevenci kardiovaskulárních příhod shrnula jedna z prvních a nejznámějších metaanalýz klinických studií – Antiplatelet Trialists' Collaboration [3–5]. Tato převratná metaanalýza jasně ukázala, že protidestičková léčba, v té době takřka výhradně ASA, snižuje přibližně o čtvrtinu výskyt závažných kardiovaskulárních příhod u velkého spektra nemocných s nejrůznějšími klinickými manifestacemi aterosklerózy, nejenom akutními, ale také chronickými, včetně stavu po prodělané CMP nebo TIA (graf 1). Nižší dávky ASA (75–150 mg/den) se ukázaly být v sekundární prevenci stejně účinnými jako dávky vyšší, přitom ale s sebou nesou významně nižší riziko gastrointestinálních hemoragických komplikací. Podávání ASA snižuje riziko tím více, čím vyšší je výchozí kardiovaskulární riziko nemocného. Protože riziko komplikací a rekurujících příhod je nejvyšší v akutní fázi, v době nestability aterosklerotického plátu, jehož ruptura a následná intraarteriální trombóza k příhodě vedla, začíná sekundární prevence protidestičkovou léčbou vlastně již v době léčby akutní příhody. Je proto ![Graf 1 Snížení relativního rizika (RRR) výskytu velkých kardiovaskulárních příhod (kardiovaskulárních úmrtí + nefatálních infarktů myokardu + nefatálních cévních mozkových příhod) protidestičkovou léčbou (vesměs kyselinou acetylsalicylovou) ve srovnání s placebem v primární a v sekundární prevenci u širokého spektra nemocných s různými kardiovaskulárními onemocněními; podle [4] – metaanalýza Antiplatelet Trialists Collaboration, 1994.](https://www.remedia.cz/photo-a-27400---.jpg) odůvodněné, aby ASA byla podána co nejdříve po prokázaném ischemickém iktu, nejpozději však do 48 hodin. Podmínkou pro zahájení léčby ASA je spolehlivé vyloučení intracerebrálního krvácení (časně provedené CT mozku) a neindikování trombolytické léčby z jakéhokoliv důvodu. Pokud je trombolytická léčba indikována, podává se ASA až 24 hodin po jejím ukončení. Dávkování ASA v akutní fázi ischemického iktu není jednotné a není ani známa optimální dávka. Nejobvyklejší používané schéma u nás je 200 mg ASA denně první 2–4 dny po akutní příhodě s následným dlouhodobým (trvalým) podáváním 100 mg ASA denně [2].
odůvodněné, aby ASA byla podána co nejdříve po prokázaném ischemickém iktu, nejpozději však do 48 hodin. Podmínkou pro zahájení léčby ASA je spolehlivé vyloučení intracerebrálního krvácení (časně provedené CT mozku) a neindikování trombolytické léčby z jakéhokoliv důvodu. Pokud je trombolytická léčba indikována, podává se ASA až 24 hodin po jejím ukončení. Dávkování ASA v akutní fázi ischemického iktu není jednotné a není ani známa optimální dávka. Nejobvyklejší používané schéma u nás je 200 mg ASA denně první 2–4 dny po akutní příhodě s následným dlouhodobým (trvalým) podáváním 100 mg ASA denně [2].
Preventivní léčba ASA má svá omezení. Monoterapie ASA ve srovnání s placebem snižuje riziko rekurence CMP jen o 10–15 relativních procent. U malé části nemocných (méně než 10 %) způsobuje ASA problémy zažívacího traktu; tito nemocní léčbu ASA netolerují nebo na ni jsou alergičtí nebo je u nich léčba ASA kontraindikována. Nejdůležitější je ale rezistence k ASA, která může být laboratorní nebo klinická. Příčiny rezistence k ASA mohou být různé: nízká dávka ASA, alternativní aktivace destiček (stimulace kolagenem, adenosindifosfátem, syntéza tromboxanu alternativní cestou přes cyklooxygenázu-2), současné podávání nesteroidních antirevmatik, která kompetují o vazebné místo na cyklooxygenáze-1, zvýšená produkce trombocytů např. při zánětu nebo stresu a další. Biochemickou rezistenci k ASA lze zjistit laboratorně pomocí různých metod, které měří agregaci trombocytů po různých podnětech (např. po aplikaci adrenalinu, fibrinu, ADP apod.). Klinická rezistence k ASA je volně definována rekurencí CMP nebo TIA při preventivní léčbě dostatečnou dávkou ASA. Je přítomna až u 40 % nemocných. Při rezistenci k ASA je nutné přejít na alternativní protidestičkovou léčbu.
Thienopyridiny
Thienopyridinové protidestičkové léky blokují aktivaci destiček ireverzibilní blokádou destičkových povrchových receptorů pro ADP. Patří k nim starší tiklopidin, novější klopidogrel a nejnovější a nejúčinnější prasugrel. Prasugrel byl zatím velmi úspěšně zkoušen jen u nemocných s akutními koronárními syndromy.
Tiklopidin byl testován proti vysokým dávkám ASA ve třech menších randomizovaných klinických studiích (CATS, TASS a AAASPS). Neprokázal v nich vyšší účinnost než obvyklé dávky ASA, léčba tiklopidinem byla ale provázena významně nižším výskytem případů gastrointestinálního krvácení. Při podávání tiklopidinu se mohou objevit jiné nežádoucí účinky, z nich nejzávažnější je neutropenie u asi 2 % nemocných. Proto je potřeba na počátku léčby kontrolovat krevní obraz. Klinicky významná těžká neutropenie se však objevuje u méně než 1 % nemocných a i ta je plně reverzibilní po ukončení léčby. Přímé srovnání tiklopidinu proti obvyklým nízkým dávkám ASA (75–150 mg denně) nebylo nikdy provedeno; dříve než se tak mohlo stát, byl totiž tiklopidin z klinické praxe vytlačen novějším a o něco bezpečnějším thienopyridinovým derivátem klopidogrelem. Všechny další randomizované klinické studie již byly uskutečňovány s klopidogrelem.
Klopidogrel je jediným protidestičkovým lékem, u kterého byla v sekundární prevenci prokázána nepatrně vyšší účinnost než u ASA. Jeho účinnost je pravděpodobně srovnatelná s tiklopidinem, ale léčba klopidogrelem je o něco bezpečnější, neutropenie se při ní objevuje jen vzácně (u méně než 0,4 % nemocných), ostatní nežádoucí účinky jako průjem či kožní vyrážka však mají při podávání tiklopidinu i klopidogrelu stejnou incidenci. Účinnost klopidogrelu v sekundární prevenci aterosklerotických příhod včetně CMP byla přímo porovnána s účinností ASA sice jen v jediné, ale zato velké randomizované, dvojitě zaslepené klinické studii CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischaemic Events) [6]. Více než 19 000 nemocných, kteří nedávno prodělali ischemickou CMP nebo infarkt myokardu (IM) nebo měli symptomatickou ischemickou chorobu dolních končetin (ICHDK), v ní bylo randomizováno buď k užívání klopidogrelu v denní dávce 75 mg, nebo k užívání ASA v denní dávce 325 mg. Primárním sledovaným klinickým ukazatelem byl součet ischemických CMP, IM a kardiovaskulárních úmrtí. Po průměrné době sledování 1,9 roku byl výskyt tohoto primárního kombinovaného klinického ukazatele při podávání klopidogrelu o 8,7 % nižší než při užívání ASA, tento rozdíl těsně dosáhl statistické významnosti (p = 0,043), viz graf 2. U více než 6000 nemocných, kteří byli do studie zařazeni na základě prodělané ischemické CMP jako kvalifikující příhody, však nebyl mezi klopidogrelem a ASA ve výskytu primárního ukazatele statisticky významný ![Graf 2 Snížení výskytu primárního kombinovaného klinického ukazatele (součet kardiovaskulárních úmrtí + nefatálních infarktů myokardu + nefatálních ischemických cévních mozkových příhod)léčbou klopidogrelem ve srovnání s kyselinou acetylsalicylovou ve studii CAPRIE; podle [6] – CAPRIE Steering Committee, 1996.](https://www.remedia.cz/photo-a-27401---.jpg) rozdíl. Pouze u podskupiny nemocných po ischemické CMP s nejvyšším kardiovaskulárním rizikem, tj. těch, kteří současně měli ICHDK nebo byli po IM, byl klopidogrel o 22,7 % účinnější. Výskyt nežádoucích účinků byl u obou látek stejný. Intrakraniální krvácení se objevilo při podávání klopidogrelu i ASA se stejnou frekvencí, zatímco krvácení do zažívacího traktu bylo u nemocných, kteří užívali ASA, častější než u těch, kteří užívali klopidogrel. Ani u klopidogrelu nemáme k dispozici přímé srovnání s nižšími, u nás obvykle používanými dávkami ASA (< 200 mg/den).
rozdíl. Pouze u podskupiny nemocných po ischemické CMP s nejvyšším kardiovaskulárním rizikem, tj. těch, kteří současně měli ICHDK nebo byli po IM, byl klopidogrel o 22,7 % účinnější. Výskyt nežádoucích účinků byl u obou látek stejný. Intrakraniální krvácení se objevilo při podávání klopidogrelu i ASA se stejnou frekvencí, zatímco krvácení do zažívacího traktu bylo u nemocných, kteří užívali ASA, častější než u těch, kteří užívali klopidogrel. Ani u klopidogrelu nemáme k dispozici přímé srovnání s nižšími, u nás obvykle používanými dávkami ASA (< 200 mg/den).
Kombinace klopidogrelu a ASA
Protože klopidogrel i ASA inhibují agregační schopnost trombocytů na různých místech a různým mechanismem, hypoteticky se předpokládalo, že kombinace obou těchto látek může být v sekundární prevenci účinnější než samotný klopidogrel. K potvrzení této hypotézy byla provedena randomizovaná, dvojitě zaslepená klinická studie MATCH (Management of Atherothrombosis with Clopidogrel in High-Risk Patients) [7]. Rozhodnutí testovat v této studii v sekundární prevenci duální protidestičkovou léčbu na relativně vysoce rizikové populaci bylo založeno na některých analýzách ze studie CAPRIE provedených post hoc, které naznačovaly, že vyšší účinnost klopidogrelu než ASA byla nejzřetelnější zejména u nemocných s diabetem mellitem, po ischemických příhodách nebo po chirurgické koronární revaskularizaci. Do studie MATCH bylo zařazeno 7599 nemocných, kteří prodělali v posledních 3 měsících ischemickou CMP nebo TIA, a navíc ještě měli další kardiovaskulární rizikový faktor (další CMP nebo IM v anamnéze, anginu pectoris, diabetes mellitus nebo symptomatickou ICHDK). Při vstupu do studie užívalo 80 % nemocných ASA, 79 % nemocných prodělalo ischemickou CMP jako kvalifikující příhodu a 27 % mělo další ischemickou CMP a 19 % TIA již před kvalifikujícím iktem. Nemocní byli randomizováni k užívání duální protidestičkové léčby kombinací klopidogrelu 75 mg + ASA 75 mg denně nebo samotného klopidogrelu jako komparátoru v dávce 75 mg denně. Primárním sledovaným klinickým ukazatelem byl kombinovaný výskyt ischemických CMP, IM a kardiovaskulárních úmrtí (včetně smrtelných krvácení). Po průměrné době sledování 18 měsíců byl výskyt primárního kombinovaného klinického ukazatele při duální léčbě nižší jen o 6,4 %, což nebylo statisticky významné (p = 0,244). Žádný rozdíl nebyl nalezen ani ve výskytu samotných ischemických CMP nebo všech CMP. Výskyt krvácivých komplikací byl ale při duální léčbě trojnásobně vyšší než při monoterapii klopidogrelem.
Prakticky stejný výsledek přinesla o něco později velká preventivní studie CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance) [8]. Tato studie byla navržena a provedena proto, aby zhodnotila bezpečnost a účinnost duální protidestičkové léčby u široké populace nemocných s vysokým rizikem aterotrombotických kardiovaskulárních příhod. Bylo do ní zařazeno 15 603 nemocných ve věku nad 45 let s klinicky manifestním kardiovaskulárním onemocněním (např. ICHS, cerebrovaskulární ischemická choroba, ICHDK) nebo s mnohočetnými rizikovými faktory aterosklerózy (např. diabetes mellitus, asymptomatická stenóza a. carotis, nikotinismus, hypercholesterolémie), kteří byli randomizováni k užívání kombinace klopidogrelu 75 mg a malé dávky ASA denně (75–162 mg). Při vstupu do studie mělo přibližně 42 % nemocných diabetes mellitus, 35 % bylo po prodělaném IM, 36 % po prodělané CMP nebo TIA a 23 % mělo dokumentovanou symptomatickou ICHDK. Sledovaným primárním kombinovaným klinickým ukazatelem byl součet IM + CMP + kardiovaskulárních úmrtí, současně byla sledována i bezpečnost léčby daná rizikem výskytu nejrůznějších krvácivých komplikací. Po průměrné době sledování 28 měsíců se neprokázalo, že by duální protidestičková léčba byla statisticky významně účinnější ve snížení primárního ukazatele než monoterapie ASA s poklesem relativního rizika na 0,93 (p = 0,22). Výskyt těžkého, fatálního i primárně intrakraniálního krvácení byl v obou léčebných skupinách také podobný, ale středně závažná krvácení (definovaná jako krvácení, která nevyžadovala krevní transfuzi a nevedla k hemodynamickému zhoršení) se objevila významně častěji ve skupině léčené duální protidestičkovou léčbou (RRR = 1,62, p < 0,001). Na každých 94 závažných ![Graf 3 Snížení relativního rizika (RRR) výskytu primárního kombinovaného klinického ukazatele (součet kardiovaskulárních úmrtí + nefatálních infarktů myokardu + nefatálních cévních mozkových příhod) při léčbě kombinací ASA + klopidogrel ve srovnání s monoterapií ASA. Analýza předem specifikovaných podskupin nemocných s manifestním onemocněním aterosklerotické etiologie (sekundární prevence) a nemocných s vysokým kardiovaskulárním rizikem, ale zatím bez zjevného onemocnění (primární prevence) ve studii CHARISMA; podle [8] – Bhatt, et al., 2006.](https://www.remedia.cz/photo-a-27402---.jpg) ischemických příhod, jimž se podařilo zabránit duální léčbou, se tak objevilo 93 případů středně těžkého až těžkého krvácení. Při předem specifikované podskupinové analýze se ukázalo, že u 12 153 nemocných s již manifestním aterotrombotickým onemocněním (sekundární prevence) snížila duální protidestičková léčba výskyt primárního ukazatele významně více než samotná ASA (RRR = 0,88; p = 0,046), zatímco v primární prevenci žádný dodatečný prospěch nepřinesla (graf 3). Nepřinesla také žádný prospěch nemocným, kteří měli v anamnéze prodělanou ischemickou CMP.
ischemických příhod, jimž se podařilo zabránit duální léčbou, se tak objevilo 93 případů středně těžkého až těžkého krvácení. Při předem specifikované podskupinové analýze se ukázalo, že u 12 153 nemocných s již manifestním aterotrombotickým onemocněním (sekundární prevence) snížila duální protidestičková léčba výskyt primárního ukazatele významně více než samotná ASA (RRR = 0,88; p = 0,046), zatímco v primární prevenci žádný dodatečný prospěch nepřinesla (graf 3). Nepřinesla také žádný prospěch nemocným, kteří měli v anamnéze prodělanou ischemickou CMP.
Kombinace dipyridamolu a malé dávky ASA
Dipyridamol inhibuje uptake adenosinu do trombocytů, což vede k lokálnímu zvýšení koncentrace adenosinu. Adenosin pak vazbou na destičkové receptory A2 zvyšuje v destičkách tvorbu cyklického adenosinmonofosfátu (cAMP). Tímto mechanismem brání destičkovému aktivačnímu faktoru, kolagenu, ADP a jiným podnětům aktivovat destičky s jejich následnou agregací. Dipyridamol byl kdysi s nevalným úspěchem zkoušen v sekundární prevenci jako monoterapie proti placebu i v kombinaci s ASA proti ASA samotné [3, 4]. V těchto malých studiích byl použit dipyridamol s okamžitým uvolňováním. Tato léková forma dipyridamolu byla použita i ve studii ESPS-1 (First European Stroke Prevention Study) [9], ve které bylo dvojitě zaslepeně randomizováno 2500 nemocných 3 měsíce po prodělané CMP nebo TIA k užívání kombinace ASA 330 mg/den + dipyridamol s okamžitým uvolňováním v dávce 75 mg podávané 3krát denně nebo k užívání placeba. Kombinační léčba vedla k poklesu celkové mortality včetně úmrtí na CMP o 33,5 % (p < 0,001). Výskyt fatálních i nefatálních CMP byl kombinační léčbou snížen o 38,1 % (p < 0,001).
V následné studii ESPS-2 (Second European Stroke Prevention Study) [10] s randomizovaným a dvojitě zaslepeným uspořádáním s 6500 nemocnými, kteří prodělali v posledních 3 měsících CMP nebo TIA, byly zkoušeny celkem 4 sekundárně preventivní léčebné režimy: (1) kombinace ASA 25 mg/den + dipyridamol s prodlouženým uvolňováním (ERDP) 2 x 200 mg/den, (2) monoterapie ASA 50 mg/ den, (3) monoterapie dipyridamolem v dávce 2 x 200 mg/den, (4) placebo. Primárními sledovanými klinickými ukazateli byly CMP, úmrtí ze všech příčin a jejich součet. Po dvou letech vedla kombinační protidestičková léčba k významnému poklesu výskytu CMP o 37 % (p < 0,001) ve srovnání s poklesem o 18 % při monoterapii ASA (p = 0,013) a ve srovnání s poklesem o 16 % při monoterapii dipyridamolem (p = 0,039), vše proti placebu. Žádné rozdíly ve výskytu krvácení mezi jednotlivými režimy aktivní protidestičkové léčby nebyly zjištěny. Tyto vynikající výsledky ve prospěch kombinační léčby však byly vzápětí zpochybněny četnými limitacemi studie: (1) Ve studii nebylo provedeno přímé srovnání účinnosti kombinační léčby proti monoterapii ASA, místo toho byly všechny léčebné režimy porovnány proti placebu a srovnání mezi nimi navzájem bylo pouze nepřímé. (2) Použitá denní dávka ASA byla nižší než účinné dávky vyzkoušené v klinických studiích. Při použití vyšších denních dávek ASA mohly být výsledky úplně jiné. (3) Kombinační léčba byla účinnější než monoterapie ASA jen v prevenci CMP, ale nikoliv v redukci IM nebo úmrtí.
Nedávno byla publikována další klinická studie, která srovnávala účinnost léčby kombinací malé dávky ASA s dipyridamolem proti monoterapii ASA v sekundární prevenci ischemických CMP a TIA. Do studie ESPRIT (European-Australian Stroke Prevention in Reversible Ischemia Trial) bylo zařazeno 2763 nemocných, kteří prodělali v posledních 6 měsících lehčí ischemickou CMP nebo TIA, a ti byli randomizováni k „open label“ (!!!) léčbě kombinací dipyridamolu 2 x 200 mg/den + ASA 30–325 mg/ den nebo k monoterapii ASA 30–325 mg/ den. Denní dávka ASA byla jako součást kombinace, tak i v monoterapii ponechána na volbě ošetřujícího lékaře a léková forma dipyridamolu s prodlouženým uvolňováním byla investigátorům pouze doporučena, ale nebyla mandatorní. Primárním sledovaným klinickým ukazatelem byla kombinace celkové mortality a nefatálních CMP a nefatálních IM a závažných krvácení. Při průměrné době sledování 3,5 roku se primární klinický ukazatel objevil u 13 % pacientů léčených kombinací a u 16 % nemocných s monoterapií ASA (RRR = 0,80; p < 0,05). Poněkud překvapivě se závažnější krvácivé komplikace objevily méně často při kombinační léčbě než při monoterapii ASA.
Studie ESPRIT je nepochybně velmi kontroverzní a vyvolala spoustu kritiky [12, 13]. V prvé řadě se jednalo o studii nezaslepenou. Autoři to zdůvodnili tím, že chtěli ve studii co nejvíce simulovat podmínky reálného světa. Faktem však je, že výsledky nezaslepených studií mají obecně velmi malou váhu. Velkým nedostatkem také je, že volba denní dávky ASA i volba lékové formy dipyridamolu byla ponechána na rozhodnutí lékařů. Výsledkem této benevolence bylo, že 42–46 % nemocných užívalo ASA v dávce 30 mg/den, 15 % v dávce 75 mg/den, 23–25 % v dávce 100 mg/den a zbytek sledovaných pacientů užíval ASA v širokém rozmezí 40–325 mg/den. Celkem 17 % nemocných užívalo dipyridamol s okamžitým uvolňováním, jehož délka účinku je naprosto nedostatečná. Pouhých 8 % nemocných užívalo kombinaci dipyridamolu s prodlouženým uvolňováním 2 x 200 mg/den + ASA 2 x 25 mg/den, která odpovídá komerčně dostupnému přípravku na trhu. Distribuce dávek ASA byla v obou léčebných větvích, tj. v kombinační větvi i v monoterapii, podobná. Dalším problémem je, že třetina nemocných, kteří byli randomizováni ke kombinační léčbě, tuto léčbu v průběhu studie ukončila pro výskyt nežádoucích účinků, zejména bolestí hlavy. Když byla provedena analýza typu tzv. on treatment, tedy analýza účinnosti podle toho, jakou léčbou nemocní v průběhu studie skutečně byli léčeni, nikoliv k jaké terapii byli randomizováni (analýza intention-to-treat), nebyl mezi účinností kombinační protidestičkové léčby a monoterapie ASA zjištěn žádný rozdíl. A konečně, kritizován je i fakt, že součástí primárního sledovaného kombinovaného klinického ukazatele byly i závažnější nefatální krvácivé komplikace. Jak již bylo uvedeno výše, překvapivě vedla kombinační léčba k menšímu výskytu krvácivých komplikací než monoterapie ASA (2,2 % vs. 3,6 %). To vzbudilo důvodné podezření, že lepší preventivní účinnost kombinační léčby byla dána právě nižším výskytem krvácení.
Studie PRoFESS – přímé srovnání kombinace dipyridamolu s malou dávkou ASA a klopidogrelu
Výsledky všech výše uvedených studií s protidestičkovou léčbou v sekundární prevenci ischemických CMP lze shrnout následovně [14, 15]:
- ASA v denní dávce 50–325 mg snižuje oproti placebu rekurenci CMP a jiných ischemických příhod přibližně o 23 %.
- Klopidogrel je o něco účinnější než ASA (p = 0,043). V denní dávce 75 mg snižuje rekurenci CMP a jiných ischemických příhod o necelých 9 % více než ASA v denní dávce 325 mg.
- Kombinace dipyridamolu s malou dávkou ASA je významně účinnější než samotná ASA (p < 0,001). Kombinace snižuje rekurenci CMP a jiných ischemických příhod o 20–23 % více než ASA.
Tyto závěry vedly k předpokladu, že kombinace dipyridamolu s malou dávkou ASA je v sekundární prevenci účinnější než monoterapie klopidogrelem, a tento předpoklad se stal základem pro oficiální doporučení k sekundární prevenci CMP [16, 17]. Nicméně, přímé srovnání obou preventivních protidestičkových strategií bylo provedeno až v nedávno ukončené a publikované megastudii PRoFESS [18]. V této dvojitě zaslepené randomizované studii v uspořádání 2 x 2 faktoriál byla jednak testována účinnost blokátoru receptorů pro angiotenzin II telmisartanu oproti placebu a jednak dva protidestičkové léčebné režimy – kombinace malé dávky ASA (2 x 25 mg denně) s dipyridamolem s prodlouženým uvolňováním (2 x 200 mg denně) proti monoterapii klopidogrelem (75 mg denně). Primárním sledovaným ukazatelem účinnosti byla rekurence CMP jakékoliv etiologie. Studie byla uspořádána k průkazu non-inferiority obou preventivních protidestičkových režimů s následným testováním superiority kombinační léčby (která se předpokládala). Do studie bylo zařazeno celkem 20 332 nemocných po nedávno prodělané ischemické CMP, kteří byli sledováni po průměrnou dobu 2,5 roku. Rekurující CMP se objevila u 916 (9 %) nemocných, kteří užívali kombinační léčbu, a u 898 (8,8 %) nemocných, kteří užívali klopidogrel. Ve výskytu 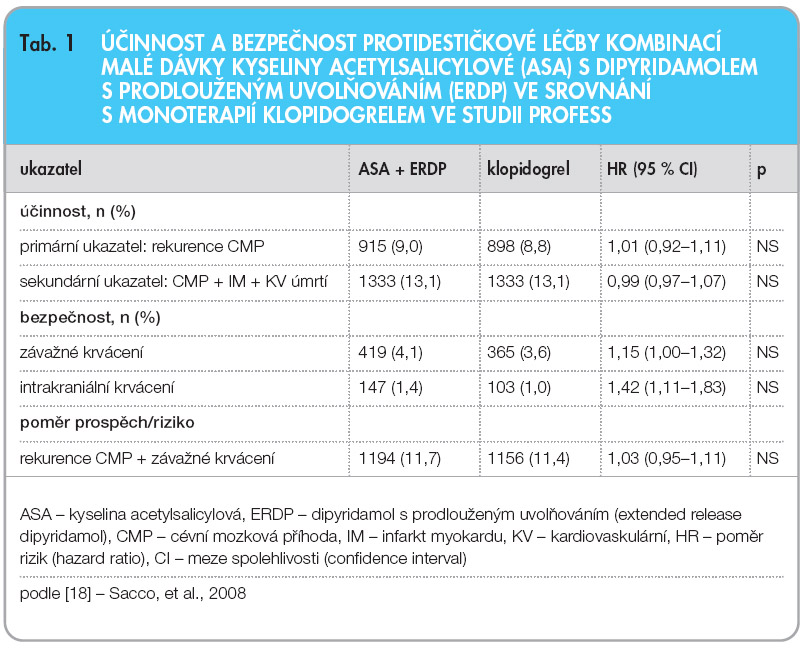 rekurujících CMP tedy nebyl mezi oběma léčebnými strategiemi vůbec žádný rozdíl (HR = 1,01; 95% CI: 0,92–1,11). Ani ve výskytu velkých kardiovaskulárních příhod (součet CMP + IM + kardiovaskulárních úmrtí) nebyl mezi oběma skupinami zjištěn žádný rozdíl. Při kombinační léčbě se ale objevilo více krvácení (HR = 1,15) včetně krvácení intrakraniálních (HR 1,42). Čisté riziko rekurující CMP nebo krvácivé komplikace však bylo mezi oběma skupinami prakticky stejné (HR = 1,03), viz tab. 1. Závěrem studie PRoFESS tedy je, že mezi sekundární prevencí CMP kombinací malé dávky ASA a dipyridamolu a monoterapií klopidogrelem není žádný významný rozdíl. Trend k menšímu výskytu krvácení a lepší snášenlivost upřednostňují klopidogrel, ale absolutní rozdíl je malý.
rekurujících CMP tedy nebyl mezi oběma léčebnými strategiemi vůbec žádný rozdíl (HR = 1,01; 95% CI: 0,92–1,11). Ani ve výskytu velkých kardiovaskulárních příhod (součet CMP + IM + kardiovaskulárních úmrtí) nebyl mezi oběma skupinami zjištěn žádný rozdíl. Při kombinační léčbě se ale objevilo více krvácení (HR = 1,15) včetně krvácení intrakraniálních (HR 1,42). Čisté riziko rekurující CMP nebo krvácivé komplikace však bylo mezi oběma skupinami prakticky stejné (HR = 1,03), viz tab. 1. Závěrem studie PRoFESS tedy je, že mezi sekundární prevencí CMP kombinací malé dávky ASA a dipyridamolu a monoterapií klopidogrelem není žádný významný rozdíl. Trend k menšímu výskytu krvácení a lepší snášenlivost upřednostňují klopidogrel, ale absolutní rozdíl je malý.
Co vyplývá pro klinickou praxi
-
Stávající doporučení pro sekundární prevenci CMP doporučují ASA, kombinaci malé dávky ASA s dipyridamolem s prodlouženým uvolňováním a klopidogrel jako přijatelné strategie počáteční protidestičkové léčby [16, 17]. Na základě výsledků starších studií ESPS-1 a ESPS-2 a velmi kontroverzní studie ESPRIT tato doporučení jednoznačně preferují jako účinnější kombinaci malé dávky ASA s dipyridamolem před samotnou ASA.
-
Předpokládaná superiorita kombinace malé dávky ASA s dipyridamolem s prodlouženým uvolňováním nad monoterapií klopidogrelem [15], která vyplynula z nepřímých srovnání výsledků klinických studií včetně síťové metanalýzy, se při přímém srovnání ve velké klinické studii PRoFESS nepotvrdila [18]. Kombinace nejenže neprokázala superioritu nad klopidogrelem (přestože se to na základě nepřímých srovnání výsledků předcházejících studií evidentně chybně předpokládalo), ale nedosáhla ani limitů non-inferiority [13].
-
Obecně pak platí, že výsledky klinických studií jsou někdy iracionální a logika, která platí v matematice, v nich neplatí. Tak např. při interpretaci výsledků klinických studií evidentně neplatí, že když A je lepší než B a B je lepší než C, je nezbytně A lepší než C. Nepřímá srovnání výsledků klinických studií včetně tzv. síťových metaanalýz (network meta-analysis) mohou být zavádějící a chybná. Nemohou nahradit přímé srovnání léčiv nebo léčebných postupů, pokud je takové srovnání v klinické studii možné. Metaanalýza klinických studií v sekundární prevenci CMP protidestičkovou léčbou včetně studie PRoFESS názorně demonstruje, že získání většího množství informací může statistickou nejistotu paradoxně zvýšit namísto snížit a zmenšit jednoznačnost léčebných doporučení a rozhodnutí [13].
- A konečně poslední obecný závěr, který by měl být z příběhu protidestičkové léčby v sekundární prevenci CMP učiněn, je, že účinnost by neměla být jediným a rozhodujícím ukazatelem při rozhodování o tom, jaký protidestičkový lék nebo kombinaci zvolit. V úvahu musí být brána také snášenlivost jednotlivých léčiv, výskyt nežádoucích účinků a riziko krvácení. V neposlední řadě musí být vzaty v úvahu i náklady na léčbu, které se v případě protidestičkových léků liší až stonásobně! Evidentně nejdůležitější je po prodělané ischemické CMP začít nemocnému preventivně podávat jakýkoliv protidestičkový lék. Je možné, že vítězem usilovného hledání „superaspirinů“ bude ASA samotná.
Seznam použité literatury
- [1] Rosamond W, Flegal K, Furie K, et al. Heart disease and stroke statistics – 2008 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation 2008; 117: e25–e146.
- [2] Kalina M, et al. Cévní mozková příhoda v medicínské praxi. Triton, Praha, 2008.
- [3] Antiplatelet Trialists' Collaboration. Secondary prevention of vascular events by prolonged antiplatelet therapy. Br Med J 1988; 296: 320–331.
- [4] Antiplatelet Trialists' Collaboration. Collaborative overview of randomised trials of antiplatelet therapy. Prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy on various categories of patients. Br Med J 1994; 308: 81–106.
- [5] Antiplatelet Trialists' Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction and stroke in high risk patients. Br Med J 2002; 324: 71–86.
- [6] CAPRIE Steering Committee. A randomised, blinded trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996; 348: 1329–1339.
- [7] Dinner HC, Bogousslavsky J, Brass LM, et al. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo-controlled trial. Lancet 2004; 364: 331–337.
- [8] Bhatt DL, Fox KA, Hacke W, et al. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006; 354: 1706–1717.
- [9] European Stroke Prevention Study Group. European stroke prevention study. Stroke 1990; 21: 1122–1130.
- [10] Diener HC, Cunha L, Forbes C, et al. European stroke prevention study 2. Dipyridamol and acetylsalicylic acid in the secondary prevention of stroke. J Neurol Sci 1966; 143: 1–13.
- [11] Halkes PH, van Gijn J, Kappele LJ, et al. Aspirin plus dipyridamol versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial Lancet 2006; 367: 1665–1673.
- [12] Diener HC. How much esprit is in ESPRIT? Stroke 2006; 37: 2856–2857.
- [13] Kent DM, Thaler DE. Stroke prevention – insights from incoherence. N Engl J Med 2008; 359: 1287–1289.
- [14] Van de Griend JP, Saseen JJ. Combination antiplatelet agents for secondary prevention of ischemic stroke. Pharmacotherapy 2008; 28: 1233–1242.
- [15] Thijns V, Lemmens R, Fieuws S. Network meta-analysis: simultaneous meta-analysis of common antiplatelet regimens after transient ischaemic attack or stroke. Eur Heart J 2008; 29: 1086–1092.
- [16] Sacco RL, Adams R, Albers G, et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: co-sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline. Stroke 2006; 37: 577–617.
- [17] European Stroke Organisation (ESO) Executive Committee, ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis 2008; 25: 457–507.
- [18] Sacco RL, Diener HC, Yusuf S, et al. Aspirin and extended-release dipyridamol versus clopidogrel for recurrent stroke. N Engl J Med 2008; 359: 1238–1251.