Antiarytmická farmakologická léčba fibrilace síní
Přes výrazně narůstající počet a nadějné výsledky katetrizačních ablací a kardiochirurgických výkonů k ovlivnění fibrilace síní (FS) zůstává v současnosti hlavním léčebným postupem u různých forem FS medikamentózní léčba. Uplatňují se dvě hlavní strategie této léčby: kontrola srdeční frekvence a kontrola srdečního rytmu. Klíčové postavení má antitrombotická léčba. K obnovení a udržení sinusového rytmu jsou používána u pacientů bez strukturálního srdečního postižení především tři antiarytmika – propafenon, sotalol, flekainid – a u pacientů s mírným strukturálním kardiálním postižením je to dronedaron, případně sotalol. U pacientů s významným strukturálním postižením srdce je vhodným antiarytmikem amiodaron.
Je třeba dodržovat zásadu pro výběr a dávkování antiarytmika u FS, podle níž je hlavním kritériem bezpečnost antiarytmika, a to s ohledem na základní kardiovaskulární a nekardiální onemocnění jednotlivého pacienta a na jeho schopnost metabolizace daného léku a potenciální lékové interakce.
Perspektivně lze očekávat, že budou k dispozici antiarytmika nová, selektivní pro síňový myokard. Ta by neměla mít proarytmický potenciál ohrožující pacienta komorovými arytmiemi a měla by být použitelná i u pacientů se strukturálním srdečním postižením. Studován je též efekt léčiv, která potlačují vývoj arytmogenního substrátu v síních (inhibitory ACE, sartany, statiny aj.), a mají tedy antiremodelační účinek. Léky mohou být podávány k posílení efektu nefarmakologické léčby v rámci tzv. hybridní terapie.
Úvod
V současné době se mění pohledy na léčebné možnosti u pacientů s fibrilací síní (FS), která je – s prevalencí 1 % až 2 % – nejčastější udržující se poruchou srdečního rytmu v dospělé populaci. Nová doporučení jsou obsažena v nedávno publikovaném materiálu Evropské kardiologické společnosti (ESC Guidelines), který odráží aktuální poznatky a informace o dané problematice a zohledňuje též poměr přínosu a rizika u jednotlivých léčebných postupů [1].
V platnosti zůstává, že léčba FS se má soustředit na 3 hlavní cíle:
- prevence tromboembolických komplikací
- úprava srdečního rytmu a/nebo srdeční frekvence;
- léčba a prevence případného základního onemocnění, které se může podílet na vzniku a perzistenci FS (hypertenze, srdeční selhání, chlopňová vada, thyreopatie aj.).
Nové trendy v oblasti ovlivnění FS jsou charakterizovány tím, že jsou v dané indikaci ověřovány léky, jejichž vývoj se opírá o nové patofyziologické poznatky o podstatě této arytmie; patrný je důrazný nástup nefarmakologické léčby především v podobě katetrizačních ablací – tzv. izolace plicních žil (s cílem odstranění spouštěcího faktoru arytmie) či komplexnějšího postupu cíleného též na modifikaci arytmogenního substrátu v síních. Nové poznatky o patofyziologickém podkladu FS směřují také k většímu uplatnění tzv. antiremodelační léčby (či „upstream“ terapie). Touto problematikou se zabývá jiné sdělení.
Perspektivní směry se též zaměřují na analýzu genetických variant spojených se zvýšeným rizikem výskytu FS a komplikací této arytmie, na farmakogenetiku a na ověření možností tzv. personalizované medicíny, tedy léčby „ušité na míru“ pro jednotlivé pacienty [2]. Vrátíme se nyní zpět k současné realitě.
Přes příznivé reference o výsledcích nefarmakologické léčby je u podstatně větší části populace s různými formami uvedené arytmie dominantní farmakologická léčba. Na prvním místě, jak je již výše zdůrazněno, zůstává antitrombotická, respektive antikoagulační léčba. To platí i pro další postup léčby po úspěšné nefarmakologické léčbě. Tento článek je zaměřen především na chronickou medikamentózní antiarytmickou léčbu.
Indikace farmakologické antiarytmické léčby
Vlastní farmakologické ovlivnění symptomů, hemodynamického a prognostického dopadu srdečního rytmu při FS je v současnosti obvykle rozdělováno do dvou hlavních léčebných strategií: kontroly srdeční frekvence a kontroly srdečního rytmu. Při záchytu první epizody FS, trvající pravděpodobně déle než 48 hodin, je zahajována léčba ke kontrole komorové frekvence a samozřejmě antikoagulační léčba. Pokud to hemodynamická situace a symptomy umožní, odkládá se farmakologická či elektrická kardioverze o 3 týdny při zajištěné účinné antikoagulační léčbě [1]. Tento interval je možno zkrátit, pokud jícnovou echokardiografií vyloučíme přítomnost intrakardiálního trombu (se zaměřením především na levostranné srdeční oddíly včetně ouška levé síně). Při kontrole srdeční frekvence je účinek medikace cílen na ovlivnění vedení síňo-komorovým uzlem při trvající FS. V této indikaci jsou používány především betablokátory (nejčastěji metoprolol), blokátory kalciového kanálu (verapamil nebo diltiazem) a digoxin. Zřídka, například při intoleranci či při výrazných vedlejších účincích betablokátorů a blokátorů kalciového kanálu, jsou pro docílení vyrovnané komorové frekvence využívána i antiarytmika, a to především ta, která mají mírný beta-blokující efekt a pacient je toleruje.
Při kontrole srdečního rytmu jsou používána antiarytmika nebo další léky k obnově a udržení sinusového rytmu. V této indikaci jsou podávána především konvenční antiarytmika třídy III a I dle původní klasifikace Vaughana-Williamse.
Obě zmíněné strategie léčby FS srovnávalo několik randomizovaných studií, z nichž největší a nejvýznamnější je studie AFFIRM s více než čtyřmi tisíci pacientů průměrného věku téměř 70 roků. Studie ukázala při 5letém sledování celkovou mortalitu ve skupině s kontrolou rytmu 24 % a ve skupině s kontrolou srdeční frekvence 21 %. Tento rozdíl nebyl statisticky významný (p = 0,08) [3]. Rovněž výsledky dalších studií nepotvrdily výhodu strategie kontroly srdečního rytmu oproti kontrole srdeční frekvence pro střednědobé přežívání pacientů [4, 5]. Ani studie provedená u téměř 1400 pacientů s FS, s chronickým srdečním selháváním, s ejekční frakcí levé komory 35 % či nižší neukázala rozdíl v celkové a v kardiovaskulární mortalitě mezi oběma uvedenými léčebnými strategiemi při průměrné délce sledování 37 měsíců. Kardiovaskulární mortalita (tj. primární sledovaný ukazatel) byla ve skupině s kontrolou srdečního rytmu (kde jako antiarytmikum naprosto dominoval amiodaron) 27 % versus 25 % ve skupině s kontrolou srdeční frekvence (p = 0,59) [6].
Zásadní význam má udržování účinné antikoagulace při obou uvedených terapeutických postupech. Přes výše uvedené závě![Obr. 1 Senzitivita jednotlivých metod pro detekci asymptomatických či málo symptomatických epizod fibrilace síní; volně podle [10] – Arya, et al., 2007.](https://www.remedia.cz/photo-a-28377---.jpg) ry o neutrálním vlivu kontroly rytmu na mortalitu však studie AFFIRM i další studie a jejich subanalýzy zaměřené na posouzení kvality života a výskyt komplikací při FS hovoří ve prospěch kontroly rytmu [7, 8]. Řada prací ukázala, že při sinusovém rytmu je srdeční výdej vyšší až o 20 %, zejména u pacientů se zhoršenou poddajností (compliance) levé komory. Je zjištěno, že při sinusovém rytmu mají pacienti lepší kvalitu života a menší riziko kardiovaskulárních komplikací [1]. Je též známo, že déletrvající komorová frekvence vyšší než 120–130 tepů/min při dlouhodobě perzistující FS může vyústit v tzv. posttachyarytmickou kardiomyopatii [1]. Proto je u velké části pacientů upřednostňována snaha o docílení a udržení sinusového rytmu. Objektivní hodnocení srdečního rytmu má velký
ry o neutrálním vlivu kontroly rytmu na mortalitu však studie AFFIRM i další studie a jejich subanalýzy zaměřené na posouzení kvality života a výskyt komplikací při FS hovoří ve prospěch kontroly rytmu [7, 8]. Řada prací ukázala, že při sinusovém rytmu je srdeční výdej vyšší až o 20 %, zejména u pacientů se zhoršenou poddajností (compliance) levé komory. Je zjištěno, že při sinusovém rytmu mají pacienti lepší kvalitu života a menší riziko kardiovaskulárních komplikací [1]. Je též známo, že déletrvající komorová frekvence vyšší než 120–130 tepů/min při dlouhodobě perzistující FS může vyústit v tzv. posttachyarytmickou kardiomyopatii [1]. Proto je u velké části pacientů upřednostňována snaha o docílení a udržení sinusového rytmu. Objektivní hodnocení srdečního rytmu má velký 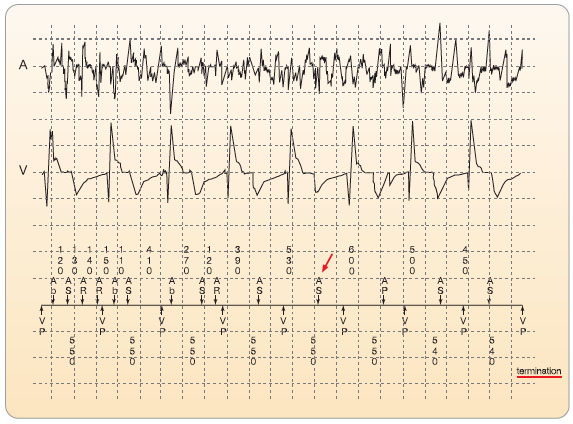 význam pro správné vedení dlouhodobější léčby a hodnocení jejího efektu. Detekce recidiv arytmie je dnes podstatně spolehlivější díky novějším možnostem dlouhodobé monitorace srdečního rytmu – například pomocí epizodických záznamníků ekg, několikadenní kontinuální holterovské monitorace, pravidelné transtelefonické monitorace či implantabilních záznamníků ekg. Pokud má pacient implantován novější typ kardiostimulátoru či kardioverteru-defibrilátoru, zejména se síňovou elektrodou, je možné využít paměťové funkce přístroje, nebo dokonce průběžný „telemonitoring“ k poměrně velmi spolehlivému hodnocení výskytu FS za určité sledované období [9–11], viz obr. 1. Měli bychom však mít na zřeteli, že ani tato posledně jmenovaná monitorace nemá 100% senzitivitu (obr. 2). Je proto vhodné posuzovat efekt antiarytmické léčby dostatečně kriticky a nepospíchat s případným ukončením antitrombotické léčby.
význam pro správné vedení dlouhodobější léčby a hodnocení jejího efektu. Detekce recidiv arytmie je dnes podstatně spolehlivější díky novějším možnostem dlouhodobé monitorace srdečního rytmu – například pomocí epizodických záznamníků ekg, několikadenní kontinuální holterovské monitorace, pravidelné transtelefonické monitorace či implantabilních záznamníků ekg. Pokud má pacient implantován novější typ kardiostimulátoru či kardioverteru-defibrilátoru, zejména se síňovou elektrodou, je možné využít paměťové funkce přístroje, nebo dokonce průběžný „telemonitoring“ k poměrně velmi spolehlivému hodnocení výskytu FS za určité sledované období [9–11], viz obr. 1. Měli bychom však mít na zřeteli, že ani tato posledně jmenovaná monitorace nemá 100% senzitivitu (obr. 2). Je proto vhodné posuzovat efekt antiarytmické léčby dostatečně kriticky a nepospíchat s případným ukončením antitrombotické léčby.
Výběr antiarytmika
Problematika ukončení epizody FS farmakologickou nebo elektrickou kardioverzí není předmětem tohoto sdělení. Jak již bylo řečeno v úvodu, před volbou další léčby k prevenci recidiv dané arytmie je třeba zvážit možný podíl vyvolávajících faktorů (např. nedostatečně kontrolované hypertenze, thyreopatie, minerálové dysbalance, spánkové apnoe, abúzu alkoholu, aj.) a zajistit jejich korekci či eliminaci. Při výběru antiarytmika je třeba zhodnotit základní 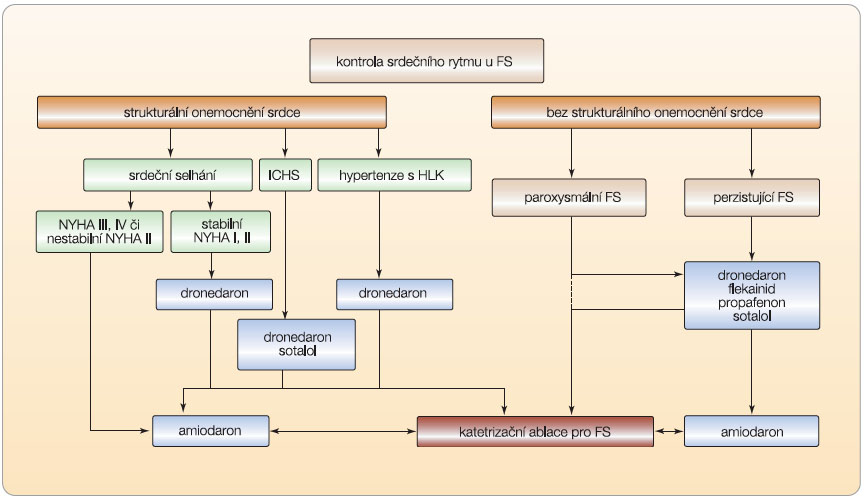 kardiální postižení, kontraktilní funkci levé komory, významné komorbidity (renální, hepatální insuficienci aj.), chronické podávání léků prodlužujících repolarizaci (QT interval) na ekg aj. V zásadě platí, že při chronické léčbě
kardiální postižení, kontraktilní funkci levé komory, významné komorbidity (renální, hepatální insuficienci aj.), chronické podávání léků prodlužujících repolarizaci (QT interval) na ekg aj. V zásadě platí, že při chronické léčbě 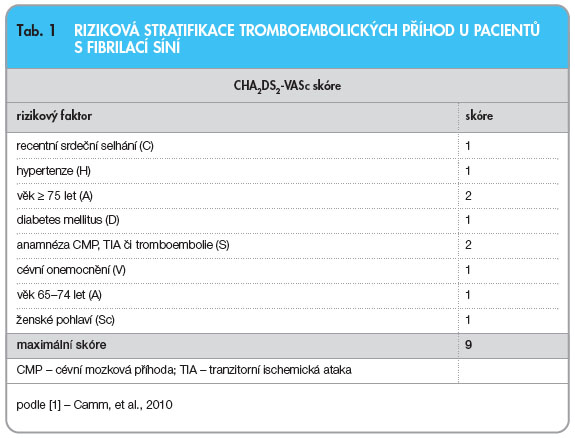 používáme co nejnižší dávku antiarytmika, která zajistí žádaný efekt. Volba vhodného antiarytmika a jeho dávkování jsou tedy individuální a mají respektovat výše uvedená hlediska u konkrétního pacienta.
používáme co nejnižší dávku antiarytmika, která zajistí žádaný efekt. Volba vhodného antiarytmika a jeho dávkování jsou tedy individuální a mají respektovat výše uvedená hlediska u konkrétního pacienta.
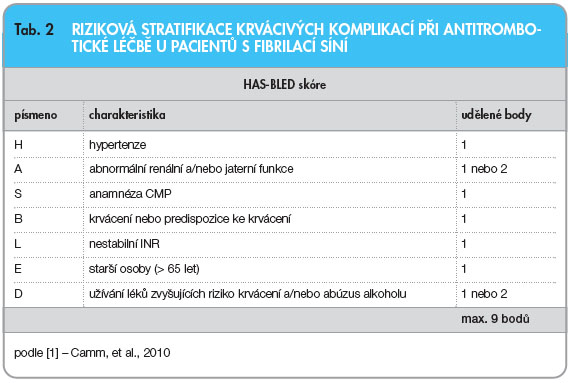
Výběr vhodného antiarytmika dle Guidelines ESC je shrnut ve schématu na obr. 3 na [1]. Přehled používaných dávek hlavních antiarytmik u fibrilace síní uvádí tab. 1.
Přehled současných antiarytmik pro léčbu FS
Antiarytmika používaná nyní v léčbě FS mají určité limitace. Je to zejména nižší účinnost v ovlivnění dané arytmie v jednotlivých případech a též relativně vyšší riziko vedlejších účinků a nesnášenlivost této léčby. Hodnocení účinnosti testovaných léků dle výsledků určitých klinických studií může být ovlivněno mimo jiné výraznou selekcí pacientů při zařazování do dané studie, takže složení pacientů ve studii se značně liší od běžné populace, na kterou by se měly výsledky vztahovat. Kupříkladu ve studii SAFE-T (Sotalol Amiodarone Atrial Fibrillation Efficacy Trial) bylo posuzováno při výběru do studie 10krát více pacientů, než bylo nakonec zařazeno [12]. V běžné klinické praxi jsou hlavní populací s FS pacienti ve věkové skupině nad 70 let a u nich je zvýšené riziko antiarytmické léčby vzhledem k častým komorbiditám a polyfarmakoterapii s potenciální možností lékových interakcí.
V současné době není k dispozici antiarytmikum ke kontrole srdečního rytmu bez zřetelnějších vedlejších účinků. V dalším textu je uveden krátký komentář k jednotlivým – abecedně seřazeným – konvenčním antiarytmikům.
Amiodaron
Tento lék bývá označován jako „širokospektré“ antiarytmikum. Patří do III. třídy výše uvedené konvenční klasifikace anti-arytmik. Účinkuje jako blokátor draslíkových, sodíkových i vápníkových iontových kanálů a má antiadrenergní účinky. Amiodaron prodlužuje refrakterní fázi síňového i komorového myokardu, prodlužuje tedy QT interval na ekg, ale nezvýrazňuje rozdíly v délce repolarizace jednotlivých vrstev komorového myokardu, a má tedy malý proarytmický potenciál z hlediska komorových tachyarytmií. Snižuje mírně frekvenci tvorby vzruchů v sinusovém uzlu a mírně prodlužuje vedení síňo-komorovým uzlem. Amiodaron má mimořádně dlouhý poločas vylučování, jeho hodnota je obvykle udávána v délce 4–6 týdnů.
Toto antiarytmikum je v léčbě FS považováno za nejúčinnější, avšak jeho chronické podávání je spojeno s vysokým výskytem (10–30 %) extrakardiálních vedlejších účinků (např. plicní toxicita 1–17 %, hepatotoxicita 15–30 %, dysfunkce štítné žlázy 10 %). Vedlejší účinky s menší závažností se vyskytují podstatně častěji (zvýšená fotosenzitivita v 25–75 %, korneální mikrodepozita > 90 %) [12–14]. Většina vedlejších účinků tohoto antiarytmika závisí na kumulativní dávce a objevuje se obvykle až po delším podávání amiodaronu (déle než 12 měsíců) v dávce větší než 200 mg denně [15]. Ojediněle jsou však popsány kazuistiky s klinicky závažnými nežádoucími účinky již po krátce trvající léčbě amiodaronem [16]. Je proto důležité při léčbě antiarytmiky důsledně kontrolovat možný výskyt vedlejších účinků této léčby a snažit se o jejich prevenci dodržováním zásad bezpečné farmakoterapie [17]. Ty spočívají v podávání pokud možno nízké dávky antiarytmika a v dodržování kratších intervalů kontrol během léčby se zaměřením pozornosti na výskyt symptomů budících podezření na vedlejší účinky léčby. Dostatečný efekt v potlačení recidiv FS u řady pacientů zajistí dávka amiodaronu 100–200 mg podávaná 3–4krát týdně. Je třeba provádět doporučené laboratorní kontroly v odpovídajících časových intervalech, nepodávat „rizikové“ kombinace léků a myslet na možnost výskytu lékových interakcí. Amiodaron vykazuje časté lékové interakce v rámci biotransformace enzymy cytochromového systému. Například současné podávání amiodaronu s warfarinem či digoxinem vede ke zvýšení účinku uvedených léků, jejich dávky by proto měly být sníženy dle klinického stavu a relevantních laboratorních ukazatelů.
Vzhledem k poměrně bezpečnému profilu amiodaronu z hlediska nežádoucích kardiálních účinků je toto antiarytmikum považováno za vhodný lék u pacientů s FS se strukturálním srdečním postižením či s přítomností hypertrofie levé komory. Vzhledem k uvedeným častým vedlejším extrakardiálním účinkům amiodaron rozhodně není antiarytmikem první volby u pacientů bez strukturálního srdečního onemocnění [1].
Dronedaron
Toto nové antiarytmikum je benzofuranový derivát podobný amiodaronu, který ale neobsahuje jod, a má navíc methansulfonovou skupinu, jež působí jeho nižší lipofilii, kratší poločas vylučování a menší kumulaci ve tkáních, a tím menší tkáňovou toxicitu. S tímto lékem bylo provedeno několik randomizovaných studií, které prokázaly jeho účinnost při prevenci recidiv FS a jeho bezpečnost u pacientů s mírnějším stupněm strukturálního srdečního postižení. Dronedaron oproti placebu ve velké randomizované studii ATHENA vedl u „rizikovějších“ pacientů k významnému snížení počtu hospitalizací pro kardiovaskulární příčiny a k významnému snížení mortality pro kardiovaskulární důvody [18]. Lze očekávat, že toto antiarytmikum v nejbližší době rozšíří armamentarium antiarytmické léčby fibrilace síní [1]. Tento lék je kontraindikován u pacientů se srdečním selháním odpovídajícím funkční třídě NYHA III a IV a u hemodynamicky nestabilních pacientů s funkční třídou NYHA II a s výraznou systolickou dysfunkcí levé komory, s ejekční frakcí < 35 %. Dronedaron může vykazovat významnější interakce s řadou kardiálních i nekardiálních léků a jeho podávání je nevhodné u pacientů, kteří užívají silné inhibitory izoenzymu CYP3A4 cytochromového systému (např. klarithromycin, ketokonazol, flukonazol, verapamil, diltiazem, některá virostatika aj.), a pacient by neměl při léčbě dronedaronem konzumovat grapefruity. V tomto čísle časopisu Remedia je dronedaronu věnováno samostatné sdělení.
Flekainid
Tento lék patří do stejné skupiny anti-arytmik (I-C) jako propafenon a má obdobné indikace a obdobnou účinnost jako propafenon. Je vhodné připomenout známou studii CAST (Cardiac Arrhythmia Suppression Trial), v níž byl tento lék před zhruba 20 lety testován s cílem potlačit komorovou ektopickou aktivitu u pacientů po infarktu myokardu s dysfunkcí levé komory. Tato studie ukázala na riziko komorové proarytmie po léčbě uvedeným antiarytmikem a na zvýšení kardiovaskulární mortality oproti placebu. Proto po řadu let byla zvýšená obava z používání flekainidu. Je však třeba zdůraznit, že v léčbě FS u pacientů bez strukturálního srdečního postižení je tento lék poměrně bezpečný a má v uvedené indikaci své místo [1].
Metaanalýza řady menších studií ukázala, že při sledování trvajícím alespoň 6 měsíců byl účinkem flekainidu udržen sinusový rytmus zhruba v 60 % případů [19].
Při léčbě flekainidem se doporučuje současně podávat léky ke kontrole síňo-komorového převodu (nejspíše betablokátor) pro případ, že se fibrilace síní konvertuje do flutteru síní, u nějž může vlivem flekainidu dojít k deblokování síňo-komorového převodu s rychlou komorovou odpovědí.
Flekainid je v rámci ČR používán poměrně málo, protože není registrován, a jeho použití je limitováno v rámci tzv. specifického léčebného programu v komplexních kardiologických centrech. Vzhledem k omezeným zkušenostem s tímto lékem v našem státě připomeneme jeho základní farmakokinetické vlastnosti. Po perorálním podání je absorpce flekainidu rychlá a téměř kompletní. Maximální plazmatické koncentrace je po podání neretardované formy dosaženo za 3 hodiny. Jídlo neovlivňuje vstřebávání tohoto léku, poločas vylučování po podání jednotlivé perorální dávky je zhruba 20 hodin. Flekainid je metabolizován v játrech pomocí cytochromu P-450 (izoenzymem CYP2D6) a jsou známy výrazné rozdíly ve vybavení tímto izoenzymem v rámci genového polymorfismu, takže je možno očekávat zřetelné rozdíly v dávkování tohoto antiarytmika mezi jednotlivými pacienty k dosažení žádoucího antiarytmického účinku. Zvýšené opatrnosti je třeba u pacientů s prodlouženým intraventrikulárním vedením, tj. s fascikulární blokádou. Pokud během léčby flekainidem dojde k rozšíření QRS o více než 25 % ve srovnání s výchozí hodnotou, je třeba považovat toto za ukazatel zvýšeného rizika proarytmie a redukovat dávku či přerušit tuto léčbu.
Propafenon
Toto velmi často používané antiarytmikum je také ze skupiny I-C zmíněné klasifikace antiarytmik. Absorpce po perorálním podání je téměř kompletní. Maximální plazmatické koncentrace je dosaženo za 2–3 hodiny. Poločas vylučování propafenonu je průměrně 6–8 hodin. Takzvaní rychlí metabolizátoři mají poločas vylučování zhruba 5 hodin. Oproti tomu tzv. pomalí metabolizátoři mají vlivem snížené enzymové kapacity mikrozomálního cytochromu P-450 v játrech poločas vylučování až 20 hodin a je u nich více vyjádřen beta-blokující efekt propafenonu.
Podávání propafenonu zvyšuje pravděpodobnost střednědobého udržení sinusového rytmu po úspěšné kardioverzi FS zhruba dvojnásobně oproti placebu. Tento závěr vyplynul z řady menších randomizovaných studií [1]. Je možno uvést jednu z novějších studií, v níž u téměř 200 pacientů s předchozí perzistující fibrilací síní při další léčbě propafenonem byl docílen sinusový rytmus po 12 měsících u 63 % pacientů, při podávání placeba to bylo u 35 % (p < 0,001) [20]. Propafenon je možné podávat bezpečně u pacientů bez významnějšího strukturálního srdečního postižení [1]. V této situaci byl dosud u nás antiarytmikem první volby. Propafenon není vhodný u pacientů s klinicky manifestní ischemickou chorobou srdeční či jiným strukturálním kardiovaskulárním postižením a s dysfunkcí levé srdeční komory.
Sotalol
Tento lék patří do III. skupiny původní klasifikace antiarytmik (dle Vaughana-Williamse). Sotalol je racemická směs D- a L-izomerů, přičemž vlastnosti antiarytmika má především D-izomer, zatímco L-izomer má vlastnosti neselektivního hydrofilního betablokátoru bez vnitřní sympatomimetické aktivity. Toto antiarytmikum se velmi dobře vstřebává po perorální aplikaci a maximální plazmatické koncentrace je dosaženo za 3–4 hodiny po tomto podání. Poločas vylučování je 12–15 hodin.
Účinnost D,L-sotalolu na FS byla prokázána v řadě menších studií [1]. Z relativně novějších prací je možno uvést randomizovanou studii u více než 250 pacientů, kde byla prováděna poměrně dobrá pravidelná kontrola aktuálního srdečního rytmu pomocí transtelefonického přenosu ekg. Průměrný interval k první zachycené recidivě FS byl při dávce sotalolu 2krát denně 120 mg či 2krát 160 mg denně signifikantně delší než u placeba (175 a 229 dnů oproti 27 dnům, p < 0,004) [21].
Je dobře známo, že podání tohoto léku vede k prodloužení repolarizace (prodloužení QT intervalu). To s sebou nese zvýšené riziko proarytmie, obávané jsou komorové tachykardie typu torsade de pointes. Sotalol není vhodný u pacientů s významnějším strukturálním srdečním postižením a u pacientů, kteří užívají další léky (například psychofarmaka, prokinetika aj.) prodlužující repolarizační fázi srdečního cyklu. Pokud QT interval při léčbě sotalolem dosáhne více než 500 ms, léčba tímto antiarytmikem by měla být přerušena nebo dávka sotalolu výrazněji snížena [1].
Taktika jednorázové aplikace antiarytmika
Tento postup léčebného ovlivnění je také označován jako „pill-in-the-pocket“ („tableta v kapse“) a předpokládá, že pacient krátce po vzniku symptomatické přetrvávající epizody arytmie (FS) si sám aplikuje jednorázově určitou, již dříve ověřenou, dávku propafenonu (nejspíše 300 mg) nebo flekainidu (nejspíše 200 mg); takový postup může vést poměrně bezpečně k dosažení verze na sinusový rytmus ve 45 % epizod arytmií do 3 hodin. Účinnost je obdobná u obou uvedených léků [22].
Tento postup může být používán u vybraných pacientů s výrazně symptomatickými epizodami FS, které se vyskytují s malou frekvencí (1krát měsíčně až 1krát ročně), když předtím u nich byl při hospitalizaci a monitoraci ekg ověřen jako efektivní a bezpečný [1]; podmínkou je, že u těchto nemocných nesmí být přítomna jasná kontraindikace k podání uvedených antiarytmik. Pacienti jsou dostatečně poučeni o tom, za jaké situace mohou použít jednorázově antiarytmikum, a také o tom, jak mají postupovat, pokud se nedostaví očekávaný efekt [1, 23].
Dávkování antiarytmik Personalizovaná medicína
Obecně při dávkování antiarytmik platí, že doporučované dávky (dle výsledků relevantních klinických studií) by neměly být nekriticky převzaty, aniž bychom pečlivě hodnotili efekt léčby a případný výskyt vedlejších účinků (včetně prvních signálů jejich manifestace) u jednotlivých pacientů. Současné poznatky ukazují na velké interindividuální rozdíly v metabolizaci určitých léků (včetně antiarytmik) vlivem genových polymorfismů, které ovlivňují funkci enzymů podílejících se na farmakokinetice i farmakodynamice jednotlivých léků, a vlivem lékových interakcí. Podle výsledků častých klinických kontrol je možné určit vhodné dávkování antiarytmika pro docílení větší účinnosti léčby u jednotlivého pacienta a zároveň tak snížit výskyt vedlejších účinků [2]. Tento perspektivní směr ve farmakoterapii, který bude postupně více využívat informace z farmakogenetiky, jistě výrazně ovlivní naše chápání správné medikamentózní léčby, zvažování farmakologických interakcí a jejich potenciální využití i k tzv. modulaci léčby a bude směřovat k postupně většímu uplatnění tzv. personalizované terapie (tedy léčby „šité na míru“ pro individuálního pacienta).
Nová antiarytmika
Jasně definovaným cílem je vývoj účinnější a bezpečnější antiarytmické medikamentózní léčby FS. Nejspíše by to mělo být antiarytmikum selektivní pro síňový myokard [24, 25].
Akční potenciál myokardu síní má na rozdíl od akčního potenciálu komorového myokardu kratší trvání a málo vyjádřenou fázi plateau. V síňových kardiomyocytech jsou iontové draslíkové kanály, které v komorovém myokardu nejsou zřetelněji zastoupeny (např. IKur, IKACh ). Draslíkový kanál IKur je rychle aktivován během depolarizace membrány na hodnoty nad -20 mV a je nejvýraznější během fáze 2 akčního potenciálu a odpovídá za kratší trvání síňového akčního potenciálu. Kanál IKACh je nejzřetelnější v buňkách sinusového uzlu. V pracovním myokardu síní je patrně zodpovědný za abnormální automacii. Jeho aktivace acetylcholinem uvolněným z vagových nervových zakončení zkracuje trvání akčního potenciálu síní a může tak podmiňovat některé paroxysmální fibrilace síní, které vykazují vazbu na zvýšenou vagotonii.
Vývoj nových antiarytmik pro léčbu fibrilace síní vychází z novějších poznatků o patofyziologické podstatě fibrilace síní a je soustředěn na:
- léky selektivní pro síňový myokard;
- léky blokující více iontových kanálů (jako amiodaron, ale méně toxické);
- léky s účinky na tzv. gap-junkce (umožňující úpravu vzniklé poruchy vedení vzruchu);
- léky ovlivňující jiné iontové kanály, které se mohou podílet na vzniku a udržení fibrilace síní (kanály aktivované napětím myocytů – „stretch-activated“…).
 V současnosti probíhá řada studií s novými léky v dané indikaci. Některé studie se zatím nacházejí v preklinické fázi, jiné jsou již v některé fázi klinického zkoušení. V následující části stručně shrneme základní informace o několika vybraných nových antiarytmikách perspektivně použitelných v léčbě FS (tab. 2).
V současnosti probíhá řada studií s novými léky v dané indikaci. Některé studie se zatím nacházejí v preklinické fázi, jiné jsou již v některé fázi klinického zkoušení. V následující části stručně shrneme základní informace o několika vybraných nových antiarytmikách perspektivně použitelných v léčbě FS (tab. 2).
Azimilid je poměrně novým antiarytmikem III. třídy, blokuje iontové kanály IKr, IKs. S tímto antiarytmikem byla uskutečněna studie ALIVE, jejímž primárním cílem bylo zjistit vliv azimilidu v dávce 100 mg denně na mortalitu pacientů se systolickou dysfunkcí levé komory po proběhlém infarktu myokardu. Subanalýza této studie ukázala, že z 3278 pacientů, u nichž byl při randomizaci sinusový rytmus, se objevila FS v době studie u 0,5 % při léčbě azimilidem a u 1,2 % při podávání placeba (p < 0,05). U pacientů, kteří měli při vstupu do studie FS, bylo po léčbě azimilidem docíleno vyšší procento verzí na sinusový rytmus ve srovnání s placebem (26,8 % vs. 10,8 %) [26]. Z metaanalýzy 4 studií s azimilidem vyplynulo, že toto antiarytmikum v dávce 100 mg a 125 mg prodloužilo interval do první recidivy FS (p < 0,02) [27]. I další studie s azimilidem (A-COMET-II) ukázala, že po léčbě tímto antiarytmikem byl prodloužen interval k první recidivě FS (p = 0,034). Byly však zaznamenány ojedinělé případy výskytu komorové tachykardie typu torsade de pointes [28]. Proto zatím panuje rezervovaný postoj k případné indikaci podávání azimilidu u FS.
AVE-0118 patří mezi selektivní síňová antiarytmika: blokuje zejména síňový draslíkový vyrovnávací proud (IKur) a má jen minimální efekt na komorový myokard. Blokuje též kanály IKACh a Ito, prodlužuje efektivní refrakterní periodu síní. Experimentální práce navíc ukázaly jeho příznivý efekt na síňovou kontraktilitu [29, 30]. Po experimentálních příznivých výsledcích se však uvedený lék neukázal jako dostatečně efektivní u déletrvající fibrilace síní u lidí. Proto je dále studován analog původní molekuly označený AVD-1231, který je zatím v počáteční fázi klinického zkoušení [31, 32].
Vernakalant (RSD-1235) je nové anti-arytmikum s vlastnostmi obdobnými jako u předchozího léčiva – je to selektivní síňový blokátor kanálů IKACh, IKur. Vernakalant blokuje také iontový draslíkový kanál Ito, prodlužuje efektivní refrakterní periodu síní. Bylo pozorováno, že tento efekt je výraznější v levé síni [33]. Série 4 studií ACT 1-4 (Atrial Arrhythmia Conversion Trial) s intravenózní infuzní aplikací vernakalantu u krátce i déle trvající FS ukázala dobrou účinnost tohoto léku pro obnovení sinusového rytmu a přitom jeho bezpečnost [34, 35]. Rovněž testování účinnosti perorální aplikace vernakalantu k prevenci recidivy FS ukazuje slibné výsledky [36]. Vernakalant je metabolizován pomocí cytochromového systému CYP2D6. Je pravděpodobné, že účinné dávky léku se mohou výrazně lišit u pomalých a rychlých metabolizátorů.
Poslední dvě jmenovaná antiarytmika patří do skupiny několika nových léků, které prodlužují repolarizaci síní (Atrial Repolarization-Delaying Agents – ARDA) a které jsou ve fázi preklinického nebo počátečního i pokročilejšího klinického výzkumu. Tyto léky mají jen malý efekt na elektrofyziologické vlastnosti komorového myokardu a lze očekávat, že některé z nich budou použitelné k léčbě FS v klinické praxi.
Rotigaptid (ZP 123) je modulátor přenosu vzruchu na mezibuněčných spojeních, tzv. gap-junkcích. Rotigaptid patří mezi nadějné léky s antiarytmickým potenciálem pro léčbu FS. Je známo, že narušení šíření elektrického vzruchu mezi buňkami představuje arytmogenní podnět. Uvedený lék zlepší přenos vzruchu mezi buňkami při určitých patofyziologických situacích (například ischemie, acidóza) a může tak snížit výskyt FS [37, 38]. Problémem limitujícím klinické použití tohoto léku je velmi nízká biologická dostupnost po perorální aplikaci.
Ovlivnění iontových kanálů aktivovaných napětím myocytů
Někteří autoři ukázali, že blokáda „stretch-activated“ kanálů vede k potlačení inducibility FS [39, 40]. V novější experimentální práci na izolovaných králičích srdcích bylo demonstrováno, že dofetilid i flekainid jsou srovnatelně účinné v potlačení FS indukované zvýšeným napětím („stretch“) myocytů [41]. Lékům, které mají potenciál působit na zmíněný typ iontových kanálů, jež mohou ovlivnit vznik FS, je nadále věnována dostatečná pozornost.
Neantiarytmická medikamentózní léčba fibrilace síní
Potlačení síňové „elektrické“ a strukturální remodelace je nadějným cílem ve vývoji léků a farmakologických léčebných postupů k potlačení fibralace síní. Tato antiremodelační terapie spadá do oblasti tzv. upstream terapie, která vychází z důkladnější znalosti patofyziologického podkladu dané arytmie a je směřována k potlačení fibrotizace myokardiální tkáně a dalších remodelačních procesů přispívajících k arytmogenezi [42, 43]. Této problematice je věnováno samostatné sdělení.
Závěr
Přes rychlý rozvoj nefarmakologické léčby FS a její zlepšující se výsledky a bezpečnost zůstává v současnosti dominantním postupem u většiny pacientů s uvedenou arytmií medikamentózní léčba. Základem je antitrombotická léčba bez ohledu na formu FS.
Ke kontrole srdečního rytmu, tedy k prevenci recidiv FS, je u pacientů bez strukturálního srdečního postižení používán propafenon nebo flekainid, u strukturálního postižení mírného stupně to může být sotalol a dronedaron a u pacientů s významnějším organickým kardiovaskulárním postižením je lékem volby amiodaron. V zásadě platí, že výběr antiarytmické léčby u FS je založen na pravidle, že přednost má bezpečné, i když méně účinné antiarytmikum [1]. Volba léku má respektovat základní kardiovaskulární a nekardiální onemocnění jednotlivého pacienta, jeho schopnost metabolizace daného léku a potenciální lékové interakce.
Ke zlepšení současné situace by perspektivně měla přispět nová antiarytmika. Cílem je, aby byla selektivní pro síňový myokard, který obsahuje některé iontové kanály, jež nejsou v komorovém myokardu významněji zastoupeny. Pozornost se též soustřeďuje na léky ovlivňující další struktury (jako mezibuněčné spoje), jejíchž porušená funkce se může podílet na genezi FS.
Poměrně velký zájem je nyní cílen na tzv. antiremodelační medikamentózní léčbu u fibrilace síní. Je studována profibrotická role systému renin-angiotenzin-aldosteron, oxidativního stresu a zánětlivých procesů a možnost jejich účinného ovlivnění.
Můžeme shrnout, že perspektivní směry medikamentózní antiarytmické léčby u různých forem FS vycházejí z nových patofyziologických poznatků a snaží se o vývoj účinnějších a bezpečnějších léků selektivně působících na síňový myokard. Do popředí se dostává strategie, která anti-arytmickou léčbu kombinuje s tzv. antiremodelační léčbou a v některých případech ji kombinuje s nefarmakologickou (tj. především ablační) léčbou v podobě tzv. hybridní terapie.
Seznam použité literatury
- [1] Camm AJ, Kirchhof P, Lip YH, et al. Guidelines for the management of atrial fibrillation. Eur Heart J 2010; 31: 2369–2429.
- [2] Lubitz SA, Ozcan C, Magnani JW, et al. Genetics of atrial fibrillation. Implications for future research directions and personalized medicine. Circ Arrhythm Electrophysiol 2010; 3: 291–299.
- [3] AFFIRM Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347: 1825–1833.
- [4] Hagens VE, Crijns HJGM, Van Veldhuisen DJ, et al. Rate control versus rhythm control for patients with persistent atrial fibrillation with mild to moderate heart failure: results from the RAte Control versus Electrical Cardioversion (RACE) study. Am Heart J 2005; 149: 1106–1111.
- [5] Hohnloser SH, Kuck KH, Lilienthal J, for the PIAF Investigators. Rhythm or rate control in atrial fibrillation – Pharmacological Intervention in Atrial Fibrillation (PIAF): a randomized trial. Lancet 2000; 356: 1789–1794.
- [6] Roy D, Nattel S, Wyse G, et al. Rhythm control versus rate control for atrial fibrillation and heart failure. N Engl J Med 2008; 358: 2667–2677.
- [7] AFFIRM Investigators. Quality of life in atrial fibrillation: the Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) study. Am Heart J 2005; 149: 112–120.
- [8] Singh SN, Tang XC, Singh BN, et al., for the SAFE-T Investigators. Quality of life and exercise performance in patients in sinus rhythm versus persistent atrial fibrillation. J Am Coll Cardiol 2006; 48: 721–730.
- [9] Brignole M, Vardas P, Hoffman E, et al. Indications for the use of diagnostic implantable and external ECG loop recorders. Europace 2009; 11: 671–687.
- [10] Arya A, Piorkowski C, Sommer P, et al. Clinical implications of various follow up strategies after catheter ablation of atrial fibrillation. Pacing Clin Electrophysiol 2007; 30: 458–462.
- [11] Israel CW, Gronefeld G, Ehrlich JR, et al. Long-term risk of recurrent atrial fibrillation as documented by an implantable monitoring device: implication for optimal patient care. J Am Coll Cardiol 2004; 43: 47–52.
- [12] Singh BN, Singh SN, Reda DJ, et al, for the SAFE-T Investigators. Amiodarone versus sotalol for atrial fibrillation. N Engl J Med 2005; 352: 1861–1872.
- [13] Waldo AL. A perspective on antiarrhythmic drug therapy to treat atrial fibrillation: There remains an unmet need. Am Heart J 2006; 151: 771–778.
- [14] Vassalo P, Trohman RG. Prescribing amiodarone: an evidence-based review of clinical indications. JAMA 2007; 298: 1312–1322.
- [15] Ruangchira-Urai R, Colby TV, Klein J, et al. Nodular amiodarone lung disease. Am J Surg Pathol 2008; 32: 1654–1660.
- [16] Kharabsheh S, Abendroth CS, Kozak M. Fatal pulmonary toxicity occuring two weeks of initiation of amiodarone. Am J Cardiol 2002; 89: 896–898.
- [17] Olshansky B, Sami M, Rubin A, et al. Use of amiodarone for atrial fibrillation in patients with preexisting pulmonary disease in the AFFIRM Study. Am J Cardiol 2005; 95: 404–405.
- [18] Hohnloser SH, Crijns HJGM, van Eickels M, et al. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009; 360: 668– 678.
- [19] Levy S, Breithardt G, Campbell RW, et al. Atrial fibrillation: current knowledge and recomendations for management. Working Group on Arrhythmias of the European Society of Cardiology. Eur Heart J 1998; 19: 1294–1320.
- [20] Bellandi F, Simonetti I, Leontini M, et al. Long-term efficacy and safety of propafenone and sotalol for the maintenance of sinus rhythm after conversion of recurrent symptomatic atrial fibrillation. Am J Cardiol 2001; 88: 640–645.
- [21] Bendit DG, Williams JH, Jin J, et al. Maintenance of sinus rhythm with oral d,l-sotalol therapy in patients with symptomatic atrial fibrillation and/or atrial flutter. d,l-Sotalol Atrial Fibrillation/Flutter Study Group. Am J Cardiol 1999; 84: 270–277.
- [22] Alboni P, Botto GL, Baldi N, et al. Outpatient treatment of recent-onset atrial fibrillation with the „pill-in-the-pocket“ approach. N Engl J Med 2004; 351: 2384–2391.
- [23] Camm AJ, Savelieva I. Some patients with paroxysmal atrial fibrillation should carry flecainide or propafenone to self treat. BMJ 2007; 334: 637.
- [24] Conway E, Musco S, Kowey PR. New horizons in antiarrhythmic therapy: will novel agents overcome current deficits? Am J Cardiol 2008; 102 (Suppl.): 12H–19H.
- [25] Mazzini MJ, Monahan KM. Pharmacotherapy for atrial arrhythmias: present and future. Heart Rhythm 2008; 5: 526–531.
- [26] Craig M, Pratt MD, Singh SN, et al. Tle efficacy of azimiliee in the treatment of atrial fibrillation in the presence of left ventricular systolic dysfunction. Results from the Azimilide Postinfarct Survival Evaluation (ALIVE) trial. J Am Coll Cardiol 2004; 43: 1211–1216.
- [27] Connollly SJ, Schnell DJ, Page RL, et al. Dose-response relations of azimilide in the management of symptomatic, recurrent atrial fibrillation. Am J Cardiol 2001; 88: 974–979.
- [28] Lombardi F, Borggrefe M,Ruzylo W, et al. Azimilide vs placebo and sotalol for persistent atrial fibrilation: the A-COMET-II (Azimilide-CardiOversion MainEnance Trial-II) trial. Eur Heart J 2006; 27: 2224–2231.
- [29] Blaauw Y, Gogelein H, Tieleman RG, et al. „Early“ class III drugs for the treatment of atrial fibrillation. Efficacy and atrial selectivity of AVE 0118 in remodeled atria of the goat. Circulation 2004; 110: 1717–1724.
- [30] De Haan S, Greiser M, Harks E, et al. AVE0118, blocker of the transient outward current (Ito) and ultrarapid delayed rectifier current (Ikur) fully restores atrial contractility after Cardioversion for atrial fibrillation in the goat. Circulation 2006; 114: 1234–1242.
- [31] Wirth KJ, Brendel J, Steinmeyer KPD, et al. In vitro and in vivo effects of the atrial selective antiarrhythmic compound AVE 1231. J Cardiovasc Pharmacol 2007; 49: 197–206.
- [32] Ford JW, Milnes JT. New drugs targeting the cardiac ultra-rapid delayed-rectifier current (Ikur): rationale, pharmacology and evidence for potential therapeutic value. J Cardiovasc Pharmacol 2008; 52: 105–120.
- [33] Dorian P, Pinter A, Mangat I, et al. The effect of vernakalant (RSD 1235) an investigational antiarrhythmic agent on atrial electrophysiology in humans. J Cardiovasc Pharmacol 2007; 50: 35–40.
- [34] Roy D, Pratt C, Camm AJ, et al. RSD 1235 effectively converts atrial fibrillation to sinus rhythm independent of background use of oral rate- or rhythm-control medications (abstr.). Circulation 2006; 114: II_790.
- [35] Pratt C, Roy D, Juul-Molle S, et al. Efficacy and tolerance of RSD 1235 in the treatment of atrial fibrillation or atrial flutter. Results of a phase III, randomized-placebo controlled multicenter trial (Abstr.). J Am Coll Cardiol 2006; 47: 10 A.
- [36] Pratt CM, Navratil J, Nagy A, et al. Oral vernakalant (RSD 1235-SR) prevents recurrence of atrial fibrillation following cardioversion (Abstr.). Heart Rhythm 2007; 4: S176.
- [37] Guerra J, Everett T IV, Lee K, et al. Effects of the gap junction modifier rotigaptide (ZP 123) on atrial conduction and vulnerability to atrial fibrillation. Circulation 2006; 114: 110–118.
- [38] Shiroshita-Takeshita A, Sakabe M, Haugan K, et al. Model-dependent effects of the gap junction conduction-enhancing antiarrhythmic peptide rotigaptide (ZP123) on experimental atrial fibrillation in dogs. Circulation 2007; 115: 310–318.
- [39] Bode F, Katchman A, Woosley RL, et al. Gadolinium decreases stretch-induced vulnerability to atrial fibrillation. Circulation 2000; 101: 2200–2205.
- [40] Bode F, Sachs F, Franz MR. Tarantula peptide inhibits atrial fibrillation. Nature 2001; 409: 35–36.
- [41] Kalifa J, Bernand M, Gout B, et al. Anti-arrhythmic effects of INa, Ikr, and combined Ikr-ICaL blockade in experimental model of acute stretch-related atrial fibrillation. Cardiovasc Drugs Ther 2007; 21: 47–53.
- [42] Murray KT, Mace LC, Yang Z. Nonantiarrhythmic drug therapy for atrial fibrillation. Heart Rhythm 2007; 4: Suppl. 3: S 88–S 90.
- [43] Burstein B, Nattel S. Atrial structural remodeling as an antiarrhythmic target. J Cardiovasc Electrophysiol 2008; 52: 4–10.