Antimikrobiální látky v léčbě komplikací jaterních onemocnění
Úloha antibiotické terapie v léčbě komplikací jaterní cirhózy je zcela zásadní. Týká se zejména léčby ascitu a spontánní bakteriální peritonitidy, krvácení z jícnových varixů a léčby jaterní encefalopatie. Zařazení profylaktické antibiotické terapie do standardního postupu při léčbě krvácení z jícnových varixů zásadně změnilo přežití pacientů, podobně je tomu při léčbě a prevenci spontánní bakteriální peritonitidy.
Úvod
Jaterní cirhóza je výsledkem přestavby jaterní tkáně na podkladě postupného vývoje chronického jaterního onemocnění. U jaterní cirhózy je narušena původní lobulární a vaskulární mikroarchitektura jater, což je doprovázeno řadou oběhových a metabolických změn. Komplikace jaterní cirhózy souvisí buď s jaterní insuficiencí danou zánikem jaterních buněk a projevující se především nedostatečnou proteosyntézou nebo s portální hypertenzí s rozvojem kolaterálního oběhu a portosystémových zkratů [1].
Ascites
Ascites je nejčastější komplikací jaterní cirhózy. Během 10 let se objeví u zhruba 60 % pacientů s dosud kompenzovanou jaterní cirhózou [2] a bývá nejčastější příčinou hospitalizace pacienta s jaterní cirhózou [3].
Ascites se objeví pouze tehdy, když je přítomna portální hypertenze, a primárně souvisí s neschopností vyloučit adekvátní množství sodíku do moči, což vede k pozitivní sodíkové bilanci. Existuje mnoho důkazů o tom, že retence sodíku v ledvinách u pacientů s jaterní cirhózou je sekundární a vzniká v důsledku vazodilatace ve splanchnickém řečišti. Ta způsobí pokles efektivního arteriálního krevního volumu, aktivaci arteriálních a kardiopulmonálních volumových receptorů a homeostatickou aktivaci vazokonstriktorů a sodík-retenčních systémů (sympatiku, systému renin-angiotenzin-aldosteron). Retence sodíku v ledvinách vede k expanzi extracelulárního objemu a vzniku ascitu a otoků.
Vznik ascitu je výrazně negativním prognostickým ukazatelem: 15 % pacientů s jaterní cirhózou a ascitem zemře do 1 roku, 44 % do 5 let [4]. Z tohoto důvodu by měl být vznik ascitu signálem ke zvážení indikace k transplantaci jater.
U všech pacientů s nově zjištěným středním a velkým ascitem (tj. každým, který je patrný při fyzikálním vyšetření) a u všech pacientů hospitalizovaných pro zhoršení ascitu či jiné komplikace jaterní cirhózy by měla být provedena diagnostická paracentéza [5]; tento výkon nemá kromě nesouhlasu pacienta prakticky žádné kontraindikace.
Spontánní bakteriální peritonitida (SBP)
Pacienti se SBP mohou vykazovat následující symptomy: bolest a palpační citlivost břicha, zvracení, průjem, známky zánětu (teplota, zimnice, leukocytóza, vyšší hodnoty CRP, tachykardie), zhoršení jaterních funkcí, zhoršení encefalopatie či renálních funkcí, šok, krvácení do GIT. Pacienti ale mohou být často i asymptomatičtí.
Diagnostika
Diagnostickým kritériem SBP je počet neutrofilů ≥ 0,25 x 109/l v ascitické tekutině. Vzorek ascitické tekutiny by měl být rovněž odeslán na kultivaci v lahvičkách na hemokultury a dále by měla být stanovena hladina celkové bílkoviny, protože pacienti s obsahem bílkovin v ascitu nižším než 15 g/l mají zvýšené riziko SBP a mohou mít prospěch z antibiotické profylaxe.
Kultivace z ascitické tekutiny jsou ve většině případů negativní a pozitivita kultivace není nutná ke stanovení diagnózy SBP, je však důležitá k možnému určení optimální antibiotické terapie. Pokud je kultivace pozitivní, nejčastěji nacházíme gramnegativní bakterie (E. coli) a grampozitivní koky (streptokoky a enterokoky). Nedávná studie ukázala, že 30 % izolovaných gramnegativních bakterií je rezistentních na chinolony a 30 % je rezistentních na sulfamethoxazol-trimethoprim; 70 % gramnegativních bakterií rezistentních na chinolony je rovněž rezistentních na sulfamethoxazol-trimethoprim. Incidence SBP způsobené kmeny rezistentními na chinolony je vyšší u pacientů dostávajících profylaktickou terapii norfloxacinem. Pacienti užívající profylakticky norfloxacin mohou vyvinout SBP způsobenou grampozitivními koky. Míra rezistence na cefalosporiny je obecně nízká, a to bez ohledu na předchozí profylaxi norfloxacinem [6]. Epidemiologie bakteriálních infekcí se liší u komunitních a nozokomiálních infekcí.
Pacienti s počtem neutrofilních granulocytů vyšším než 0,25 x 109/l a negativní kultivací by měli být léčeni stejně jako pacienti s pozitivní kultivací.
Diagnostická paracentéza by měla být rovněž provedena u pacientů s jaterní cirhózou s ascitem a krvácením do gastrointestinálního traktu, u pacientů v šoku, s horečkou a dalšími systémovými známkami infekce, gastrointestinálními symptomy, stejně tak jako při horšení jaterních a renálních funkcí a vzniku nebo zhoršení jaterní encefalopatie.
Empirická antibiotická terapie
Empirická antibiotická terapie SBP musí být zahájena ihned po diagnóze. Je chybou čekat na výsledky kultivace. Pro empirickou terapii by neměla být použita žádná potenciálně nefrotoxická antibiotika (např. aminoglykosidy). Nejvíce studovaným antibiotikem v této indikaci je cefalosporin 3. generace cefotaxim. Jeho spektrum účinku zahrnuje většinu obvyklých patogenů a dosahuje vysokých koncentrací v ascitu – je proto lékem první volby. K vymizení infekce po léčbě dochází u 77–98 % pacientů. Bylo prokázáno, že dávka 4 g/den je stejně efektivní jako 8 g/den a délka léčby 5 dnů je stejně efektivní jako 10 dnů [7]. Podobných výsledků je dosahováno také podáním amoxicilinu/klavulanátu, který je aplikován nejprve intravenózně (1,2 g `a 8 h) a poté perorálně (625 mg `a 8 h) [8]. Alternativní volbou jsou chinolony, neměly by však být podávány pacientům, kteří je užívali již jako profylaxi, a dále v oblastech s vysokou prevalencí rezistence na chinolony a u nozokomiální SBP. Ciprofloxacin podávaný 7 dní intravenózně nebo 2 dny intravenózně a dále 5 dní perorálně dosahuje srovnatelných výsledků jako cefotaxim [9]. Perorálně podávaný ofloxacin vykazoval u pacientů s nekomplikovanou SBP (bez renálního selhání, krvácení do GIT, encefalopatie, ileu nebo šoku) stejnou účinnost jako cefotaxim. Cefotaxim a amoxicilin/klavulanát jsou efektivní u pacientů, u kterých se objeví SBP při profylaxi norfloxacinem.
Efekt léčby je vhodné zhodnotit 2 dny po zahájení antibiotické terapie. Neklesne-li počet neutrofilů v ascitu během této doby na méně než 25 % původní hodnoty, je zde vysoká pravděpodobnost selhání terapie [10]. SBP vymizí při antibiotické léčbě u zhruba 90 % pacientů. Úspěch léčby by měl být prokázán poklesem počtu neutrofilů pod 0,25 x 109/l a negativní kultivací, byla-li původně pozitivní. Selhání antibiotické terapie bychom měli předpokládat při zhoršení klinických příznaků, při nedostatečném snížení a nebo při zvýšení počtu neutrofilů v ascitu ve srovnání s první punkcí. Selhání léčby je většinou způsobeno rezistencí vyvolávajících kmenů bakterií. Další příčinou může být jiný zdroj infekce v dutině břišní, po kterém je třeba pátrat (CT břicha, vysoká hladina laktátdehydrogenázy a celkové bílkoviny v ascitu, polymikrobiální nález v kultivaci). Po vyloučení sekundární příčiny ascitu je třeba provést výměnu antibiotik podle citlivosti nebo použít alternativní empirické antibiotikum.
Profylaxe spontánní bakteriální peritonitidy
Profylaxe SBP je vzhledem k nevyhnutelnému vzniku rezistentních bakteriálních kmenů při dlouhodobém podávání antibiotik striktně omezena na vybrané skupiny pacientů s jaterní cirhózou.
Pacienti s akutním krvácením do gastrointestinálního traktu
Bakteriální infekce (včetně SBP) představují u pacientů s jaterní cirhózou a akutním krvácením do gastrointestinálního traktu jeden z hlavních problémů. Incidence je obzvláště vysoká u pacientů s pokročilou cirhózou a/nebo těžkým krvácením. Přítomnost bakteriální infekce je u těchto pacientů spojena se zvýšenou mírou selhání kontroly krvácení, recidivy krvácení a mortality. Zavedení rutinní antibiotické profylaxe do léčby krvácení z jícnových varixů zásadně změnilo incidenci komplikací (sepse, SBP) a tím i přežití pacientů
Vhodnými antibiotiky jsou cefalosporiny 3. generace nebo chinolony (perorální nebo intravenózní norfloxacin 400 mg/ 12 h/7 dní). Antibiotikem volby je ceftriaxon (1 g/den i.v.). Optimální je jeho podání již v přednemocniční péči.
Pacienti s nízkým obsahem bílkoviny v ascitu bez předchozí anamnézy SBP (primární profylaxe)
Cirhotici s nízkým obsahem bílkoviny v ascitu (< 15 g/l) a/nebo s vysokými hodnotami bilirubinu v séru mají vysoké riziko vzniku SBP [11]. Bylo prokázáno, že dlouhodobé profylaktické podávání norfloxacinu v dávce 400 mg denně vede u této skupiny pacientů ke snížení rizika vzniku SBP a zlepšení přežití [12, 13], proto by měla být i u této skupiny pacientů antibiotická profylaxe zvážena.
Pacienti s předchozí prodělanou SBP (sekundární profylaxe)
Pacienti, kteří přežijí epizodu SBP, mají kumulativní riziko rekurence v prvním roce přibližně 70 % [14]. Pravděpodobnost přežití je 30–50 % v prvním roce a pouze 25–30 % do 2 let. U pacientů po první epizodě SBP by měla být vždy zvážena indikace k transplantaci jater. Při podávání profylaktické dávky norfloxacinu bylo prokázáno snížení pravděpodobnosti rekurence SBP z 68 % na 20 % a snížení pravděpodobnosti SBP způsobené G-bakteriemi ze 60 % na 3 % [15]. Lékem volby je norfloxacin v dávce 400 mg denně. Alternativními antibiotiky jsou sulfamethoxazol-trimethoprim podávaný v dávce 960 mg denně, případně ciprofloxacin 750 mg týdně. Antibiotika nutno podávat do vymizení ascitu, do jaterní transplantace či doživotně.
Jaterní encefalopatie
Jaterní encefalopatie je závažnou neuropsychiatrickou komplikací, která provází především jaterní cirhózu, ale může se vyskytovat i při fulminantním jaterním selhání. Jedná se o reverzibilní stav, který se u pacientů s jaterní insuficiencí a/nebo portosystémovými zkraty může vyvíjet buď plíživě, nebo se může projevit akutním zhoršením, a to zejména v souvislosti s některým z vyvolávajících faktorů [16]. Jaterní encefalopatie různého stupně se někdy v průběhu života projeví u zhruba 75 % pacientů s jaterní cirhózou.
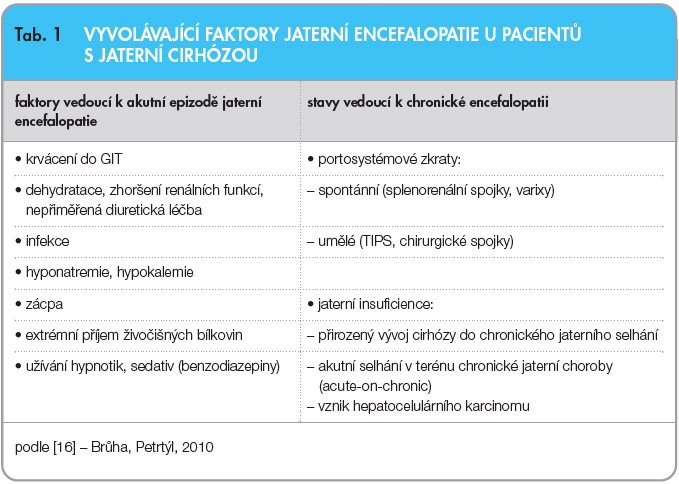 Za klinickými projevy jaterní encefalopatie stojí působení neurotoxických a neuromodulačních látek, které jsou za normálních okolností metabolizovány játry. Při jaterní insuficienci nebo při portosystémových zkratech se ale tyto látky ve zvýšené míře dostávají do systémové cirkulace a ovlivňují činnost centrálního nervového systému (CNS). Předpokládá se, že tyto látky většinou vznikají v tlustém střevě. Nejdůležitější roli hraje nejspíše amoniak, který se pak ve zvýšené koncentraci dostává do CNS, kde negativním způsobem ovliňuje činnost astrocytů. To má za následek alteraci mezibuněčné komunikace s neurony a inhibici nervového přenosu. Předpokládá se vliv i dalších látek, jako jsou merkaptany, fenoly, mastné kyseliny s krátkým řetězcem, tryptofan a cytokiny produkované při bakteriálních infekcích, významný je rovněž vliv hyponatremie.
Za klinickými projevy jaterní encefalopatie stojí působení neurotoxických a neuromodulačních látek, které jsou za normálních okolností metabolizovány játry. Při jaterní insuficienci nebo při portosystémových zkratech se ale tyto látky ve zvýšené míře dostávají do systémové cirkulace a ovlivňují činnost centrálního nervového systému (CNS). Předpokládá se, že tyto látky většinou vznikají v tlustém střevě. Nejdůležitější roli hraje nejspíše amoniak, který se pak ve zvýšené koncentraci dostává do CNS, kde negativním způsobem ovliňuje činnost astrocytů. To má za následek alteraci mezibuněčné komunikace s neurony a inhibici nervového přenosu. Předpokládá se vliv i dalších látek, jako jsou merkaptany, fenoly, mastné kyseliny s krátkým řetězcem, tryptofan a cytokiny produkované při bakteriálních infekcích, významný je rovněž vliv hyponatremie.
Projevy jaterní encefalopatie sahají od těžko postřehnutelných změn chování, kterých si všimne spíše okolí nemocného, přes poruchy spánkového režimu a různý stupeň dezorientace až po hluboké kóma. Základem diagnózy zůstává klinické vyšetření, předpokladem jsou dostatečné zkušenosti vyšetřujícího. Diagnostika počínajících forem jaterní encefalopatie je jinak snadná a lze ji provést během několika minut v každé ordinaci. Mezi spolehlivé příznaky jaterní encefalopatie patří flapping tremor a foetor hepaticus.
K nejjednodušším psychomotorickým testům patří vyšetření orientace pacienta místem a časem, schopnost podepsat se, namalovat pěticípou hvězdu či odečítat číslo 7 od 100. Dále lze použít jednoduchý test spojování čísel (Number Connection Test – NCT). Velké opatrnosti je třeba u pacientů se změnami mentálních funkcí či s poruchou vědomí, u nichž není diagnóza jaterní cirhózy jednoznačně stanovena. U těchto pacientů je potřeba pečlivě vyloučit jiné možné příčiny (krvácení do CNS, intoxikace, infekce či nádory CNS, primární neurologické choroby).
Klasifikace jaterní encefalopatie dle etiologie:
- typ A – při akutním jaterním selhání,
- typ B – při portosystémovém zkratu,
- typ C – při jaterní cirhóze.
Klasifikace jaterní encefalopatie dle závažnosti klinických projevů:
- minimální – normální klinický nález, abnormální psychometrické či neurofyziologické vyšetření,
- manifestní – se zjevnými klinickými projevy.
Vzhledem k tomu, že je jaterní encefalopatie často vyvolána či potencována zevními vlivy, je třeba se zaměřit na odstranění těchto vyvolávajících faktorů. Objevení se jaterní encefalopatie bez jasné příčiny je vždy známkou dekompenzace pokročilé jaterní cirhózy. Prognóza pacientů s jaterní encefalopatií vyvolanou zevními vlivy je proto podstatně lepší, přesto tříleté přežití pacientů s jaterní cirhózou po první atace jaterní encefalopatie nedosahuje ani 25 %. Přítomnost jaterní encefalopatie by proto měla vždy vést k úvaze o řešení základní choroby transplantací jater, ostatní léčebné metody jsou pouze symptomatické.
K důležitým opatřením v léčbě jaterní encefalopatie patří optimalizace příjmu bílkovin. Velká část pacientů s jaterní cirhózou trpí malnutricí, která představuje výrazně negativní prognostický faktor dalšího vývoje. Restrikce bílkovin proto většinou není vhodným řešením, ideální množství bílkovin ve stravě cirhotika je 1–1,5 g/kg tělesné hmotnosti a den, vyšší poměr rostlinných bílkovin je výhodou.
Zlatým standardem léčby jaterní encefalopatie v běžné praxi jsou nestravitelné disacharidy laktulóza a laktitol. Ovlivňují pH v lumen tlustého střeva, zrychlují střevní pasáž a mění bakteriální spektrum v tlustém střevě ve prospěch mikroorganismů, které neprodukují amoniak, čímž způsobují nejen snížení jeho produkce, ale i snížení jeho vstřebávání z tlustého střeva. Dávkování je individuální, cílem jsou maximálně 3 stolice denně. Nestravitelné disacharidy lze podávat dlouhodobě a mají minimální nežádoucí účinky.
Obdobný účinek jako nestravitelné disacharidy má sterilizace střevního obsahu pomocí antibiotik. V současné době se používá nevstřebatelné antibiotikum rifaximin (3krát denně 400 mg) či perorálně podávaný metronidazol (3krát denně 250 mg). Vzhledem k protichůdnému mechanismu účinku nevstřebatelných disacharidů a antibiotik není kombinace obou terapeutických postupů přínosná.
Hepatotoxicita antimikrobiálních látek
Polékové jaterní poškození je časté a mezi jeho nejčastější původce patří právě antimikrobiální látky, proto je u pacientů s pokročilou jaterní chorobou potřeba zvláštní opatrnosti. Základním patogenetickým mechanismem hepatotoxického účinku antimikrobiálních látek je idiosynkratická reakce, která není závislá na dávce a nedá se predikovat.
Léčba všemi betalaktamovými antibiotiky může být spojena s přechodným vzestupem hodnot jaterních testů. Nejčastěji k tomu dochází při podávání amoxicilinu/ klavulanátu. Typicky vzniká cholestáza, která se klinicky může projevit až po několika týdnech od ukončení léčby a může přetrvávat několik měsíců. Jaterní lézi může způsobit méně často i amoxicilin samotný.
Nitrofurantoin může způsobit akutní hepatitidu (cholestatickou/granulomatózní) [17], nebo dokonce agresivní chronickou autoimunní hepatitidu, spojenou s pozitivitou ANA a SMA protilátek, hypergamaglobulinemií a typickou jaterní histologií. Za kritickou bývá považována doba léčby delší než 10 dní.
Sulfonamidy stejně jako trimethoprim mohou způsobit cholestázu a nekrózu hepatocytů [18].
Makrolidy (zejména erythromycin, méně často klarithromycin a azithromycin) mohou způsobit cholestatickou hepatitidu, klinicky se mohou objevit příznaky imitující akutní cholecystitidu/cholangitidu, po ukončení léčby se stav během několika dní upraví.
Klindamycin většinou způsobuje asymptomatický vzestup hladin aminotransferáz, byla ovšem popsána i těžká cholestatická hepatitida [19].
Hepatotoxické účinky patří k nejčastějším nežádoucím účinkům antituberkulotik a mohou být poměrně závažné. Při podávání isoniazidu se objeví lehké zvýšení aminotransferáz u 10–20 % pacientů během dnů až týdnů od zahájení léčby, závažnější u 1–2 % pacientů. Rifampicin vykazuje hepatotoxicitu zejména v kombinaci s isoniazidem nebo pyrazinamidem, jejichž toxicitu výrazně zvyšuje.
Klíčovým léčebným opatřením při podezření na polékové jaterní poškození je neprodleně ukončit podávání potenciálně hepatotoxického léku.
Závěr
Antibiotická terapie v léčbě komplikací jaterních chorob a zejména jaterní cirhózy již nepochybně prokázala svoji významnou úlohu a názor na nutnost antibiotické profylaxe a léčby se již nejspíše nezmění. Lze předpokládat, že do budoucna může dojít k úpravě užívaných preparátů podle měnícího se spektra patogenů a jejich rezistence.
Článek byl podpořen grantem IGA MZ ČR NR 12290.
Seznam použité literatury
- [1] Pracovní skupina pro portální hypertenzi při ČHS. Doporučený postup ČHS pro ambulantní péči o pacienty s jaterní cirhózou 2009.
- [2] Ginés P, Quintero E, Arroyo V, et al. Compensated cirrhosis: natural history and prognostic factors. Hepatology 1987; 7: 122–128.
- [3] Lucena MI, Andrade RJ, Togoni G, et al. Multicenter hospital study on prescribing patterns for prophylaxis and treatment of complications of cirrhosis. Eur J Clin Pharmacol 2002; 58: 435–440.
- [4] Panas R, Montoliu S, Balleste B, et al. Natural history of patients hospitalized for management of cirrhotic ascites. Clin Gastroenterol Hepatol 2006; 4: 1385–1394.
- [5] EASL clinical practice guidelines of the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010; 53: 397–417.
- [6] Fernández J, Navasa M, Gómez J, et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology 2002; 35: 140–148.
- [7] Rimola A, Salmerón JM, Clemente G, et al. Two different dosages of cefotaxime in the treatment of spontaneous bacterial peritonitis in cirrhosis: results of a prospective, randomized, multicenter study. Hepatology 1995; 21: 674–679.
- [8] Ricart E, Soriano G, Novella MT, et al. Amoxicillin-clavulanic acid versus cefotaxime in the therapy of bacterial infections in cirrhotic patients. J Hepatol 2000; 32: 596–602.
- [9] Terg R, Cobas S, Fassio E, et al. Oral ciprofloxacin after a short course of intravenous ciprofloxacin in the treatment of spontaneous bacterial peritonitis: results of a multicenter randomized study. J Hepatol 2000; 33: 564–569.
- [10] Guarner C, Soriano G. Spontaneous bacterial peritonitis. Semin Liver Dis 1997; 17: 203–217.
- [11] Rimola A, Garcia-Tsao G, Navasa M, et al. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. International Ascites Club. J Hepatol 2000; 32: 142–153.
- [12] Grange JD, Roulot D, Pelletier G, et al. Norfloxacin primary prophylaxis of bacterial infections in cirrhotic patients with ascites: a double-blind randomized trial. J Hepatol 1998; 29: 430–436.
- [13] Fernández J, Navasa M, Planas R, et al. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorenal syndrome and improves survival in cirrhosis. Gastroenterology 2007; 133: 818–824.
- [14] Garcia-Tsao G. Current management of the complications of cirrhosis and portal hypertension: variceal hemorrhage, ascites, and spontaneous bacterial peritonitis. Gastroenterology 2001; 120: 726–748.
- [15] Ginés P, Rimola A, Planas R, et al. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: results of a double-blind, placebo-controlled trial. Hepatology 1990; 12: 716–724.
- [16] Brůha R, Petrtýl J. Jaterní encefalopatie. In: Hepatologie. Ehrmann J, Hůlek P, Grada, Praha 2010: 193–197.
- [17] Carson JL, Strom BL, Duff A, et al. Acute liver disease associated with erythromycins, sulfonamides, and tetracyclines. Ann Intern Med 1993; 119: 576–583.
- [18] Dujovne CA, Chan CH, Zimmerman HJ. Sulfonamide hepatic injury. Review of the literature and report of a case due to sulfamethoxazole. N Engl J Med 1967; 277: 785–788.
- [19] Navarro VJ, Senior JR. Drug related hepatotoxicity. N Engl J Med 2006; 354: 731–739.