Antiresorpční léčiva v terapii osteoporózy a v redukci relativního rizika zlomenin
Autor uvádí definici osteoporózy a nástin šíře problému této civilizační choroby. Zabývá se rizikem zlomenin i problematikou mortality po prodělané zlomenině proximálního femuru, která je i přes adekvátní a rychlé chirurgické ošetření v prvním roce po zlomenině značně vysoká. V další části práce rozebírá mechanismus účinku antiresorpčních léčiv a způsob, jakým terapie těmito léčivy ovlivňuje kostní remodelační jednotky a jak následně působí na kortikální i trabekulární kost. Po obecné charakteristice bisfosfonátů soustřeďuje pozornost na dva základní typy působení bisfosfonátů na osteoklasty a na základní mechanismus působení na farnesyldifosfátsyntázu i vazebnou afinitu ke kosti. V další části práce jsou charakterizovány jednotlivé bisfosfonáty používané v terapii osteoporózy (alendronát, risedronát, ibandronát a zoledronát) včetně provedených klinických studií a účinnosti v redukci rizika zlomenin. V závěru se autor zabývá strategií léčby osteoporózy v duchu zásad Evidence Based Medicine a dotýká se i otázky farmakoekonomiky léčby.
Osteoporóza (OP) je významným zdravotním problémem, který způsobuje, že 30–50 % žen a 15–30 % mužů utrpí v důsledku tohoto onemocnění během života zlomeninu. Proto se prevence fraktur dostává do popředí zájmu lékařů mnoha oborů.
Podle mezinárodně schválené definice z roku 1993 je osteoporóza progresivní systémové skeletální onemocnění charakterizované malou kostní masou a postižením mikroarchitektury kostní tkáně doprovázené následným vzestupem kostní fragility a sklonem k frakturám [1].
Fraktury jsou spojeny se zvýšenou morbiditou a mortalitou a způsobují významnou finanční zátěž zdravotního systému společnosti. Hlavním centrem zájmu jsou většinou zlomeniny páteře a kyčle, ale i rostoucí počet ostatních fraktur má nepřehlédnutelný vliv na vzestup pracovní neschopnosti, četnost návštěv u lékaře a opakované vyšetřování, což přispívá k celkovému zvýšení nákladů na léčbu jednotlivých typů fraktur.
Plná třetina zlomenin kyčle se vyskytuje u mužů. Celková mortalita po zlomenině kyčle se pohybuje kolem 20 % během prvních 12 měsíců, u mužů je dokonce vyšší než u žen, pravděpodobně v důsledku vyšší prevalence komorbidit [2]. První registrovatelný nárůst incidence osteoporotických zlomenin nastává kolem 55. roku věku, kdy zaznamenáváme vzestup počtu zlomenin v oblasti distálního zápěstí, který do 65 let převyšuje více než dvojnásobně incidenci zlomenin obratlových těl i kyčle. Zhruba od sedmdesáti let začínají strmě stoupat počty diagnostikovaných zlomenin obratlů, které po 75. roce převýší geometricky narůstající křivka zlomenin proximálního femuru [3]. Incidence fraktur páteře se zvyšuje s věkem a je dvojnásobně vyšší u žen než u mužů. Zlomeniny obratlových těl zvyšují morbiditu a mortalitu u obou pohlaví, navíc se jich diagnostikuje pouze jedna třetina z celkového množství v souvislosti se skutečností, že bolesti zad ve vyšším věku se přičítají degenerativním změnám páteře a jiným koexistujícím onemocněním. Předpokládáme, že obecně bude počet fraktur narůstat, protože přibývá i počet starších lidí a protože se incidence věkově vázaných fraktur ve společnostech západoevropského životního stylu zvyšuje. Kromě toho je vyšší výskyt fraktur též popisován u lidí žijících v domovech důchodců či zcela osamoceně [4].
Léčba antiresorpčními léčivy vychází ze snahy obnovit porušenou rovnováhu mezi resorpcí a novotvorbou kosti.
Ve věku do 35 let je množství kostní hmoty vytvářené na periostálním povrchu a kosti odbourávané na endostálním povrchu v rovnováze. Během stárnutí subperiostální kostní formace zvyšuje tvorbu kosti a vyrovnává ztrátu kostní hmoty na endostálním povrchu. V praxi to znamená, že čistá ztráta kostní hmoty z určité oblasti během dospělosti je výsledkem rozdílu mezi množstvím subperiostálně vytvořené kosti a množstvím endostální ztráty kosti. V povědomí lékařské veřejnosti dosud převládá mylný názor, že ztráta kostní hmoty u žen je vyšší než u mužů. Je tedy nutné zdůraznit, že endostální ztráta kosti u mužů a u žen je prakticky totožná [2].
Zvýšený počet remodelačních jednotek společně s negativní kostní rovnováhou v rámci každé kostní remodelační jednotky (bone mineralization unit, BMU) vede k endostální kostní ztrátě (prodloužená doba života osteoklastů a zkrácená doba přežití osteoblastů), zatímco zvýšená resorpční hloubka má za následek strukturální poškození kosti. Remodelační nerovnováha na endokortikálním povrchu zeslabuje kortex a remodelační nerovnováha na trabekulárním povrchu zeslabuje trabekuly a vede ke ztrátě soudržnosti spojení – konektivity. Nerovnováha je morfologickým základem akcelerované ztráty kostní hmoty v pozdním věku u žen. Ztráta kosti akceleruje, ale nárůst trabekulární části se zmenšuje tak, jak se trabekuly ztenčují a mizí, takže nejvyšší kostní ztráta je spongiózního původu. Předchozí teorie přeceňovaly vliv úbytku trabekulární kosti na ztrátu mechanické odolnosti kosti.
Fragilita kosti narůstá více, než vyplývá z podílu ztráty kostní hmoty. Malý pokles v BMD (bone mineral density, denzita kostního minerálu) vede k významnému poklesu pevnosti, takže stejné nebo menší zatížení může vést ke strukturálnímu selhání.
Antiresorpční terapie
Antiresorpční terapie snižuje intenzitu kostní remodelace tím, že vede k poklesu počtu remodelačních míst iniciovaných na jednotku endostálního povrchu. Antiresorpční léčiva tak dovolují vyplnit remodelovaný prostor nově formovanou kostí. Pomalá remodelace umožňuje kompletnější mineralizaci nově tvořené matrix. Léčiva uvedená v tomto přehledu mohou také snížit negativní kostní rovnováhu v BMU tím, že redukují hloubku kostní resorpce (snížením doby života osteoklastů) a pravděpodobným zvýšením kostní formace v důsledku prodloužení doby života osteoblastů.
Antiresorpční terapie snižuje míru trabekulárního a kortikálního zeslabení, stejně tak jako ztrátu trabekulárního spojení (konektivitu trámců). Trabekulární kostní objem se pravděpodobně nezvyšuje vlivem antiresorpční terapie, ale může se zmenšovat pomaleji než u kontrolní skupiny. Neexistují však zatím důkazy, že antiresorpční léčiva upravují strukturální poškození kosti tím mechanismem, že by obnovovala trabekulární spojení nebo jejich použití vedlo k zesílení stávajících trabekul nebo kortikalis.
U antiresorpčních léčiv, která se dnes používají pro léčbu osteoporózy, bylo ve studiích splňujících kritéria medicíny založené na důkazech (Evidence Based Medicine, EBM) prokázáno, že snižují riziko fraktur obratlových těl. Z bisfosfonátů (BF) se jedná se o alendronát (ALN), risedronát (RIS), ibandronát (IBA), zoledronát (ZOL) a ze selektivních modulátorů estrogenních receptorů o raloxifen (RLX), který je zatím jen jediným zástupcem této skupiny používaným v klinické praxi.
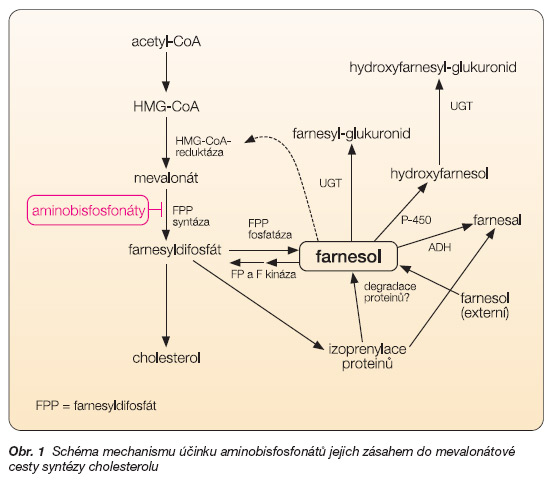
Podle mechanismu účinku mohou být BF rozděleny na dvě skupiny. První skupina BF neobsahující dusík (klodronát, CL; pamidronát, PAM) může být inkorporována do fosfátových řetězců sloučenin obsahujících ATP. Druhá skupina ALN, RIS, IBA a ZOL patří mezi bisfosfonáty, které fungují na bázi zablokování mevalonátové cesty syntézy cholesterolu, kde inhibují farnesyldifosfátsyntázu [5, 6]. Tento efekt se zřejmě dominantně podílí na urychlení apoptózy osteoklastů (obr. 1).
V současnosti máme k dispozici tři generace bisfosfonátů, ale příslušnost do některé z generací nevypovídá o síle jejich účinku. U bisfosfonátů I. generace, tzn. bez aminoskupiny, se připouští jistý stupeň degradace v osteoklastech (Ocl), kde dochází k energetickému vyčerpání Ocl v důsledku tvorby nehydrolyzovatelných analogů adenosintrifosfátu (ATP).
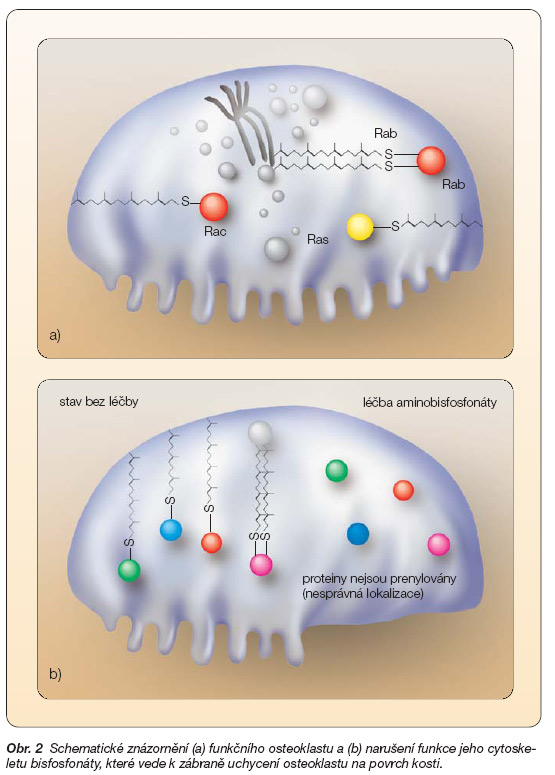
Naopak II. generace BF působí na Ocl především účinkem na farnesyldifosfátsyntázu (FPP syntáza), což vede k inhibici prenylace malých proteinů vázajících GTP (guanosintrifosfát) v Ocl a k narušení jeho cytoskeletu (obr. 2). U aminoBF nebyla dosud popsána biodegradace, ke které dochází u I. generace BF.
Zdá se ale, že i když BF nejsou v zásadě biodegradabilní, mohou být metabolizovány některé jejich postranní řetězce. Např. u RIS vede rotace stávajícího postranního řetězce ke značnému zvýšení jeho účinku na FPP syntázu.
Alendronát
Alendronát (ALN) je preferenčně vychytáván v místech skeletu, kde probíhá osteoklastická resorpce kosti, obvykle jde o místa s nejvíce sníženou denzitou kostního minerálu. Vazba ALN na kostní minerál je určena řetězcem R1, který je zodpovědný za vazebnou kapacitu, tzn. afinitu ke kosti, a patří ve srovnání s ostatními BF k nejsilnějším. Osteoklast, který adheruje k povrchu kosti, pak postrádá zvlněný lem, který je indikátorem aktivní resorpce kosti. Dochází k poklesu osteoklastické resorpce kosti a následkem funkčního provázání Ocl a osteoblastů (Ob) i k poklesu novotvorby kostní hmoty. Snížení úrovně kostní remodelace jako celku zastaví pokles objemu kostní hmoty, zvýšení stupně mineralizace kosti vede ke zvýšení tvrdosti kosti. Strukturálně je mineralizace uniform-ní, a tím dojde ke zvýšení pevnosti kosti, která je jedním z atributů snížení rizika zlomenin.
V klinických hodnoceních III. fáze týkajících se ALN byly získány bioptické vzorky z hřebene kosti kyčelní u podskupiny pacientek po 2 a 3 letech léčby. Ve vzorcích byl kvantitativně vyšetřen účinek ALN na kostní obrat (tloušťka osteoidu a stupeň minerální apozice). Tyto studie prokázaly, že ALN může snížit úroveň kostní resorpce s následným snížením kostní formace v důsledku zaplnění remodelačních prostor v BMU. Přibližně po 6měsíční kontinuální léčbě bylo dosaženo nového stabilního stavu kostního obratu, i když byly pozorovány další malé přírůstky kostní denzity. Dynamická měření úrovně mineralizace přinesla nepřímé důkazy o tom, že ALN nezhoršuje kostní mineralizaci [7, 8].
V řadě dvojitě slepých studií bylo prokázáno, že ALN má pozitivní účinek na snížení rizika vzniku fraktur, ale dosud není zcela jasný mechanismus, jakým ALN dosahuje změny kostní kvality [9].
Histomorfometrické analýzy bioptických vzorků kosti z hřebene kosti kyčelní neodhalily u pacientů léčených ALN významné morfologické změny v porovnání s placebem s výjimkou poklesu kostního obratu. To může souviset se specifickými účinky na určité partie skeletu, neboť trámčitá kost v této oblasti nemusí nutně obrážet změny v objemu kostní tkáně, kostního obratu nebo zvýšenou kostní formaci v jiných částech kostry (kupř. v páteři nebo v kyčelním kloubu). Jiné mechanismy, jako např. změny mineralizace, mohou alespoň částečně vysvětlit dokumentovaný nárůst BMD a kostní kvality.
V Roschgerově studii [9] byly použity dvě metody, které umožňují vyšetření mineralizované matrix v rutinně připravených kostních vzorcích. První technikou určenou ke studiu mineralizovaných tkání bylo kvantitativní elektronové zobrazení v elektronovém mikroskopu [10–12], druhou techniku představovalo rentgenologické vyšetření z malého úhlu (scanning small-angle X-ray scattering = scanning-SAXS) [13]. První technika byla určena pro kvantitativní měření distribuce kostní mineralizační denzity (bone mineralization density distribution = BMDD) v bioptických vzorcích kostní tkáně [14], druhá technika poskytla údaje o strukturálním uspořádání kolagenu a minerálu.
Užití výše uvedených technik při vyšetření kostních vzorků (z obratlů a žeber) v rámci preklinických studií na prasatech prokázalo, že v měřítku mikrometrů byla trámčitá kost po léčbě ALN jednotněji mineralizována [15], zatímco obsah minerálu a kolagenu (měřeno scanning-SAXS) se neodlišoval od kontrolních vzorků [16]. Kombinované použití těchto dvou technik ukazuje, že vyšší a jednotnější mineralizační denzita, která je provázena normální mikrostrukturou tkáně, může přispívat k vyšší kostní odolnosti pozorované v obratlích při mechanickém testování.
ALN snižuje riziko fraktury páteře o 50 % a snižuje výskyt mnohočetných páteřních fraktur o 90 % u žen s OP, s frakturami nebo bez fraktur na počátku léčby. S přihlédnutím k frakturám kyčle byly provedeny 2 studie s ALN a vykázaly snížení těchto zlomenin o 50 %, ačkoli protizlomeninový efekt léčiva na kyčel nebyl primárním cílem těchto studií [17].
Užívání ALN zabraňuje ztrátám kostní hmoty u osteopenických čerstvě postmenopauzálních žen bez osteoporózy [18–20]. Ve studii EPIC (Early Postmenopausal Intervention Cohort) byl po dobu 4 let zkoumán účinek 2 rozdílných denních dávek alendronátu: 2,5 a 5 mg. Podávání 5 mg alendronátu denně vedlo k nárůstu BMD v páteři o 4 % a v kyčli o 3 %. Nárůst BMD byl srovnatelný s nárůstem, jehož bývá dosaženo hormonální substituční terapií s estrogeny a gestageny (HRT) [18]. První skupina žen souhlasila s účastí v prodloužení této studie na dobu 5 let a se zhodnocením přerušení léčby: 52 žen dostávalo 5 mg alendronátu denně po dobu 5 let (skupina I), dalších 56 žen dostávalo placebo po dobu 3 let a poté následovalo podávání ALN (5 mg denně) po dobu 2 let (skupina II) a třetí skupina 52 žen dostávala alendronát (20 mg) po dobu 2 let bez další terapie po následující 3 roky (skupina III) [18]. Na konci studie došlo u první skupiny k nárůstu BMD v oblasti páteře a trochanteru o 2,5 % a 3,2 % a hodnoty celotělové denzity a denzity v oblasti krčku femuru byly stabilizovány v porovnání s hodnotami před léčbou. Ve skupinách I a III byly po 5 letech hodnoty celotělové BMD a BMD v oblasti kyčle a páteře obdobné. Po vysazení BF v posledních 3 letech ve skupině III došlo k poklesu BMD o 1,8–5,7 % v porovnání s hodnotami před léčbou.
Luckey a kol. [20] hodnotili účinnost a bezpečnost ALN podávaného 1krát týdně v dávce 35 mg (n = 362) v porovnání s denní dávkou 5 mg ALN (n = 361) při prevenci OP. Studie trvala 1 rok, byla dvojitě zaslepená, multicentrická a zahrnovala postmenopauzální ženy (6 měsíců a více po menopauze) ve věku 40–70 let s hodnotami BMD v oblasti páteře a krčku femuru v rozmezí -2,5 až 1 T-skóre. Průměrný vzestup BMD v oblasti bederní páteře byl po 12 měsících rovnocenný pro obě dávkovací schémata. Vzestup BMD v jiných oblastech skeletu a vliv na kostní obrat byl rovněž totožný. Je prokázáno, že podávání ALN 1krát týdně nezvyšuje výskyt nežádoucích účinků a může zlepšit spolupráci při užívání léků u žen s osteopenií nebo u žen s výraznou rodinnou anamnézou týkající se OP. Přesto je compliance i u týdenních forem stále suboptimální.
Risedronát
Risedronát (RIS) je pyridinylový BF se silným antiresorpčním účinkem, jehož účinnost byla též prokázána při léčbě Pagetovy choroby [21, 22] a mnohočetného myelomu [23, 24] i v prevenci úbytku kostní hmoty v časném období po menopauze [25].
Harrisova studie byla uspořádána s cílem zhodnotit účinnost každodenního podávání RIS na snížení výskytu zlomenin obratle i jiných kostí u žen po menopauze s anamnézou zlomeniny obratle [26].
Studie s RIS prováděné v Severní Americe v letech 1993–1998 se mohly zúčastnit chodící pacientky mladší 85 let, pokud od přirozené či chirurgicky navozené menopauzy uplynulo více než 5 let – byl to tedy obvyklý design studie. Rozdílná byla podmínka přítomnosti dvou nebo více radiologicky identifikovaných zlomenin obratle (Th4–L4 včetně) nebo jedné zlomeniny obratle a současně přítomné nízké BMD v oblasti bederní páteře (L1–L4) definované jako < 0,83 g/cm2 (přístroj Hologic) nebo < 0,94 g/cm2 (přístroj Lunar).
Tyto hodnoty BMD odpovídají T-skóre -2.
Účastnice byly stratifikovány podle počtu zlomenin obratle při vstupu do studie [26].
Velikost vzorku pro hodnocení nově vzniklé zlomeniny obratle přibližně 2400 pacientek vycházela z předpokládané 10% roční incidence nových zlomenin obratle ve skupině, která dostávala placebo. Je třeba vycházet z předpokladu, že v průběhu tří let léčby předčasně ukončí účast ve studii 50 % pacientek, proto byla uspořádána studie tak, aby měla 90% sílu k zachycení 40% poklesu rizika zlomenin obratle s oboustrannou hladinou významnosti p = 0,05.
Screeningovým vyšetřením prošlo asi 9400 pacientek, přičemž rentgenové snímky byly pořízeny u 5800 žen, z nichž ovšem u 35 % nebyla splněna rtg kritéria pro účast ve studii.
Kritéria pro vstup do studie splnilo 2458 žen, které byly zařazeny do studie ze zmíněných 110 pracovišť v Severní Americe. Dobrovolně odstoupilo ze studie před jejím zahájením 10 pacientek, 9 porušilo protokol. Zbylé pacientky byly rozděleny takto: 813 pacientek užívalo 5 mg RIS, dalších 811 žen dostávalo 2,5 mg RIS a 815 užívalo kombinaci kalcia a vitaminu D v souladu s protokolem studie. Ze všech léčených pacientek dokončilo první rok studie 75,5 %, po prvním roce byla skupina léčená 2,5 mg RIS ukončena dodatkem protokolu a plné 3 roky dokončilo 55 % pacientek ze skupiny, jíž bylo podáváno placebo, a 60 % ze skupiny léčené dávkou 5 mg RIS. U většiny účastnic studie (86 %) došlo ke zlomeninám obratle, resp. postihla je nejméně 1 nová zlomenina obratle. Přitom ve skupině léčené se statisticky významně snížilo riziko zlomenin obratlů, ve skupině léčené 5 mg RIS činilo snížení 41 % ve srovnání s placebem (p = 0,003). Kumulativní incidence nevertebrálních zlomenin byla v léčené skupině o 39 % nižší (p = 0,02). Konkrétně pro kyčel a pánev byly počty pacientek se zlomeninami ve skupině léčené oproti placebové 12 v. 15. Přes velmi dobrou snášenlivost byl počet pacientů, kteří ukončili předčasně studii, vysoký.
Do tříleté studie [27], jejímž primárním cílem bylo sledování účinnosti léčby RIS na snížení rizika fraktury kyčle, bylo zahrnuto 5445 jedinců. Incidence zlomenin kyčle u žen s OP léčených risedronátem byla 1,9 %, tedy o 40 % méně než u kontrolní skupiny (3,2 %). U 1683 žen, které měly již přítomnou prokázanou zlomeninu obratle, se riziko zlomeniny kyčle snížilo o 60 % (6,6 % v. 2,3 %) a u 2648 subjektů bez předchozího výskytu zlomenin obratlů došlo ke snížení zlomenin kyčle o 40 % (1,9 % v. 1,1 %). Poslední nález však nebyl statisticky signifikantní. Nebyl prokázán žádný účinek léčby u žen vybraných dle přítomnosti rizikových faktorů pro zlomeninu kyčle, pravděpodobně proto, že mnoho těchto nemocných nemělo OP (BMD nebyla zmíněna v této podskupině studie).
Ibandronát
Zcela nově dostupným bisfosfonátem pro léčbu postmenopauzální osteoporózy na našem trhu je ibandronát.
Ibandronát patří mezi BF 3. generace. Podobně jako u jiných aminobisfosfonátů je absorpce IBA ze střeva po perorálním podání nízká (biologická dostupnost = 0,6 %) a klesá až o 90 %, pokud se tableta neužívá nalačno. Strava přijatá po době delší než jedna hodina od podání tablety už absorpci IBA neovlivňuje. Maximum koncentrace IBA v plazmě až do perorální dávky 50 mg závisí na dávce a je ho dosaženo průměrně po 60 minutách od podání léčiva. Časně dosažené plazmatické koncentrace se však rychle snižují a za 3 až 8 hod. po podání dosahují pouze 10 % vrcholových hodnot [28]. Poločas eliminace IBA z kostí je zhruba 1 rok [29].
IBA byl testován v mnoha studiích, jejichž primárním cílem bylo zjistit účinnost IBA v prevenci zlomenin a optimální denní dávkování.
Studie BONE byla randomizovaná dvojitě zaslepená placebem kontrolovaná studie, do níž bylo zařazeno 2946 postmenopauzálních pacientek (průměrný věk 69 let) s BMD ≤ -2,0 T-skóre v oblasti lumbální páteře a anamnézou 1–4 prodělané vertebrální fraktury.
Pacientky dostávaly placebo, nebo IBA podávaný perorálně buď denně v dávce 2,5 mg, nebo intermitentně (20 mg ob den, 12 dávek, přestávka, opakování po 3 měsících) s cílem prokázat účinnost střídavé dávky 20 mg perorálně podávaného IBA na snížení rizika nové zlomeniny obratle. Při srovnání obou dávkovacích schémat IBA se nárůst BMD signifikantně nelišil. BMD bederní páteře a proximálního femuru se zvýšila po 3 letech podávání 2,5 mg IBA o 6,5 %, resp. 3,4 %, ve skupině s intermitentním dávkováním o 5,7 %, resp. 2,9 %. Zvýšení BMD u obou skupin bylo v porovnání se skupinou kontrolní (1,3 %, resp. -0,7 %) signifikantně vyšší (vždy p < 0,0001).
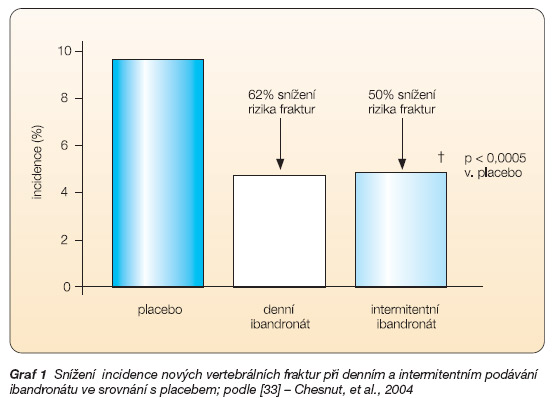
Relativní riziko pro nové zlomeniny obratle bylo sníženo při denním podávání o 62 % a při intermitentním podávání o 50 %, což představuje největší relativní snížení ze všech BF používaných k léčbě osteoporózy (graf 1). Např. po třech letech léčby denně podávaným ALN [30] či RIS [31] bylo snížení relativního rizika vzniku nové vertebrální fraktury do 50 %, resp. 49 %.
Snížení relativního rizika vzniku nonvertebrálních fraktur nedosahovalo ve studii statistické významnosti. Tento výsledek lze vysvětlit charakteristikou populace pacientek, která měla ve studii BONE relativně vysoké hodnoty BMD v oblasti proximálního femuru v porovnání se skupinami ve studiích s jinými BF. Například průměrná BMD krčku femuru v této studii (0,63–0,64 g/cm2) byla téměř o 10 % vyšší než ve studii FIT 1 (0,56 g/cm2) [32]. Tomu odpovídá i nižší riziko zlomenin, které může být odvozeno z incidence nových vertebrálních fraktur v placebové skupině. Srovnáme-li incidenci fraktur v placebových skupinách ve studii BONE a studii FIT 1 (9,6 % a 15 % po 3 letech), je zřejmé, že v případě studie BONE se jedná o populaci se zřetelně nižším rizikem.
Analýza výsledků rizikovější skupiny pacientek (T-skóre < -3 v oblasti krčku femuru) prokázala snížení rizika nonvertebrálních fraktur o 69 % (p = 0,0122).
Ve studii BONE navodila stejná kumulativní dávka (225–240 mg každé 3 měsíce) srovnatelné zlepšení BMD, snížení rizika zlomenin stejně jako obdobné změny markerů kostní remodelace. IBA byl tedy prvním perorálním BF, u kterého byla prokázána možnost prodloužit dávkovací interval na dobu delší než jeden týden [33].
Po 3 letech snížilo perorální podávání intermitentní dávky IBA relativní riziko zlomeniny o 50 % v případě nových zlomenin obratle (p = 0,0006), o 48 % v případě nových klinických zlomenin obratle (p = 0,0143) a rovněž o 50 % v případě nových nebo zhoršujících se zlomenin obratle (p = 0,0005). U pacientů s T-skóre < -3,0 v krčku stehenní kosti došlo k 49% redukci osteoporotických klinických zlomenin. V rámci studií hodnotících účinnost BF v léčbě osteoporózy představují tyto výsledky nejvýznamnější snížení relativního rizika zlomenin obratle.
Tolerance u použitých dávek byla ve všech případech srovnatelná s placebem.
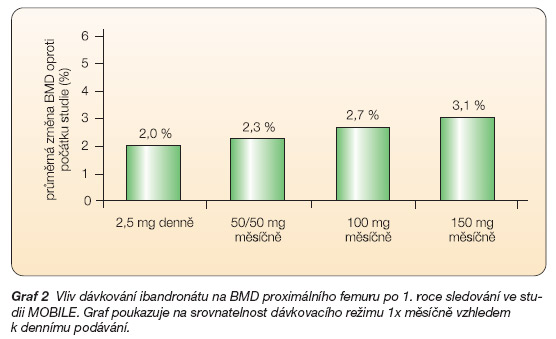
Studie MOBILE zkoumala účinnost léčby dávkou 100 mg (50 mg podaných ve dvou po sobě následujících dnech v měsíci nebo 100 mg podaných jednou měsíčně v jednom dni) a dávkou 150 mg (podaných v jednom dni), kde primární cíl nárůstu BMD splnily všechny tři zkoumané dávkovací režimy a dávka 150 mg měsíčně ve srovnání s denní formou 2,5 mg denně vykázala signifikantně vyšší nárůst BMD v oblasti bederní páteře 4,9 % v. 3,9 % na hladině významnosti p < 0,001 [34].
Ekvivalentní byla situace v oblasti kyčle, kde byl zaznamenán nárůst 3,1 % v. 2,0 %, a v krčku stehenní kosti s nárůstem 2,2 % v. 1,7 % (graf 2).
V trochanterické krajině, kde se dosahuje zpravidla nejlepších výsledků při léčbě BF, byl nárůst 4,6 % v. 3,2 %. Z hlediska odpovědi na léčbu, která byla sledována pomocí předem definovaného snížení sérového CTX (C-terminální telopeptid kolagenu typu I) -50 % a -70 %, odpovídal na léčbu měsíční formou IBA signifikantně vyšší podíl pacientů (p < 0,05 a p < 0,001) ve srovnání s denním podáním. Při sledování účinku terapie na kostní izoformu ALP došlo k poklesu o 35 % při denním podávání, zatímco při léčbě dávkou podanou jednou měsíčně došlo k poklesu o 50 % (p < 0,005). Všechny dávkovací režimy měly bezpečnostní profil srovnatelný s placebem a zúčastněné ženy vykazovaly vyšší adherenci v závislosti na délce intervalu podávání. Je to celkem pochopitelné, protože pacientka s měsíční formou terapie užívá pouze 12 tablet ročně ve srovnání s 52 tabletami při týdenní formě léčby či s 365 tabletami užívanými při denní formě léčby bisfosfonáty.
Komentář k provedeným klinickým studiím a praktické implikace
Tolik jednotlivé BF z hlediska klinických studií, ovšem ekonomicky a především klinicky nejdůležitější je efekt na redukci zlomenin v oblasti kyčelního kloubu.
Ani studie s ALN ani studie s RIS a IBA nebyly stratifikovány podle počtu pádů, je tedy možné, že nižší incidence zlomenin kyčle v léčené větvi může být výsledkem nižšího výskytu pádů v této skupině. Ve studii zabývající se léčbou RIS [27] byl vysoký počet vyřazených jedinců. V takové situaci, kdy studii (větev s léčenými pacienty) opustí z různých příčin více jedinců, mohou být výsledky ovlivněny nižším počtem zlomenin kyčle v této větvi studie.
Typickým příkladem jsou studie prokazující, že kalcium a vitamin D snižují riziko zlomenin kyčle u obyvatel domovů pro staré občany, ale takové výsledky nebyly potvrzeny u běžných obyvatel.
Léčba raloxifenem (RAL) rovněž není spojena s redukcí počtu fraktur kyčle. V nedávné subanalýze RAL [35] neredukoval riziko zlomeniny kyčle ani jiné neobratlové zlomeniny u nemocných stratifikovaných do nejnižšího, středního a nejvyššího tercilu snížené BMD.
Za předpokladu, že fraktury jsou významným zdravotním problémem, křehkost kosti se zvyšuje s věkem a že jsou k dispozici četné dobře připravené a provedené klinické studie vykazující, že určitá léčiva snižují riziko fraktur, je třeba odpovědět na otázku, kdo by měl být léčen.
Asi jediným a nejsnadněji rozpoznatelným rizikovým faktorem pro fraktury je přítomnost jakékoli zlomeniny obratlů i neobratlových zlomenin v důsledku minimálního traumatu. Riziko dalších zlomenin obratlů se pak zvyšuje 3–5krát, tak jak se zvyšuje počet nebo závažnost (tzn. míra snížení původní výšky obratlového těla) předchozích deformit obratlových těl. Riziko se dokonce zvyšuje až 11krát, je-li přítomno 3 a více fraktur. Riziko zlomeniny kyčle je zvýšené za přítomnosti jedné nebo více zlomenin obratlů. Podobně riziko zlomeniny předloktí je zvýšené za přítomnosti předchozí zlomeniny předloktí. U nemocných s frakturou distálního předloktí utrpělo další frakturu během 7 let 46 % žen a 30 % mužů, celkové riziko fraktur bylo 55 % během 10 let a 80 % během 20 let.
Navíc, u nemocných s nově vzniklými frakturami (s předchozí frakturou nebo bez předchozích fraktur na počátku) je riziko dalších fraktur zvýšené o 30–40 % během dalších 3 let. Lze tedy shrnout, že přítomnost fraktur je indikací k léčbě, která má být podávána tehdy, je-li BMD v OP či osteopenickém rozmezí. Hodnoty osteopenického rozmezí by neměly klinika odradit od vyšetření a léčení těchto případů. Jestliže osteopenie nebo OP přítomna není, vyšetření by mělo být provedeno s vědomím diferenciální diagnostiky zlomeniny jako důsledku traumatu nebo malignity spíše než zvýšené křehkosti kosti.
Cílem léčby OP je předcházet první a všem dalším zlomeninám bezpečně a bez velkých nákladů, tedy snižovat celkovou morbiditu a mortalitu. Ženy kolem 50 let a starší s OP již mají zvýšené riziko fraktur, a to dokonce i tehdy, je-li jejich absolutní riziko fraktury v následujících 5 letech nízké. Estrogenová deficience spojená s menopauzou bude zvyšovat kostní remodelaci v důsledku prodloužení délky života osteoklastů a redukce délky přežití osteoblastů. Ženy s OP bez fraktur a ženy s OP s frakturami by tedy měly být léčeny.
Existuje málo dat týkajících se účinnosti antiresorpčních léčiv u žen s osteopenií, protože nejvíce klinických studií je prováděno u žen s OP.
Z těchto důvodů je obtížné dávat doporučení ohledně terapie žen s osteopenií, doporučovat léčbu velké části populace s malým rizikem fraktur není v souladu se zásadami EBM.
Ve studii FIT dostávaly ženy s BMD mezi -1 a -2,3 T-skóre ALN a měly snížené riziko páteřních zlomenin přibližně o 50 %, ale toto snížení nedosáhlo statistické významnosti, protože u osob s osteopenií byl počet sledovaných událostí nízký.
Stejně málo důkazů zatím potvrzuje předpoklad, že ženy s pouhou existencí rizikových faktorů pro OP nebo se zvýšenou tendencí k pádům budou mít prospěch z léčby.
Studie ukazují, že spíše opak je pravdou. Ve studii s RIS nevykazovali jedinci vybraní pro léčbu na základě rizikových faktorů pro zlomeninu kyčle snížení počtu zlomenin kyčle.
Je ovšem možné, že většina těchto pacientů neměla OP, neboť jenom 30 % těchto subjektů mělo změřeno BMD.
Z těchto důvodů i vzhledem k tomu, že máme k dispozici rychle působící a účinná léčiva, je třeba zahajovat farmakoterapii jen u pacientů reálně ohrožených zlomeninou.
Dalším problémem je délka podávání léčby. Léčba má být podávána zásadně dlouhodobě a bez přestávek, protože snižuje remodelaci, kostní ztrátu, progresi strukturálního poškození a zvýšeného rizika fraktur. Nejvíce se objevuje zvýšení BMD během prvních 2 let terapie, i když k přírůstku BMD dochází i při protrahované léčbě např. ALN [36]. Jestliže se BMD zvýší do normálních hodnot, je rozumné zvážit přerušení léčby na 12–24 měsíců nebo snížit dávku. Efekt BF na redukci remodelace je perzistentní, zřejmě z důvodu, že látka je v kosti přítomna stále a uvolňuje se během remodelace. Může tedy být přijatelné v některých případech přerušit léčbu na 1–2 roky a monitorovat kostní obrat a ztrátu kostní hmoty. Je ale nezbytné podpořit tato fakta ještě dalšími výzkumy.
Použití hormonální substituční terapie (HRT – hormone replacement therapy) je odůvodněné u časně postmenopauzálních žen – stává se léčbou volby v případě, že jsou přítomny postmenopauzální symptomy jako např. návaly. RAL je alternativou u mladších postmenopauzálních žen bez návalů či žen, které nemohou nebo nechtějí užívat HRT. Vždy je třeba nesmírně pečlivě odebrat předchozí tromboembolickou (TEN) anamnézu, protože riziko vzniku TEN je u RAL stejné jako u HRT. Léčba RAL se jeví jako výhodná u žen s rizikem fraktury, které užívaly HRT po mnoho let a přejí si změnit léčbu. V takových situacích se HRT postupně vysazuje před zavedením léčby RAL, tak aby se neobjevily návaly. Ačkoli redukce rizika karcinomu prsu byla popsána při terapii RAL, prevence karcinomu prsu se nezdá oprávněnou indikací pro podávání RAL. U této skupiny pacientek jsou BF rovněž léky první volby.
HRT je indikována jen u části pacientek starších 60 let, je třeba vždy zvážit rizika a přínosy terapie a postupovat individuálně.
RAL, ALN a RIS představují léčbu první volby u žen této skupiny s rizikem zlomeniny obratle v důsledku osteoporózy. ALN, RIS i IBA zvyšují BMD více než RAL. Bisfosfonáty tudíž mohou být preferovány u žen s těžkou OP za předpokladu, že větší nárůst BMD je spojen s větším snížením rizika fraktur.
Hovoříme-li o tom, že chceme zabránit fraktuře kyčle, ALN je prvním léčivem, jehož podávání zvažujeme, protože u něj byla prokázána účinnost na snížení rizika fraktur kyčle. RIS představuje možnost léčby u pacientů s již prodělanou zlomeninou obratle. IBA nám pak umožní nejrychleji normalizovat BMD v oblasti bederní páteře.
Cílem našeho snažení by mělo být rovněž zlepšení kvality života našich pacientů tím, že pro ně zvolíme tu nejvhodnější terapii.
Obr. 1 Schéma mechanismu účinku aminobisfosfonátů jejich zásahem do mevalonátové cesty syntézy cholesterolu
Obr. 2 Schematické znázornění (a) funkčního osteoklastu a (b) narušení funkce jeho cytoskeletu bisfosfonáty, které vede k zábraně uchycení osteoklastu na povrch kosti.
Graf 1 Snížení incidence nových vertebrálních fraktur při denním a intermitentním podávání ibandronátu ve srovnání s placebem; podle [33] – Chesnut, et al., 2004
Graf 2 Vliv dávkování ibandronátu na BMD proximálního femuru po 1. roce sledování ve studii MOBILE. Graf poukazuje na srovnatelnost dávkovacího režimu 1x měsíčně vzhledem k dennímu podávání.
Seznam použité literatury
- [1] NIH Consensus Development Panel. Osteoporosis prevention, diagnosis, and therapy. JAMA 2001; 285: 785–795.
- [2] Seeman E. The dilemma of osteoporosis in men. American Journal of Medicine 1995; 98 (Suppl 1A): 75S–787S.
- [3] Chrischilles EA, Butler CD, Davis CS, Wallace RB. A model of lifetime osteoporosis impact. Arch Intern Med 1991: 151; 2026–2032.
- [4] Kannus P, Parkkari J, Sievanen H, Heinonen A, et al. Epidemiology of hip fractures. Bone 1996; 18: 57S–61S.
- [5] Fleisch H. Bisphosphonates in bone diseases. Third Edition. New York: The Parthenon Publishing Group, 1997.
- [6] Gonnelli S, Rottoli P, Capollaro C, et al. Prevention of corticosteroid-induced osteoporosis with alendronat in sarcoid patients. Calcif Tiss Int 1997; 61: 382–385.
- [7] Chavassieux PM, Arlot ME, Reda C, et al. Histomorphometric assessment of the long-term effects of alendronate on bone quality and remodeling in patients with osteoporosis. J Clin Invest 1997; 100: 1475–1480;
- [8] Meunier PJ, Arlot M, Chavassieux P, et al. The effects of alendronate on bone turnover and bone quality. Int J Clin Pract 1999; 101 (Suppl.): 14–17.
- [9] Roschger P, Rinnerthaler S, Yates J, et al. Alendronate Increases Degree and Uniformity of Mineralization in Cancellous Bone and Decreases the Porosity in Cortical Bone of Osteoporotic Women. Bone 2001; 29: 185–191.
- [10] Bloebaum RD, Skedros JG, Vajda EG, et al. Determining mineral content variations in bone using backscattered electron imaging. Bone 1997; 20: 485–490.
- [11] Boyde A, Compston JE, Reeve J, et al. Effect of estrogen suppression on the mineralization density of iliac crest biopsies in young women as assessed by backscattered electron imaging. Bone 1998; 22: 241–250.
- [12] Boyde A, Jones SJ, Aerssens J, et al. Mineral density quantitation of the human cortical iliac crest by backscattered electron image analysis: Variations with age, sex, and degree of osteoarthritis. Bone 1995; 16: 619–627.
- [13] Rinnerthaler S, Roschger P, Jakob HF, et al. Scanning small angle X-ray scattering analysis of human bone sections. Calcif Tissue Int 1999; 64: 422–429.
- [14] Roschger P, Fratzl P, Eschberger J, et al. Validation of quantitative backscattered electron imaging for the measurement of mineral density distribution in human bone biopsies. Bone 1998; 23: 319–326.
- [15] Roschger P, Fratzl P, Klaushofer K, et al. Mineralization of cancellous bone after alendronate and sodium fluoride treatment: A quantitative backscattered electron imaging study on minipig ribs. Bone 1997; 20: 393–397.
- [16] Fratzl P, Schreiber S, Roschger P, et al. Effects of sodium fluoride and alendronate on the bone mineral in minipigs: A small-angle X-ray scattering and backscattered electron imaging study. J Bone Miner Res 1996; 11: 248–253.
- [17] Black DM, Thompson DE, Bauer DC, et al. Fracture risk reduction with alendronate in women with osteoporosis: the Fracture Intervention Trial. J Clin Endocrinol Metab 2000; 85: 4118–4124.
- [18] Ravn P, Bidstrup M, Wasnich RD, et al. Alendronate and estrogen-progestin in the long-term prevention of bone loss: four-year results from the Early Postmenopausal Intervention Cohort Study: a randomized trial. Ann Intern Med 1999; 131: 935–942.
- [19] Ravn P, Weiss SR, Rodriguez-Portales JA, et al. Alendronate in early postmenopausal women: effects on bone mass during long-term treatment and after withdrawal. Alendronate Osteoporosis Prevention Study Group. J Clin Endocrinol Metab 2000; 85: 1492–1497.
- [20] Luckey MM, Gilchrist N, Bone HG, et al. Therapeutic equivalence of alendronate 35 milligrams once weekly and 5 milligrams daily in the prevention of postmenopausal osteoporosis. Obstet Gynecol 2003; 101: 711–721.
- [21] Miller PD, Brown JP, Siris ES, et al. A comparative trial of risedronate versus etidronate in the treatment of patients with Pageťs disease of bone. Am J Med 1999; 106: 513–520.
- [22] Hosking DJ, Eusebio RA, Chines AA. Pageťs disease of bone: reduction of disease activity with oral risedronate. Bone 1998; 22: 51–55.
- [23] Roux C, Ravaud P, Cohen-Solal M, et al. Biologic, histologie and densitometrie effects of oral risedronate on bone in patients with multiple myeloma. Bone 1994; 15: 41–49.
- [24] Cohen-Solal ME, Roux C, Valentin-Opran A, et al. Histomorphometric effect of six month treatment with oral risedronate in patients with multiple myeloma. Bone 1993; 14: 505–509.
- [25] Mortensen L, Charles P, Bekker PJ, et al. Risedronate increases bone mass in an early postmenopausal population: two years of treatment plus one year of follow-up. J Clin Endocrinol Metab 1998; 83: 396–402.
- [26] Harris ST, Watts NB, Genant HK, et.al. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. Vertebral Efficacy With Risedronate Therapy (VERT) Study Group. JAMA 1999; 282: 1344–52.
- [27] McClung MR, Geusens P, Miller PD, et al. Intervention Program Study Group: Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group. NEJM 2001; 344: 333–340.
- [28] SPC Bonviva EU/1/03/265/003.
- [29] Bauss F, Russell RG. Ibandronate in osteoporosis: preclinical data and rationale for intermittent dosing. Osteoporos Int 2004; 15: 423–433.
- [30] Cummings SR, Black DM, Thompson DE, et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: Results from the Fracture Intervention Trial. JAMA 1998; 280: 2077–2082.
- [31] Reginster J, Minne HW, Sorensen OH, et al. Eastell R Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Vertebral Efficacy with Risedronate Therapy (VERT) study group. Osteoporos Int 2000; 11: 83–91.
- [32] Ravn P, Clemmesen B, Riis BJ, et al. The effect on bone mass and bone markers of different doses of ibandronate: a new bisphosphonate for prevention and treatment of postmenopausal osteoporosis: a 1-year, randomized, double-blind, placebo-controlled dose-finding study. Bone 1996; 19: 527–533.
- [33] Chesnut CH, Skag A, Christiansen C, et al. Effects of Oral Ibandronate Administered Daily or Intermittently on Fracture Risk in Postmenopausal Osteoporosis J Bone Miner Res 2004; 19: 1241–1249.
- [34] Miller PD, McClung MR, Macovei L, et al. Monthly Oral Ibandromate Therapy in Postmenopausal Osteoporosis 1-Year Results from the MOBILE Study. J Bone Miner Res 2005; 20: 1315–1322.
- [35] Siris ES, Harris ST, Eastell R, et al. Skeletal effects of raloxifene after 8 years: results from the continuing outcomes relevant to Evista (CORE) study. J Bone Miner Res 2005; 20: 1514–24.
- [36] Papapoulos SE, Quandt SA, Liberman UA, et al. Meta-analysis of the efficacy of alendronate for the prevention of hip fractures in postmenopausal women. Osteoporos Int 2005; 16: 468–74.