Bezpečnosť liečiv z aspektu historických aktivít v našich krajinách
Souhrn:
V komentári sa poukazuje na podiel československej farmakologickej komunity na formovaní základov farmakovigilancie v 60‑tych rokoch minulého storočia. Autor porovnáva aktivity lekárov v monitorovaní liekového rizika v podmienkach Slovenska po začlenení do štruktúr EU.
Key words: history of pharmacovigilance, Czechoslovakia, drug risk, ADR monitoring.
Summary:
This commentary deals with the historical role of former Czechoslovak pharmacological community in worldwide pharmacovigilance during the 1960s. The activities of physicians in drug risk monitoring then and now, within the European Union, are compared.
Bezpečnosť liečiv je relatívny pojem, jeho obsah sa mení historicky. Súvisí s mierou tolerovaného rizika liečiv v terapii. Pri registrácii liečiva je úlohou nadnárodných a národných autorít priniesť dôkazy o relatívnej bezpečnosti liečiva v danej indikácii. Riziko v bežnej klinickej praxi – GVP (Good PharmacoVigilance Practice, správna farmakovigilančná prax) [1] – sa najjednoduchšie vyjadruje počtom (frekvenciou) a intenzitou nežiaducich účinkov liečiv (NÚ) [2].
Základom prevencie rizika liekov je efektívne vyhľadávanie, monitorovanie, analýza nežiaducich účinkov, čo je osou funkčného sys-tému farmakovigilancie. Najvšeobecnejšou formou systému je spôsob ich spontánneho monitorovania. Ide o dobrovoľné hlásenie s vylúčením ekonomických stimulov.
Základným štandardom hodnotenia poliekového rizika je NÚ, paralelne sa v praxi používa aj termín nežiaduca lieková reakcia [3,4]. Pojem sa etabloval po thalidomidovej tragédii v šesťdesiatych rokoch minulého storočia v rámci systému Svetovej zdravotníckej organi-zácie (WHO, World Health Organization), ktorá od začiatku zohrávala metodicky a integračne najdôležitejšiu úlohu. Počas II. svetovej konferencie farmakológov IUPHAR (International Union of Pharmacology), ktorá sa konala v Prahe roku 1963, bol jednou z dominujúcich nových tém thalidomid a jeho teratogénny účinok, dosiaľ v nepredvídateľnej forme poliekového poškodenia; vtedajšia thalidomidová tragédia traumatizovala spoločnosť. Vzhľadom na silnú pozíciu farmakológie v Československu nebolo ani prekvapením, že nový medicínsky odbor klinickej farmakológie dostal do vienka novú povinnú tému potrebnú pre budovanie zdravotnej starostlivosti „západného typu“.
Pri vzniku systému WHO bolo 10 zakladajúcich štátov, medzi ktoré patrilo i Československo, čo predstavuje naďalej prinajmenšom morálny záväzok pre ďalšie generácie zdravotníkov. K úspechu vtedajšej liekovej politiky neprispievala len skvelá diplomacia prof. Heleny Raškovej, ale aj entuziazmus vtedajšej generácie teoretikov (farmakológov) v spolupráci s praktikmi (klinickými pracov-níkmi). Krátka historická reminiscencia je aj podnetom pre zvýšenie iniciatívy oboch našich terajších spoločností klinickej farmakológie. Pre zabezpečenie funkčnosti programu hodnotenia rizika liekov v rámci jednotlivých krajín v priebehu sedemdesiatych rokov minulého storočia vznikali Národné centrá pre zber a vyhodnocovanie NÚ. Pri nich pracovali Komisie pre nežiaduce účinky liečiv. Českosloven-ská komisia začala pracovať za predsedníctva prof. Vaněčka, s výdatnou asistenciou prof. Finka a ďalších entuziastov, akým bol doc. Štika, ktorého prínos pri vytváraní základov modernej farmakoepidemiológie bol medzinárodne uznávaný. Slovensko zastupovali v komisii počas prvého obdobia prof. Niederland, MUDr. Daněková, MUDr. Ježek, doc. Kriška, ktorí neskôr v rámci regionalizácie národných centier vytvorili samostatnú Komisiu pre nežiaduce účinky liečiv pri Štátnom ústave kontroly liečiv (ŠÚKL) v Bratislave. Tá sa v rámci budovania systému farmakovigilancie v deväťdesiatych rokoch minulého storočia pretransformovala na Komisiu pre bezpeč-nosť liekov s orientáciou na širšiu spoluprácu s vybranými klinickými pracoviskami a univerzitnými pracovníkmi, a predovšetkým s novovzniknutou Spoločnosťou klinickej farmakológie. Sídli doteraz na ŠÚKL. Pri tejto príležitosti je potrebné spomenúť vedecký a metodický prínos profesora J. Elisa aj vo funkcii riaditeľa SÚKL, prof. M. Kršiaka, predsedy Komisie pre nežiaduce účinky liekov, MUDr. H. Fouskovej, tajomníčky Komisie pre nežiaduce účinky liekov, na Slovensku podporoval integračný proces riaditeľ ŠÚKL PhDr. V. Parák.
Už v období budovania systému farmakovigilancie treba vyzdvihnúť aktivity predovšetkým na univerzitných pracoviskách. Kolektív autorov z katedry farmakológie a iných pracovísk Lekárskej fakulty UP v Olomouci už v roku 1975 komplexne pojednáva v Supplementu Farmakoterapeutických zpráv SPOFA o farmakoterapeutickom riziku a faktoroch, ktoré ho ovplyvňujú [5]. Kvôli struč-nému prehľadu uvádzame, že na Slovensku:
- V posledných piatich rokoch Národné centrum pre NÚ, toho času zaradené do štruktúry liekových agentúr podľa schémy Europskej únie (EÚ) ako sekcia pre hodnotenie liečiv, prijíma ročne 950–1 050 hlásení NÚ. Pre porovnanie v počte hlásení na 1 milión obyva-teľov ide približne o 200/1 000 000, čo je asi priemer EÚ.
- Z hľadiska kvality hlásení viac ako 60 % reportov sa týka závažných a stredne závažných hlásení, málo sa hlásia organotoxické NÚ a ojedinele sa hlásia neočakávané NÚ.
- V posledných rokoch vznikla smernicou z Ministerstva zdravotníctva Slovenskej republiky povinnosť pre lekárov hlásiť NÚ po podaní vakcín, tieto teraz tvoria viac ako 30 % z celkového počtu hlásení.
Najčastejšie hlásia lekári z internistických disciplín, všeobecní lekári hlásia menej ako 5–7 % zo sumy hlásení (www.sukl.safety.sk). Pre porovnanie s vyspelým zahraničím, v Anglicku tvorí základňu systému praktickí lekári s najvyššou iniciatívou v unikátnom systéme vyhľadávania nových, nepoznaných NÚ, ktorý je označovaný skratkou PEM (Prescription Event Monitoring) a koordinovaný v Southamptone nadáciou, ktorú založil prof. Inman na spolupráci s praktickými lekármi [6].
Prudko poklesol počet hlásení od klinických farmakológov, paralelne s rušením oddelení a zmenami v osadení funkčných miest v regionálnych nemocniciach. Farmaceuti posielajú okolo 5 hlásení za rok, je to podstatne menej ako v Nizozemsku, Anglicku, Dánsku. Čo je potešujúce, počet hlásení od pacientov stúpa, a dokonca prevyšuje aktivitu farmaceutov.
Z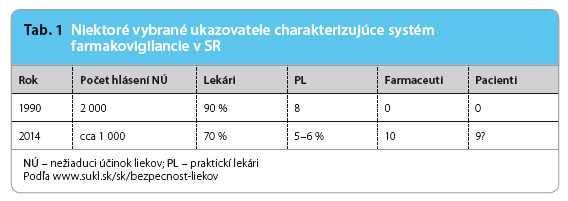 orientačných čísel vyplýva, že monitorovanie rizika lekármi stagnuje, a nebyť hlásení od zástupcov farmaceutických spoločností, ktorí ich aktívne zbierajú, boli by sme svedkami dramatického poklesu počtu hlásení do Národného centra (www.sukl.safety.sk).
orientačných čísel vyplýva, že monitorovanie rizika lekármi stagnuje, a nebyť hlásení od zástupcov farmaceutických spoločností, ktorí ich aktívne zbierajú, boli by sme svedkami dramatického poklesu počtu hlásení do Národného centra (www.sukl.safety.sk).
Nežiaduce účinky liečiv v podstate dobrovoľne monitorujú zdravotnícki pracovníci a pacienti na základe rozpoznania, vyplnením štandardizovaného tlačiva a jeho doručením do Národného centra. Novšie sa výrazne uprednostňuje elektronická forma hlásenia.
Nežiaduci účinok registrovaný v databáze Národného centra treba považovať za súčasť diagnostického procesu lekára v klinickej praxi alebo farmaceuta po rozhovore s pacientom.
V minulosti nás zaujala otázka, či sme v oblasti farmakobdelosti dosiahli európsky štandard [7] a dotkli sme sa systému, ktorý by mal garantovať bezpečnosť liečiv v praxi. Dnes je u nás skôr aktuálny problém, či si vôbec udržíme minulé pozície. Poznamenávam, že farma-kobdelosť je oficiálny preklad Ministerstva zdravotníctva Slovenskej republiky od farmakovigilancie, ktorú ešte prekladajú aj imperatív-nejšie ako dohľad nad bezpečnosťou liekov. Názvy vyjadrujú skôr priania ako skutočnosť. Od historickej chvíle založenia celosvetového systému spontánneho hlásenia NÚ pri WHO sa ťažisko hodnotenia bezpečnosti liečiv u nás a v krajinách EÚ presúva na Európsku liekovú agentúru (EMA, European Medicines Agency) a potom na národné liekové agentúry, ktoré s ňou z princípu dohôd EÚ organizačne úzko spolupracujú na základe konsenzuálnych rozhodnutí.
Základom systému zostáva zlepšovanie metód hodnotenia rizika, pribudla transparentnosť v celom rozsahu činností liekových agentúr s dôrazom na komunikáciu s pacientmi. Čo znamená, že na webe sa zverejňujú všetky rozhodnutia Komisie pre bezpečnosť liekov, hlá-senia o NÚ, teraz je až „nepríjemný“ záujem o NÚ pri vakcinácii. V príslušnej krajine sa liekové agentúry podieľajú na organizovaní sys-tému kontroly, auditu, prevencie rizika spätého s podaním liečiv. Na Slovensku sa ŠÚKL podieľa prostredníctvom mediálnych kanálov, vlastnej webovej stránky a periodika Liekové riziko na informovanosti účastníkov systému farmakovigilancie s dôrazom na pacientov. Pre nový systém GVP a EMA bude okrem zabezpečovania transparentnosti kľúčovým problémom výchova profesionálov aj laikov (zákon č. 140/1998 o liekoch a zdravotníckych pomôckach, smernica rady EÚ, Good Vigilance Practice 1, GVP 1, viď níže).
Vzhľadom na problémy kvality hlásení NÚ a organizácie bolo zlomovým momentom vydanie zásad GVP 1 v podobe smernice EÚ 21. júna 2012. Ide prakticky o dokument menený aktuálnymi vstupmi inovácií vo farmakovigilancii, ktorý sa postupne zdokonaľuje a dopĺňa na rozdiel od vžitých a v praxi samozrejmých zásad SKP, SLP, SVP (správna klinická, laboratórna, výrobná prax).
Azda podstatným rysom konceptu GVP je, že do registrácie liečiva aj po nej organizuje kontinuálny dohľad nad bezpečnosťou lieči-va držiteľ registrácie, novšie držiteľ autorizácie liečiva (Manufactury Authorisation Holder, MAH). Nedostatkom je získavanie výsledkov. Pôvodné výsledkové štúdie (outcome research) väčšinou chýbajú pri kľúčových témach dis-kusie a rozhodovania) [8].
Citovanie a argumentácia na základe observačných štúdií typických pre systém farmakoepidemiológie sú v našich podmienkach podpriemerné ani nie z dôvodu neochoty časti nadšencov pripraviť takéto štúdie, ale z pretrvávajúceho nedostatku odbornej a ekonomickej podpory epidemiologicky, presnejšie farmakoepidemiologicky orientovaného výskumu. Teoretické zázemie v našom regióne sa vytratilo.
Výhľad do budúcnosti nie je zrovna optimistický, u nás pretrváva neprimerane sebavedomé a často faktami z domáceho výskumu málo podložené správanie poisťovní s požiadavkami na praktizujúcich lekárov. Inými slovami, chýba konštruktívny dialóg vo farmako-vigilancii, čo je základným predpokladom účinnej prevencie rizika liečiv. Poisťovne sú významnou súčasťou systému farmakovigilancie a údaje zo zahraničia prostredníctvom účinnej prevencie dokladujú, že možno znížiť náklady na „terapiu NÚ“ v rozmedzí od 40 % do 50 %. Priame náklady vyčíslené v eurách u nás by si vyžadovali podrobnú analýzu problému využitím databáz poisťovní a nutná by bola účasť ďalších odborníkov, ako je to bežné vo vyspelom zahraničí [9].
Mohla by však slúžiť ako impulz pre seriózne riešenie a hľadanie rezervných zdrojov pre zdravotníctvo, nehovoriac o možnosti zvyšovania kvality služieb na základe relevantných údajov.
Záver
Bezpečnosť liečiv v terapii sa mení a je stále relatívnym pojmom. Treba odlíšiť stanovené limity bezpečnosti zistené pred registráciou v podmienkach sledovaných klinických pokusov v schéme randomizovaných klinických štúdií [10]. Kritickým momentom zostáva me-ranie a prevencia poliekového poškodenia v tzv. vulnerabilných skupinách pacientov, ako sú deti, starší ľudia, ľudia s polymorbiditou či s poškodením eliminačných orgánov. Pri uvádzaní a registrovaní nového liečiva obvyklou klauzulou sa stáva: zatiaľ neboli uskutočnené klinické štúdie u detí, v tehotenstve a často u pacientov vo veku nad 70 rokov. Ak tento stav pretrváva, rizikové je použitie metódy „off label“, čo je pri vzrastajúcej aktivite právnikov orientujúcich sa na poškodených pacientov mimoriadne nevhodná situácia na zvyšovanie kredibility zdravotníctva, hlavne lekárov, ale tiež farmaceutov.
Prijatím záväznej normy pre krajiny EÚ vo forme smernice GVP schválenej plénom EÚ vznikajú nové povinnosti nielen pre výrob-cov a držiteľov registrácie liečiv, ale predovšetkým pre ŠÚKL, u nás nedostatočne podporovaný, najmä vzhľadom na pravidelný audit pracovísk s účasťou na randomizovaných klinických štúdiách, ale najmä v súvislosti s podporou a organizovaním štúdií PASS (Post Authorization Safety Studies). Tieto poskytujú nielen dáta o realite farmakovigilancie, ale aj o kvalite Systému zdravotnej starostlivosti. Zvyšuje sa kvalita a dôležitosť hlásenia NÚ pacientmi [11], najmä pre účinnú prevenciu predvídateľného rizika liečiv v blízkej budúc-nosti [12]. História nás morálne zaväzuje, aby sme postupne neskĺzli do druhej kategórie štátov v hodnotení bezpečnosti liečiv.
Seznam použité literatury
- [1] EU Smernica; Commission implementing regulation (EU) No 520/2012 Official J of the EU 2012; I155.
- [2] van Boxtel CJ, Santoso B, Edwards IR eds. Drug benefits and risks: International textbook of clinical Pharmacology. Revised 2nd Ed.: IOS Press and Uppsala Monitoring Centre, 2008.
- [3] Royer RJ, Kriška M. Farmakovigilancia. In: Kriška M, et al. Riziko liekov v medicínskej praxi. Bratislava: SAP 2000, s. 43–49.
- [4] Aronson J. Aristotles’ prior knowledge. The general approach to definition in drug safety, and its relevance to signal detection. Uppsala conference 2008 Impacting patient safety: Adverse drug reaction signal detection, Uppsala 24. October 2008.
- [5] Dušek J, Jezdinský J, Kroutil M, et al. Farmakoterapeutické riziko, Farmakoterapeutické zprávy. SPOFA 1975; Suppl. 3: 169.
- [6] Inman W, Pearce G. Prescribers profile and post marketing surveillance. Lancet 1993; 342: 658–661.
- [7] Kriška M, Luliak M, Hegyi E. Farmakobdelosť, dosiahli sme európsky štandard? Interná Med 2009; 9: 54–58.
- [8] Leape LL, Berwick DM, Bates DW. What practices will most improve safety? Evidence based medicine meets patient safety. JAMA 2002; 288: 501–507.
- [9] Thomsen AG, Winterstein B, Sondergaard L, et al. A Systematic Review of the Incidence and Characteristics of Preventable Adverse Drug Events in Ambulatory Care. Ann Pharmacother 2007; 41: 1411–1426.
- [10] Clark DVJ, Coulter DM, Besag FMC. Randomized Controlled Trials and Assessment of Drug Safety. Drug Saf 2008; 31: 1057–1061.
- [11] Herxheimer A, Crombag MR, Alves TL. Direct patient reporting of adverse drug reactions. A twelve country survey & literature review. Health Action International (HAI) Europe, 2010 January.
- [12] Lessing A, Schmitz B, Albers C, Schrappe M. Impact of sample size on variation of adverse events and preventable adverse events: systematic review on epidemiology and contributing factors. BMJ Qual Saf 2010; 19: 1–5.