Biologická léčba astmatu – historie a budoucnost nových léčebných možností
I přes široké možnosti farmakologické léčby zůstává asthma bronchiale trvalým celosvětovým problémem. Proto jsou neustále hledány další možnosti ovlivnění imunopatologického procesu jeho vzniku. K těmto cestám patří biologická léčba. V současné době je studována řada molekul s biologickou aktivitou – omalizumab, mepolizumab, keliximab, daklizumab, golimumab, pitrakinra, anticytokinové protilátky, agonisté toll-like receptoru 4 a 9, imunostimulační oligodeoxynukleotidy, blokátory cytokinů a jejich receptorů, látky ovlivňující efekt transkripčních faktorů, proliferačně účinné látky aktivující receptor gamma a látky působící proti NF-kB. Jednou z posledních novinek je i protilátka proti IL-17 a antigenu CD69. Jedinou látkou používanou dnes v terapeutické praxi je omalizumab. V současné době je posunuto jeho indikační doporučení do nižší věkové kategorie (děti od 6 let věku) a je rozšířena hranice hladiny sérového IgE pro zahájení léčby omalizumabem.
Úvod
I v končící první dekádě nového tisíciletí zůstává astma aktuálním celosvětovým problémem, který je příčinou mortality a stoupající morbidity s významným ekonomickým dopadem. Je tomu tak hlavně u pacientů, jimž se nedostává dostatečné kontroly nad astmatem, přestože jsou léčeni dle schválených zásad globálního doporučení léčby astmatu – GINA (Global Initiative for Asthma). Tyto pacienty neustále ohrožují exacerbace a dlouhodobě i nebezpečí plicní remodelace a trvalá ztráta plicních funkcí. Právě na tyto pacienty je orientována snaha o nalezení nových, agresivnějších a cílenějších principů léčby. Tyto moderní trendy, směřující často do oblasti biologické léčby, byly diskutovány mimo jiné na nejvýznamnějších evropských fórech v roce 2009, tj. na konferenci Evropské akademie alergologie a klinické imunologie (6.–10. června 2009) a na kongresu Evropské respirační společnosti (12.–16. září 2009).
Asthma bronchiale je chronické zánětlivé onemocnění, které se projevuje zánětem dýchacích cest a bronchokonstrikcí. Mechanismus vzniku astmatu je velice komplexní a podílí se na něm řada genetických faktorů a faktorů prostředí.
Dnes je velmi dobře popsán mechanismus vzniku zánětlivé reakce a alergického astmatu. Tento typ patří k nejčastějším fenotypům astmatu a je spojen s poměrně dobrými plicními funkcemi, ale na druhé straně s vyšším rizikem rozvoje exacerbací [1].
Ústřední roli ve vzniku zánětu a alergického astmatu hrají Th-2 lymfocyty. Jsou-li stimulovány IL-4 produkovaným aktivovanými Th buňkami a IL-25 produkovaným epiteliálními buňkami dýchacích cest, bazofily a eozinofily, začínají produkovat celou řadu cytokinů (IL-3, IL-4, IL-5, IL-9, IL-13 a GM-CSF). IL-4 a IL-13 ovlivňují tvorbu IgE B lymfocyty, IL-4, IL-9 a IL-13 aktivují mastocyty a IL-3, IL-5 a GM-CSF ovlivňují dozrávání bazofilů a eozinofilů [2–6].
Zánětlivá reakce typu Th-2 převažuje zejména u lehčích forem astmatu. U středně těžkého a těžkého astmatu se uplatňují také reakce zprostředkované Th-1 lymfocyty a regulačními T lymfocyty a cytotoxickými CD8+ T lymfocyty [3, 7].
Anti-IgE (omalizumab)
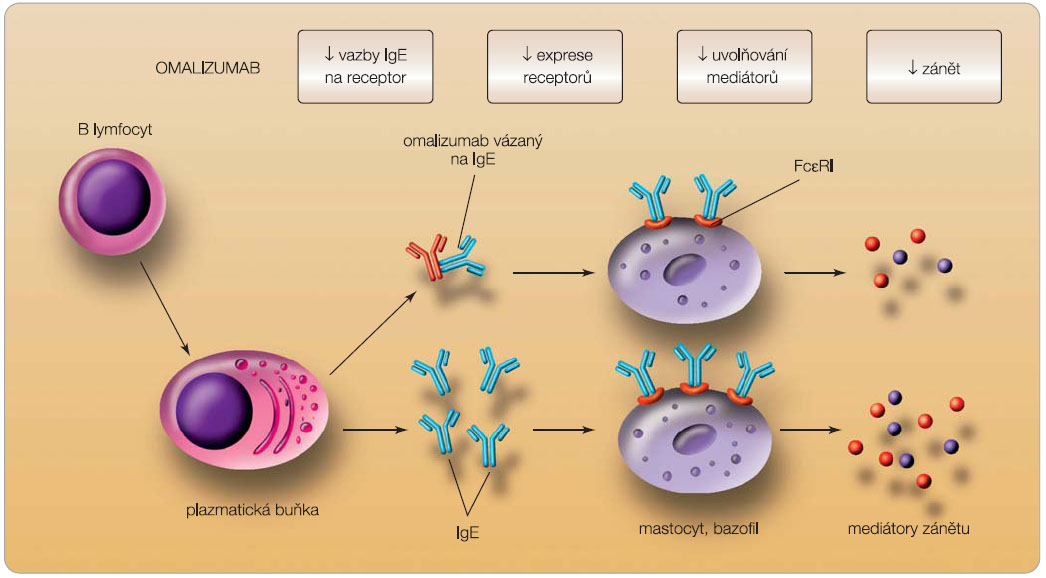 Pro část nemocných s alergickým astmatem je v současné době k dispozici jediné, autoritami schválené a registrované, biologické léčivo – omalizumab, humanizovaná monoklonální protilátka proti imunoglobulinu E (IgE).Omalizumab se váže na cirkulující protilátky IgE a tím zamezuje jejich vazbě na FceRI receptor na mastocytech a bazofilech (obr. 1). Snížením hladiny protilátek IgE snižuje také expresi vysoce afinního receptoru FceRI na bazofilech, mastocytech a dendritických buňkách (tzv. down regulace). Duální mechanismus účinku je velice podstatný, protože bez down regulace receptoru na efektorových buňkách by bylo nutno vyvázat takřka veškerý volný IgE k dostatečně účinné blokádě dalších dějů zprostředkovaných bazofily a žírnými buňkami. Redukcí produkce mediátorů uvolňovaných mastocyty může omalizumab regulovat další buňky, které zodpovídají za rozvoj zánětu (zejména eozinofily), remodelaci tkání a funkční změny dýchacích cest, což přispívá k redukci alergického zánětu [8–11].
Pro část nemocných s alergickým astmatem je v současné době k dispozici jediné, autoritami schválené a registrované, biologické léčivo – omalizumab, humanizovaná monoklonální protilátka proti imunoglobulinu E (IgE).Omalizumab se váže na cirkulující protilátky IgE a tím zamezuje jejich vazbě na FceRI receptor na mastocytech a bazofilech (obr. 1). Snížením hladiny protilátek IgE snižuje také expresi vysoce afinního receptoru FceRI na bazofilech, mastocytech a dendritických buňkách (tzv. down regulace). Duální mechanismus účinku je velice podstatný, protože bez down regulace receptoru na efektorových buňkách by bylo nutno vyvázat takřka veškerý volný IgE k dostatečně účinné blokádě dalších dějů zprostředkovaných bazofily a žírnými buňkami. Redukcí produkce mediátorů uvolňovaných mastocyty může omalizumab regulovat další buňky, které zodpovídají za rozvoj zánětu (zejména eozinofily), remodelaci tkání a funkční změny dýchacích cest, což přispívá k redukci alergického zánětu [8–11].
V současné době je k dispozici mnoho publikovaných důkazů o účinnosti omalizumabu. U pacientů s alergickým astmatem potlačuje časnou i pozdní fázi alergické reakce. Omalizumab účinně potlačuje příznaky astmatu, zvyšuje kvalitu života a umožňuje snížit nutnost podávání i dávky systémových i inhalačních kortikosteroidů (KS). U pacientů s těžkým alergickým astmatem, u nichž nebylo jinak dosaženo dostatečné úrovně kontroly, snižuje počet a frekvenci těžkých exacerbací a hospitalizace. Léčba anti-IgE je již dnes zahrnuta do doporučovaného schématu léčby v dokumentech GINA a Národního programu pro edukaci a prevenci astmatu (NAEP). Zahájit léčbu anti-IgE je preferovanou alternativou chronického podávání systémových KS.
Celosvětově je v současné době léčeno omalizumabem více než 100 000 pacientů a vzhledem k registraci přípravku ve více než 50 zemích světa tento počet rapidně narůstá. Správným určením vhodného fenotypu pro léčbu se předchází plýtvání prostředky. Účinnost se zhodnocuje individuálně u všech pacientů v 16. týdnu léčby tzv. dotazníkem GETE. Pacienti vyhodnocení jako respondéři poté zůstávají léčeni udržovací dávkou i nadále. Zatím se nepodařilo prokázat, zda biologická léčba představuje možnost měnit charakter onemocnění v jeho základu, tzv. disease modifying agents. Krátkodobé studie hodnotící přerušení terapie po 6 měsících léčby prokazují návrat symptomů, naopak zatím individuální zkušenosti s přerušením terapie po delším časovém období ukazují slibné oddálení nástupu symptomů. V tomto směru bude určitě nutné vyčkat dalších výsledků kontrolovaných studií. Na kongresu Evropské respirační společnosti byl představen posun schválené věkové hranice z 12 na 6 let. Tento krok, schválený Evropskou lékovou agenturou, byl uskutečněn na základě zkušeností a průkazu účinnosti klinickými studiemi provedenými na cílové skupině. Hlavní podmínky indikace u pacientů od 12 let zůstávají zatím stejné: těžké perzistující astma, které není pod dostatečnou kontrolou, přítomnost celoroční alergie, hladina IgE v rozmezí 30–1500 IU/ml a FEV1 nižší než 80 % n.h. Pro indikaci u dětí ve věku 6–12 let byla odstraněna podmínka FEV1 a dávkovací rozmezí umožňuje indikaci omalizumabu až k hladinám 1500 IU/ml. Omalizumab se dnes aplikuje podkožní injekcí ad hoc připravené suspenze, zjednodušení aplikace může přinést použití předplněných injekcí s roztokem léčiva. Dávka a frekvence podávání (aplikace každé dva nebo čtyři týdny) se stanovuje dle hmotnosti pacienta a hladiny IgE před léčbou. Z experimentálních prací a kazuistik je patrná snaha lékařů prosadit užívání této léčby i u pacientů s atopickými projevy, jako je dermatitida, rinitida nebo urtikarie.
Šíře dat i počet lékařů prezentujících zkušenosti s touto léčbou přímo i nepřímo poskytují důkazy o bezpečnostním profilu omalizumabu. Od prvních experimentálních studií je velký důraz kladen na obezřetnost po podání. Mezi nejčastěji zmiňované vážné nežádoucí účinky může patřit sérová nemoc, anafylaktická reakce, rozvoj malignit a také kardiovaskulární a cerebrospinální účinky. Tyto nežádoucí účinky naštěstí nepatří mezi časté, v klinických studiích včetně studií z běžné praxe se vyskytují ve frekvenci porovnatelné s placebem, a tak se bezpečnostní profil léku z pohledu národních i nadnárodních autorit výrazně nezměnil [12–22].
Anti-IL-4 a anti-IL-13
Další možností, která se v současné době v rámci biologické léčby alergického astmatu otevírá, je použití protilátek proti IL-4 a IL-13. První pokusy zde směřovaly pouze k inhibici IL-4 a byly neúspěšné. Novější studie použily takzvanou dvojí inhibici a byly již výrazně úspěšnější. Pitrakinra, biologikum podobné IL-4, potlačuje zánět zprostředkovaný Th-2 prostřednictvím inhibice účinku IL-4 i IL-13 na receptoru IL-4Ra. Klinický efekt tohoto přístupu se potvrdil i ve II. fázi klinického hodnocení a výsledky dalších klinických studií se očekávají, stejně jako výsledky studií dalších molekul, a to minimálně tří, které se nezávisle testují [23, 24].
Anti-IL5mAb
Atopická eozinofilie, hypereozinofilní syndrom a eozinofilní astma jsou doprovázeny vysokou produkcí IL-5, a proto se zdá být cesta neutralizace IL-5 pomocí protilátek velmi slibnou terapeutickou příležitostí léčby onemocnění charakterizovaných eozinofilií (např. eozinofilní astma). Takovou protilátkou je mepolizumab. Po podání mepolizumabu lidem se nepotvrdil dostatečný klinicky prokazatelný prospěch u pacientů s astmatem, u kterých přetrvávaly symptomy navzdory léčbě inhalačními KS. Některé studie však ukazují, že anti-IL5mAb zmírňují proces remodelace v plicní tkáni a zlepšují stav u pacientů s eozinofilní ezofagitidou, eozinofilním zánětem a nosními polypy. Určitou naději dávají výsledky recentní studie, ve které byla podskupina pacientů s obtížně léčitelným eozinofilním astmatem úspěšně léčena mepolizumabem. Efekt léčby se projevil snížením počtu exacerbací, snížením symptomů (hodnoceno pomocí ACQ), snížením potřeby podání systémových KS a zvýšením kvality života (AQLQ test). Na kongresu Evropské respirační společnosti byla prezentována studie popisující nárůst eozinofilů ve sputu a v krvi po 3 měsících od přerušení léčby mepolizumabem [23, 25–34].
Anti-IL-2
Ve vztahu k protilátkám anti-IL-2 je nutné připomenout úlohu T regulačních buněk (Treg) v mnoha procesech včetně vzniku astmatu a zánětu vyvolaného alergenem. Vývoj léčiv ubírající se touto cestou je teprve v prvopočátcích. Ve studii in vivo, která sledovala vliv podání IL-2, monoklonární protilátky proti IL-2 (anti-IL-2) a komplexu IL-2 a anti-IL-2 na zánět vyvolaný alergenem, se zjistilo, že pouze podání komplexu IL-2 a anti-IL-2 je schopno expandovat Treg buňky a zmírnit zánět. Bylo také prokázáno, že dochází k inhibici produkce IL-5 a eotaxinu-1, která se následně projevila menší produkcí hlenu, nižší hyperaktivitou průdušek a snížením zánětu parenchymu plic. Více výsledků zatím nemáme k dispozici a bude zajímavé sledovat, zda cesta endogenního ovlivnění Treg buněk přispěje k lepší kontrole astmatu [35].
Anti-CD4
T buňkám CD4+ je v astmatu přiřazována role zdroje prozánětlivých cytokinů. Keliximab, protilátka anti-CD4, prokázala u těžkých astmatiků přechodné snížení počtu CD4+ buněk a také změnu exprese CD4+ receptorů. Tento efekt byl pravděpodobně zprostředkován nižší expresí vnějšího povrchu buňky, snížením počtu T lymfocytů a také redukcí proliferace buněk vyvolané alergenem. Klinický efekt byl však nevýrazný, a proto byl vývoj tohoto léku zastaven [36, 37].
Anti-CD25
Zánět v dýchacích cestách u těžkých astmatiků je doprovázen aktivací T buněk se zvýšeným množstvím aktivovaných T buněk CD25+ a také s nadprodukcí IL-2 a „rozpustného“ IL-2 receptoru. Daklizumab – humanizovaná monoklonální protilátka proti a-řetězci receptoru (CD25) aktivovaných lymfocytů – byl klinicky testován na účinnost a bezpečnost v léčbě středně těžkých až těžkých astmatiků. Další studie musí ještě plně potvrdit aplikovatelnost a prospěšnost tohoto nového přístupu v léčbě astmatu, stejně jako musí potvrdit mechanismus účinku daklizumabu. Zatím je za nejpravděpodobnější považována hypotéza o inhibici uvolňování prozánětlivých cytokinů právě blokádou IL-2 receptoru na aktivovaných T buňkách [23].
Anti-TNF-α
Tzv. up-regulace tohoto cytokinu, doprovázená zvýšenou koncentrací v plicní tkáni i zvýšenou expresí TNF-α v monocytech periferní krve, se ukázala jako významná složka u pacientů s těžkým perzistujícím astmatem. Navíc se prokázalo, že TNF-α je schopný indukovat prozánětlivé procesy pozorované u těžkého astmatu, včetně neutrofilního zánětu. Zájem o tento přístup v léčbě astmatu vzbudily výsledky provedených pilotních klinických studií, jedné zkřížené a jedné otevřené, ve kterých etanercept prokázal klinicky významný efekt v léčbě astmatu. Ve studii, která svým rozsahem převyšovala zmíněné studie, se bohužel plný klinický efekt nepotvrdil, nebo potvrdil pouze slabé zlepšení astmatu a stupně zánětu měřeného pomocí sérového albuminu a C-reaktivního proteinu. Trochu zklamání přinesl neúspěch klinického hodnocení golimumabu, který nepotvrdil účinek u pacientů s těžkým astmatem. Další studie sledují, zda lze efekt prokázat u subpopulací astmatických pacientů na základě jejich fenotypizace [38, 39].
Další směry klinického výzkumu
Tak rychle, jak dovolují možnosti současné biotechnologie připravit variace protilátek, se rozvíjí, objevují a testují další zástupci biologické léčby v terapii astmatu. V prvních fázích klinického výzkumu se testují mj. agonisté toll-like receptoru 4 a 9, imunostimulační oligodeoxynukleotidy, blokátory cytokinů, blokátory receptorů cytokinů, látky ovlivňující efekt transkripčních faktorů, proliferačně účinné látky aktivující receptor gamma a látky působící proti NF-kappaB. Jednou z posledních novinek je i protilátka proti IL-17 a CD69 antigenu, která může hrát významnou roli v aktivaci a apoptóze eozinofilů, a tím zasahovat do vzniku a projevů astmatického zánětu. Prozatím slibné výsledky na myším modelu prokázaly reverzibilitu astmatického zánětu po podání IC87114 (p110d selective fosfoinositol 3-kinase inhibitor) a anti-CD69mAb [23, 40, 41].
Specifické nežádoucí účinky biologické léčby
![Obr. 2 Klasifikace nežádoucích vedlejších účinků biologické léčby; převzato z [23] – Bousquet, et al., 2008.](https://www.remedia.cz/photo-a-27886---.jpg) Nový princip a mechanismus účinku, který biologická léčba přinesla, si našel své odpůrce a skeptiky, hlavně z řad odborníků upozorňujících na možné nežádoucí účinky těchto agens. Ukázalo se, že vedlejší a nežádoucí účinky doprovázejí tuto léčbu stejně jako standardní farmakoterapii, pouze je nutno k charakteru účinku přistupovat z jiného pohledu. Proto byl vypracován protokol pěti hlavních kategorií nežádoucích účinků biologické léčby, znázorněný na obr. 2.
Nový princip a mechanismus účinku, který biologická léčba přinesla, si našel své odpůrce a skeptiky, hlavně z řad odborníků upozorňujících na možné nežádoucí účinky těchto agens. Ukázalo se, že vedlejší a nežádoucí účinky doprovázejí tuto léčbu stejně jako standardní farmakoterapii, pouze je nutno k charakteru účinku přistupovat z jiného pohledu. Proto byl vypracován protokol pěti hlavních kategorií nežádoucích účinků biologické léčby, znázorněný na obr. 2.
Závěr
Přes celosvětově znatelný posun v kvalitě a efektivitě léčby astmatu je stále patrné, že pro malou část pacientů představuje kontrola nad astmatem nedosažitelnou metu. V tomto prostoru se také rozhodne, zda nové terapeutické přístupy, mezi něž lze bezesporu řadit i biologickou léčbu, umožní kvalitativní posun v léčebných možnostech, nebo zda se zařadí do schématu optimalizace dávek a přístupu k individuálním pacientům. Zkušenosti s prvním dostupným lékem, stejně tak jako výsledky klinického hodnocení dalších kandidátů praktického použití, poukazují na nezbytnost dobré fenotypizace pacientů před léčbou. Tyto maximálně standardizované přístupy k identifikaci vhodných pacientů odrážejí komplexnost biologické a imunitní podstaty astmatu a prakticky podporují efektivní podání a farmakoekonomiku léčby těžkého astmatu. Obecně se odborníci shodují na několika bodech, které charakterizují biologickou léčbu astmatu:
-
přímo ovlivňuje receptory nebo mediátory, jejichž funkci nelze ovlivnit nízkomolekulárními léky,
-
obvykle vykazuje vysokou specifitu k cílové struktuře, čímž je schopna ovlivnit spuštění kaskády zprostředkovaných dějů a funkcí
-
projevuje tendenci k blokádě pouze jednoho děje,
-
vzhledem k vyšším finančním nárokům je určena převážně pro těžké a závažné případy,
-
na základě biomarkerů lze identifikovat vhodné pacienty,
-
podává se subkutánně či intravenózně,
-
vyžaduje správné určení fenotypu pacientů před léčbou.
Seznam použité literatury
- [1] Sedlák V, Koblížek V. Určování fenotypu astmatu ve výzkumu a klinické praxi. Medicína pro praxi, speciální vydání: 1–12.
- [2] Wang YH, Angkasekwinai P, Lu N, et al. IL-25 augments type 2 immune responses by enhancing the expansion and functions of TSLP-DC-activated Th2 memory cells. J Exp Med 2007; 204: 1837–1847.
- [3] Barnes PJ. Immunology of asthma and chronic obstructive pulmonary disease. Nat Rev Immunol 2008; 8: 183–192.
- [4] Kay AB. The role of T lymphocytes in asthma. Chem Immunol Allergy 2006; 91: 59–75.
- [5] Hammad H, Smits HH, Ratajczak C, et al. Monocyte-derived dendritic cells exposed to Der p 1 allergen enhance the recruitment of Th2 cells: major involvement of the chemokines TARC/CCL17 and MDC/CCL22. Eur Cytokine Netw 2003; 14: 219–228.
- [6] Ito T, Wang YH, Duramad O, et al. TSLP-activated dendritic cells induce an inflammatory T helper type 2 cell responce through OX40 ligand. J Exp Med 2005; 202: 1213–1223.
- [7] Lee JH, Yu HH, Wang LC, et al. The levels of CD4+CD25+ regulatory T cells in paediatric patients with allergic rhinitis and bronchial asthma. Clin Exp Immunol 2007; 148: 53–63.
- [8] Holgate S, Casale T, Wenzel S, et al. The anti-inflammatory effects of omalizumab confirm the central role of IgE in allergic inflammation. J Allergy Clin Immunol 2005; 115: 459–465.
- [9] MacGlashan Jr DW, Bochner BS, Adelman DC, et al. Down-regulation of FceRI expression on human basophils during in vivo treatment of atopic patients with anti-IgE antibody. J Immunol 1997; 158: 1438–1445.
- [10] Lin H, Boesel KM, Griffith DT, et al. Omalizumab rapidly decreases nasal allergic response and FceRI on basophils. J Allergy clin Immunol 2004; 113: 297–302.
- [11] Humbles AA, Lloyd CM, McMillan SJ, et al. A critical role for eosinophils in allergic airways remodeling. Science 2004; 305: 1776–1779.
- [12] Djukanovic R, Wilson SJ, Kraft M, et al. Effects of treatment with anti-immunoglobulin E antibody omalizumab on airway inflammation in allergic asthma. Am J Respir Crit Care Med 2004; 170: 583–593.
- [13] Fahy JV. Anti-IgE. Lessons learned from effects on airway inflammation and asthma exacerbation. J Allergy Clin Immunol 2006; 117: 1230–1232.
- [14] Holgate ST, Djukanovic R, Casale T, Bousquet J. Anti-immunoglobulin E treatment with omalizumab in allergic disease: an update on anti-inflammatory activity and clinical efficacy. Clin Exp Allergy 2005; 35: 408–416.
- [15] Bousquet J, Cabreta P, Bekman N, et al. The effect of treatment with omalizumab, an anti-IgE antibody, on asthma exacerbations and emergency medical visitors in patients with severe persistent asthma. Allergy 2005; 60: 302–328.
- [16] Bousquet J, Rabe K, Humbert M, et al. Predicting and evaluating response to omalizumab in patients with severe allergic asthma. Respir Med 2007; 101: 1483–1492.
- [17] Avila PC. Does anti-IgE therapy help in asthma? Efficacy and controversies. Annu Rev Med 2007; 58: 185–203.
- [18] Molimard M, de Blay F, Didier A, Le Gros V. Effectiveness of omalizumab (Xolair®) in the first patients treated in real-life practise in France. Respir Med 2008; 102: 71–76.
- [19] Curtiss FR. Omalizumab and other new drug therapies occupy a small sace in asthma disease management. J Manag Care Pharm 2009; 15: 289–293.
- [20] Pesko LJ. Omalizumab has a place in therapy for asthma disease management. Manag Care Pharm 2009; 15: 284–88.
- [21] Casale TB, Stokes J. Anti-IgE therapy: Clinical utility beyond asthma. J Allergy Clin Immunol 2009; 123: 770–771.
- [22] Holgate S, Buhl R., Bousquet J, et al. The use of omalizumab in the treatment of severe allergic asthma: A clinical experience update. Respir Med 2009; 103: 1098–1113.
- [23] Bousquet J, Chiron R, Humbert M. Biologics in asthma: difficulties and drawbacks. Expert Opin Biol Ther 2008; 8: 1921–1928.
- [24] Wenzel S, Wilbraham D, Fuller R, et al. Effect of an interleukin-4 variant on late phase astmatic response to allergen challenge in asthmatic patients: results of two phase 2a studies. Lancet 2007; 370: 1422–1431.
- [25] Gevaert P, Lang- Loidolt D, Lackner A, et al. Nasal IL-5 levels determine the response to anti-IL-5 treatment in patients with nasal polyps. J Allergy Clin Immunol 2006; 118: 1133–1141.
- [26] Ploth SG, Simon HU, Darsow U, et al. Use of an anti-interleukin-5 antibody in the hypereosinophilic syndrome with eosinophilic dermatitis. N Engl J Med 2003; 349: 2334–2339.
- [27] Flood-Page P, Menzies-Gow A, Phipps S, et al. Anti-IL-5 treatment reduces deposition of ECM proteins in the bronchial subepithelial basement membrane of mild atopic asthmatics. J Clin Invest 2003; 112: 1029–1036.
- [28] Von Rensen EL, Stirling RG, Scheerens J, et al. Evidence for systemic rather than pulmonary effects of interleukin-5 administration in asthma. Thorax 2001; 56: 935–940.
- [29] Simon D, Braathen LR, Simon HU. Anti-interleukin-5 antibody therapy in eosinophilic deseases. Pathobiol 2005; 72: 287–292.
- [30] Leckie MJ, Ten Brinke A, Khan J, et al. Effects of an interleukin-5 blocking monoclonal antibody on eosinophils, airway hyper-responsiveness, and the late asthmatic response. Lancet 2000; 356: 2144–2148.
- [31] Flood-Page P, Swenson C, Faiferman I, et al. A study to evaluate safety and efficacy of mepolizumab in patients with moderate persistent asthma. Am J Respir Crit Care Med 2007; 176: 1062–1071.
- [32] Haldar P, Brightling CE, Hargadon B, et al. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med 2009; 360: 973–984.
- [33] Antoniu SA. Mepolizumab for difficult-to-control asthma with persistent sputum eosinophilia. Expert Opin Investig Drugs 2009; 18: 869–871.
- [34] Nair P, Pizzichini MM, Kjarsgaard M, et al. Mepolizumab for prednisone-dependent asthma with sputum eosinophilia. N Engl J Med 2009; 360: 985–993.
- [35] Wilson MS, Pesce JT, Ramalingam TR, et al. Suppression of murine allergic airway disease by IL-2: anti-IL-2 monoclonal antibody-induced regulatory T cells. J Immunol 2008; 181: 6942–6954.
- [36] Kon OM, Sihra BS, Loh LC, et al. The effects of an anti-CD4 monoclonal antibody, keliximab, on peripheral blood CD4+ T-cells in asthma. Eur Respir J 2001; 18: 45–52.
- [37] Kon OM, Sihra BS, Compton CH, et al. Randomised, dose-ranging, placebo-controlled study of chimeric antibody to CD4 (keliximab) in chronic severe asthma. Lancet 1998; 352: 1109–1113.
- [38] Berry MA, Hargadon B, Shalley M, et al. Evidence of a role of tumor necrosis factor a in refractory asthma. N Engl J Med 2006; 354: 697–708.
- [39] Howarth PH, Babu KS, Arshad HS, et al. Tumor necrosis factor (TNFa) as a novel therapeutic target in syptomatic corticosteroid dependent asthma. Thorax 2005; 60: 1012–1018.
- [40] Casale TB, Stokes JR. Immunomodulators for allergic respiratory disorders. J Allergy Clin Immunol 2008; 121: 331–333.
- [41] Dimov VV, Stokes JR, Casale TB. Immunomodulators in asthma therapy. Curr Allergy Asthma Rep 2009; 9: 475–483.