Biologická léčba psoriázy – současná doporučení
Psoriáza je chronické zánětlivé systémové onemocnění, které postihuje 2 % až 3 % populace. Závažná psoriáza výrazně omezuje kvalitu života nemocného, často je doprovázena dalšími systémovými zánětlivými nemocemi a může podstatně zkrátit průměrnou délku života. Nemocní proto potřebují dlouhodobou účinnou a přitom bezpečnou léčbu. V posledních letech se rozšířily naše terapeutické možnosti zavedením nové biologické léčby, která je zacílena na hlavní cytokiny účastnící se při vzniku psoriázy. Při výběru biologické terapie je třeba vycházet nejen ze závažnosti klinického obrazu a formy psoriázy, její předchozí léčby a průběhu, ale i přihlédnout k přítomnosti dalších souběžných nemocí, aby mohla být zvolena optimální individualizovaná léčba.
Úvod
Biologická léčba je moderní převratnou léčebnou metodou řady zánětlivých a onkologických nemocí. V roce 2002, resp. 2004, byla zahájena biologická léčba u nemocných s psoriatickou artritidou a posléze s psoriázou. Od té doby bylo publikováno nesmírné množství dat o této nové terapii, vycházejících z výsledků mezinárodních randomizovaných klinických studií, národních registrů, postmarketingových hlášení, různých klinických hodnocení a jednotlivých popisů případů. V posledních letech byly také vydány i různé národní a mezinárodní doporučené postupy pro biologickou léčbu psoriázy, některé z nich pak byly revidovány a doplněny, např. v letošním roce postupy německé a americké [1–5]. Všechna doporučení se shodují v tom, že biologická léčba je vhodná pouze pro závažná onemocnění, u kterých selhala standardní systémová terapie.
Indikace a kritéria k podání biologické léčby
Psoriáza je chronické zánětlivé systémové onemocnění, které postihuje 2 % až 3 % populace [6]. Závažná psoriáza výrazně omezuje kvalitu života nemocného, často je doprovázena dalšími systémovými zánětlivými nemocemi a může podstatně zkrátit průměrnou délku života. Nemocní proto potřebují dlouhodobou účinnou a přitom bezpečnou léčbu. Mírné formy onemocnění, které nepřesahují 5 % celkového kožního povrchu, lze léčit pouze lokálními přípravky, zatímco středně těžké a těžké formy vyžadují léčbu systémovou.
Jak můžeme zjistit, kdy je lupénka závažná? Hodnocení závažnosti onemocnění by mělo zahrnovat jak objektivní hodnocení závažnosti kožních změn, tak zohledňovat vliv na kvalitu života nemocného, ale také současně přítomnost přidružených onemocnění, tzv. komorbidit, a údaje o předchozím průběhu nemoci a účinku léčby. Nejrozšířenějším a obecně uznávaným objektivním hodnocením závažnosti kožních změn je PASI skóre (angl. Psoriasis Area and Severity Index; jeho hodnota se může pohybovat v rozmezí 0–72). PASI větší než 10 obvykle znamená závažné onemocnění, které vyžaduje hospitalizaci nebo použití systémové terapie. Kde nelze použít PASI (např. u pustulózní psoriázy), používá se hodnocení BSA (angl. Body Surface Area, hodnota 0–100 %, kdy 1 % znamená postižení v rozsahu 1 pacientovy ruky) a závažné onemocnění je definováno hodnotou přesahující 10 %. K hodnocení subjektivního vnímání kvality života se používá dotazník kvality života DLQI (angl. Dermatology Life Quality Index, rozmezí 0–30), kdy pro závažnost psoriázy svědčí DLQI hodnota vyšší než 10.
Kritériem pro podání biologik podle většiny dnešních doporučení je přítomnost závažné psoriázy, která je definována PASI ≥ 10 (nebo BSA ≥ 10 %, kde PASI nelze použít) a DLQI > 10. Výjimečně lze zvážit léčbu u pacientů s postižením způsobujícím značné funkční i psychické potíže, kdy nejsou splněna předcházející kritéria, jako je úporná psoriáza na dlaních a ploskách (tato léčba však nemusí být hrazena z prostředků zdravotních pojišťoven). Současně je třeba splnit další podmínky, které jsou podle britských doporučení takto vyjmenovány [3]:
I. Fototerapiea nebo jiná standardní systémová léčbab je kontraindikována nebo nemůže být použita vzhledem k předpokládanému vývoji vážné lékové toxicity.
II. Standardní systémová léčba není tolerována.
III. Standardní systémová léčba je neúčinná.
IV. Souběžná onemocnění předem vylučují možnost použití systémové léčby.
V. Závažná, nestabilní, život ohrožující psoriáza.
aFototerapie je nevhodná, když:
1. byl dosažen bezpečnostní limit (150–200 ošetření PUVA, 350 ošetření úzkopásmovým UVB zářením);
2. nedochází k dostatečnému účinku nebo dochází k rychlému návratu kožních změn;
3. v anamnéze je výskyt kožních nádorů nebo opakované spálení sluncem;
4. fototerapie není tolerována, zejména u pacientů s fototypem I;
5. fototerapie není dostupná.
bStandardní systémová léčba je definována jako podávání cyklosporinu v dávce 2,5–5 mg/kg/den, methotrexátu v dávce 15–25 mg týdně či acitretinu v dávce 25–50 mg/den po dostatečně dlouhou dobu, aby se mohl projevit účinek léčby (většinou jde o 3 až 4 měsíce).
Jestliže pacient trpí závažnou psoriázou a současně psoriatickou artritidou, je biologická léčba indikována, jsou-li splněna kritéria revmatologických a dermatologických společností a současně selhala léčba methotrexátem nebo jeho podání není možné.
Definice terapeutických cílů
Po skončení indukční fáze léčby, tj. za 3–4 měsíce po zahájení léčby, je nutné zjistit, zda došlo ke zlepšení stavu nemocného. Adekvátní odpověď na léčbu je definována buď jako zlepšení výchozího PASI o 50 % a více (odpověď PASI50), nebo BSA tam, kde nelze použít PASI, a zlepšení o 5 a více bodů v indexu DLQI nebo jako snížení PASI o 75 % ve srovnání s výchozí hodnotou (odpověď PASI75) [3]. Podle nového doporučení vycházejícího z jednání evropských dermatologů v roce 2010 je stanoveno jako žádoucí cíl léčby dosažení PASI75. Dojde-li ke zlepšení o méně než 50 %, je nutné léčbu pozměnit. Zlepší-li se PASI o více než 50 %, ale o méně než o 75 %, záleží na kvalitě života pacienta. Je-li DLQI horší než 5, to znamená, že dopad na kvalitu života je stále ještě značný, doporučuje se léčbu modifikovat stejně, jako když nedojde k 50% zlepšení PASI. Úpravou léčby se rozumí zvýšení dávky nebo zkrácení intervalu léčby či přidání standardního léku či změna biologika [7].
Biologická léčba chronické ložiskové psoriázy
V současné době jsou k biologické léčbě chronické ložiskové psoriázy schváleny 4 preparáty, které ovlivňují cytokiny účastnící se v patogenezi psoriázy viz tab. 1. Jde o 3 přípravky působící proti faktoru nekrotizujícího tumory (TNF). TNF-α α je prozánětlivý cytokin produkovaný mnoha buňkami včetně keratinocytů. Hraje hlavní roli v patogenezi psoriázy, psoriatické artritidy a řady jiných nemocí. TNF je uvolňován z buněk jako solubilní cytokin (sTNF) po odštěpení ze svého prekurzoru vázaného na povrch buňky (transmembránový TNF). Oba TNF jsou biologicky aktivní a váží se na dva odlišné receptory: TNF receptor 1 (TNFR1, p55) a TNF receptor 2 (TNFR2, 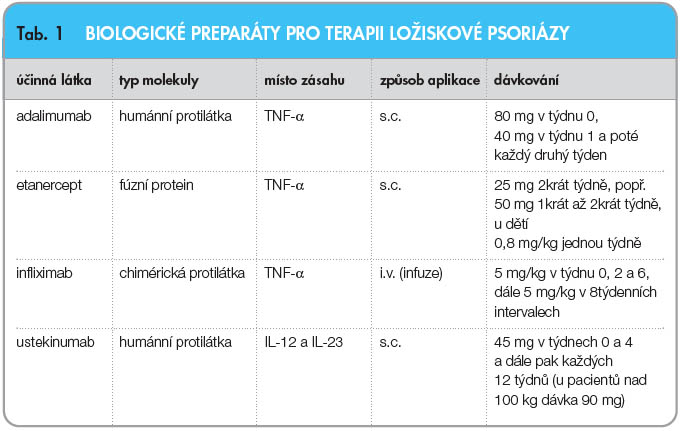 p75). V současné době existují dvě schválené skupiny biologických přípravků zacílených na TNF: anti-TNF monoklonální protilátky (adalimumab a infliximab) a solubilní TNF receptory (etanercept). Infliximab představuje chimérickou humánní-myší monoklonální protilátku, adalimumab je plně humánní. Etanercept je fúzní protein skládající se z dimeru extracelulárních částí lidského TNF receptoru 2 (p75) fúzovaného s Fc doménou lidského IgG1.
p75). V současné době existují dvě schválené skupiny biologických přípravků zacílených na TNF: anti-TNF monoklonální protilátky (adalimumab a infliximab) a solubilní TNF receptory (etanercept). Infliximab představuje chimérickou humánní-myší monoklonální protilátku, adalimumab je plně humánní. Etanercept je fúzní protein skládající se z dimeru extracelulárních částí lidského TNF receptoru 2 (p75) fúzovaného s Fc doménou lidského IgG1.
Všechny tři přípravky specificky váží jak solubilní, tak transmembránové formy TNF, ale existují mezi nimi významné rozdíly ve farmakokinetice, imunogenicitě a mechanismech účinku, které jsou pravděpodobně zodpovědné za pozorované rozdíly v profilech účinnosti a nežádoucích účinků [3].
Dalšími cytokiny jsou interleukiny (IL) 12 a 23, které jsou secernovány aktivovanými dendritickými buňkami a sdílejí společnou proteinovou podjednotku p40. Pro psoriázu je významné, že IL-12 aktivuje Th1 buňky a jejich produkci TNF-α , interferonu α a IL-2, zatímco IL-23 má hlavní roli ve vývoji Th17 buněk, které produkují IL-17, IL-22 a TNF-α . Ustekinumab je plně humánní IgG1α monoklonální protilátka, která působí jako inhibitor interleukinů navázáním s vysokou afinitou a specificitou na proteinovou podjednotku p40 [8].
Tyto biologické přípravky jsou doporučeny k léčbě pacientů s těžkou ložiskovou psoriázou, která splňuje jmenovaná kritéria závažnosti onemocnění; anti-TNF přípravky jsou v současnosti schváleny i k léčbě psoriatické artritidy. Podle současných znalostí tuto terapii nelze doporučit u palmoplantární pustulózy, kdežto u pacientů s těžkou, invalidizující akropustulózou (acrodermatitis continua suppurativa), u kterých selhala standardní systémová terapie, mohou mít antagonisté TNF, popř. ustekinumab, dobrý účinek. Dále může být biologická léčba zvažována u pacientů s generalizovanou pustulózní psoriázou a u pacientů s psoriatickou erytrodermií [3, 9].
Terapie etanerceptem se zahajuje v dávce 25 mg 2krát týdně (popř. 50 mg 1krát až 2krát týdně) a odpověď onemocnění má být hodnocena za 3–4 měsíce, přitom k vzestupu účinnosti může docházet i poté (až za 24 týdnů). Pacienti se zavedenou léčbou etanerceptem v dávce 25 mg dvakrát týdně mohou přejít na dávkování 50 mg jednou týdně, jelikož oba tyto dávkovací režimy jsou vzhledem k účinnosti ekvivalentní [4]. Etanercept je také doporučen k léčbě těžké psoriázy u dětí ve věku od 8 let, když jsou splněna stanovená kritéria závažnosti onemocnění, a léčba se podává v dávce 0,8 mg/kg jednou týdně.
Terapie infliximabem se zahajuje dávkou 5 mg/kg v týdnu 0, 2 a 6 a odpověď onemocnění by měla být hodnocena po 3 měsících. Při dostatečné odpovědi na léčbu by měly být podány následné infuze (5 mg/kg) v osmitýdenních intervalech k udržení kontroly onemocnění.
Adalimumab se podává v dávce 80 mg podkožně v týdnu 0, 40 mg v týdnu 1 a poté každý druhý týden, léčebná odpověď onemocnění má být hodnocena za 3–4 měsíce.
Ustekinumab je podáván pacientům s hmotností do 100 kg v dávce 45 mg subkutánně v týdnech 0 a 4 a dále pak každých 12 týdnů (u pacientů s tělesnou hmotností nad 100 kg je dávka 45 mg rovněž účinná, ale dávka 90 mg je účinnější). Odpověď onemocnění má být hodnocena za 3–4 měsíce.
Podle nástupu účinku se rozlišují biologika rychle působící (adalimumab, infliximab a ustekinumab) a pomalu působící (etanercept). Léčba etanerceptem, adalimumabem a ustekinumabem může být přerušena bez rizika nového vzplanutí onemocnění, někdy při opakovaném zahájení terapie může být účinnost nižší. Pouze terapie infliximabem by se neměla přerušovat, protože hrozí rozvoj infuzních reakcí a zhoršení odezvy při pokračování léčby.
Za určitých klinických okolností může být methotrexát doporučen jako souběžná medikace, např. jestliže má pacient přidruženou artropatii nebo pro zlepšení účinku či k omezení vzniku protilátek proti léčivu. V současné době ale není dostatek důkazů pro doporučení kombinace s jinými standardními léky nebo s fototerapií, i když v praxi se mnohdy takové kombinace podávají, aby se zvýšila účinnost biologické terapie [10].
Biologická terapie a riziko infekce
Vzhledem k tomu, že dosud nejsou zcela známa rizika a bezpečnostní data dlouhodobé biologické léčby, je nutné sledovat všechny nežádoucí účinky nejlépe podle údajů získaných z národních registrů. Ve studiích se ukazuje, že běžné infekce jsou při léčbě časté, ale celkové počty nejsou vyšší než při podávání placeba. Hrozí ale vznik vážných virových, bakteriálních a mykotických infekcí, především granulomatózních, protože TNF hraje klíčovou úlohu při tvorbě granulomu. Proto je třeba zejména v prvních měsících léčby myslet na možnost vzniku latentní či aktivní TBC. Riziko může být vyšší u monoklonálních protilátek (infliximab a adalimumab) ve srovnání s etanerceptem. Infekce je často atypická a ve více než 50 % případů má extrapulmonální lokalizaci [11].
Pohled na možné vyšetřovací metody TBC při biologické léčbě není dosud jednotný. RTG hrudníku a tuberkulinový kožní test (Mantoux II test) je přednostním screeningovým vyšetřením u pacientů, kteří nejsou léčeni imunosupresivy. Dostupné jsou také testy uvolňování interferonu gama (IGRA, angl. interferon gamma release assay), zejména stanovení quantiferonu (QT), které se osvědčily jako vhodné testy k identifikaci latentní tuberkulózy právě u pacientů, kteří byli léčeni imunosupresivy nebo byli v minulosti vakcinováni, kde tuberkulinový test nemusí být validní.
Všichni pacienti musí mít vyloučenu tuberkulózu před zahájením terapie, proto je třeba provést tuberkulinový test, QT, RTG hrudníku a odebrat pečlivou anamnézu z hlediska výskytu a kontaktu s TBC. Stanovení quantiferonu by mělo být zopakováno po 3 měsících terapie a po prvním roce léčby a RTG hrudníku zkontrolován po prvním roce léčby. Pokud je některý z testů pozitivní, což může být známkou latentní tuberkulózy, je nutné podávat isoniazid v délce 6 měsíců a biologickou léčbu je možné zahájit až po 1–2 měsících antituberkulózní léčby.
Na riziko vzniku TBC je třeba myslet nejen během biologické léčby, ale i po skončení léčby až do celkové doby 6 měsíců. Pokud vznikne aktivní TBC během biologické léčby, doporučuje se terapii ukončit. Po zhojení TBC a skončení léčby antituberkulotiky je možné v indikovaném případě znovu podat biologickou léčbu [3, 12, 13].
V praxi požadovaná vyšetření však musí v některých centrech provádět sám dermatolog, stejně jako předepisování a monitorování doporučené antituberkulózní léčby, často se liší i postupy jednotlivých pneumologů.
Biologická léčba je kontraindikována i při jiných aktivních infekcích a nedoporučuje se ani očkování živými a oslabenými vakcínami. Léčba antagonisty TNF se dále podle současných doporučení nemá podat u chronických nosičů hepatitidy B vzhledem k možnému riziku reaktivace. U nosičů viru hepatitidy C by se anti-TNF terapie mohla zahájit za předpokladu, že budou náležitě vyšetřeni a monitorováni v průběhu terapie [3, 4, 14].
Po celou dobu léčení je třeba myslet na možnost rozvoje rozličných infekcí a je nutné věnovat pozornost příznakům, jako je zvýšená teplota, únavnost, pokles hmotnosti, noční pocení, kašel, bolest na hrudi, dušnost aj. Pacienti by měli být varováni před rizikem infekce i jinými bakteriemi (např. rodu Salmonella a Listeria), neměli by jíst či pít syrové nebo jen částečně uvařené masné či mléčné výrobky, nepasterizované mléko, měli by důkladně omývat zeleninu a ovoce. Během léčby se doporučuje každoroční očkování proti chřipce a očkování proti pneumokokům [3].
Další rizika při biologické léčbě
Terapie antagonisty TNF se nedoporučuje u pacientů se závažným srdečním selháním (NYHA třída III a IV). Při kompenzovaném srdečním selhání (NYHA třída I a II) by měl být před léčbou proveden echokardiogram a při ejekční frakci s hodnotami nižšími než 50 % by se terapie antagonisty TNF neměla podávat. Léčba by měla být ukončena při nástupu nových symptomů nebo zhoršení dříve existujícího srdečního selhání [15].
Anti-TNF terapie se také nemůže používat u pacientů s demyelinizačním onemocněním. Jestliže se během léčení vyvinou neurologické symptomy naznačující možnost demyelinizace (např. parestezie, poruchy vidění, zmatenost, sfinkterové poruchy, poruchy rovnováhy a chůze, paréza n. facialis), je nutné léčbu přerušit a pacient by měl být podrobně vyšetřen neurologem.
Protože se objevují varování před možným vyšším výskytem některých maligních onemocnění při biologické léčbě, terapie by se dále neměla podávat u pacientů s anamnézou současného nebo nedávného nádorového onemocnění, vyjma situace, kdy byla malignita zjištěna a léčena před více než 5 lety anebo jestliže je vysoká pravděpodobnost vyléčení (např. nemelanomové kožní nádory) [16].
Proto doporučená vyšetření před zahájením a k monitorování léčby zahrnují pečlivou anamnézu, klinické vyšetření, RTG plic, laboratorní vyšetření (krevní obraz, moč, biochemie, QT, HIV, antinukleární protilátky). Je třeba zjistit jiné souběžné nemoci, vyloučit hrozící srdeční selhání, demyelinizační onemocnění, chronické infekce včetně latentní tuberkulózy, hepatitidy a AIDS, malignity, provést komplexní dermatologické vyšetření k vyloučení nádorů kůže, včetně melanomu, vyšetření uzlin a případné hepatosplenomegalie. Současně je nutné zhodnotit závažnost kožního postižení (PASI, BSA, DLQI) a pátrat po kloubních potížích.
Závěr
Rozvoj moderní biologické léčby v posledních letech nám umožnil prohloubit si znalosti o závažné psoriáze a jiných často sdružených zánětlivých chorobách a současně nám umožňuje podávat mnohem účinnější cílenou léčbu pacientům se závažnou lupénkou či psoriatickou artritidou. Protože jde o finančně velmi nákladnou terapii, mohou ji vést pouze erudovaní dermatologové v centrech biologické léčby a předpis by měl být vázán na zavedení příslušných údajů do národního registru pro biologickou léčbu psoriázy. V naší republice je od letošního roku zmodernizován registr BIOREP, jehož cílem je evidovat pacienty s biologickou léčbou psoriázy a získat dlouhodobá data o účinnosti a bezpečnosti léčby.
Výběr biologického léku by měl vždy vycházet z klinické potřeby, pečlivého zhodnocení rizik a přínosu každého přípravku, je třeba zvážit nejen závažnost psoriázy, její klinickou formu, zkušenosti s předchozí léčbou a průběhem nemoci, ale také přítomnost souběžných nemocí v každém individuálním případě.
Seznam použité literatury
- [1] Menter A, Gottlieb A, Feldman SR, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics. J Am Acad Dermatol 2008; 58: 826–850.
- [2] Menter A, Korman NJ, Elmets CA, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 6. Guidelines of care for the treatment of psoriasis and psoriatic arthritis: Case-based presentations and evidence-based conclusions. J Am Acad Dermatol 2011; Feb 7, [Epub ahead of print].
- [3] Smith CH, Anstey AV, Barker JN, et al. British Association of Dermatologists' guidelines for biologic interventions for psoriasis 2009. Br J Dermatol 2009; 161: 987–1019.
- [4] Pathirana D, Ormerod AD, Saiag P, et al. European S3-guidelines on the systemic treatment of psoriasis vulgaris. J Eur Acad Dermatol 2009; 23: 1–70.
- [5] Nast A, Boehncke WH, Mrowietz U. Leitlinie zur Therapie der Psoriasis vulgaris update 2011; http: //www.awmf.org/uploads/tx_szleitlinien/013-001l_S3_Psoriasis_vulgaris_Therapie_01.pdf
- [6] Nestle FO, Kaplan DH, Barker J. Psoriasis. N Engl J Med 2009; 361: 496–509.
- [7] Mrowietz U, Kragballe K, Reich K, et al. Definition of treatment goals for moderate to severe psoriasis: a European consensus. Arch Dermatol Res 2011; 303: 1–10.
- [8] van de Kerkhof PC. Novel biologic therapies in development targeting IL-12/IL-23. J Eur Acad Dermatol 2010; 24 (suppl. 6): 5–9.
- [9] Santos-Juanes J, Coto-Segura P, Mas-Vidal A, Galache-Osuna C. Ustekinumab induces rapid clearing of erythrodermic psoriasis after failure of antitumour necrosis factor therapies. Br J Dermatol 2010; 162: 1144–1146.
- [10] Mrowietz U, Kragballe K, Nast A, Reich K. Strategies for improving the quality of care in psoriasis with the use of treatment goals – a report on an implementation meeting 2011; 25 (suppl. 3): 1–13.
- [11] Hernandez Cruz B, Cetner AS, Jordan JE, et al. Tuberculosis in the age of biologic therapy. J Am Acad Dermatol 2008; 59: 363–380.
- [12] Vencovský J a výbor České revmatologické společnosti. Bezpečnost biologické léčby – doporučení České revmatologické společnosti. Čes Revmatol 2009; 17: 146–160.
- [13] http: //www.pneumologie.cz/zapisy/2005/sekce-TBC-20051201.php
- [14] Papp KA, et al. Canadian Guidelines for the Management of Plaque Psoriasis. 2009; Jun, http: //www.dermatology.ca/guidelines/cdnpsoriasisguidelines.pdf
- [15] Danila MI, Patkar NM, Curtis JR, et al. Biologics and heart failure in rheumatoid arthritis: are we any wiser? Curr Opin Rheumatol 2008; 20: 327–333.
- [16] http: //www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm174474.htm