Biosimilární přípravky v diabetologii
Souhrn:
Adamíková A. Biosimilární přípravky v diabetologii. Remedia 2019; 29: 213–215.
Biosimilární přípravky jsou biologické produkty, které jsou vysoce podobné referenčním lékům a klinicky se od nich významně neodlišují. Mohou být použity ve stejné indikaci jako referenční léky, s nimiž mají stejné účinky. Biosimilárních léčiv je celá řada, v diabetologii se jedná hlavně o inzuliny. Prvním biosimilárním inzulinem v České republice je přípravek Abasaglar (glargin), který byl schválen Evropskou lékovou agenturou již v roce 2014 a je bez komplikací používán. Zdravotní systémy hledají cesty ke snížení nákladů na terapii. Cena biosimilárních inzulinů může být až o 30 % nižší než cena originálních přípravků. Kromě inzulinu glargin a lispro se připravují i další biosimilární inzuliny, např. inzulin aspart. Nezbytné je poučení lékaře i pacienta.
Summary:
Adamikova A. Biosimilar products in diabetology. Remedia 2019; 29: 213–215.
Biosimilar products are biological products which are similar to a high degree and which do not have significant clinical differences with respect to reference medicinal drugs. They can be used for the same indication as those reference drugs which have the same effects. A whole line of biosimilar drugs exists; in diabetology, this involves mainly various insulins. The first biosimilar insulin in the Czech Republic is Abasaglar insulin (glargine) which was approved by the European Medicines Agency already in 2014 and since then has been used without any complications. Health systems are seeking ways of reducing the costs of the therapy. The price of biosimilar insulins can be lower by 30% compared to the price of the original medicinal drug. Besides glargine and lispro, other biosimilar insulins are in a stage of preparation, e.g., insulin aspart. It is essential that both the physician and the patient are instructed and advised.
Key words: biosimilar insulins, glargine, lispro, costs of therapy
Úvod
V poslední době se vedle originálních léků objevují v praxi biologické léky, které se svým účinkem podobají referenčním lékům a jsou označovány jako biosimilární léčivé přípravky. Biosimilars jsou kopie biologického léku s podobností, účinností a bezpečností doloženými klinickými studiemi. Mohou být použity ve stejné indikaci jako referenční lék, s nímž mají i stejný mechanismus účinku. Jedná se o proteinové molekuly získávané biotechnologickým postupem a dle toho se mohou vyskytnout drobné odchylky v molekule. Nedají se označit za generika, protože vycházejí nikoliv z chemické, ale z biologické (proteinové) struktury referenčního léku. Složitá struktura neumožní zcela identické kopie. Biosimilárních léčiv je celá řada, např. k léčbě revmatoidní artritidy biosimilární infliximab, etanercept, adalimumab, v onkologické léčbě trastuzumab; dále somatotropin, erytropoetin a také inzuliny. V roce 2018 bylo vytvořeno mezinárodní doporučení Consensus based recommendations for the use of biosimilars to treat rheumatological diseases. Cílem biosimilární léčby je snížení nákladů na terapii, dle dokumentu až o 30 %. V dokumentu se uvádí, že v revmatologii jsou důkazy, že jeden přechod z originálního léku na biosimilární (tzv. switch) je bezpečný a nedochází ke ztrátě účinnosti, není však zatím prokázáno, jak je to u opakovaných switchů, a není známo, zda jsou bezpečné přechody mezi biosimilárními léky. Zdůrazňuje se nutnost správně informovat pacienta o této terapii a potřeba jeho souhlasu [1].
Odhadem 100 milionů lidí na světě potřebuje k léčbě inzulin. Pro pacienty s diabetes mellitus 1. typu je inzulin nezbytný pro přežití, ale také je potřebný pro optimální kompenzaci u řady diabetiků 2. typu. Zhruba 96 % objemu trhu s inzuliny obhospodařují tři největší společnosti [2]. Zdravotní systémy hledají cesty ke snížení nákladů na terapii. Po ukončení platnosti licence přichází možnost výroby molekuly biosimilárního inzulinu rozdílnou technologií za vzniku podobné, ale ne zcela stejné molekuly inzulinu, rozdíl může být např. v prostorovém uspořádání [3]. Cílem je, aby rozdíly byly minimální. Výhodou jsou zkušenosti s výrobou biologických léků. Před klinickým zavedením je nezbytné ověřit pomocí studií účinnost a bezpečnost těchto přípravků. Mimo jiné i vazby k inzulinovému receptoru a receptoru pro IGF1 (insulin like growth factor 1), vlivy na buněčný růst. Odhadovaná cena biosimilárního inzulinu představuje 60−80 % ceny originálních inzulinů. První molekuly biosimilárního inzulinu byly připraveny společnostmi Eli Lilly/Boehringer Ingelheim – inzulin Abasaglar, biosimilární inzulin glargin, schválený Evropskou lékovou agenturou (EMA) již v roce 2014.
Biosimilární inzulin glargin
Abasaglar (LY2963016) je biosimilární
inzulin glargin se sekvencí aminokyselin identickou
s referenčním produktem Lantus. Evropská léková agentura
schválila Abasaglar jako biosimilární přípravek v roce
2014; ve Spojených státech amerických byl LY2963016 schválen
jako Basaglar v roce 2015. Abasaglar oproti inzulinu Lantus
prošel pěti studiemi fáze I a dvěma klinickými
hodnoceními fáze III. ELEMENT 1 a ELEMENT 2 [4] byly
randomizované kontrolované studie fáze III, které srovnávaly
účinnost a bezpečnost LY2963016 oproti inzulinu Lantus
u diabetiků 1. a 2. typu. Primárním výstupem
v obou studiích byla změna hodnot glykovaného hemoglobinu
(HbA1c) od vstupu do 24. týdne studie.
Non inferiorita LY2963016 oproti glarginu byla prokázána
v obou léčebných skupinách s podobným snížením
hodnoty HbA1c ve 24. týdnu (ELEMENT 1: −0,35 %
vs. −0,46 % [95% interval spolehlivosti, CI, −0,002,
0,219], p > 0,05,
a ELEMENT 2: −1,29 % vs. −1,34 % [95%
CI −0,070, 0,175], p > 0,05),
tabulka 1.
LY2963016 a Lantus měly podobný bezpečnostní profil
a imunogenitu [5,6]. Inzulin Abasaglar je v České
republice v praxi dlouhodobě používán bez komplikací.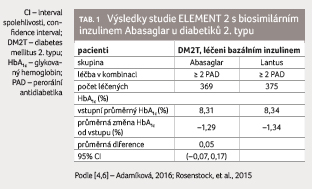
Biosimilární inzulin lispro
SAR34234, biosimilární inzulin lispro (Sanofi) 100 j/ml, prošel rovněž klinickým hodnocením fáze III (SORELLA 1). V USA je registrován pod názvem Admelog. Také v Evropské unii je registrován v lahvičkách, zásobnících i v předplněném peru. Do České republiky se nedováží [7].
Biosimilární inzulin glargin
Biosimilární inzulin glargin MK 1293 (Merck) byl také zkoušen ve studiích fáze III u diabetiků 1. a 2. typu [8]. Prokázala se non inferiorita dle změny hodnot HbA1c MK 1293 oproti inzulinu Lantus. MK 1293 má stejnou sekvenci aminokyselin jako přípravek Lantus. Tento přípravek u nás není v klinické praxi k dispozici.
Perspektivy
Dle tiskových zpráv [9] americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) v USA připravuje změnu v březnu 2020. Inzulinová medikace bude regulována jako biologické léky a tím se otevře cesta pro biosimilární přípravky a zvýší se konkurenční možnosti. Dalším plánovaným biosimilárním inzulinem kromě glarginu a lispro je inzulin aspart. Otázky inzulinů řeší pracovní skupina American Diabetes Association s názvem Insulin Access and Affordability Working Group, která připravila doporučení a strategii ke zlepšení [10].
Závěr
Biosimilární inzuliny jsou biologické produkty vysoce podobné referenčním přípravkům s klinicky nevýznamnými odlišnostmi. Lze je použít ve stejné indikaci jako referenční přípravky. Zásadní výhodou je jejich nižší cena. Z hlediska praxe je potřeba důkladné poučení lékaře a pacienta o tomto typu léčby.
Seznam použité literatury
- [1] Kay J, Schoels MM, Dörner T, et al. Consensus‑based recommendations for the use of biosimilars to treat rheumatological diseases. Dostupné na: http://dx.doi.org/10.1136/annrheumdis‑2017‑211937
- [2] Gotham D, Barber MJ, Hill A. Production cost and potential prices for biosimilars of human insulin and insulin analogues. BMJ Glob Health 2018; 3: e000850.
- [3] Škrha J. Biosimilární inzuliny – nové možnosti v léčbě diabetu. Dostupné na: http://wp.interna‑cz.eu
- [4] Adamíková A. Rekombinantní inzulin glargin (Abasaglar). Farmakoterapie 2016; 12: 164−167.
- [5] Blevins TC, Dahl D, Rosenstock J, et al. Efficacy and safety of LY2963016 insulin glargine compared with insulin glargine (Lantus®) in patients with type 1 diabetes in randomized controlled trial: the ELEMENT 1 study. Diab Obes Metab 2015; 17: 726−733.
- [6] Rosenstock J, Hollander P, Bhargava A, et al. Similar efficacy and safety of LY2963016 insulin glargine and insulin glargine (Lantus®) in patients with type 2 diabetes who were insulin‑naïve or previously treated with insulin glargine: a randomized, double‑blind controlled trial (the ELEMENT 2 study). Diab Obes Metab 2015; 17: 734−741.
- [7] Clinical Trials.gov. Comparison of SAR342434 to Humalog as the rapid acting insulin in adults patients with type 1 diabetes mellitus also using insulin glargine (SORELLA 1); https://clinicaltrials.gov./ct2/show/NCT02273180 [accessed 28 July 2016].
- [8] GaBI Online. Insulin biosimilar meets primary endpoint in phase III studies; www.gabionline.net/Biosimilars/Research/Insulin‑biosimilar‑meets‑primary‑endpoint‑in‑phase III‑studies [accessed 28 July 2016].
- [9] Hargreaves B. Insulin biosimilars? US FDA readies market for entry. Dostupné na: https://www.biopharma‑reporter.com/Article/2018/12/12/Insulin‑biosimilars‑US‑FDA‑readies‑market‑for‑entry
- [10] Cefalu WT, Dawes DE, Gavlak G, et al. Insulin Access and Affordability Working Groups: Conclusions and recommendations. Diabetes Care 2018; 41: 1299−1311.