Chemoprevence nádorů gastrointestinálního traktu
Chemoprevence je nutriční nebo farmakologická intervence směřující k zablokování či oddálení vzniku nádorového onemocnění. Experimentální i klinická data ukazují, že existuje řada látek potenciálně využitelných k tomuto účelu v oblasti gastrointestinálního traktu. Kyselina acetylsalicylová a nesteroidní antirevmatika včetně koxibů patří mezi látky s nejsilnějším chemopreventivním účinkem zejména v tlustém střevě a v jícnu. Hlavní překážkou jejich použití k celoplošné chemoprevenci je gastrointestinální a kardiovaskulární toxicita. Vysoké riziko kolorektálního karcinomu u nemocných s idiopatickým střevním zánětem v tlustém střevě je významně potlačeno dlouhodobým užíváním mesalazinu. Riziko nádorové transformace metaplastického epitelu v Barrettově jícnu snižuje podávání inhibitorů protonové pumpy a/nebo kyseliny acetylsalicylové. Navzdory významné roli helikobakterové infekce v patogenezi žaludečního karcinomu není plošná eradikace vhodnou metodou ke snížení rizika vzniku tohoto nádoru. Praktické využití chemoprevence gastrointestinálních nádorů je v současnosti vyhrazeno pro osoby ve vysokém riziku; běžná populace je odkázána na screeningové metody nebo na zvýšenou konzumaci potravin obsahujících potenciálně chemopreventivní, avšak netoxické substance.
Úvod a definice
Nádory zažívacího traktu patří spolu s rakovinou plic a gynekologickými tumory k nejčastějším malignitám. Jejich výskyt je vysoký především v ekonomicky rozvinutých oblastech světa, a jsou proto považovány za onemocnění „civilizační". Etiologie gastrointestinálních nádorů je multifaktoriální a patogenetické mechanismy spočívají ve vzájemné interakci faktorů vnitřních (tj. genetických) a faktorů zevních, mezi nimiž je hlavní role přisuzována dietě. Druh stravy a stravovací zvyklosti mohou do značné míry spolurozhodovat o tom, který typ nádoru je v dané oblasti dominantní (např. karcinom žaludku v Japonsku, kolorektální karcinom ve většině zemí Evropy a v severní Americe apod.) [1].
Poznání patogenetických mechanismů kancerogeneze umožňuje nejen vývoj nových a účinnějších terapeutických postupů, ale ukazuje i cesty vedoucí k prevenci nádorových onemocnění. Z praktického hlediska jsou pro účinnou profylaxi podstatné dva faktory. Za prvé, prevence je snazší, trvá-li vývoj malignity dostatečně dlouhou dobu. Příkladem takového onemocnění je kolorektální karcinom (KRK). Postupná přeměna adenomů – prekurzorů většiny střevních karcinomů – probíhá v časovém horizontu 10 i více let v závislosti na velikosti adenomu a stupni buněčné dysplazie [2].
Druhým faktorem je možnost odhalit přednádorová stadia nebo nádory v iniciální fázi vyšetřením s vysokou senzitivitou a specificitou. V tomto ohledu se nádory zažívacího traktu diametrálně liší. Na jednom pólu stojí opět kolorektální karcinom, kde je detekce premaligních stavů nebo časné malignity poměrně jednoduchá. Opačným příkladem je karcinom slinivky břišní, jehož časné odhalení je téměř vždy dílem náhody, a proto i prognóza nemocných je velmi špatná.
Podstatou chemoprevence je snaha o zablokování, zvrácení či oddálení vzniku nádoru, dříve než tento proces dosáhne stadia invazivně rostoucí malignity. K tomuto účelu mohou být použita jak dietní, resp. nutriční opatření, tak i farmakologická intervence.
Chemoprofylaktická opatření se mohou uplatnit v kterékoli fázi vývoje nádoru a mohou být aplikována buďto samostatně, nebo jako součást jiných forem nádorové prevence, např. screeningu. Je pochopitelné, že na potenciálně chemopreventivní látky jsou kladeny vysoké nároky zejména z hlediska bezpečnosti. Využití konkrétní chemoprofylaxe v klinické praxi pak závisí na poměru rizika a přínosu. U osob ve vysokém riziku nádoru lze akceptovat vyšší riziko vedlejších účinků chemoprofylaxe a naopak. Možnosti profylaktické léčby musí být rovněž posouzeny v kontextu dostupnosti screeningu a jeho účinnosti u dané malignity.
Možnosti chemoprevence v gastrointestinálním traktu
Chemoprofylaktická opatření lze rozdělit do dvou základních skupin. Nespecifická profylaxe zahrnuje preparáty s necíleným protinádorovým působením v celém organismu. Patří sem většina látek nutriční povahy, ale i některá farmaka, např. nesteroidní antirevmatika (NSA), některé hormony nebo statiny. Tyto látky působí na univerzální kroky kancerogeneze, a mohou tak, alespoň teoreticky, snižovat riziko vzniku většího počtu nádorů současně.
Druhou skupinu tvoří látky (většinou léčiva), které cíleně potlačují vznik nebo vývoj konkrétní prekancerózy. Typickým příkladem takového léčiva jsou inhibitory protonové pumpy u nemocných s Barrettovým jícnem.
Jako primární označujeme chemoprevenci osob v průměrném riziku nádorového onemocnění. Jedná se tedy o intervenci v běžné populaci, zpravidla u osob bez rodinné anamnézy nádoru a bez nádoru v předchorobí. Sekundární chemoprevence se uplatňuje u jedinců se zvýšeným rizikem nádoru, obvykle v přítomnosti některé prekancerózy. Týká se např. nemocných s kolorektálními adenomy, Barrettovým jícnem apod. Terciární chemoprevence spočívá v prevenci recidivy nádoru u nemocných s anamnézou malignity v předchorobí.
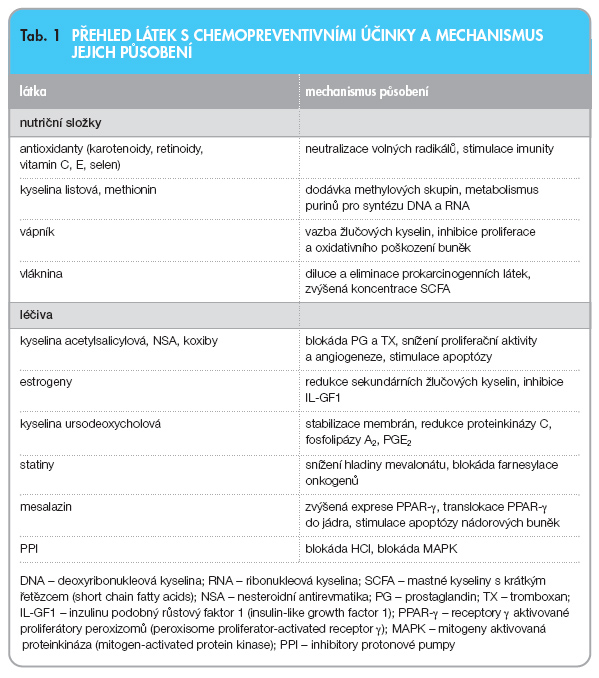
V chemoprevenci gastrointestinálních nádorů byla testována celá řada látek nutriční i farmakologické povahy (tab. 1).
Nutriční složky jsou, vedle své přirozené dietní formy, často k dispozici také jako farmaka s přesně definovaným množstvím příslušné látky.
Přehled látek s chemopreventivním účinkem v GIT
Antioxidanty, kyselina listová a methionin
Mezi antioxidanty patří např. karotenoidy, retinoidy, kyselina askorbová (vitamin C), a-tokoferol (vitamin E) nebo selen. Tyto látky, obsažené především v čerstvém ovoci a zelenině, ale i v jiných potravinách (např. v čaji), mohou neutralizovat volné kyslíkové radikály, a omezovat tak jejich škodlivý vliv na DNA. Existují také práce dokladující, že chemopreventivní efekt antioxidantů je zčásti zprostředkován stimulací imunitního systému [3]. Hodnocení efektu antioxidantů je komplikováno přítomností řady dalších bioaktivních látek ve stejných potravinách a nemožností odlišit jejich vliv na proces kancerogeneze.
Prospektivní i retrospektivní studie s antioxidanty přinášejí rozporuplné výsledky [4], a proto je v současnosti nelze považovat za spolehlivé chemopreventivní substance. Přesto, potenciální benefit a prakticky nulová toxicita umožňují jejich široké využití v rámci celopopulačních dietních doporučení.
Kyselina listová a methionin jsou donátory methylových skupin nezbytných pro syntézu DNA a expresi genů. Jejich deficit tak může vést k defektní syntéze, k poruchám při opravách nebo při transkripci řetězce DNA. Nedostatek kyseliny listové způsobuje masivní inkorporaci uracilu do lidské DNA a chromozomové změny podobné těm, které vznikají například působením radiace [5]. Řada klinických studií se zabývala účinky kyseliny listové na kancerogenezi v tlustém střevě, vesměs s příznivými výsledky. Epidemiologické studie prokazují snížený výskyt KRK u osob s vysokým příjmem folátu a naopak vyšší riziko karcinomu při jeho nedostatku [6, 7]. Zejména vysoké dávky kyseliny listové (> 400 mg denně) podávané po dobu 15 let a déle významně snižují pravděpodobnost vzniku KRK. Suplementace folátu ve vysoké dávce má větší význam u osob s rodinnou anamnézou KRK, kde mohou vysoké dávky (> 400 mg denně) snížit riziko KRK až o 50 % [8].
Vápník
Chemopreventivní efekt podávání vápníku se uplatňuje především v tlustém střevě a je zprostředkován dvěma mechanismy. Jedním je vazba kalcia se žlučovými a mastnými kyselinami ve střevě a následné omezení mutagenního potenciálu žlučových kyselin v tračníku. Vedle toho má vápník i přímý protinádorový efekt (např. snižuje výskyt mutací k-ras genu, stabilizuje buněčné membrány a moduluje aktivitu proteinkinázy C) [4]. Epidemiologické studie prokazují vesměs mírný protektivní vliv suplementace kalcia na proces kancerogeneze ve střevě. Podle některých údajů se efekt vápníku liší v závislosti na lokalizaci nádoru. Kombinovaná analýza dvou rozsáhlých studií, do nichž byli zařazeni zdravotničtí pracovníci, odhalila signifikantní pokles KRK v levé, nikoli však v pravé polovině tračníku [9]. V rozsáhlé metaanalýze 24 observačních studií prokázal Bergsma-Kadijk mírný a statisticky nevýznamný efekt vápníku na vznik KRK [10].
Dietní vláknina
Vláknina byla vždy považována za jeden z nejvýznamnějších protektivních faktorů při vzniku kolorektálního karcinomu. Většina retrospektivních epidemiologických studií ukazuje na příznivý efekt zvýšeného příjmu dietní vlákniny jak na snížení výskytu karcinomu tračníku a rekta, tak i na incidenci adenomových polypů [11, 12]. Předpokládá se, že zvýšený příjem vlákniny zvětšuje objem stolice, vede k diluci karcinogenně působících látek, urychluje jejich eliminaci, a snižuje tak dobu jejich působení ve střevě. U zvířat snižuje celulóza a hemicelulóza hladinu některých bakteriálních enzymů ve střevě a brání aktivaci karcinogenů. Rovněž mastné kyseliny s krátkým řetězcem, které vznikají fermentací vlákniny v tlustém střevě, mohou snížením pH příznivě ovlivnit kancerogenezi ve střevě [2].
Přes řadu uvedených možností je třeba říci, že přesný mechanismus, kterým vláknina přispívá ke snížení rizika vzniku KRK, není dosud znám. Existují rozdíly mezi stravou obsahující převážně zeleninu, ovoce anebo vlákninu cereálního původu. Zdá se, že větší přínos má zelenina ve srovnání s ovocem, eventuálně pouze určitý druh ovoce či zeleniny. Uvedené skutečnosti vedly American Institute for Cancer Research ke konstatování, že „zvýšený příjem vlákniny pravděpodobně snižuje riziko vzniku kolorektálního karcinomu" [13].
Protektivní efekt vlákniny na kancerogenezi v tlustém střevě vyžaduje nepochybně velmi dlouhou expozici. Například výsledky intervenčních studií, kde byl sledován výskyt adenomů po 3–4 letech, neprokázaly žádný protektivní účinek zvýšeného příjmu vlákniny na recidivu kolorektálních adenomů [14, 15]. Dokonce ani metaanalýza, která zahrnula obrovský počet osob (více než 725 tisíc) sledovaných po dobu 6–20 let, jednoznačně nepotvrdila, že by vláknina byla nezávislým protektivním faktorem pro vznik KRK [16].
Statiny
Inhibitory 3-hydroxy-3-methylglutaryl-koenzym A (HMG-CoA) reduktázy neboli statiny jsou velmi rozšířená léčiva v primární a sekundární prevenci kardiovaskulárních (KV) onemocnění. Studie in vitro i experimentální práce na zvířatech vesměs prokazují jejich protinádorové působení, které je jakýmsi „vedlejším produktem" snížené syntézy mevalonátu v játrech a následné blokády farnesylace membránových proteinů [17]. Navzdory těmto teoretickým předpokladům nebyl dosud prokázán jednoznačný vliv statinů na snížení výskytu maligních onemocnění. Jedním z důvodů je např. skutečnost, že většina dat pochází ze studií, které nebyly designovány pro hodnocení chemopreventivního efektu statinů, ale pro sledování výskytu kardiovaskulárních onemocnění. Rozporuplné výsledky statinových studií lze demonstrovat dvěma příklady.
V tzv. PROSPER studii (Prospective Study of Pravastatin in the Elderly at Risk) byl sledován výskyt KV komplikací u více než 5800 mužů a žen ve věku 70–82 let, kteří užívali pravastatin v dávce 40 mg/den (nebo placebo) po dobu více než tři roky [18]. Ačkoli pravastatin vedl k signifikantnímu snížení KV onemocnění, frekvence malignit, a to zejména gastrointestinálních, byla v intervenované skupině zvýšena o 46 %. Úmrtnost na nádorová onemocnění tak ve sledované skupině kompletně eliminovala snížení mortality v důsledku cévních onemocnění.
Opačné výsledky přinesla studie případů a kontrol Poyntera a kol. [19]. Na téměř 4000 subjektech byl sledován výskyt kolorektálního karcinomu ve vztahu k užívání statinů i dalších potenciálně chemopreventivních látek. Autoři zjistili, že dlouhodobá expozice statinům (5 a více let) je spojena se snížením rizika vzniku KRK o 50 %. Tento efekt byl nezávislý na současném užívání NSA, příslušnosti k etnické skupině, míře fyzické aktivity, hladině cholesterolu, rodinné anamnéze KRK i množství konzumované zeleniny. Nebyl prokázán významný rozdíl mezi jednotlivými statiny, přičemž většina sledovaných osob užívala simvastatin nebo pravastatin.
Díky ubikvitérnímu efektu v organismu patří statiny k velmi nadějným a potenciálně široce použitelným chemopreventivním léčivům. Jejich příznivý účinek však bude nutno dále potvrdit ve studiích cíleně zaměřených na výskyt nádorových onemocnění.
Hormonální substituce
Epidemiologické studie naznačují možnost preventivního účinku hormonální substituční léčby estrogeny především na výskyt KRK. Předpokládaný mechanismus spočívá v přímé i nepřímé inhibici produkce sekundárních žlučových kyselin a v blokádě inzulin-like růstového faktoru I. Metaanalýza epidemiologických studií ukazuje přibližně 20% snížení výskytu KRK, přičemž efekt hormonální léčby postupně mizí po jejím ukončení [20]. Otázkou je však bezpečnost dlouhodobé hormonální substituce. Např. ve studii Women´s Health Initiative byla předčasně ukončena placebem kontrolovaná větev z důvodu zvýšeného výskytu mozkových příhod u žen užívajících kombinaci konjugovaného estrogenu a methylprogesteronu [21].
Kyselina acetylsalicylová a nesteroidní antirevmatika
Chemopreventivní účinky kyseliny acetylsalicylové a NSA se dostaly do popředí zájmu poté, co bylo zjištěno, že osoby užívající kyselinu acetylsalicylovou mají významně snížené riziko karcinomu tračníku a rekta [22]. Tato skutečnost byla opakovaně potvrzena v dalších, tzv. kohortových studiích, které prokázaly snížení rizika KRK při užívání kyseliny acetylsalicylové o 40 % [23, 24]. V randomizovaných studiích bylo zjištěno, že sulindak, další léčivo ze skupiny nesteroidních antirevmatik, a také celekoxib (selektivní inhibitor cyklooxygenázy 2) významně snižují počet a velikost adenomových polypů u nemocných s familiární polypózou (FAP) [25, 26].
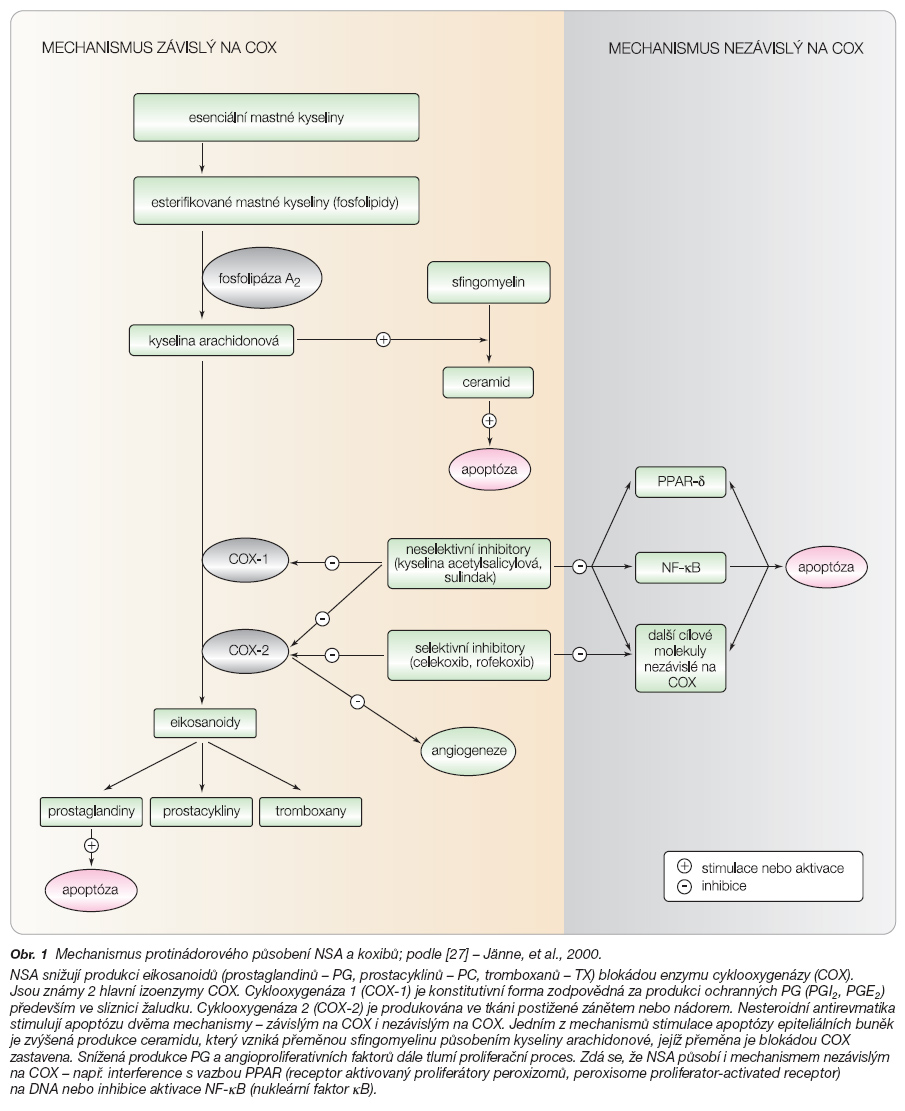
Mechanismus preventivního účinku NSA je komplexní, dosud ne zcela objasněný děj (obr. 1) [27].
NSA snižují produkci eikosanoidů (prostaglandinů – PG, prostacyklinů – PC, tromboxanů – TX) blokádou enzymu cyklooxygenázy (COX) [28]. Jsou známy 2 hlavní izoenzymy COX. Cyklo-oxygenáza 1 (COX-1) je konstitutivní forma zodpovědná za produkci ochranných PG (PGI2, PGE2) především ve sliznici žaludku. Cyklooxygenáza 2 (COX-2) je produkována ve tkáni postižené zánětem nebo nádorem, včetně raných stadií adenomových polypů. Inhibice COX-2 v laboratorních podmínkách potlačuje růst střevních nádorových buněk. Nesteroidní antirevmatika stimulují apoptózu epiteliálních buněk zvýšenou produkcí ceramidu, který vzniká přeměnou sfingomyelinu působením kyseliny arachidonové, jejíž přeměna je blokádou COX zastavena. Snížená produkce PG a angioproliferativních faktorů dále tlumí proliferační proces [29, 30]. Zdá se, že NSA působí i mechanismem nezávislým na COX – např. stimulací ligandů pro PPAR (receptory aktivované proliferátory peroxizomů, peroxisome proliferator-activated receptors) [31].
Praktické využití kyseliny acetylsalicylové a NSA (včetně koxibů) v chemoprevenci KRK i ostatních nádorů naráží na problém nežádoucích účinků. Preventivní efekt těchto léčiv stoupá s dávkou a délkou užívání, jak prokázal např. Chan a kol. [32]. Ke snížení rizika vzniku KRK o polovinu bylo nutno užívat alespoň 14 tablet kyseliny acetylsalicylové (325 mg) týdně po dobu 10 let. Současně se však ukázalo, že prevence 1–2 případů KRK je vykoupena až 8 případy závažného krvácení do GIT (na 10 000 pacientoroků). Jiným příkladem vedlejších účinků je kardiovaskulární toxicita koxibů, ale pravděpodobně i řady neselektivních NSA. Známý je případ rofekoxibu (selektivní inhibitor COX-2), který byl stažen z trhu poté, co byl zjištěn vyšší výskyt kardiovaskulárních příhod po 18 měsících jeho užívání ve studii zaměřené na prevenci kolorektálních adenomů (studie APPROVe) [33]. Toxicita kyseliny acetylsalicylové a NSA při dlouhodobém podávání je tak hlavním důvodem toho, že jejich chemopreventivní efekt lze v současnosti využít pouze u osob ve vysokém riziku KRK.
Na základě Steinbachovy práce [25] publikované v roce 2000 schválil FDA (Food and Drug Administration) celekoxib jako doplňkové léčivo v terapii nemocných s FAP. V uvedené studii byl zjištěn 28% úbytek adenomových polypů ve střevě při užívání celekoxibu v dávce 400 mg 2krát denně po dobu 6 měsíců. Jiní autoři navíc prokázali příznivý efekt celekoxibu na redukci duodenálních adenomů [34]. Otázkou zůstává použití koxibů u nemocných s Lynchovým syndromem.
Ubikvitérní působení kyseliny acetylsalicylové a NSA opravňuje k domněnce, že tato léčiva mají protinádorový efekt i v ostatních částech GIT. Zvyšující se frekvence a vysoká mortalita karcinomu jícnu jsou důvodem zkoumání chemopreventivního efektu NSA v této lokalizaci. Corley v rozsáhlé metaanalýze ukázal, že užívání kyseliny acetylsalicylové i NSA snižuje celkový výskyt karcinomu jícnu o 43 % [35]. Podrobnější analýza potvrdila vyšší účinnost kyseliny acetylsalicylové oproti ostatním NSA (snížení rizika o 50 %, resp. 25 %) a závislost na dávce (46 % vs. 18 % pro frekventní, resp. intermitentní uživatele léčiva). Profylaktický efekt kyseliny acetylsalicylové a NSA byl prokázán jak u spinocelulárního karcinomu (snížení rizika o 42 %), tak u adenokarcinomu jícnu (snížení o 33 %). Ačkoli v současné době neexistuje jednoznačné doporučení, rizika spojená s dlouhodobým užíváním vyšších dávek kyseliny acetylsalicylové a NSA připouštějí jejich použití pouze u vysokorizikových pacientů.
Mesalazin
Kolorektální karcinom je závažnou komplikací mnohaletého průběhu ulcerózní kolitidy (UC). Přibližně 15 % nemocných s extenzivním postižením tračníku zemře na KRK, přičemž vznik této komplikace je posunut o 1–2 dekády dříve oproti sporadické formě KRK. Dalším podstatným rozdílem mezi sporadickým a UC asociovaným KRK je absence adenomových polypů u nemocných s idiopatickým střevním zánětem a nízká efektivita preventivního dispenzárního programu. Tato skutečnost komplikuje časnou diagnostiku kolorektální neoplazie v terénu UC, a poskytuje tak větší prostor pro uplatnění chemopreventivních opatření [36].
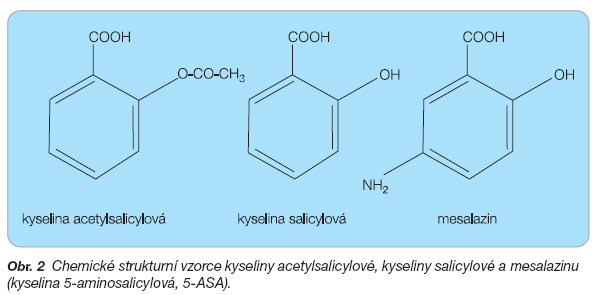
Mesalazin (kyselina 5-aminosalicylová, 5-ASA) patří od poloviny 70. let k základním léčivům v terapii idiopatických střevních zánětů, zejména ulcerózní kolitidy. Podobně jako kyselina acetylsalicylová (kyselina acetylosalicylová) je odvozen od základní molekuly kyseliny salicylové (obr. 2).
Experimentální práce prokazují protinádorové účinky mesalazinu, které jsou pravděpodobně zprostředkovány působením na PPAR-g [37]. Přestože výsledky klinických studií nejsou zcela jednoznačné, převažuje v současné době názor, že 5-ASA disponuje významným chemopreventivním účinkem. V rozsáhlé metaanalýze Eadenová zjistila, že kumulativní riziko vzniku KRK u nemocných s UC dosahuje 2 % po 10 letech, 8 % po 20 letech a 18 % po 30 letech trvání střevního zánětu [38]. Naproti tomu frekvence KRK v dánské populaci, kde pravidelně užívá mesalazin minimálně 70 % nemocných, byla ve stejných intervalech pouze 0,2 %, 1,4 % a 3,1 % [39]. Podle Eadenové je dostatečný preventivní efekt zajištěn dávkou 1,2 g/den a vyšší. Také recentní velká epidemiologická studie [40] stejně jako rozsáhlá metaanalýza [41] potvrzují snížení rizika KRK v terénu UC o 40–50 %. Mesalazin tak představuje ideální chemopreventivní léčivo u nemocných s IBD postihující tlusté střevo (ulcerózní kolitida a Crohnova kolitida). Vzhledem k minimálnímu výskytu vedlejších účinků je bezpečnějším léčivem než NSA, nabízí se tedy otázka jeho využití i v chemoprevenci KRK u dalších skupin nemocných.
Inhibitory protonové pumpy
Adenokarcinom jícnu patří mezi nádory s nejrychleji stoupajícím výskytem v posledních 30–40 letech. Ačkoli jednoznačný důvod tohoto nárůstu není znám, není pochyb o přímé souvislosti mezi přítomností intestinální metaplazie na sliznici distálního jícnu (Barrettův jícen, BJ) a vznikem adenokarcinomu v této lokalizaci. Podle různých údajů zvyšuje Barrettův jícen riziko adenokarcinomu až 40krát oproti běžné populaci. Enterální metaplazie je považována za přímý důsledek abnormálního kyselého refluxu do jícnu, který je působením inhibitorů protonové pumpy (PPI) významně potlačen [42].
Ačkoli existují zprávy o regresi BJ při léčbě PPI, spolehlivá data dokladující tento efekt nejsou v současné době k dispozici. Naproti tomu dlouhodobé sledování nemocných s BJ ukazuje příznivý vliv PPI na vývoj dysplastických změn. El Serag a kol. prokázali až 75% snížení výskytu dysplazie v terénu BJ u osob léčených PPI oproti pacientům neléčeným [43].
Eradikace infekce Helicobacter pylori
Etiologický vztah mezi helikobakterovou infekcí a nádory žaludku byl prokázán jak v případě žaludečního MALT-lymfomu, tak u karcinomu žaludku. Zatímco však eradikace H. pylori u nemocných s MALT-lymfomem může vést k plné regresi onemocnění, vztah mezi infekčním agens a karcinomem je podstatně komplexnější.
Experimentální i epidemiologická data jednoznačně dosvědčují, že H. pylori je nejběžnějším rizikovým faktorem pro žaludeční karcinom (intestinální i difuzní typ). Současně je však známo, že riziko vzniku nádoru souvisí s virulencí mikroba, a navíc je ovlivněno faktory na straně hostitelského organismu [44]. Jednoznačně bylo sice prokázáno, že eradikační léčba brání vzniku preneoplastických změn (atrofická gastritida, intestinální metaplazie), avšak data jednoznačně podporující plošnou eradikaci jako preventivní opatření před rozvojem karcinomu žaludku neexistují. Rizika spojená s plošnou eradikací a také skutečnost, že naprostá většina infikovaných osob nikdy karcinomem neonemocní, tak stále omezují profylaktické indikace eradikační léčby na následující situace: atrofická gastritida, stav po resekci žaludku pro karcinom, diagnóza karcinomu žaludku u příbuzného prvého stupně [45].
Reálné možnosti chemoprevence gastrointestinálních nádorů v současnosti
Chemoprevence je potenciálně atraktivní metoda ke snížení výskytu nádorů zažívacího traktu a mortality na tyto nádory. Tato onemocnění patří k nejčastějším malignitám a všeobecně je jejich prognóza velmi špatná. Reálné možnosti současné chemoprevence jsou nicméně z mnoha důvodů omezené.
Některé látky s prokázaným chemopreventivním efektem disponují současně řadou toxických účinků. Komplikace spojené s jejich dlouhodobým podáváním (krátkodobé užívání neřeší problém chemoprevence) mohou být závažné a leckdy více než eliminují přínos vzniklý snížením nebo oddálením vzniku nádoru. Tato skutečnost se týká především kyseliny acetylsalicylové a NSA včetně koxibů.
Potvrzení preventivního účinku léčiva či jiné látky vyžaduje v ideálním případě důkaz v podobě snížení výskytu či úmrtnosti na dané onemocnění. Kancerogeneze většiny nádorů v gastrointestinálním traktu je dlouhodobým procesem a provedení studie na dostatečně velkém souboru po dostatečně dlouhou dobu je v mnoha případech nereálné.
Skutečná potřeba chemoprevence závisí také na dalších možnostech prevence daného onemocnění, např. na možnosti screeningu. V případě kolorektálního karcinomu je potenciál screeningu v populaci s průměrným rizikem značný a dosud nevyužitý. V praxi existují v současnosti pouze dvě reálné indikace k chemoprevenci KRK. První z nich je familiární polypóza, kde je podávání celekoxibu v dávce 2krát 400 mg doplňkem standardní chirurgické léčby (kolektomie nebo proktokolektomie). U nemocných po resekci tlustého střeva je celekoxib určen k inhibici progrese a maligní transformace duodenálních adenomů. Druhou indikací je dlouhodobý průběh ulcerózní kolitidy (nebo Crohnovy kolitidy). Zde je mesalazin v dávce > 1,2 g/den nejen součástí udržovací léčby IBD, ale plní i funkci chemopreventivní.
U nádorů jícnu je situace odlišná v závislosti na histologickém typu. Běžnou praxí je dlouhodobé podávání inhibitorů protonové pumpy nemocným s Barrettovým jícnem – tento postup pravděpodobně snižuje riziko vzniku dysplazie a adenokarcinomu jícnu. Alternativním postupem může být kombinace kyseliny acetylsalicylové a PPI (PPI blokují toxické účinky kyseliny acetylsalicylové v horní části trávicí trubice), toto schéma je zkoumáno v probíhajících studiích. Naproti tomu účinná a bezpečná chemoprevence spinocelulárního karcinomu jícnu není v současné době známa.
Přestože v patogenezi karcinomu žaludku hraje helikobakterová infekce zásadní roli, není plošná eradikace v současnosti akceptovatelnou metodou prevence. Preventivní eradikace je omezena pouze na nemocné s anamnézou karcinomu žaludku (příklad terciární chemoprevence) a na příbuzné pacientů s tímto onemocněním.
Chemoprevence karcinomu pankreatu, ač potenciálně velmi žádoucí s ohledem na vysokou mortalitu, nebyla dosud adekvátně studována. Pouze experimentální a epidemiologická data ukazují, že nejen kyselina acetylsalicylová, NSA a koxiby, ale též somatostatinová analoga, selektivní modulátory estrogenového receptoru nebo antiandrogenní látky mohou snižovat riziko výskytu této malignity.
Je zřejmé, že chemoprevence gastrointestinálních nádorů je omezena na několik konkrétních situací, které představují vysoké riziko vzniku malignity. Pro osoby v průměrném nebo mírně zvýšeném riziku neexistuje v současnosti prokazatelně účinný a současně bezpečný způsob, jak zabránit vzniku nádorového onemocnění. Tato část populace je tedy odkázána na obecná dietní a režimová opatření, která lze označit termínem zdravý životní styl. Dostatečný příjem vlákniny, ovoce a zeleniny, přiměřený kalorický příjem, rozumná konzumace alkoholu, nekuřáctví a dostatečná fyzická aktivita sice nezaručí stoprocentní ochranu před nádorem, ale jsou prosta vedlejších účinků, a navíc snižují riziko i mnoha dalších závažných onemocnění.
Článek vznikl s podporou Výzkumného záměru MSM 0021620808.
Seznam použité literatury
- [1] Feldman M, Friedman LS, Sleizenger MH. Gastrointestinal and liver disease. New York, 1998.
- [2] Bresalier RS, Kim YS. Malignant neoplasms of the large intestin: In: Sleizenger M.H., Fordtran J.S. Gastrointestinal and liver disease. New York 1998: 1906–1942.
- [3] Surh YJ, Ferguson LR. Dietary and medicinal antimutagens and anticancerogens: molecular mechanisms and chemopreventive potential – highlights of a symposium. Mutat Res 2003; 523–524: 1–8.
- [4] Hawk ET, Umar A, Viner JL. Colorectal cancer chemoprevention – an overview of the science. Gastroenterology 2004; 126: 1423–1447.
- [5] Ames BN. Micronutrient deficiensies. A major cause of DNA damage. Ann N Y Acad Sci 1999; 889: 87–106.
- [6] Giovannucci E, Rimm EB, Ascherio A, et al. Alcohol, low-methionin-low-folate diets and risk of colon cancer in men. J Natl Cancer Inst 1995; 87: 265–273.
- [7] Giovannucci E, Stampfer MJ, Colditz GA, et al. Multivitamin use, folate, and colon cancer in women in the Nurse´s Health Study. Ann Intern Med 1998; 129: 517–524.
- [8] Fuch CS, Willett WC, Golditz GA, et al. The influence of folate and multivitamin use on the familial risk of colon cancer in women. Cancer Epidemiol Biomark Prev 2002; 11: 227–234.
- [9] Wu K, Willett WC, Fuchs CS, et al. Calcium in-take and risk of colon cancer in women and men. J Natl Cancer Inst 2002; 94: 437–946.
- [10] Bergsma-Kadijk JA, van ´t Veer P, Kampman E, et al. Calcium does not protect against colorectal neoplasia. Epidemiology 1996; 7: 590–597.
- [11] Giovannucci E, Stampfer MJ, Colditz G, et al. Relationship of diet to risk of colorectal adenoma in men. J Natl Cancer Inst 1992; 84: 91–98.
- [12] Howe GR, Benitu E, Castelleto R, et al. Dietary intake of fiber and decreased risk of cancer of the colon and rectum: Evidence from combined analysis of 13 case-control studies. J Natl Cancer Inst 1992; 84: 1887–1892.
- [13] World Cancer Research Fund (WCRF) Panel (Potter J.D., Chair). Diet, nutrition, and the prevention of cancer: a global perspective. Washington (DC): WCRF/American Institute of Cancer Research, 1997.
- [14] Alberts DS, Martinez ME, Roe DJ, et al. Lack of effect of high-fiber cereal supplement on the recurrence of colorectal adenomas. N Engl J Med 2000; 342: 1156–1162.
- [15] Schatzkin A, Lanza E, Corle D. Lack of effect of a low-fat, high-fiber diet on the recurrence of colorectal adenomas. N Engl J Med 2000; 342: 1149–1155.
- [16] Park Y, Hunter DJ, Spiegelman D, et al. Dietary fiber intake and risk of colorectal cancer. JAMA 2005; 294: 2849–2857.
- [17] Gbelcová H, Leníček M, Zelenka J, et al. Protinádorové účinky statinů na experimentálním modelu lidského adenokarcinomu pankreatu. Čes a Slov Gastroent a Hepatol 2007; 61: 75–81.
- [18] Stepherd J, Blauw GJ, Murphy MB, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet 2002; 360: 1623–1630.
- [19] Poynter JN, Gruber SB, Higgins PDR, et al. Statins and the risk of colorectal cancer. N Engl J Med 2005; 352: 2184–2192.
- [20] Grodstein F, Martinez ME, Platz EA, et al. Postmenopausal hormone use and risk for colorectal cancer and adenoma. Ann Intern Med 1998; 128: 705–712.
- [21] Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women´s Health Initiative randomized controlled trial. JAMA 2002; 288: 321–333.
- [22] Giovannucci E, Rimm EB, Stampfer MJ, et al. Aspirin use and the risk for colorectal cancer and adenoma in male health professionals. Ann Intern Med 1994; 121: 241–246.
- [23] Giovannucci E, Egan KM, Hunter DJ, et al. Aspirin and the risk of colorectal cancer in women. N Engl J Med 1995; 333: 609–614.
- [24] Labayle D, Fischer D, Vielh P, et al. Sulindac causes regression of rectal polyps in familial adenomatous polyposis. Gastroenterology 1991; 101: 635–639.
- [25] Steinbach G, Lynch PM, Phillips RKS, et al. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis. N Engl J Med 2000; 342: 1946–1952.
- [26] Taketo MM. Cyclooxygenase-2 inhibitors in tumorigenesis. J Natl Cancer Inst 1998; 90: 1529–1536.
- [27] Jänne PA, Mayer RJ. Chemoprevention of colorectal cancer. N Engl J Med 2000; 342: 1960–1968.
- [28] Sheng H, Shao J, Kirkland SC, et al. Inhibition of human colon cancer cell growth by selective inhibition of cyclooxygenase-2. J Clin Invest 1997; 99: 2254–2259.
- [29] Chau TA, Morin PJ, Vogelstein B, Kinzler KV. Mechanisms underlying nonsteroidal antiinflammatory drug-related apoptosis. Proc Natl Acad Sci USA 1998; 95: 681–686.
- [30] Ferrazoni M, La Vecchia C, D´Avanzo B, et al. Selected micronutrient intake and the risk of colorectal cancer. Br J Cancer 1994; 70: 1150–1155.
- [31] Lehmann JM, Lenhard JM, Oliver BB, et al. Peroxisome proliferator-activated receptors alpha and gamma are activated by indomethacin and other NSAID. J Biol Chem 1997; 272: 3406–3410.
- [32] Chan AT, Giovannucci EL, Meyerhardt JA, et al. Long-term use of aspirin and nonsteroidal anti-inflammatory drugs and risk of colorectal cancer. JAMA 2005; 294: 914–923.
- [33] Baron JA, Sandler RS, Bresalier RS, et al. A randomized trial of rofecoxib for the chemoprevention of colorectal adenomas. Gastroenterology 2006; 131: 1674–1682.
- [34] Philips RK, Wallace MH, Lynch PM, et al. A randomised, double blind, placebo controlled study of celecoxib, a selective cyclooxygenase 2 inhibitor, on duodena polyposis in familial adenomatous polyposis. Gut 2002; 50: 857–860.
- [35] Corley DA, Kerlikowski K, Verma R, Buffler P. Protective association of aspirin/NSAID and esophageal cancer. Gastroenterology 2003; 124: 47–56.
- [36] Itzkowitz SH, Harpaz N. Diagnosis and management of dysplasia in patients with inflammatory bowel disease. Gastroenterology 2004; 126: 1634–1648.
- [37] Stange EF. Review article: the effect of aminosalicylates and immunomodulation on cancer risk in inflammatory bowel disease. Aliment Pharmacol Ther 2006; 24 (Suppl. 3): 64–67.
- [38] Eaden J, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut 2001; 48: 526–535.
- [39] Munkholm P. Review article: The incidence and prevalence of colorectal cancer in inflammatory bowel disease. Aliment Pharmacol Ther 2003; 18: 1–5.
- [40] van Staa TP, Card T, Logan RF, Leufkens HGM. 5-Aminosalicylate use and colorectal cancer risk in inflammatory bowel disease: a large epidemiological study. Gut 2005; 54: 1573–1578.
- [41] Velayos FS, Terdiman JP, Walsh JM. Effect of 5-aminosalicylate use on colorectal cancer and dysplasia risk. A systematic review and meta-analysis of observational studies. Am J Gastroenterol 2005; 100: 1345–1353.
- [42] Leedham S, Jankowski J. The evidence base of proton pump inhibitor chemopreventive agents in Barrett´s esophagus – the good, the bad, and the flawed! Am J Gastroenterol 2007; 102: 21–23.
- [43] El Serag HB, Aguirre TV, Davis S, et al. Proton pump inhibitors are associated with reduced incidence of dysplasia in Barrett´s esophagus. Am J Gastroenterol 2004; 99: 1877–1883.
- [44] Helicobacter and Cancer Collaborative Group. Gastric cancer and Helicobacter pylori: a combined analysis of 12 case control studies nested within prospective cohorts. Gut 2001; 49: 347–353.
- [45] Malferthainer P, Megraud F, O´Morain C, et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht III consensus report. Gut 2007; 56: 772–781.