Chemoprevence u karcinomu prsu
Souhrn:
Krásenská M. Chemoprevence u karcinomu prsu. Remedia 2019; 29: 334–339.
Nejúčinnější metodou k omezení výskytu nádorových onemocnění je prevence jejich vzniku. Přepokládá se, že úpravou dietních návyků, změnou životního stylu (omezení alkoholu, kouření, stresu), udržováním normální tělesné hmotnosti a pravidelnou fyzickou aktivitou by bylo možné přispět k významnému snížení jejich prevalence. U karcinomu prsu se za jednu z účinných metod považuje chemoprevence. Efektivitu prokázaly antiestrogeny u žen s vysokým rizikem vzniku karcinomu prsu stanoveným na podkladě rodinné anamnézy nebo při přítomnosti tzv. prekurzorových lézí v prsu. Další látky již byly zkoumány v minulosti nebo jsou v současnosti předmětem klinického výzkumu.
Summary:
Krasenska M. Chemoprevention in breast cancer. Remedia 2019; 29: 334–339.
The most effective method to reduce the incidence of cancer is to prevent it. It is believed that by adjusting dietary habits, lifestyles changes (reducing alcohol, smoking, stress), maintaining normal body weight, and regular physical activity, its prevalence could be significantly reduced. In breast cancer, chemoprevention is considered one of the effective methods. Antiestrogens have shown efficacy in women with a high risk of developing breast cancer based on family history or the presence of precursor lesions in the breast. Other substances have already been investigated in the past or are currently under clinical research.
Key words: breast cancer, chemoprevention , tamoxifen, raloxifen, aromatase inhibitors.
Karcinom prsu je nejčastějším
zhoubným nádorovým onemocněním žen. Jeho incidence, tedy počet
nových případů na 100 000 obyvatel za rok,
ve vyspělých zemích narůstá (graf 1). Hlavními rizikovými faktory jsou ženské pohlaví
a věk. Nejčastěji onemocní ženy mezi 50. a 60. rokem
a jen výjimečně před 20. rokem života (graf 2). Běžné celoživotní riziko vzniku karcinomu prsu
v naší populaci se pohybuje kolem 8‒10 %. Vznik karcinomu
prsu u muže je vzácný [1].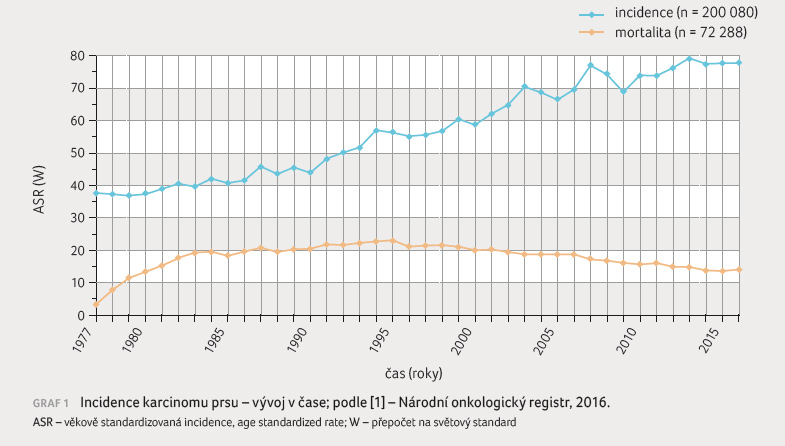
Kancerogeneze
Vznik nádoru (kancerogeneze) je
složitý mnohastupňový proces, během něhož se normální buňka
mění hromaděním řady klíčových genetických a epigenetických
mutací na buňku nádorovou. K těmto změnám dochází
vlivem kancerogenních podnětů (chemické kancerogeny, některé
viry, záněty, záření). Uvedené změny se zpravidla rozvíjejí
v řádu let. Proces kancerogeneze je možné zpomalit nebo
zastavit pouze v jeho iniciálních fázích (iniciace
a promoce) [2].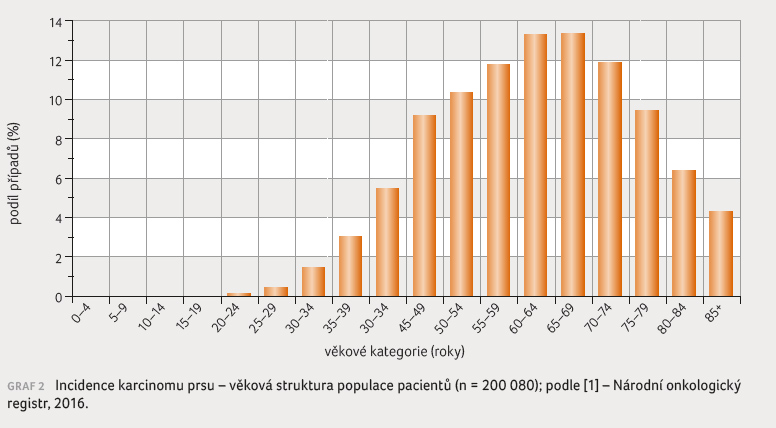
Rizikové faktory a stanovení rizika
Příčina vzniku karcinomu prsu není
ve většině případů jasná. Známe však některé faktory,
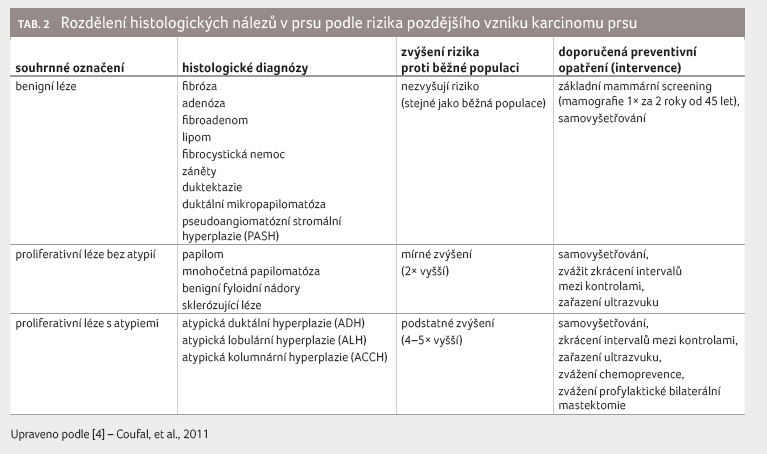
které riziko karcinomu prsu zvyšují [3], viz tabulku 1. K významnému nárůstu rizika dochází při
přítomnosti tzv. prekurzorových lézí v prsu (tab.
2) [4]. Přibližně 5‒10 % nádorových onemocnění
může být způsobeno dědičnou dispozicí. Mezi nejčastější
příčiny dědičné formy nádorů prsu patří mutace v genech
BRCA1 a BRCA2 (BReast CAncer). Nosičství mutace BRCA1 může
pro ženu představovat až 85% celoživotní riziko možnosti
onemocnět karcinomem prsu [5]. Pro odhad individuálního rizika
byly vyvinuty různé statistické modely, které však nemusejí být
použitelné pro jinou populaci, než pro kterou byly validovány
(například Gailův model [6] užívaný pro americkou populaci se
pro českou populaci neosvědčil). V České republice se u žen
bez prokázané mutace v genech spojených se zvýšeným
rizikem rozvoje nádorového onemocnění a s pozitivní
rodinnou anamnézou využívají tzv. Clausovy tabulky (nízké
riziko ≤ 10 %, středně zvýšené riziko 10‒20 %,
vysoké celoživotní riziko > 20 %) [5]. Ženy
s vysokým rizikem by měly být sledovány ve specializovaných
ambulancích.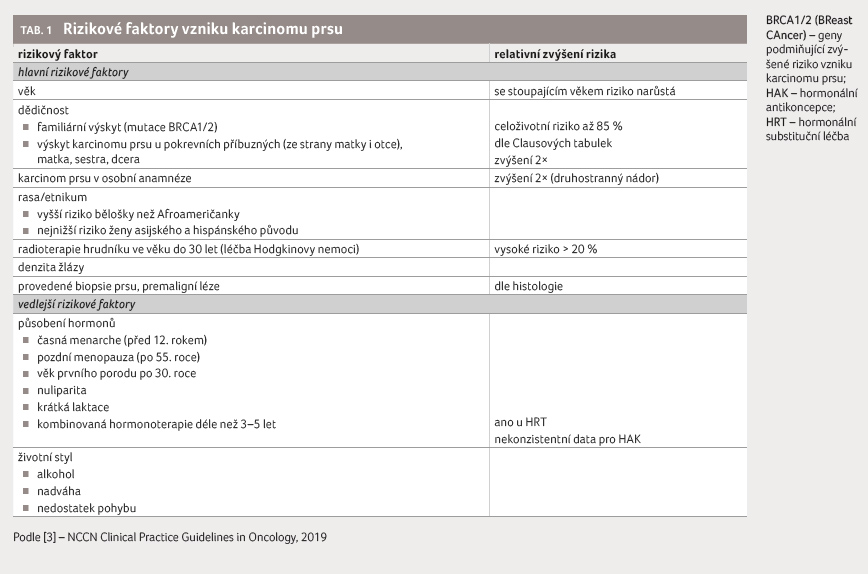
Efektivní možnosti redukce rizika ‒
chemoprevence
Za metody s prokázanou efektivitou na snížení rizika rozvoje karcinomu prsu se v současné době považují [3]:
- úprava životního stylu (omezení příjmu alkoholu, fyzická aktivita, redukce nadváhy)
- operace redukující riziko (profylaktická mastektomie – RRM – a/nebo profylaktická bilaterální salpingo ooforektomie, pouze u žen s průkazem zárodečné mutace genů vysokého rizika BRCA1, BRCA2)
- chemoprevence
Pojmem chemoprevence se označuje použití přirozených nebo syntetických látek s úmyslem zabránit vzniku nádoru, případně dosáhnout zpomalení nebo úplného zastavení kancerogeneze [7]. V prevenci karcinomu prsu byla v klinických studiích dobře zdokumentována efektivita tamoxifenu, raloxifenu a inhibitorů aromatázy anastrozolu a exemestanu.
Tamoxifen
Selektivní modulátor estrogenového receptoru (SERM) tamoxifen je účinný v adjuvantní léčbě časného karcinomu prsu a v terapii diseminovaného onemocnění. V retrospektivních analýzách studií s adjuvantním podáním tamoxifenu [8‒11] a v jejich metaanalýze provedené Early Breast Cancer Trialists’ Collaborative Group (EBCTCG) [12] pětileté podávání tamoxifenu ženám s karcinomem prsu s pozitivní nebo neznámou expresí estrogenového receptoru (ER) signifikantně redukovalo roční riziko kontralaterálního karcinomu o 41 % (poměr rizik [HR] 0,59). Tamoxifen byl následně zkoušen v několika studiích v prevenci invazivních a neinvazivních nádorových onemocnění prsu. Jeho podání je zatíženo rizikem vzniku závažných nežádoucích účinků.
Studie P 1 (NSABP Breast Cancer Prevention Trial)
Studie P 1 představovala randomizované, dvojitě zaslepené klinické hodnocení, které zkoumalo efektivitu tamoxifenu u 13 388 žen starších 60 let a dále u žen ve věku 35–59 let, jež měly vyšší pětileté kumulativní riziko karcinomu prsu (≥ 1,7 %) stanovené dle Gailova modelu, nebo s historií lobulárního karcinomu in situ (LCIS) [13]. Pacientkám byl podáván po dobu pěti let tamoxifen nebo placebo. Primárním cílovým ukazatelem studie byla incidence invazivního karcinomu prsu, sekundárními cílovými ukazateli incidence neinvazivního karcinomu prsu, mortalita na karcinom prsu a bezpečnost. Studie byla odslepena a první výsledky byly publikovány v roce 1998, následně asi třetina nemocných v placebové větvi podstoupila cross over a začala užívat tamoxifen [14]. V roce 2005 byla referována data sedmiletého sledování. Tamoxifen u žen ve věku 35 let a starších redukoval riziko vzniku invazivního karcinomu prsu o 49 % (po 7 letech o 43 %) [13]. Efektivita tamoxifenu byla konzistentní napříč všemi podskupinami nemocných, vysoce účinný byl zejména v podskupině nemocných s atypickou duktální hyperplazií (ADH), kde redukoval riziko vzniku invazivního karcinomu o 86 % při iniciální analýze (relativní riziko [RR] 0,14) a o 75 % při analýze sedmiletého sledování (RR 0,25). Dlouhodobě redukoval o 28 % riziko rozvoje benigních onemocnění prsu (RR 0,72) a biopsií prsu (redukce o 29 %), a to zejména u žen mladších 50 let [15]. Tamoxifen měl v této studii příznivý efekt na redukci rizika vzniku kostních fraktur (RR 0,81), nicméně dle očekávání byl pozorován vyšší výskyt invazivního endometriálního karcinomu ve skupině postmenopauzálních žen (RR 2,53) a vyšší výskyt plicní embolie zejména u žen ve věku 50 let a starších. Tamoxifen neprokázal signifikantní redukci mortality (RR 1,10) [13]. Analýza podskupin nemocných potvrdila významnou efektivitu tamoxifenu u pacientek s mutací BRCA2, u nichž bylo riziko karcinomu prsu ve srovnání s placebem sníženo o 62 % (RR 0,38). Tento efekt nebyl pozorován u žen s mutací BRCA1, což lze vysvětlit častějším výskytem karcinomů exprimujících ER u žen nosiček mutace BRCA2 [16]. Nicméně data jsou limitována malým počtem žen s mutací BRCA1/2 v tomto souboru. Žádná prospektivní studie zkoumající efektivitu tamoxifenu u nosiček mutace BRCA1/2 dosud provedena nebyla. Na základě výsledků této studie byl tamoxifen v roce 1998 doporučen americkým Úřadem pro kontrolu potravin a léčiv (FDA) pro redukci rizika rozvoje karcinomu prsu u žen se zvýšeným rizikem vzniku tohoto onemocnění.
Evropské studie
V Evropě byly provedeny celkem tři studie srovnávající efektivitu tamoxifenu s placebem v prevenci karcinomu prsu.
1. Royal Marsden Hospital ‒ studie zařazovala ženy ve věku 30–70 let, které měly zvýšené riziko vzniku karcinomu prsu na podkladě pozitivní rodinné anamnézy [17,18]. Postmenopauzální ženy mohly užívat hormonální substituční léčbu. Statisticky významný rozdíl ve frekvenci výskytu invazivního karcinomu prokázán nebyl [18]. Při analýze dvacetiletého sledování však byla v rameni s tamoxifenem signifikantně nižší incidence ER pozitivního karcinomu (HR 0,61; p = 0,005). Efekt byl patrný až v době, kdy pacientky již nebyly tamoxifenem aktivně léčeny [19].
2. Italská studie ‒ v této studii bylo randomizováno celkem 5 408 žen ve věku 35–70 let, které podstoupily dříve hysterektomii, často s bilaterální adnexektomií [20]. Uspořádání studie připouštělo souběžné podání hormonální léčby (HT). Podíl žen s vysokým rizikem pro vznik karcinomu prsu byl malý (pouze 13 % souboru). Signifikantní rozdíl ve výskytu karcinomu prsu v rameni s tamoxifenem a placebem nebyl pozorován, a to ani při delším mediánu sledování [20‒22]. Při analýze podskupin se však prokázal prospěch z tamoxifenu u žen vysokého rizika užívajících současně HT [22,23].
3. The first International Breast Cancer Intervention Study (IBIS 1) ‒ studie IBIS 1 randomizovala celkem 7 152 žen ve věku 35‒70 let se zvýšeným rizikem rozvoje karcinomu prsu [24]. Tamoxifen zde prokázal jak časnou redukci rizika invazivního karcinomu nebo duktálního karcinomu in situ (DCIS) o 32 % (95% interval spolehlivosti [CI] 8‒50; p = 0,13), přičemž větší prospěch z léčby měly mladší pacientky [25], tak v horizontu 10 let a delším (HR 0,72; 95% CI 0,58–0,91; p = 0,004) [26]. Tamoxifen byl spojen s častějším výskytem tromboembolické nemoci (poměr šancí [OR] 2,5; 95% CI 1,5–4,4; p = 0,001) [25].
Raloxifen
Raloxifen je selektivní modulátor estrogenového receptoru 2. generace. Má podobný antiestrogenní efekt jako tamoxifen, ale liší se profilem nežádoucích účinků. Výrazně méně stimuluje endometrium. V roce 2007 získal doporučení FDA pro redukci rizika invazivního karcinomu prsu u postmenopauzálních žen s osteoporózou. Efektivita raloxifenu byla testována v klinických studiích MORE, v navazující studii CORE a ve velké studii STAR, kde byl srovnáván s tamoxifenem.
Studie MORE (The Multiple Outcomes of Raloxifene Evaluation)
Studie MORE testovala účinnost raloxifenu v redukci výskytu osteoporotických fraktur. U souboru 7 705 postmenopauzálních žen ve věku 31–80 let, které měly osteoporózu nebo prodělaly osteoporotickou frakturu [27], srovnávala raloxifen v denní dávce 60 mg a 120 mg podávaný po dobu tří let proti placebu. Raloxifen redukoval riziko vzniku vertebrálních fraktur a prokázal nárůst kostní minerální denzity (BMD). Incidence karcinomu prsu byla sekundárním cílovým ukazatelem studie. Při mediánu sledování 40 měsíců byla doložena redukce rizika vzniku karcinomu prsu (RR 0,24; 95% CI 0,13–0,44), významná redukce rizika rozvoje ER pozitivních karcinomů prsu (RR 0,10) [28]. Incidenci karcinomů ER negativních raloxifen neovlivnil. Při srovnání s největší studií s tamoxifenem P 1 [13] byly pacientky ve studii MORE starší a měly nižší riziko vzniku karcinomu prsu. Podání raloxifenu bylo častěji zatíženo návaly horka (hot flashes), zvýšeným výskytem hluboké žilní trombózy a plicní embolie, naopak nedošlo ke zvýšení rizika rozvoje endometriálního karcinomu.
Studie CORE
Studie CORE navázala na studii MORE a vytyčila si jako primární cílový ukazatel efektivitu dalších čtyř let léčby raloxifenem na incidenci invazivního karcinomu prsu u postmenopauzálních žen s osteoporózou [29]. Primární cíl studie byl splněn, raloxifen redukoval riziko vzniku invazivního karcinomu prsu o 59 % (RR 0,41; 95% CI 0,24–0,71) a incidenci ER pozitivních karcinomů prsu o 66 % (sekundární cíl studie). Neovlivnil však incidenci neinvazivního karcinomu (RR 1,78; 95% CI 0,37–8,61) [29].
Studie STAR (NSABP studie P 2)
Výsledky studií MORE a CORE se staly podkladem pro provedení studie STAR, která přímo srovnávala efektivitu raloxifenu s tamoxifenem. Randomizovala 19 747 postmenopauzálních žen ve věku 35 let a starších, které měly zvýšené riziko vzniku invazivního karcinomu prsu dle modifikovaného Gailova modelu nebo měly v anamnéze LCIS [30]. Po čtyřletém sledování nebyl zaznamenán signifikantní rozdíl v efektivitě tamoxifenu a raloxifenu (RR 1,02; 95% CI 0,82–1,28). Raloxifen byl stejně účinný u žen s anamnézou ADH nebo LCIS, nebyl však účinný v redukci neinvazivních karcinomů [30]. V delším horizontu sledování (analýza po osmi letech) byl raloxifen méně účinný (RR 1,24; 95% CI 1,05–1,47) [31]. Nebyl prokázán rozdíl v přežití. Ve skupině s raloxifenem byly méně často zaznamenány invazivní endometriální karcinom (statisticky nesignifikantně), hyperplazie endometria a tromboembolická nemoc.
Inhibitory aromatázy (anastrozol a exemestan)
V adjuvantním podání byla prokázána o něco větší efektivita všech inhibitorů aromatázy (anastrozol, letrozol a exemestan) [32‒35] při srovnání s tamoxifenem (redukce recidiv a mortality). V těchto studiích byla pozorována také menší incidence kontralaterálního karcinomu prsu [33]. Dvě studie potvrdily efektivitu inhibitorů aromatázy v prevenci karcinomu prsu.
Studie MAP.3
MAP.3 byla multicentrická, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie, která randomizovala 4 560 žen k podávání exemestanu nebo placeba. Při mediánu sledování tři roky redukoval exemestan ve srovnání s placebem incidenci invazivního karcinomu prsu o 65 % (HR 0,35; 95% CI 0,18–0,70) [36].
Studie IBIS II
IBIS II byla studie, která randomizovala 3 864 postmenopauzálních žen s vysokým rizikem vzniku karcinomu prsu (pozitivní rodinná anamnéza, DCIS, LCIS nebo ADH v osobní anamnéze) k podávání anastrozolu nebo tamoxifenu. Pacientky léčené anastrozolem měly nižší incidenci invazivního karcinomu prsu (HR 0,47; 95% CI 0,32‒0,68) a high grade tumorů (HR 0,35; 95% CI 0,16‒0,74) [37].
Adjuvantní léčba duktálního karcinomu in situ
Se zavedením screeningové mamografie narůstá záchyt DCIS (celosvětově asi 20 % nově diagnostikovaných karcinomů prsu). Duktální karcinom in situ je přímým prekurzorem invazivního duktálního karcinomu prsu. Základním přístupem v terapii DCIS je chirurgická léčba, jejímž cílem je kompletní odstranění ložiska. Duktální karcinom se šíří vývody žlázy a má sklon lokálně recidivovat, přičemž asi v polovině případů recidivy jde o invazivní karcinom. Ve čtyřech prospektivních klinických studiích s adjuvantní radioterapií byla během 13‒20letého sledování zaznamenána incidence lokální recidivy po samotné parciální mastektomii 26‒36 % [38‒41]. Adjuvantní radioterapie po parciální mastektomii snižuje riziko rozvoje lokální recidivy asi o 50 % [42]. Tamoxifen po parciálním výkonu s radioterapií nebo bez radioterapie redukuje riziko lokální recidivy asi o 30 %. Efektivitu ve studiích prokázal také anastrozol.
Prospěch tamoxifenu ve srovnání s placebem u žen s DCIS léčených parciální mastektomií a radioterapií zkoumala studie NSABP B 24, ve které tamoxifen v kombinaci s radioterapií redukoval o 32 % riziko recidivy v ipsilaterálním i kontralaterálním prsu. Nebyl pozorován rozdíl v přežití nemocných [38]. V další studii fáze III (The UK, Australia, and New Zealand, UK/ANZ DCIS trial) snižoval tamoxifen výskyt ipsilaterálních nebo kontralaterálních událostí v prsu pouze u žen, jimž nebyla podána adjuvantní radioterapie (HR 0,77; p = 0,04 pro ipsilaterální vs. HR 0,27; p = 0,005 pro kontralaterální události), avšak nesnižoval jejich výskyt u ozářených pacientek (HR 0,93; p = 0,8 pro ipsilaterální události) [40].
Recentně byla DeCensim na SABCS (San Antonio Breast Cancer Symposium) 2018 publikována data randomizované, placebem kontrolované studie fáze III TAM 01 (NCT01357772). V této studii (n = 500) prokázal nízkodávkovaný tamoxifen 5 mg denně podávaný po dobu tří let pacientkám s DCIS nebo LCIS redukci recidiv (HR 0,48; 95% CI 0,25–0,89; p = 0,02). Většinu rekurencí představovaly invazivní karcinomy. Nízkodávkovaný tamoxifen v této studii prokázal efektivitu při limitované toxicitě (nízký výskyt flebitid a endometriálního karcinomu) [43].
V adjuvantní léčbě ER pozitivních DCIS byl s tamoxifenem porovnáván anastrozol, který prokázal u postmenopauzálních žen minimálně srovnatelný prospěch. Šlo o výše zmíněnou studii IBIS II, kde byla potvrzena efektivita anastrozolu [44] a dle očekávání byl zaznamenán odlišný profil nežádoucích účinků. Studie NSABP B 35 randomizovala 3 104 postmenopauzálních pacientek, všechny byly léčeny radioterapií prsu. Anastrozol ve srovnání s tamoxifenem v této studii dosáhl statisticky signifikantního poklesu rozvoje událostí v prsu (breast cancer free interval, HR 0,73; 95% CI 0,56–0,96; p = 0,0234). Ještě významnějšího zlepšení dosáhl anastrozol u žen mladších 60 let [45].
Dle aktuálních mezinárodních doporučení (National Comprehensive Cancer Network, NCCN; European Society for Medical Encology, ESMO) [3,46] má být tamoxifen u premenopauzálních žen nebo inhibitor aromatázy u postmenopauzálních žen (zejména mladších 60 let nebo s rizikem rozvoje tromboembolické nemoci) zvážen jako strategie redukující riziko recidivy karcinomu u pacientek léčených konzervativním chirurgickým výkonem s radioterapií nebo bez ní. V České republice je možné zvážit podání tamoxifenu u pacientek s vyšším rizikem vzniku lokální recidivy (např. dle Van Nuysova skóre) nebo k profylaxi kontralaterálního karcinomu, anastrozol nemá v této indikaci registraci.
Další látky testované v chemoprevenci karcinomu prsu
Retinoidy
Retinoidy představují přirozené nebo syntetické deriváty retinolu (vitaminu A). Po vazbě na specifické receptory v jádře buňky (retinoidové receptory) regulují expresi řady genů s výsledným antiproliferačním, diferenciačním a proapoptotickým účinkem [7]. Chemopreventivní účinek u karcinomu prsu byl popsán u fenretinidu v klinické studii (n = 1 739), která zkoumala jeho efekt na snížení rizika vzniku metachronního karcinomu prsu u pacientek po ukončené léčbě pro neinvazivní nebo invazivní karcinom prsu I. klinického stadia. Při mediánu sledování 14,6 roku nebyl prokázán rozdíl v incidenci recidiv v celém souboru (HR 0,83), avšak v následné analýze podskupin byl doložen prospěch u premenopauzálních žen (HR 0,62), který přetrvával dlouhodobě po ukončení léčby [47]. V běžné praxi se tento postup nepoužívá.
Nesteroidní antirevmatika
Chemopreventivní účinky nesteroidních antirevmatik (NSAID) byly popsány v epidemiologických studiích, kde jejich pravidelné užívání např. z důvodu revmatoidní artritidy snižovalo výskyt kolorektálního karcinomu. Vysoká koncentrace prostaglandinů se stimulačním účinkem na maligní a premaligní buňky byla nalezena také ve tkáních karcinomu prsu, je výsledkem zvýšené aktivity enzymu cyklooxygenázy (COX). Efektivita NSAID byla v experimentu potvrzena u buněk s defektem APC (adenomatous polyposis coli) signalizace [7]. Předpokládá se určitý možný prospěch v prevenci karcinomu prsu (kohortové studie, studie případů a kontrol) [48], nejsou však k dispozici data z randomizovaných klinických studií ani metaanalýzy.
Metformin
V mnoha epidemiologických studiích byla popsána redukce incidence a mortality na nádorové onemocnění u nemocných s DM 2. typu léčených metforminem [49]. V chemoprevenci jako takové se neužívá.
Vitamin D
Z epidemiologických studií je známa negativní korelace mezi intenzitou slunečního svitu a prevalencí některých nádorových onemocnění včetně karcinomu prsu. Kalcitriol (metabolicky aktivní hormonální forma vitaminu D3) se významně podílí na buněčné diferenciaci, vykazuje antiproliferační, antiangiogenní a antimetastatické účinky podobně jako retinoidy [7]. Jeho význam u karcinomu prsu je zkoumán, kanadská studie z roku 2009 prokázala signifikantně zvýšené riziko časné diseminace u žen s recentně diagnostikovaným karcinomem prsu a nedostatkem vitaminu D v době diagnózy [50]. Dosud však nemáme k dispozici jednoznačné důkazy o pozitivním významu suplementace pro prognózu nemocných.
Závěr
Možnosti chemoprevence jsou předmětem klinického výzkumu. Tamoxifen a raloxifen jsou účinné v redukci incidence karcinomu prsu u žen s vysokým rizikem jeho vzniku. V běžné klinické praxi je v České republice používán tamoxifen, avšak pouze pro léčbu pacientek s již prokázaným invazivním nebo neinvazivním karcinomem. Podání v primární prevenci jako takové není u nás zavedeno. Raloxifen není v ČR k dispozici. Ženám se zvýšeným rizikem vzniku karcinomu prsu se doporučují režimová opatření, samovyšetřování, v případě stanovení vysokého empirického rizika a při průkazu genetického rizika (potvrzení mutace genů) má být pacientka sledována ve specializované ambulanci. Ženy s prokázanou mutací v genech BRCA1/2 by měly být informovány o možnostech profylaktické bilaterální mastektomie a adnexektomie redukující riziko.
Seznam použité literatury
- [2] Klener P, Klener P jr. Nádor jako důsledek genetické a epigenetické deregulace. In: Principy systémové protinádorové léčby. Praha: Grada Publishing, 2013, s. 15–17.
- [3] NCCN Clinical Practice Guidelines in Oncology. Breast Cancer Risk Reduction. Version 1.2019. Dostupné na: https://www.nccn.org/ [staženo 15. 5. 2019].
- [4] Coufal O, Foretová L, Palácová M. Premaligní změny prsu. In: Coufal O, Fait V. Chirurgická léčba karcinomu prsu. Praha: Grada Publishing, 2011; 345.
- [5] Coufal O, Foretová L, Palácová M. Dědičné nádory prsu. In: Coufal O, Fait V. Chirurgická léčba karcinomu prsu. Praha: Grada Publishing, 2011; 341‒344.
- [6] Rockhill B, Spiegelman D, Byrne C, et al. Validation of the Gail et al. Model of breast cancer risk prediction and implications for chemoprevention. J Natl Cancer Inst 2001; 93: 358‒366.
- [7] Klener P, Klener P jr. Chemoprevence. In: Nová protinádorová léčiva a léčebné strategie v onkologii. Praha: Grada Publishing, 2010; 7–11.
- [8] Adjuvant tamoxifen in the management of operable breast cancer: the Scottish Trial. Report from the Breast Cancer Trials Committee, Scottish Cancer Trials Office (MRC), Edinburgh. Lancet 1987; 2: 171‒175.
- [9] Cyclophosphamide and tamoxifen as adjuvant therapies in the management of breast cancer. CRC Adjuvant Breast Trial Working Party. Br J Cancer 1988; 57: 604‒607.
- [10] Fisher B, Costantino J, Redmond C, et al. A randomized clinical trial evaluating tamoxifen in the treatment of patients with node‑negative breast cancer who have estrogen‑receptor‑positive tumors. N Engl J Med 1989; 320: 479‒484.
- [11] Rutqvist LE, Cedermark B, Glas U, et al. Contralateral primary tumors in breast cancer patients in a randomized trial of adjuvant tamoxifen therapy. J Natl Cancer Inst 1991; 83: 1299‒1306.
- [12] Early Breast Cancer Trialistsʼ Collaborative Group. Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15‑year survival: an overview of the randomised trials. Lancet 2005; 365: 1687‒1717.
- [13] Fisher B, Costantino JP, Wickerham DL, et al. Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P‑1 Study. J Natl Cancer Inst 1998; 90: 1371‒1388.
- [14] Fisher B, Costantino JP, Wickerham DL, et al. Tamoxifen for the prevention of breast cancer: current status of the National Surgical Adjuvant Breast and Bowel Project P‑1 study. J Natl Cancer Inst 2005; 97: 1652‒1662.
- [15] Tan‑Chiu E, Constantino JP, Paik S, et al. Effects of tamoxifen on benign breast disease in women at high risk for breast cancer. J Natl Cancer Inst 2003; 95: 302–307.
- [16] King MC, Wieand S, Hale K, et al. Tamoxifen and breast cancer incidence among women with inherited mutations in BRCA1 and BRCA2: National Surgical Adjuvant Breast and Bowel Project (NSABP‑P1) Breast Cancer Prevention Trial. JAMA 2001; 286: 2251‒2256.
- [17] Cuzick J, Powles T, Veronesi U, et al. Overview of the main outcomes in breast‑cancer prevention trials. Lancet 2003; 361: 296‒300.
- [18] Powles T, Eeles R, Ashley S, et al. Interim analysis of the incidence of breast cancer in the Royal Marsden Hospital tamoxifen randomised chemoprevention trial. Lancet 1998; 352: 98‒101.
- [19] Powles TJ, Ashley S, Tidy A, et al. Twenty‑year follow‑up of the Royal Marsden randomized, double‑blinded tamoxifen breast cancer prevention trial. J Natl Cancer Inst 2007; 99: 283‒290.
- [20] Veronesi U, Maisonneuve P, Sacchini V, et al. Tamoxifen for breast cancer among hysterectomised women. Lancet 2002; 359: 1122‒1124.
- [21] Veronesi U, Maisonneuve P, Costa A, et al. Prevention of breast cancer with tamoxifen: preliminary findings from the Italian randomised trial among hysterectomised women. Italian Tamoxifen Prevention Study. Lancet 1998; 352: 93‒97.
- [22] Veronesi U, Maisonneuve P, Rotmensz N, et al. Tamoxifen for the prevention of breast cancer: late results of the Italian Randomized Tamoxifen Prevention Trial among women with hysterectomy. J Natl Cancer Inst 2007; 99: 727‒737.
- [23] Veronesi U, Maisonneuve P, Rotmensz N, et al. Italian randomized trial among women with hysterectomy: tamoxifen and hormone‑dependent breast cancer in high‑risk women. J Natl Cancer Inst 2003; 95: 160‒165.
- [24] Cuzick J, Forbes J, Edwards R, et al. First results from the International Breast Cancer Intervention Study (IBIS‑I): a randomised prevention trial. Lancet 2002; 360: 817‒824.
- [25] Cuzick J, Forbes JF, Sestak I, et al. Long‑term results of tamoxifen prophylaxis for breast cancer‑96‑month follow‑up of the randomized IBIS‑I trial. J Natl Cancer Inst 2007; 99: 272‒282.
- [26] Cuzick J, Sestak I, Cawthorn S, et al. Tamoxifen for prevention of breast cancer: extended long‑term follow‑up of the IBIS‑I breast cancer prevention trial. Lancet Oncol 2015; 16: 67‒75.
- [27] Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3‑year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA 1999; 282: 637‒645.
- [28] Cummings SR, Eckert S, Krueger KA, et al. The effect of raloxifene on risk of breast cancer in postmenopausal women: results from the MORE randomized trial. Multiple Outcomes of Raloxifene Evaluation. JAMA 1999; 281: 2189‒2197.
- [29] Martino S, Cauley JA, Barrett‑Connor E, et al. Continuing outcomes relevant to Evista: breast cancer incidence in postmenopausal osteoporotic women in a randomized trial of raloxifene. J Natl Cancer Inst 2004; 96: 1751‒1761.
- [30] Vogel VG, Costantino JP, Wickerham DL, et al. Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) P‑2 trial. JAMA 2006; 295: 2727‒2741.
- [31] Vogel VG, Costantino JP, Wickerham DL, et al. Update of the National Surgical Adjuvant Breast and Bowel Project Study of Tamoxifen and Raloxifene (STAR) P‑2 Trial: Preventing breast cancer. Cancer Prev Res (Phila) 2010; 3: 696‒706.
- [32] Baum M, Budzar AU, Cuzick J, et al. Anastrozole alone or in combination with tamoxifen versus tamoxifen alone for adjuvant treatment of postmenopausal women with early breast cancer: first results of the ATAC randomised trial. Lancet 2002; 359: 2131‒2139.
- [33] Baum M, Buzdar A, Cuzick J, et al. Anastrozole alone or in combination with tamoxifen versus tamoxifen alone for adjuvant treatment of postmenopausal women with early‑stage breast cancer: results of the ATAC (Arimidex, Tamoxifen Alone or in Combination) trial efficacy and safety update analyses. Cancer 2003; 98: 1802‒1810.
- [34] Coombes RC, Hall E, Gibson LJ, et al. A randomized trial of exemestane after two to three years of tamoxifen therapy in postmenopausal women with primary breast cancer. N Engl J Med 2004; 350: 1081‒1092.
- [35] Goss PE, Ingle JN, Martino S, et al. A randomized trial of letrozole in postmenopausal women after five years of tamoxifen therapy for early‑stage breast cancer. N Engl J Med 2003; 349: 1793‒1802.
- [36] Goss PE, Ingle JN, Ales‑Martinez JE, et al. Exemestane for breast‑cancer prevention in postmenopausal women. N Engl J Med 2011; 364: 2381‒2391.
- [37] Cuzick J, Sestak I, Forbes JF, et al. Anastrozole for prevention of breast cancer in high‑risk postmenopausal women (IBIS‑II): an international, double‑blind, randomised placebo‑controlled trial. Lancet 2014; 383: 1041‒1048.
- [38] Cuzick J, Sestak I, Pinder SE, et al. Effect of tamoxifen and radiotherapy in women with locally excised ductal carcinoma in situ: long‑term results from the UK/ANZ DCIS trial. Lancet Oncol 2011; 12: 21–29.
- [39] Donker M, Litiere S, Werutsky G, et al. Breast‑conserving treatment with or without radiotherapy in ductal carcinoma In Situ: 15‑year recurrence rates and outcome after a recurrence, from the EORTC 10853 randomized phase III trial. J Clin Oncol 2013; 31: 4054–4059.
- [40] Wapnir IL, Dignam JJ, Fisher B, et al. Long‑term outcomes of invasive ipsilateral breast tumor recurrences after lumpectomy in NSABP B‑17 and B‑24 randomized clinical trials for DCIS. J Natl Cancer Inst 2011; 103: 478–488.
- [41] Warnberg F, Garmo H, Emdin S, et al. Effect of radiotherapy after breast‑conserving surgery for ductal carcinoma in situ: 20 years follow‑up in the randomized SweDCIS Trial. J Clin Oncol 2014; 32: 3613–3618.
- [42] Correa C, McGale P, Taylor C, et al. Early Breast Cancer Trialists’ Collaborative Group. Overview of the randomized trials of radiotherapy in ductal carcinoma in situ of the breast. J Natl Cancer Inst Monogr 2010; 2010: 162–177.
- [43] DeCensi A, Puntoni M, Guerrieri Gonzaga A, et al. A randomized placebo controlled phase III trial of low dose tamoxifen for the prevention of recurrence in women with operated hormone sensitive breast ductal or lobular carcinoma in situ. SABCS 2018, December 6, Abstract GS3‑01.
- [44] Forbes JF, Sestak I, Howell A, et al. Anastrozole versus tamoxifen for the prevention of locoregional and contralateral breast cancer in postmenopausal women with locally excised ductal carcinoma in situ (IBIS‑II DCIS): a double‑blind, randomised controlled trial. Lancet 2016; 387: 866–873.
- [45] Margolese RG, Cecchini RS, Julian TB, et al. Anastrozole versus tamoxifen in postmenopausal women with ductal carcinoma in situ undergoing lumpectomy plus radiotherapy (NSABP B‑35): a randomised, doubleblind, phase 3 clinical trial. Lancet 2016; 387: 849–856.
- [46] Curigliano G, Burstein HJ, Winer EP, et al. De‑escalating and escalating treatments for early‑stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Ann Oncol 2017; 28: 1700‒1712.
- [47] Veronesi U, Mariani L, Decensi A, et al. Fifteen‑year results of a randomized phase III trial of fenretinide to prevent second breast cancer. Ann Oncol 2006; 17: 1065‒1071.
- [48] Bardia A, Ebbert JO, Vierkant RA, et al. Association of aspirin and nonaspirin nosteroidal antiinflammatory drugs with cancer incidence and mortality. J Natl Cancer Inst 2007; 99: 881‒889.
- [49] Heckman‑Stoddard BM, DeCensi A, Sahasrabuddhe VV, et al. Repurposing metformin for the prevention of cancer and cancer recurrence. Diabetologia 2017; 60: 1639‒1647.
- [50] Goodwin PJ, Ennis M, Pritchard KI, et al. Prognostic effects of 25‑hydroxyvitamin D levels in early breast cancer chemoprevention. J Clin Oncol 2009; 37: 3757‒3763.