Chronická lymfocytární leukemie – současné možnosti léčby
Souhrn:
Chronická lymfocytární leukemie je nejčastější leukemií dospělého věku. Onemocnění je charakterizováno velmi různorodým průběhem a délkou přežití od několika měsíců po desítky let. Vzhledem k této mimořádné klinické variabilitě a s ohledem na nové léčebné možnosti je nutno zpřesnit individuální prognózu nemocných. V posledních letech přibyly zásadní poznatky týkající se posouzení prognózy onemocnění (významné genetické aberace, mutace genu TP53, mutační stav genů pro variabilní část těžkého řetězce imunoglobulinu). Objevuje se řada nových molekul s odlišnými mechanismy účinku (nové monoklonální protilátky, inhibitory drah B‑buněčného receptoru a další), které zásadním způsobem zasahují do léčebných postupů u nemocných s chronickou lymfocytární leukemií. V reakci na tuto situaci vytvořila Česká skupina pro chronickou lymfocytární leukemii, sekce České hematologické společnosti ČLS JEP, v roce 2016 aktualizovaná doporučení pro diagnostiku a léčbu v klinické praxi.
Key words: monoclonal antibodies – cytostatics therapy – idelalisib – ibrutinib – venetoclax – lenalidomid.
Summary:
Chronic lymphocytic leukemia is the most typical leukemia for adults. It is characterized by a different course and time of survival, varying from a few months to tens of years. Due to an extraordinary clinical variety and possibilities of using new agents it is necessary to specify individual prognosis of each patient. During the last few years essential findings in the area of prognosis have been added (significant genetic aberrations, mutations in the TP53 genes, mutations in immunoglobulin heavy chain variable region genes). Treatment of patients with chronic lymphocytic leukemia has been radically changing by a number of new agents with different mechanism of action (new monoclonal antibodies, targeted therapies such as B‑cell receptor inhibitors and others). Czech Chronic lymphocytic leukemia Study Group, section of Czech society of hematology ČLS JEP, updated the recommendations for the diagnosis and treatment for clinical practice in 2016 as a reaction to this situation.
Úvod
Chronická lymfocytární leukemie (CLL) je nejčastější leukemií dospělého věku. Onemocnění postihuje starší osoby, průměrný věk v době diagnózy se pohybuje v rozmezí mezi 67–72 roky [1]. Chronická lymfocytární leukemie je vzácná u osob mladších než 40 let, nevyskytuje se u dětí. Častěji onemocní muži než ženy – v poměru 1,9 : 1 [2].
Prognóza onemocnění
Stanovení klinického stadia (tzv. stážování, staging) podle Raie [5] a Bineta [6] (tab. 3 a 4) je stále základem pro klinické posouzení nemocných s nově zjištěnou CLL. Na základě tohoto stážování však není možné rozlišit nemocné, u nichž dojde k časné progresi onemocnění a kteří budou mít celkově nepříznivou prognózu. Chronická lymfocytární leukemie představuje značně různorodé onemocnění se zcela odlišným průběhem a s délkou přežití od několika měsíců po desítky let. Vzhledem k této mimořádné klinické variabilitě je doporučeno provést u nemocných vyšetření, která zpřesní jejich individuální prognózu.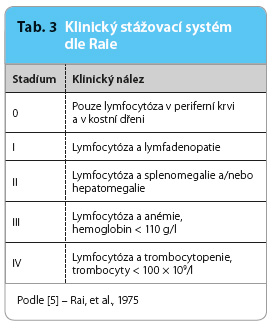
Jedná se zejména o vyšetření genetických aberací fluorescenční hybridizací in situ (FISH) – delece 13q, 11q, 17p, trisomie 12 [7], o stanovení mutačního stavu genů pro variabilní část těžkého řetězce imun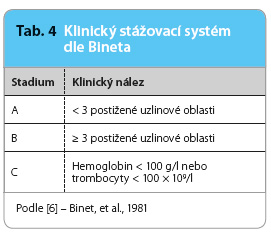 oglobulinu (immunoglobulin heavy chain variable region genes, IGHV) [8] a o vyšetření mutace genu TP53 [9,10]. S využitím těchto prognostických markerů je možno predikovat délku období bez léčby, období do progrese a celkové přežití. Za zásadní je považováno stanovení delecí 17p a analýza mutací TP53 vždy před zahájením první linie léčby a také před každou novou linií léčby [11]. Přítomnost negativních prognostických faktorů zásadním způsobem ovlivňuje terapeutický přístup. V současné době jsou intenzivně zkoumány nově objevené mutace genů BIRC 3, NOTCH 1, MYD 88, SF3B1 a další. V běžné klinické praxi zatím jejich průkaz nemění léčebné postupy, a stanovení proto není rutinně vyžadováno [12,13].
oglobulinu (immunoglobulin heavy chain variable region genes, IGHV) [8] a o vyšetření mutace genu TP53 [9,10]. S využitím těchto prognostických markerů je možno predikovat délku období bez léčby, období do progrese a celkové přežití. Za zásadní je považováno stanovení delecí 17p a analýza mutací TP53 vždy před zahájením první linie léčby a také před každou novou linií léčby [11]. Přítomnost negativních prognostických faktorů zásadním způsobem ovlivňuje terapeutický přístup. V současné době jsou intenzivně zkoumány nově objevené mutace genů BIRC 3, NOTCH 1, MYD 88, SF3B1 a další. V běžné klinické praxi zatím jejich průkaz nemění léčebné postupy, a stanovení proto není rutinně vyžadováno [12,13].
Indikace pro zahájení léčby
Stanovení diagnózy CLL není důvodem pro zahájení léčby. Většina nemocných je diagnostikována zcela náhodně na základě vyšetření krevního obrazu a nemá žádné klinické potíže. Chronická lymfocytární leukemie je indolentní onemocnění, v časných stadiích (Rai 0/Binet A) volíme strategii „watch and wait“ (pouze sledování). V randomizovaných klinických studiích nebyl prokázán přínos časného zahájení léčby [14]. Intermediární stadia (Rai I–II/Binet B) jsou indikována k léčbě, pokud jsou splněna kritéria aktivity onemocnění [3]: B symptomy (významná únava, pocení, hubnutí či horečky neinfekčního původu), rychlý nárůst lymfocytózy (zdvojovací čas počtu lymfocytů do šesti měsíců nebo nárůst počtu lymfocytů o 50 % během dvou měsíců), masivní (> 10 cm) nebo progredující lymfadenopatie, masivní (> 6 cm pod levý žeberní oblouk) a/nebo symptomatická progredující splenomegalie, autoimunitní anémie a/nebo trombocytopenie špatně odpovídající na terapii kortikosteroidy.
U nemocných v pokročilém stadiu onemocnění (Rai III–IV/Binet C) je doporučováno bez odkladů zahájit léčbu, pouze u nemocných se stabilní mírnou anémií či trombocytopenií je možno léčbu nezahajovat a pečlivě monitorovat. Vysoké hodnoty leukocytů/lymfocytů bez jiných známek aktivity choroby nejsou indikací k zahájení léčby.
Současné možnosti léčby – aktuální doporučení
V posledních letech přibyly zásadní poznatky týkající se posouzení prognózy onemocnění (význam mutací genu TP53). Objevuje se řada nových molekul s odlišnými mechanismy účinku (nové monoklonální protilátky, inhibitory drah B buněčného receptoru a další). Tento vývoj zásadním způsobem zasahuje do léčebných postupů u nemocných s CLL. Na základě nových poznatků a důkladné analýzy současné literatury vytvořila Česká skupina pro chronickou lymfocytární leukemii, sekce České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně (ČLS JEP), v roce 2016 aktualizovaná doporučení pro diagnostiku a léčbu CLL v klinické praxi [11].
Léčba nemocných s CLL je individuální a zohledňuje aktuální stav nemocného, přidružená onemocnění a v neposlední řadě přání pacienta. Všem vhodným pacientům by měla být nabídnuta účast v klinických studiích. Klinický výzkum vede ke zlepšování výsledků léčby. Významným faktorem je také dobrá komunikace mezi regionálními hematologickými pracovišti a centry intenzivní hematologické péče (CIHP). Je důležité včas rozpoznat a odeslat mladší nemocné s vysoce nepříznivým průběhem CLL ke zvážení alogenní transplantace krvetvorných buněk.
Před zahájením léčby je nutno zhodnotit celkový stav pacienta a zohlednit jeho přání. K hodnocení stavu je možno využít např. systém Cumulative Illness Rating Scale (CIRS) [15].
Léčba první linie
Nemocní bez významných přidružených onemocnění
Na základě výsledků randomizované studie CLL8 je režim FCR (fludarabin, cyklofosfamid, rituximab) považován za hlavní léčebnou možnost u nemocných v dobrém stavu bez závažných přidružených onemocnění a s normální funkcí ledvin. V případě delece 17p/mutace TP53 a nevhodnosti léčby chemoimunoterapií je doporučeno použít ibrutinib [11]. Je realitou, že fludarabin způsobuje závažnou dlouhodobou toxicitu, pro kterou se jeho indikační pole stále zužuje i u nemocných s CLL.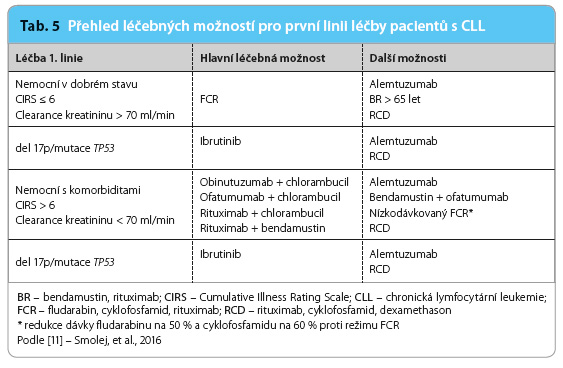
Nemocní s významnými přidruženými onemocněními
U nemocných s významnými komorbiditami (skóre CIRS > 6 a/nebo clearance kreatininu < 70 ml/min) je doporučena léčba monoklonální protilátkou anti CD20 v kombinaci s chlorambucilem nebo s bendamustinem. V případě delece 17p/mutace TP53 je vhodné použít ibrutinib [11]. Všechny možnosti jsou dále přehledně uvedeny (tab. 5).
Léčba pacientů s relapsem onemocnění
Při léčbě pacientů s relapsem onemocnění je nutno zohlednit celkový stav nemocného, věk, odpověď na předchozí léčbu a především délku trvání léčebné odpovědi. Pro pacienty s pozdním relapsem po chemoimunoterapii (délka trvání léčebné odpovědi 2–3 roky) může být přínosná opakovaná aplikace chemoimunoterapie. U časných relapsů (do 2–3 let) nebo v případě refrakterní choroby je nutné změnit léčebný přístup, zvažovat protokoly bez chemoterapie [12]. Hlavní léčebnou možnost představují nové molekuly ibrutinib a idelalisib (řazeno abecedně), které zasahují do signalizační dráhy B b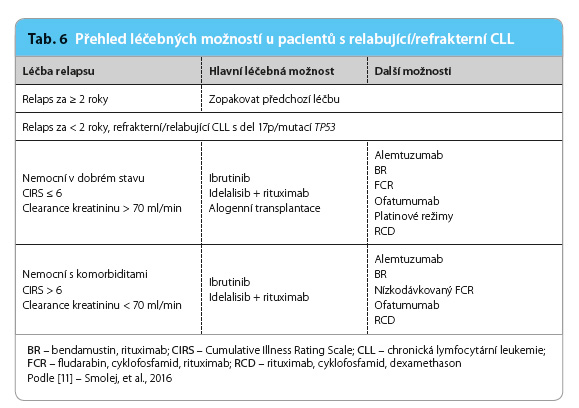 uněčného receptoru. Další léčebné možnosti uvádíme přehledně v tabulce (tab. 6) [11]. U relabujících nemocných s nepříznivými genetickými faktory (delece 17p/mutace TP53) by mělo být i v případě pozdního relapsu zvažováno podání ibrutinibu či idelalisibu. Tato nová léčiva nabízejí lepší kontrolu nemoci v porovnání s ostatní doposud dostupnou léčbou (s výjimkou alogenní transplantace krvetvorných kmenových buněk). Nemocní s refrakterní CLL by měli být včas odesláni do některého z center vysoce specializované hematoonkologické péče.Pro těžce komorbidní pacienty volíme paliativní monoterapii chlorambucilem nebo cyklofosfamidem, monoterapii kortikosteroidy. Jediným cílem této léčby je zmírnit symptomy CLL a nezhoršit stávající kvalitu života.
uněčného receptoru. Další léčebné možnosti uvádíme přehledně v tabulce (tab. 6) [11]. U relabujících nemocných s nepříznivými genetickými faktory (delece 17p/mutace TP53) by mělo být i v případě pozdního relapsu zvažováno podání ibrutinibu či idelalisibu. Tato nová léčiva nabízejí lepší kontrolu nemoci v porovnání s ostatní doposud dostupnou léčbou (s výjimkou alogenní transplantace krvetvorných kmenových buněk). Nemocní s refrakterní CLL by měli být včas odesláni do některého z center vysoce specializované hematoonkologické péče.Pro těžce komorbidní pacienty volíme paliativní monoterapii chlorambucilem nebo cyklofosfamidem, monoterapii kortikosteroidy. Jediným cílem této léčby je zmírnit symptomy CLL a nezhoršit stávající kvalitu života.
Monoklonální protilátky
Použití monoklonálních protilátek (mAb) znamenalo značný průlom v léčbě pacientů s B lymfoproliferacemi. Při léčbě CLL jsou mAb používány zejména v kombinaci s chemoterapií (chemoimunoterapie). První mAb, která byla schválena k terapii CLL, byl rituximab (anti CD20), v klinické praxi se používá od roku 1997. Ofatumumab (anti CD20) je dostupný od roku 2009, obinutuzumab (anti CD20) od roku 2013. Alemtuzumab (anti CD52) je využíván v klinické praxi od roku 2001.
Alemtuzumab
Alemtuzumab je humanizovaná potkaní monoklonální protilátka anti CD52 typu IgG1. Antigen CD52 se vyskytuje pouze na lymfocytech T a B, na monocytech a makrofázích, proto alemtuzumab nepoškozuje krvetvorné kmenové buňky. Účinek alemtuzumabu je nezávislý na signální dráze proteinu p53, což znamená významnou výhodu vzhledem k častému výskytu delece 17p zejména u nemocných trpících relabující/refrakterní CLL (R/R CLL). Nejlepší účinnost vykazuje alemtuzumab v periferní krvi a v kostní dřeni, dobře působí též na splenomegalii, problematická je účinnost u nemocných s masivní lymfadenopatií [16]. Nejčastějšími nežádoucími účinky alemtuzumabu jsou toxicita spojená s aplikací (kožní vyrážka, horečka, třesavka, hypotenze), hematologická toxicita (neutropenie, anémie, trombocytopenie, lymfopenie) a infekce včetně oportunních. Alemtuzumab není pro léčbu CLL registrován, v současné době je v České republice dostupný v rámci specifického léčebného programu.
Rituximab
Rituximab je chimérická myší lidská monoklonální protilátka, která se váže na antigen CD20. Rituximab je nejvíce používanou mAb v léčbě pacientů s CLL. Mechanismus účinku je komplexní, zahrnuje aktivaci komplementu (complement dependent cytotoxicity, CDC), přímý cytotoxický účinek (direct cell death, DCD) a buněčnou cytotoxicitu závislou na protilátce (antibody dependent cellular cytotoxicity, ADCC). Ve srovnání s léčbou lymfomů je rituximab podávaný v monoterapii méně účinný v důsledku nižší denzity antigenu CD20 na leukemických lymfocytech a kvůli rychlému odstranění rituximabu z oběhu solubilním antigenem CD20. V kombinovaných imunochemoterapeutických režimech ale přispěl ke zlepšení léčebné odpovědi a nevedl k podstatnému zvýšení toxicity léčby [17]. Studie CLL8 srovnávala účinnost režimu FC (fludarabin, cyklofosfamid) a FCR. Přidání rituximabu k FC prodloužilo dobu do progrese onemocnění (progression free survival, PFS) a délku celkového přežití (overall survival, OS) v první linii léčby (PFS 65 % vs. 45 %, OS 87 % vs. 83 % – rameno FCR vs. FC, hodnoceno za tři roky od zahájení léčby). Hematologická toxicita byla četnější v rameni s rituximabem, nehematologická toxicita byla v obou ramenech srovnatelná [18].
V léčbě relapsů rovněž prokázal režim FCR svou účinnost. V randomizované studii REACH rituximab zlepšil PFS, ale neprodloužil OS (PFS 30,6 měsíce vs. 20,6 měsíce). Přidání rituximabu do léčby vedlo k nepatrně častějšímu výskytu neutropenie, nehematologická toxicita byla opět srovnatelná [19]. Toxicita režimu FCR u starších pacientů je poměrně vysoká, a proto se v terapii CLL u pacientů starších 65 let doporučují jiné režimy. Léčebný režim BR (bendamustin, rituximab) je současným standardem pro pacienty starší 65 let v celkově dobrém stavu v první linii léčby i při relapsu onemocnění. Ve srovnání s FCR má režim BR příznivější toxický profil. Léčebná odpověď na podávání režimu BR vyhodnocovaná ve studii CLL10 byla srovnatelná s odpovědí na režim FCR (97,8 %), většího počtu kompletních remisí (complete remission, CR) a delší PFS bylo dosaženo v rameni FCR (CR 40,7 % vs. 31,5 %, PFS 53,7 měsíce vs. 43,2 měsíce). U pacientů starších 65 let nebyl rozdíl v PFS statisticky významný. Závažná hematologická i nehematologická toxicita byla vyšší v rameni FCR [20].
Pro starší a polymorbidní pacienty neschopné podstoupit intenzivnější režim je doporučena kombinace rituximab + chlorambucil (R Cbl). Nejčastějším nežádoucím účinkem rituximabu je reakce spojená s infuzí. Z infekčních komplikací je závažná reaktivace viru hepatitidy B nebo některých herpetických virů, četnější jsou respirační infekce, v ojedinělých případech reaktivace JC viru, který může vyvolat progresivní multifaktoriální leukoencefalopatii. Hematologická toxicita samotného rituximabu není vysoká. Ve snaze o zlepšení a prodloužení léčebné odpovědi se testují i nové molekuly (inhibitory B buněčného receptoru, BCL 2, anti PD1) v kombinaci s rituximabem.
Ofatumumab
Ofatumumab je lidská monoklonální protilátka IgG1, která se váže na odlišný epitop povrchového antigenu CD20 než rituximab. Oproti rituximabu je ofatumumab schopný vyvolat silnější aktivaci komplementu, zatímco ADCC je obdobná. Silnější CDC je pravděpodobně způsobena vazbou na část antigenu CD20, která je umístěna blíže k buněčné membráně a vede k efektivnější vazbě komplementu na povrch buňky [21]. Podle aktuálních doporučení se ofatumumab užívá v monoterapii u pacientů s relabujícím/refrakterním onemocněním a v kombinaci s chlorambucilem nebo s bendamustinem k terapii dosud neléčených pacientů, pro něž není vhodná léčba fludarabinovým režimem [11]. Aplikace ofatumumabu bývá spojena s hematologickou toxicitou (především s neutropenií) i s toxicitou nehematologickou, nejčastěji ji provázejí infekce horních cest dýchacích, pneumonie a herpetické infekce. Zejména v průběhu prvních aplikací se často objevuje reakce spojená s infuzí.
Obinutuzumab
Obinutuzumab je lidská monoklonální protilátka anti CD20 vyrobená metodou tzv. (glycoengineering – cíleně změněná glykosylace). Léčivo se váže na odlišný epitop antigenu CD20 než rituximab i ofatumumab. Ve srovnání s rituximabem má schopnost indukovat silnější ADCC (100×) a DCD, nicméně CDC se zdá se být slabší [22]. Obinutuzumab je schválen k terapii CLL dosud neléčených pacientů s komorbiditami, kteří nemohou podstoupit léčbu fludarabinovým režimem. Výsledky studie CLL11, která srovnávala účinnost režimů G Clb (obinutuzumab + chlorambucil) vs. R Clb vs. Clb, ukázaly, že obinutuzumab prodloužil PFS a zlepšil celkovou léčebnou odpověď (medián PFS 29,2 měsíce vs. 15,4 měsíce vs. 11 měsíců, celková míra odpovědi na léčbu – overall response rate [ORR] – 77,3 % vs. 65,7 % vs. 31,4 %). Vliv na OS nebyl statisticky významný při srovnání režimu G Clb a R Clb, výsledek však může být modifikován delším sledováním. Oproti monoterapii Clb byl ale jednoznačně potvrzen účinek obou mAb [23]. Mezi nejčastější závažné nežádoucí účinky léčby obinutuzumabem patří reakce spojená s infuzí, neutropenie a infekce [24].
Cytostatika
Fludarabin
Fludarabin představuje nejvýznamnější cytostatickou látku pro léčbu CLL. Patří mezi purinová analoga, způsobuje komplexní blokádu syntézy DNA a poruchu reparačních mechanismů DNA s následnou apoptózou maligních lymfocytů. Do léčby CLL byl zaveden počátkem devadesátých let 20. století nejprve v monoterapii. Kombinace s cyklofosfamidem vykazuje synergické působení. Na základě výsledků randomizované studie CLL8 je režim FCR považován za hlavní a nejúčinnější léčebné schéma u nemocných v dobrém stavu bez závažných přidružených onemocnění a s normální funkcí ledvin [25]. Mezi nejvýznamnější nežádoucí účinky patří hematologická toxicita (neutropenie, lymfopenie) a infekční komplikace včetně oportunních (mykotických, pneumocystových). Při léčbě fludarabinem se může rozvinout autoimunitní hemolytická anémie (AIHA) či trombocytopenie. Samotná pozitivita Coombsova testu bez známek aktivní hemolýzy není kontraindikací použití fludarabinu, ale u nemocných s aktivní AIHA nejsou fludarabinové režimy doporučovány.
Bendamustin
Bendamustin byl vyvinut v šedesátých letech 20. století v tehdejší Německé demokratické republice. Kombinuje vlastnosti alkylační látky a purinového analoga. Jeho účinnost a bezpečnost byla ověřena v randomizované studii CLL 10 (FCR vs. BR v první linii léčby) [20]. Na základě výsledků této studie je bendamustin v kombinaci s rituximabem v současné době doporučen v první linii léčby pacientů s CLL ve věku nad 65let a/nebo komorbidních pacientů, pacientů s renální insuficiencí [11]. Nejvýznamnějším nežádoucím účinkem léčby bendamustinem je hematologická toxicita, infekční komplikace, dermatologická toxicita (alergické reakce), systémové příznaky (horečka) a gastrointestinální příznaky (nauzea, zvracení).
Cyklofosfamid
Cyklofosfamid řadíme mezi alkylační cytostatika. Jeho působením dochází k poškození DNA (spojování bází, křížení řetězců, alkylace histonů) a tím k narušení buněčného cyklu. Je hojně využíván i jako imunosupresivum v léčbě autoimunitních onemocnění. V současných doporučeních pro léčbu CLL je cyklofosfamid používán zásadně v kombinacích. Je součástí nejúčinnějšího režimu FCR. V kombinaci s dexamethasonem a s monoklonální protilátkou je součástí režimu RCD (rituximab, cyklofosfamid, dexamethason). Režim RCD se používá jak v první linii léčby, tak při relapsu u nemocných, u nichž není vhodná léčba fludarabinovými režimy. S výhodou je používán pro léčbu pacientů trpících CLL s imunitními komplikacemi (AIHA, imunitní trombocytopenie) [26]. Mezi nejčastější nežádoucí účinky podávání cyklofosfamidu patří hematologická toxicita, infekční komplikace, alopecie, poškození močového traktu (hemoragická cystitida).
Chlorambucil
Chlorambucil je jedním z nejstarších cytostatik vůbec, léčivo je odvozeno od dusíkatého yperitu. Patří mezi alkylační cytostatika zasahující do syntézy a reparace DNA. Dlouhou dobu byl zlatým standardem v léčbě nemocných s CLL. Často je v klinických studiích srovnávána účinnost nových léčiv a léčebných schémat právě s chlorambucilem. Díky své nízké toxicitě, perorálnímu podávání a dobré toleranci patří k lékům volby u starších komorbidních pacientů. Problémem je nízké procento dosažených kompletních remisí (complete remission, CR) a celkových odpovědí na léčbu (ORR) při monoterapii chlorambucilem. S ohledem na výsledky klinických studií je v aktuálních doporučeních pro léčbu CLL chlorambucil podáván v kombinaci s monoklonální protilátkou anti CD20 [11]. Mezi nežádoucí účinky léčby chlorambucilem patří zejména zažívací potíže a protrahované cytopenie, jsou popisovány i případy vývoje myelodysplazie či sekundární akutní leukemie.
Kortikosteroidy
V léčbě CLL jsou kortikosteroidy používány zejména v případě sekundárních imunitních cytopenií (AIHA, imunitní trombocytopenie). Podání kortikosteroidů je účinné i v pokročilých stadiích onemocnění, vede k patrné regresi splenomegalie a lymfadenopatie. Další výhodou kortikosteroidů je nezávislost účinku na signální dráze proteinu p53. U rezistentních pacientů mohou být režimy s kortikosteroidy použity jako záchranná léčba. Lze je také využít jako první fázi – tzv. debulking (zmenšení nádorové masy) – před navazující terapií. Monoterapie kortikosteroidy však působí pouze krátkodobě a jejich podávání je spojeno s množstvím nežádoucích účinků. K nejzávažnějším patří infekční komplikace (včetně mykotických), často s fulminantním průběhem, zpomalená reakce na stres, hyperglykemie a steroidní diabetes, iatrogenní Cushingův syndrom, osteoporóza, gastrointestinální toxicita, hypertenze, atrofie kůže a svalstva, protrombotický účinek.
Inhibitory B buněčného receptoru
Důležité postavení v etiopatogenezi mnohých B buněčných maligních onemocnění má B buněčný receptor. Poznání signálních drah aktivovaného receptoru umožnilo rozvoj molekul působících inhibici některých kináz zapojených do přenosu. Dochází tak k zabránění proliferaci maligních B buněk a k aktivaci jejich apoptózy. S odlišným mechanismem účinku je spojeno i jiné spektrum nežádoucích účinků, než je tomu u klasické chemoterapie.
Idelalisib
Idelalisib je selektivní reverzibilní inhibitor fosfatidylinositol-3 kinázy δ (PI3Kδ), která funguje jako signální molekula nejen B buněčného receptoru, ale i jiných povrchových receptorů (CXCR4, CXCR5). Inhibicí tohoto enzymu dochází k brzdění proliferace maligních B buněk, k indukci apoptózy a k zabránění usídlení buněk v nádorovém mikroprostředí. Americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) schválil přípravek k léčbě pacientů s R/R CLL v kombinaci s rituximabem a k léčbě pacientů s relabujícím/refrakterním malobuněčným lymfomem v monoterapii v roce 2014. Evropská léková agentura (European Medicines Agency, EMA) navíc odsouhlasila užívání přípravku v primoléčbě u pacientů s del 17p nebo s mutací genu TP53 [27]. Tato indikace je aktuálně pozastavena na základě průběžných výsledků probíhajících studií (vyšší výskyt fatálních infekcí, především pneumonie vyvolané Pneumocystis jiroveci, a častější reaktivace cytomegalovirové infekce). Randomizovaná studie fáze III, v níž je léčba kombinací rituximab + idelalisib/placebo podávána 220 pacientům, poukazuje na účinnost léčebného režimu u pacientů s R/R CLL [28]. Kombinace BR + idelalisib vs. kombinace BR je ověřována ve studii fáze III s 390 pacienty trpícími R/R CLL. První výsledky ukazují, že idelalisib snižuje riziko progrese nemoci, prodlužuje PFS a OS a zlepšuje ORR (medián PFS 23 měsíců vs. 11 měsíců, mediánu OS nebylo dosaženo, ORR 68 % vs. 45 %) [29]. Výsledky všech studií se jen nepatrně liší při přítomnosti nebo nepřítomnosti del 17p nebo mutace genu TP53. Etiopatogeneze specifické toxicity přípravku není zcela objasněna, předpokládá se dysregulace T buněčné imunity. Nejčastěji se projevuje jako průjem asociovaný s kolitidou, pneumonitida a hepatopatie (elevace aktivity aspartátaminotransferázy, alaninaminotransferázy), projevem hematologické toxicity bývá neutropenie.
Ibrutinib
Ibrutinib je selektivní ireverzibilní inhibitor Brutonovy tyrosinkinázy (BTK). Váže se na cysteinové reziduum v oblasti ATP vazebné domény BTK a inhibuje i několik dalších kináz (ITK, TEC, BMX, EGFR). Brání tak maligní proliferaci a přežívání B buněk. V roce 2014 schválil FDA ibrutinib k terapii R/R CLL a v roce 2016 byl přípravek schválen k léčbě první linie bez ohledu na cytogenetické riziko. V České republice je schválen k léčbě R/R CLL a k primoléčbě pacientů s del 17p nebo s mutací TP53. Ve studii fáze III s léčbou ibrutinibem vs. ofatumumabem, která hodnotila 391 pacientů s R/R CLL, bylo ORR 41,6 % vs. 4,1 %, mediánu PFS nebylo při podávání ibrutinibu dosaženo, při léčbě ofatumumabem dosáhl 8,1 měsíce, a hodnota OS byla 90 % vs. 80 %, hodnoceno ve 12 měsících. Závažné infekční komplikace byly v obou ramenech srovnatelné a pacienti s nepříznivými cytogenetickými markery dosáhli obdobných výsledků v porovnání s pacienty s nižším rizikem [30].
Na základě dosažených výsledků byla iniciována jedna z největších studií hodnotících účinnost ibrutinibu v monoterapii u nemocných s R/R CLL/nebo s relabujícím/refrakterním malobuněčným lymfomem s del 17p nebo s mutací TP53. Léčeno bylo 144 pacientů, ORR jich dosáhlo 82,6 % a PFS ve 12 měsících 79,3 %. Většinu dosažených výsledků představovaly p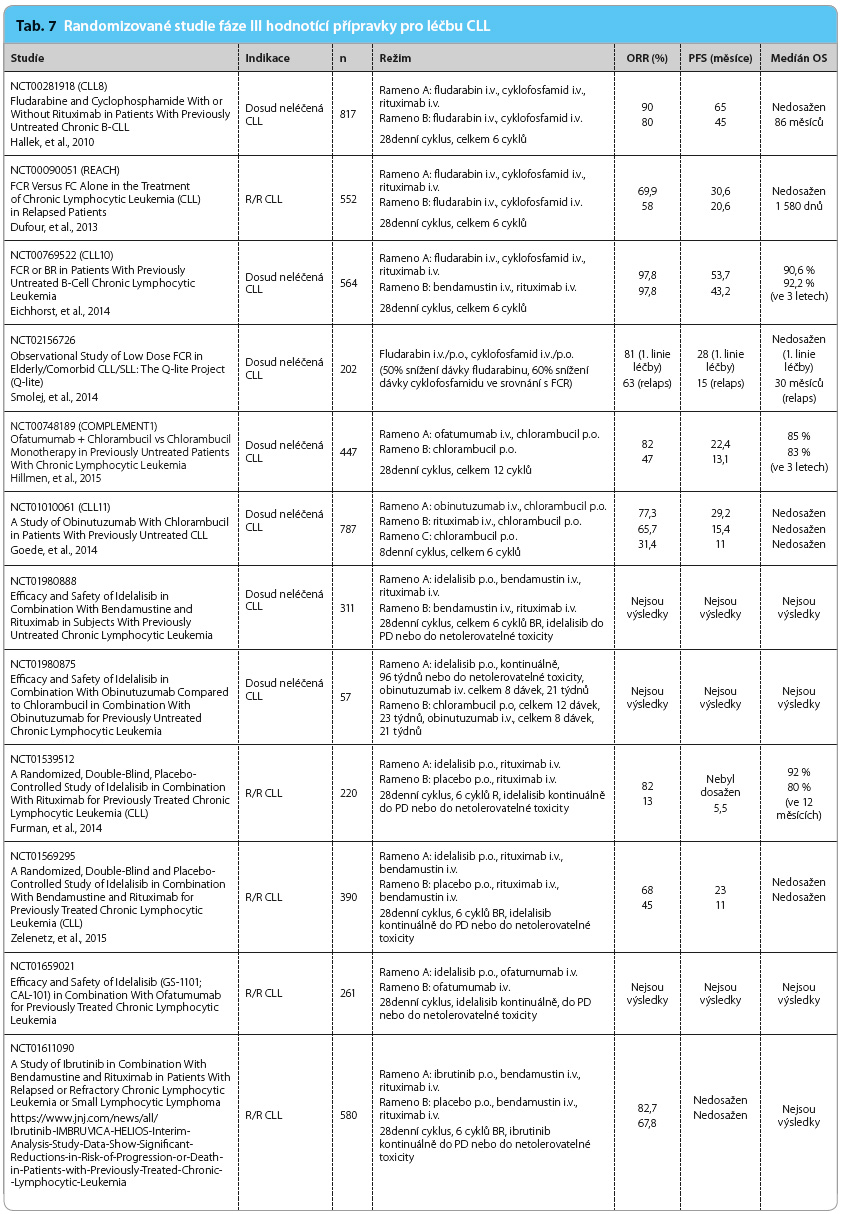 arciální remise [31]. Závažná toxicita ibrutinibu se v jednotlivých studiích zásadně nelišila. Snaha zkrátit délku terapie a najít kombinované režimy, které by prohloubily léčebnou odpověď, je předmětem dalších studií.
arciální remise [31]. Závažná toxicita ibrutinibu se v jednotlivých studiích zásadně nelišila. Snaha zkrátit délku terapie a najít kombinované režimy, které by prohloubily léčebnou odpověď, je předmětem dalších studií.
Studie fáze II hodnotící léčbu ibrutinibem v kombinaci s rituximabem u 40 pacientů zahrnuje všechny skupiny nemocných včetně vysoce rizikových (del 17p, mutace TP53, del 11q). Rozdíl v dosažených výsledcích ve skupině bez delece 17p a s potvrzenou delecí byl nepatrný, ORR 95 % vs. 90 % a PFS 78 % vs. 72 % [32]. Někteří autoři ale uvádějí možný protikladný účinek na ADCC [33]. První analýzy studie fáze III sledující léčbu kombinací BR + ibrutinib/placebo ve skupině 578 pacientů s R/R CLL/malobuněčným lymfomem dokazují zlepšení ORR i prodloužení PFS [34]. Četnost nežádoucích účinků stupně 3–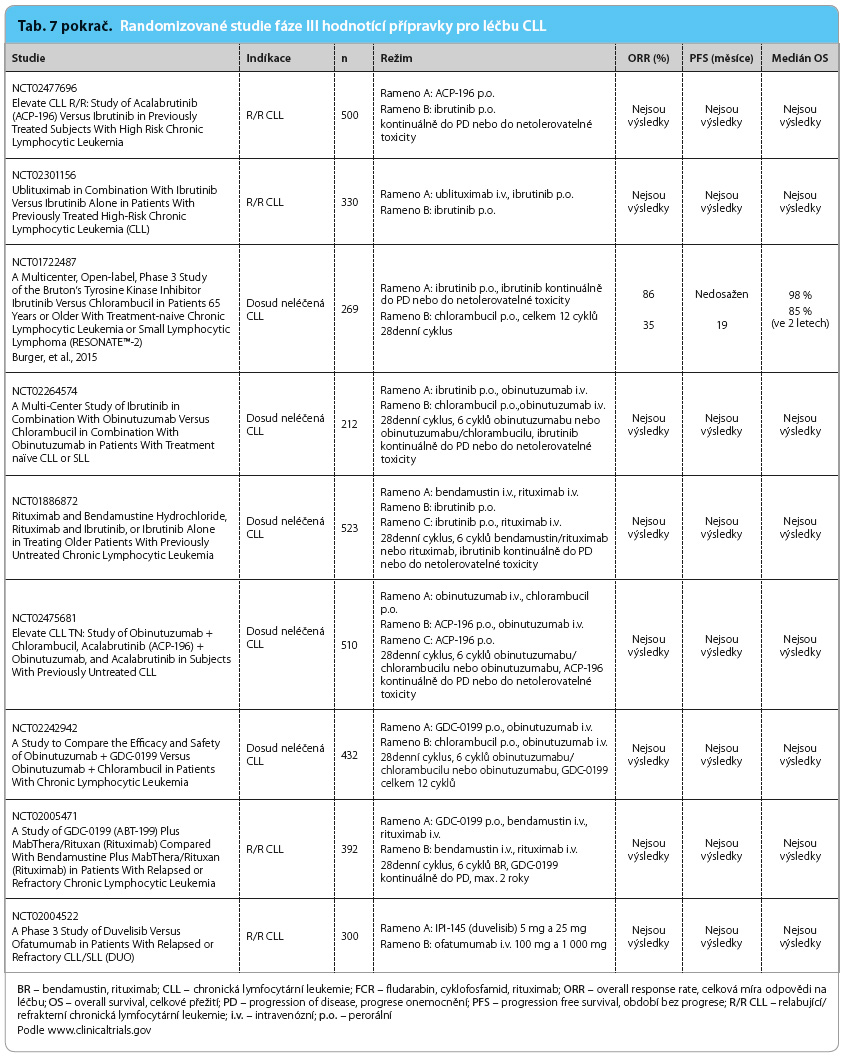 4 koreluje s toxicitou ibrutinibu a režimu BR. Výsledky studie hodnotící ibrutinib ve srovnání s chlorambucilem vedly ke schválení přípravku pro první linii léčby (ORR 86 % vs. 35 %, PFS nedosaženo vs. 19 měsíců, OS 94 % vs. 85 %) [35]. Pro dosud neléčené pacienty je aktuálně uspořádáno i několik dalších studií fáze III (tab. 7), kde je ibrutinib podáván v kombinaci s monoklonální protilátkou nebo s chemoimunoterapií.
4 koreluje s toxicitou ibrutinibu a režimu BR. Výsledky studie hodnotící ibrutinib ve srovnání s chlorambucilem vedly ke schválení přípravku pro první linii léčby (ORR 86 % vs. 35 %, PFS nedosaženo vs. 19 měsíců, OS 94 % vs. 85 %) [35]. Pro dosud neléčené pacienty je aktuálně uspořádáno i několik dalších studií fáze III (tab. 7), kde je ibrutinib podáván v kombinaci s monoklonální protilátkou nebo s chemoimunoterapií.
Specifickým fenoménem tohoto inhibitoru BTK je lymfocytóza. U většiny pacientů se objeví v úvodu léčby a odezní v průběhu 6–9 měsíců. Je způsobena uvolněním lymfocytů z lymfatických uzlin, pravděpodobně na podkladě inhibice některých signálních drah (CXCR4/5). Častější krvácení doprovází inhibice kolagenu a von Willebrandova faktoru, na kterém je závislá agregace krevních destiček. Závažnější formy krvácení byly u většiny případů spojeny se současným užíváním antagonistů vitaminu K. Další specifickou komplikací je fibrilace nebo flutter síní, pravděpodobně vyvolaný inhibicí BTK a tec proteinové tyrosinkinázy (TEC), která je v průběhu ataky arytmie zvýšeně exprimována v srdeční tkáni.
Nové možnosti léčby
Inhibitory BCL 2
Skupina proteinů BCL 2 je klíčovým regulátorem apoptotického procesu. Její součástí jsou proteiny zodpovědné za aktivaci apoptózy (proapoptotic – BAX, BAK, BAD, BIM, PUMA), ale i proteiny, které apoptóze brání (anti apoptotic, prosurvival – BCL 2, BCL XL, BCL W, MCL 1, BFL 1) [36,37].
Jedním z prvních identifikovaných apoptotických proteinů byl BCL 2. Důsledkem jeho zvýšené exprese je inhibice buněčné smrti a nekontrolovatelná proliferace B lymfocytů. Je též spojena s rezistencí na chemoterapii, s agresivním průběhem onemocnění a se zhoršením prognózy přežití. V klinických studiích se testuje několik nových molekul zacílených na inhibici tohoto proteinu. Pro CLL to je navitoclax (ABT 263), venetoclax (ABT 199) a obatoclax (GX15 070).
Navitoclax
Navitoclax (ABT 263) se váže na více proteinů patřících do skupiny BCL 2. Svou inhibicí BCL XL způsobuje navitoclax trombocytopenii, která limituje jeho využití [38].
Venetoclax
Venetoclax (ABT 199, GDC 0199, RG7601) je inhibitor BCL 2, který vykazuje vyšší selektivitu než navitoclax. Ve fázi I byl testován u 56 pacientů s R/R CLL. Dosažená ORR byla 85 % (13 % CR) a výsledky léčby byly nezávislé na přítomnosti del 17p a na refrakternosti vůči fludarabinovému režimu. Trombocytopenie byla při podávání venetoclaxu ve srovnání s navitoclaxem výrazně nižší. Nejčastější závažnou toxicitu představovala neutropenie (38 %) a tzv. tumor lysis syndrome (9 %) [39]. V březnu 2016 schválil FDA přípravek k terapii pacientů s R/R CLL s del 17p na základě výsledků studie fáze II, kde bylo dosaženo 80% ORR. V České republice přípravek zatím schválen není. Kombinace venetoclaxu s rituximabem má potenciál zlepšit účinnost léčby relapsů; je rovněž vyhodnocována ve studii fáze II se 49 pacienty. V prvních analýzách dosahuje ORR 86 %, z toho CR je 32 %. Toxicita stupně 3–4 se vyskytuje o něco častěji než při podávání monoterapie [40]. Nyní probíhá studie fáze III pro dosud neléčené pacienty s vysokým skóre CIRS, která hodnotí léčebné režimy venetoclax + obinutuzumab vs. chlorambucil + obinutuzumab, a pro pacienty s R/R CLL režimy venetoclax + rituximab vs. BR. Navíc se ukazuje, že by venetoclax mohl mít synergický účinek s ibrutinibem.
Obatoclax
Obatoclax (GX15 070) je další ze skupiny molekul inhibujících protein BCL 2. Jeho účinnost se zkouší v pilotních studiích u těžce předléčených pacientů v monoterapii i v kombinaci s FR (fludarabin + rituximab).
Imunomodulační léky
Lenalidomid
Lenalidomid je imunomodulační látka, která přímo působí na nádorovou buňku a zároveň ovlivňuje její interakci s mikroprostředím. To hraje důležitou roli v přežití maligních buněk. Lenalidomid je schválen k léčbě mnohočetného myelomu, myelodysplastického syndromu a lymfomu z plášťových buněk. Zdá se být účinný i v terapii jiných lymfoproliferativních onemocnění včetně CLL. V jedné z prvních prezentovaných studií fáze II určené pro pacienty s R/R CLL (45 pacientů) odpovědělo na léčbu celkem 47 % nemocných, z toho 9 % dosáhlo CR. Lenalidomid byl aplikován jako monoterapie a léčebná odpověď byla nezávislá na negativních prognostických faktorech (del 17p, 11q, nemutovaný gen IgVH) [41].
Následovalo několik dalších klinických studií fáze I a II, v nichž byl lenalidomid v monoterapii testován u skupiny pacientů s R/R CLL, ale i jako první linie léčby. Dávky lenalidomidu byly různé (2,5–25 mg/den), vyšší dávky byly spojeny s vyšším výskytem nežádoucích účinků, zejména hematologické toxicity a „flare reaction“ (náhle vzniklé zvětšení lymfatických uzlin se zarudnutím a zvýšenou citlivostí reagující na terapii nesteroidními antiflogistiky).
Ve snaze o prohloubení léčebné odpovědi byl přípravek testován v kombinaci s mAb. Přidání rituximabu k lenalidomidu (10 mg) sledované ve studii fáze II zaměřené na pacienty s R/R CLL přispělo k zesílení ADCC. Z 59 pacientů odpovědělo na léčbu 66 %, z toho CR dosáhlo 12 % pacientů [42]. Stejná kombinace – rituximab + lenalidomid – se stejným dávkovacím schématem byla testována i jako léčba první linie. Z celkem 48 pacientů dosáhlo ORR 83 %, 15 % s CR [43]. Udržovací terapie lenalidomidem po dosažení negativity tzv. minimální zbytkové nemoci (minimal residual disease, MRD) byla testována s režimem FCR v redukované dávce. Z dvaceti dosud neléčených pacientů dosáhlo ORR 95 %, CR 45 % [44]. Hematologická toxicita byla poměrně častá zejména při vyšších dávkách. U více než 50 % pacientů se objevila „flare reaction”.
Postavení lenalidomidu v terapii pacientů s CLL bude záviset na výsledcích některých dalších studií (lenalidomid + inhibitory B buněčného receptoru, lenalidomid + obinutuzumab, lenalidomid + rituximab + ibrutinib), které v současné době probíhají.
Závěr
V posledních letech došlo v léčbě CLL k významným pokrokům. Protokol FCR je stále léčbou první volby v první linii i při relapsu onemocnění CLL u pacientů v dobrém stavu bez závažných komorbidit. Toxicita tohoto režimu je vysoká, proto se v současné době dostává do popředí bendamustin v kombinaci s rituximabem. U starších a komorbidních pacientů je doporučena kombinace chlorambucilu s monoklonální protilátkou, která je schopna docílit u významné části nemocných kompletní remise onemocnění. Moderní léčebné protokoly vedou ke snížení leukemického klonu pod úroveň detekce běžnými metodami. Význam negativity minimální reziduální nemoci po léčbě v budoucnu pravděpodobně vzroste. Do běžné klinické praxe se dostávají nové molekuly s odlišným mechanismem účinku, se slibnými léčebnými výsledky, ale také se zcela novým spektrem nežádoucích účinků. Lze předpokládat, že v blízké budoucnosti budeme mít k dispozici další účinná léčiva, která přispějí k prodloužení celkového přežití a zlepší kvalitu života nemocných s CLL.
Prohlášení o konfliktu zájmů
Autorka práce prohlašuje, že v souvislosti s tématem, vznikem a s publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou společností. Toto prohlášení se týká i všech spoluautorů.
Poděkování
Práce vznikla za podpory Institucionálního rozvojového plánu OU v Ostravě, finanční prostředky přiděluje MŠMT (projekt č. IRP201550).
Seznam použité literatury
- [1] Molica S, Levato D. What is changing in the natural history of chronic lymphocytic leukemia? Haematologica 2001; 86: 8–12.
- [2] Dores GM, Anderson WF, Curtis RE, et al. Chronic lymphocytic leukaemia and small lymphocytic lymphoma: overview of the descriptive epidemiology.
- [3] Hallek M, Cheson BD, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute‑Working Group 1996 guidelines. Blood 2008; 111: 5446–5456.
- [4] Moreau EJ, Matutes E, A‘Hern RP, et al. Improvement of the chronic lymphocytic leukemia scoring system with the monoclonal antibody SN8 (CD79b). Am J Clin Pathol 1997; 108: 378–382.
- [5] Rai KR, Sawitsky A, Cronkite EP, et al. Clinical staging of chronic lymphocytic leukemia. Blood 1975; 46: 219–234.
- [6] Binet JL, Auquier A, Dighiero G, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981; 48: 198–206.
- [7] Dohner H, Stilgenbauer S, Benner A, et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000; 343: 1910–1916.
- [8] Ghia P, Stamatopoulos K, Belessi C, et al. ERIC recommendations on IGHV gene mutational status analysis in chronic lymphocytic leukemia. Leukemia. 2007; 21: 1–3.
- [9] Cramer P, Hallek M. Prognostic factors in chronic lymphocytic leukemia – what do we need to know? Nat Rev Clin Oncol 2011; 8: 38–47.
- [10] Malcikova J, Stano‑Kozubik K, Tichý B, et al. Detailed analysis of therapy‑driven clonal evolution of TP53 mutations in chronic lymphocytic leukemia. Leukemia. 2015; 29: 877–885.
- [11] Smolej L, et al. Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL). Česká skupina pro chronickou lymfocytární leukemii, sekce České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně (ČHS ČLS JEP), 9. 5. 2016, schváleno výborem ČHS ČLS JEP.
- [12] Eichhorst B, Robak T, Montserrat E, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up-dagger. Ann Oncol 2015; 26 (Suppl 5): v78–v84.
- [13] Kantorova B, Malcikova J, Brazdilova K, et al. Single
- [14] Cymbalista F, Müller C, Busch R, et al. Early Versus Deferred Treatment With Combined Fludarabine, Cyclophosphamide and Rituximab (FCR) Improves Event‑Free Survival In Patients With High‑Risk Binet Stage A Chronic Lymphocytic Leukemia – First Results Of a Randomized German‑French Cooperative
- [15] Salvi F, Miller MD, Grilli A, et al. A manual of guidelines to score the modified cumulative illness rating scale and its validation in acute hospitalized elderly patients. J Am Geriatr Soc 2008; 56: 1926–1931.
- [16] Keating MJ, Flinn I, Jain V, et al. Therapeutic role of alemtuzumab (Campath‑1H) in patients who have failed fludarabine: results of a large international study. Blood 2002; 99: 3554–3561.
- [17] Cheson BD. Monoclonal antibody therapy of chronic lymphocytic leukemia. Cancer Immunol Immunother 2006; 55: 188–196.
- [18] Hallek M, Fischer K, Fingerle‑Rowson G, et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open‑label, phase 3 trial. Lancet 2010; 376: 1164–1174.
- [19] Robak T, Dmoszynska A, Solal‑Celigny P, et al. Rituximab plus fludarabine and cyclophosphamide prolongs progression‑free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol 2010; 28: 1756–1765.
- [20] Eichhorst B, Fink AM, Busch R, et al. Frontline Chemoimmunotherapy with Fludarabine (F), Cyclophosphamide (C), and Rituximab (R) (FCR) Shows Superior Efficacy in Comparison to Bendamustine (B) and Rituximab (BR) in Previously Untreated and Physically Fit Patients (pts) with Advanced Chronic Lymphocytic Leukemia (CLL): Final Analysis of an International, Randomized Study of the German CLL Study Group (GCLLSG) (CLL10 Study). Blood 2014; 124: 19.
- [21] Beum PV, Lindorfer MA, Beurskens F, et al. Complement activation on B lymphocytes opsonized with rituximab or ofatumumab produces substantial changes in membrane structure preceding cell lysis. J Immunol 2008; 181: 822–832.
- [22] Herting F, Friess T, Bader S, et al. Enhanced anti‑tumor activity of the glycoengineered type II CD20 antibody obinutuzumab (GA101) in combination with chemotherapy in xenograft models of human lymphoma. Leuk Lymphoma 2014; 55: 2151–2160.
- [23] Goede V, Fischer K, Engelke A, et al. Obinutuzumab as frontline treatment of chronic lymphocytic leukemia: Updated results of the CLL11 study. Leukemia 2015; 29: 1602–1604.
- [24] Goede V, Fischer K, Busch R, et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370: 1101–1110.
- [25] Hallek M, Fingerle‑Rowson G, Fink AM, et al. First‑Line Treatment with Fludarabine (F), Cyclophosphamide (C), and Rituximab (R) (FCR) Improves Overall Survival (OS) in Previously Untreated Patients (pts) with Advanced Chronic Lymphocytic Leukemia (CLL): Results of a Randomized Phase III Trial On Behalf of An International Group of Investigators and the German CLL Study Group. Blood (ASH Annual Meeting Abstracts) 2009; 114: Abstract 535.
- [26] Michallet AS, Rossignol J, Cazin B, Ysebaert L. Ritux-
- [27] Yang Q, Modi P, Newcomb T, et al. Idelalisib: First‑in‑Class PI3K Delta Inhibitor for the Treatment of Chronic Lymphocytic Leukemia, Small Lymphocytic Leukemia, and Follicular Lymphoma. Clin Cancer Res 2015; 21: 1537–1542.
- [28] Furman RR, Sharman JP, Coutre SE. Idelalisib and Rituximab in Relapsed Chronic Lymphocytic Leukemia. N Engl J Med 2014; 370: 997–1007.
- [29] Zelenetz AD, Robak T, Coiffier B, et al. Idelalisib Plus Bendamustine and Rituximab (BR) Is Superior to BR Alone in Patients with Relapsed/Refractory Chronic Lymphocytic Leukemia: Results of a Phase 3 Randomized Double‑Blind Placebo‑Controlled Study. Blood 2015; 126: LBA‑5.
- [30] Byrd JC, Brown JR, O‘Brien S, et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014; 371: 213–223.
- [31] O’Brien S, Jones JA, Coutre SE, et al. Efficacy and safety of ibrutinib in patients with relapsed or refractory CLL/SLL with 17p deletion: results from the phase II RESONATE™‑17 trial, ASH 2014: 327.
- [32] Burger JA, Keating MJ, Wierda WG, et al. Safety and activity of ibrutinib plus rituximab for patients with high‑risk chronic lymphocytic leukaemia: a single‑arm, phase 2 study. Lancet Oncol 2014; 15: 1090–1099.
- [33] Kohrt HE, Sagiv‑Barfi I, Rafiq S, et al. Ibrutinib antagonizes rituximab‑dependent NK cell‑mediated cytotoxicity. Blood 2014; 123: 1957–1960.
- [34] https://www.jnj.com/news/all/Ibrutinib‑IMBRUVICA‑HELIOS‑Interim‑Analysis‑Study‑Data‑Show‑Significant‑Reductions‑in‑Risk‑of‑Progression‑or‑Death‑in‑Patients‑with‑Previously‑
- [34] Burger JA, Tedeschi A, Barr PM, et al. Ibrutinib as Initial Therapy for Patients with Chronic Lymphocytic Leukemia. N Engl J Med 2015; 373: 2425–2437.
- [35] Souers AJ, Leverson JD, Boghaert ER. ABT‑199, a potent and selective BCL‑2 inhibitor, achieves antitumor activity while sparing platelets. Nat Med 2013; 19: 202–208.
- [36] Balakrishnan K, Gandhi V. Bcl‑2 antagonists: a proof of concept for CLL therapy. Invest New Drugs 2013; 31: 1384–1394.
- [37] Roberts AW, Seymour JF, Brown JR, et al. Substantial susceptibility of chronic lymphocytic leukemia to BCL2 inhibition: results of a phase I study of navitoclax in patients with relapsed or refractory disease. J Clin Oncol 2012; 30: 488–496.
- [38] Seymour JF, Davids MS, Pagel JM, et al. (2013) Updated results of a phase I first‑in‑human study of the BCL‑2 inhibitor ABT‑199 (GDC‑0199) in patients with relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL). J Clin Oncol 2013; 31: Abstr 7018.
- [39] Roberts AW, Ma S, Brander DM, et al. Determination of recommended phase 2 dose of ABT‑199 (GDC‑0199) combined with rituximab (R) in patients with relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL). Blood 2014 (ASH Annual Meeting Abstracts) 124: Abstr 325.
- [40] Chanan‑Khan A, Miller KC, Musial L, et al. Clinical efficacy of lenalidomide in patients with relapsed or refractory chronic lymphocytic leukemia: results of a phase II study. J Clin Oncol 2006; 24: 5343–5349.
- [41] Badoux XC, Keating MJ, Wen S, et al. Phase II study of lenalidomide and rituximab as salvage therapy for patients with relapsed or refractory chronic lymphocytic leukemia. J Clin Oncol 2013; 31: 584–591.
- [42] Thompson PA, Keating MJ, Hinojosa C, et al. Lenalidomide and rituximab in combination as initial treatment of chronic lymphocytic leukemia: initial results of a phase II study. Blood 2014; 124: 1988a.
- [43] Mato AR, Foon KA, Feldman T, et al. Reduced‑dose fludarabine, cyclophosphamide, and rituximab (FCR‑Lite) plus lenalidomide, followed by lenalidomide consolidation/maintenance, in previously untreated chronic lymphocytic leukemia. Am J Hematol 2015; 90: 487–492.