Chronické onemocnění ledvin ve stadiu G3–5 z pohledu farmakoterapie
Základní farmakologicky ovlivnitelné léčebné postupy chronického onemocnění ledvin ve stadiu G3–5 před zahájením dialyzační léčby či před transplantací ledviny zahrnují normalizaci tlaku krve se snížením albuminurie/proteinurie, úpravu glykemie, léčbu hyperlipidemie, poruch Ca-P metabolismu, renální anémie, úpravu acidobazické rovnováhy a hyperurikemie. Významnou roli hrají upravené nízkobílkovinné diety se suplementy esenciálních aminokyselin a jejich ketoanalog.
Úvod
Onemocnění ledvin patří k častým problémům denní klinické praxe, s celkovou prevalencí výskytu až 10 %. Před podáváním léků je třeba zohlednit úroveň renální funkce, abychom zabránili předávkování a vzniku nežádoucích účinků léčby.Chronické onemocnění ledvin (CKD, chronic kidney disease) je definov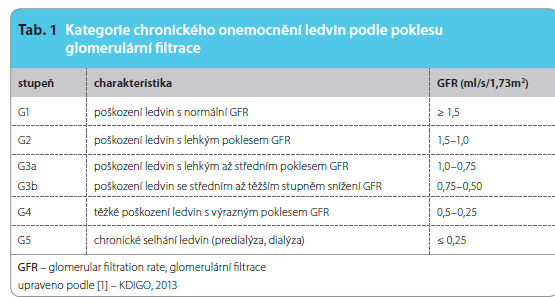 áno jako abnormality ve struktuře nebo funkci ledvin, které jsou přítomny déle než tři měsíce a mají důsledky pro zdraví pacienta [1]. V závislosti na poklesu glomerulární filtrace (glomerular filtration rate, GFR – udávané v zahraničí v jednotkách ml/min/1,73m2, u nás platí jednotky SI
áno jako abnormality ve struktuře nebo funkci ledvin, které jsou přítomny déle než tři měsíce a mají důsledky pro zdraví pacienta [1]. V závislosti na poklesu glomerulární filtrace (glomerular filtration rate, GFR – udávané v zahraničí v jednotkách ml/min/1,73m2, u nás platí jednotky SI 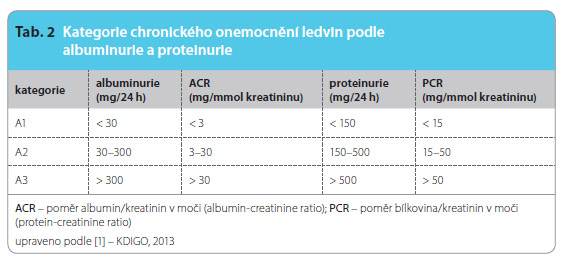 ml/s, tj. hodnoty filtrace se vydělí 60) můžeme rozdělit nemocné s chorobami ledvin nově do 6 kategorií (tab. 1). Toto rozdělení vyžaduje zhodnocení funkce ledvin, které se dnes často provádí pomocí výpočtové metody dle MDRD (Modification of Diet in Renal Disease) či CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) s přihlédnutím k míře albuminurie/proteinurie (tab. 2).
ml/s, tj. hodnoty filtrace se vydělí 60) můžeme rozdělit nemocné s chorobami ledvin nově do 6 kategorií (tab. 1). Toto rozdělení vyžaduje zhodnocení funkce ledvin, které se dnes často provádí pomocí výpočtové metody dle MDRD (Modification of Diet in Renal Disease) či CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) s přihlédnutím k míře albuminurie/proteinurie (tab. 2).
Kromě úvodního inzultu, který je způsoben renálním onemocněním ať již primární, či sekundární povahy a neovlivnitelnými faktory (věk, pohlaví, genetická predispozice), se na progresi podílejí další potencionálně farmakologicky ovlivnitelné rizikové faktory:
- progrese základního onemocnění (diagnóza, věk, pohlaví, genetika),
- arteriální hypertenze a kardiovaskulární komplikace,
- albuminurie (projev endoteliální dysfunkce)/proteinurie,
- hyperglykemie/diabetes,
- hyperlipidemie,
- poruchy Ca-P metabolismu,
- renální anémie,
- metabolická acidóza,
- hyperurikemie.
Léčba CKD ve stadiu pokročilého poškození, tj. ve stadiu G3–5 před zahájením dialyzační léčby či před preemptivní transplantací (transplantace před zahájením dialyzační léčby), má za cíl zpomalit progresi chronického onemocnění a upravit metabolické poruchy nemocného související se snižující se funkcí ledvin [2]. V progresi ledvinných chorob hrají významnou roli i kardiovaskulární onemocnění (KVO), či přímo srdeční selhání, která se sama o sobě mohou na vzniku CKD podílet či přítomné onemocnění dále urychlit. Léčba tzv. chronického kardiorenálního syndromu (typ 2 – chronické srdeční selhání vedoucí k poklesu renálních funkcí) a obráceně renokardiálního syndromu (typ 4 – chronické renální selhání vedoucí k poklesu srdeční funkce) je v současné době velmi aktuální.
Při již přítomné rozvinuté formě CKD je třeba věnovat pozornost iniciálnímu zařazení nemocného dle úrovně GFR, hodnoty sérového kreatininu a přítomné albuminurie/proteinurie. I když není dosud konzervativní léčba CKD vždy plně úspěšná a onemocnění u některých pacientů dále progreduje, je obtížné predikovat výsledek léčby na samém začátku. Proto by měla být vždy zahájena co nejdříve účelná farmakoterapie a dlouhodobě kontrolována v plném rozsahu dle compliance nemocných [3]. Dříve než nemocní dospějí do pokročilého stadia, je třeba rozhodnout o zařazení do dialyzačně-transplantačního programu. Je výhodné připravit nemocné k preemptivní transplantaci ledviny, a to jak s použitím ledviny živého dárce, tak i ledviny kadaverózní (zařazení do čekací listiny – waiting list – při GFR < 0,17 ml/s). V současné době jsou známy následující léčebné postupy, které mohou ovlivnit rychlost progrese onemocnění.
Léčba hypertenze
Terapeutické úsilí se zaměřuje na ovlivnění jak systémové, tak i glomerulární hypertenze a glomerulární hypertrofie, které jsou stále pokládány za nejdůležitější sekundární faktory progrese renální insuficience. Léčbou se snažíme dosáhnout normalizace tlaku krve (TK), tj. jeho snížení pod hodnotu 140/90 mm Hg. U mladších hypertoniků a u diabetiků je cílem TK ≈ 130/80 mm Hg. U nemocných s postižením ledvin a proteinurií se též doporučuje udržovat TK na hodnotě kolem 130/80 mm Hg.
Cílem terapie není jen snížení TK, ale také zpomalení rozvoje, eventuálně regrese orgánových změn a ovlivnění dalšího průběhu vaskulárních komplikací hypertenze. U izolované systolické hypertenze starších osob je cílem rovněž dosažení systolického TK < 140 mm Hg, TK však snižujeme velmi pozvolna (ne více než o 10 mm Hg za měsíc) za použití nižších dávek antihypertenziv. U nemocných s výraznější systolickou hypertenzí je někdy nutné nejdříve dosáhnout tzv. mezicíle, tj. systolického TK 150–160 mm Hg.
Je nepochybné, že úprava hypertenze na cílový TK ≤ 130/80 mm Hg představuje významný pokrok v ovlivnění nepříznivých orgánových účinků hypertenze. Současně je také ovlivněna proteinurie. V souladu se studií ACCORD u diabetiků 2. typu však snížení hraničního TK ze 140 mm Hg na 120 mm Hg neprokázalo pozitivní vliv na zpomalení progrese CKD, snížení GFR, byla však ovlivněna proteinurie či albuminurie [4]. Z tohoto aspektu prokázala studie ADVANCE v souboru 11 140 pacientů s diabetem 2. typu, že současné podání kombinace inhibitoru ACE (angiotenzin konvertujícího enzymu) perindoprilu s indapamidem a intenzivní kontrola glykemie gliklazidem snižuje riziko zhoršení přítomné nefropatie o 12–50 %, nově vzniklé albuminurie > 300 mg/24 hodin o 35–68 % a albuminurie < 300 mg/24 hodin o 17–34 % při celkovém snížení rizika úmrtí o 18 % [5].
Systém renin-angiotenzin-aldosteron (RAAS)
Inhibitory ACE byly prvními léky potvrzujícími příznivý vliv jejich podávání při CKD. Jasné důkazy byly přineseny v experimentálních studiích, jakož i v řadě klinických projektů. Pozitivní vliv spojený se snížením proteinurie s ohledem na současné zpomalení progrese renální insuficience však není zcela jasný u nemocných s CKD bez diabetu (především u geneticky podmíněných onemocnění, jako jsou polycystické ledviny či Alportův syndrom).
Mechanismus inhibitorů ACE a blokátorů receptorů AT1 pro angiotenzin II (ARB, sartanů) spočívá jak v hemodynamicko-antihypertenzním účinku, tak částečně i v protizánětlivém a antifibrotickém účinku. Přes možný aditivní účinek z hlediska proteinurie nebyl potvrzen pozitivní efekt současného podávání inhibitorů ACE a ARB na progresi onemocnění (studie COOPERATE, studie ONTARGET apod.) a jejich společné podávání se v současnosti i z hlediska kardiologického nedoporučuje.
Některé randomizované klinické studie prokazovaly, že inhibitory ACE a sartany zpomalují progresi CKD u pacientů s diabetickou nefropatií ve fázi albuminurie i manifestní proteinurie i u pacientů s nediabetickým onemocněním ledvin výrazněji (o 30–50 %) než jiná antihypertenziva, a měly by být u pacientů s CKD iniciálním lékem hypertenze [6]. Vedle systémového TK ovlivňují i intraglomerulární hypertenzi dilatací vas efferens. Tento účinek je patrný i u normotonických pacientů a vede ke snížení albuminurie i proteinurie [7].
Inhibitory ACE
Inhibitory ACE jsou léky první volby u hypertenzních renálních onemocnění se současnou proteinurií nebo s renální insuficiencí. Před zahájením léčby je třeba často vysadit suplementaci kalia a podávání kalium šetřících diuretik. Léčbu zahajujeme nízkou úvodní dávkou inhibitoru ACE, v závislosti na úrovni omezení funkce ledvin je nutná úprava dávkování buď snížením denní dávky, nebo prodloužením dávkovacího intervalu. K bezpečné definitivní udržovací dávce inhibitoru ACE u hypertenze s renální insuficiencí lze dospět velmi pozvolným zvyšováním dávky při monitoraci renálních funkcí a sérové koncentrace draslíku.
Zvýšené riziko vzniku akutního selhání ledvin při léčbě inhibitory ACE hrozí u osob se sníženou funkcí ledvin, starších nemocných, při závažném srdečním selhání, při snížení intravaskulárního objemu dehydratací (agresivní diuretickou léčbou, průjmy nebo nedostatečným příjmem tekutin), při sepsi a také při současné léčbě cyklosporinem nebo nesteroidními antirevmatiky. Vzestup hodnot sérového kreatininu nepřevyšující 30 % výchozí hodnoty, bez tendence k další progresi a provázený poklesem proteinurie není důvodem k přerušení léčby inhibitory ACE. Při výraznějším poklesu renální funkce u hypertonika s vyrovnanou volumovou bilancí po přerušení léčby pátráme po stenóze renální tepny.
Zvýšené riziko hyperkalemie při léčbě inhibitory ACE způsobuje současné podávání kalium šetřících diuretik, suplementace kalia, nesteroidních antirevmatik a hydrofilních betablokátorů u pacientů s renální insuficiencí na podkladě diabetické nefropatie. K potenciaci antihypertenzního i antiproteinurického účinku inhibitorů ACE dochází snížením přívodu soli nebo kombinací s dalšími antihypertenzivy – s diuretiky a s blokátory kalciových kanálů.
Sartany
Blokátory AT1 mají renoprotektivní účinek, především u diabetické nefropatie u diabetu 2. typu. Chybění suchého dráždivého kašle jako nejčastějšího nežádoucího účinku vyskytujícího se při léčbě inhibitory ACE je jejich nespornou předností. Při zahájení léčby sartany většinou není ovlivněna GFR a je přitom zachován antiproteinurický účinek. U osob s mírnou nebo středně závažnou renální insuficiencí není často třeba redukovat dávku. Zvýšená opatrnost je vhodná při hodnotě clearance endogenního kreatininu nižší než 0,25 ml/s.
Další antihypertenziva a jejich kombinace
Kontrola TK u diabetiků i nediabetiků s CKD není snadná a nejčastěji je podávána kombinace tří typů antihypertenziv [8]. Antihypertenzní a antiproteinurický účinek inhibitorů ACE a sartanů zvyšují diuretika. Dalšími vhodnými léky do kombinace jsou blokátory kalciového kanálu, betablokátory a nová centrální sympatolytika.
Diuretika
Thiazidová, kalium šetřící i kombinovaná diuretika se užívají u nemocných s renální hypertenzí a normální filtrační funkcí ledvin. Thiazidová diuretika ztrácejí svoji účinnost při sérové koncentraci kreatininu převyšující 220 μmol/l (clearance endogenního kreatininu < 0,67 ml/s) a jsou nahrazována kličkovými diuretiky. Furosemid je účinný při zvyšujícím se dávkování i při velmi pokročilé renální nedostatečnosti, je však třeba počítat s určitým rizikem nefrotoxicity.Současné podání thiazidového a kličkového diuretika má synergické působení, protože vede k sekvenční blokádě zpětné resorpce sodíku v průběhu celého nefronu (od proximálního tubulu až po kortikální část distálního tubulu). Umožní zvýšené vylučování sodíku, ale i draslíku při snížení dávky, zvláště kličkového diuretika, proto je nutné sledování sérové koncentrace draslíku. Spironolakton je indikován především u chronického srdečního selhání (NYHA III nebo IV) v kombinaci s kličkovými diuretiky (dávka 25 mg/den) a u primárního hyperaldosteronismu v denní dávce 25–75 mg. Při jeho podávání především spolu s inhibitory ACE a sartany je nutné u pacientů se sníženou renální funkcí pravidelně kontrolovat hodnoty draslíku pro riziko fatální hyperkalemie.
Blokátory kalciových kanálů
Blokátory kalciových kanálů snižují TK systémovou vazodilatací. Nevyvolávají ortostatickou hypotenzi, nepodporují sklon k retenci sodíku a vody, neovlivňují negativně metabolismus lipidů a glycidů, nevedou k bronchokonstrikci, příznivě ovliňují regresi hypertrofie levé komory srdeční, průtok krve ledvinou a periferním řečištěm. Otoky končetin jsou projevem zvýšené propustnosti kapilár, a nikoliv důsledkem zmnožení celkového extracelulárního objemu.
Blokátory kalciových kanálů (s výjimkou krátkodobě působících) jsou proto indikovány v léčbě hypertenze starších osob včetně izolované systolické hypertenze, dále u hypertenze provázené diabetem mellitem, chronickou obstrukční plicní nemocí, hypertrofií levé komory, paroxysmálními supraventrikulárními tachykardiemi (verapamil), renálním postižením a ischemickou chorobou dolních končetin. Blokátory kalciových kanálů je možno užít v léčbě hypertenze u těhotných. Isradipin i.v. může být použit v emergentních situacích.
Vzhledem k nepříznivému dlouhodobému účinku krátkodobě působících dihydropyridinů na výslednou kardiovaskulární mortalitu je třeba se jejich užití v léčbě hypertenze vystříhat, a to i v akutních stavech, kdy bylo dříve doporučováno podání nifedipinu. Tyto nepříznivé účinky nebyly prokázány u dihydropyridinů s dlouhodobým účinkem. Blokátory kalciových kanálů typu verapamilu, méně diltiazemu nejsou vhodné k léčbě hypertenze provázené srdeční slabostí nebo poruchami AV vedení pro jejich negativně inotropní účinek a zpomalení sinoatriálního a atrioventrikulárního vedení.
Betablokátory
Antagonisté β-adrenergních receptorů patří mezi nejužívanější antihypertenziva vhodná jak k monoterapii mírné až středně závažné hypertenze, tak pro kombinační léčbu těžké hypertenze (s diuretiky, blokátory kalcio-
vých kanálů, inhibitory ACE nebo blokátory AT1 a látkami s α-adrenergním účinkem).
Podle jejich afinity a vazby na receptory β1 a β2 je dělíme na selektivní a neselektivní. Některé betablokátory mají i částečnou β-agonistickou aktivitu (vnitřní sympatická aktivita – ISA). Byly syntetizovány betablokátory, které mají ještě další aditivní působení – vazodilatační účinek (např. labetalol s α-blokujícím účinkem nebo karvedilol, celiprolol). Betablokátory jsou léky volby u hypertenze provázené ischemickou chorobou srdeční (ICHS), anginou pectoris, stavy po akutním infarktu myokardu a u hypertenze s hyperkinetickou cirkulací. Výhodné je jejich podání u tachyarytmií. U hypertenze starších osob je podáváme nejčastěji v kombinaci s diuretiky. Kardioselektivní betablokátory můžeme použít i u diabetiků a také u hypertenze v těhotenství. Betablokátory s mírnou ISA jsou vhodné u hypertenze provázející diabetes mellitus.Betablokátory jsou kontraindikovány u asthma bronchiale, při atrioventrikulární blokádě II. a III. stupně, bradykardické formě sick sinus syndromu a akutním srdečním selhání.
Centrálně působící antihypertenziva
Centrálně nebo centrálně i periferně účinkující léčiva z této skupiny (α-methyldopa, klonidin, guanfacin, urapidil) jsou pro svůj sedativní účinek vhodná k léčbě hypertenze spojené s psychickou tenzí, dále pro léčbu renální hypertenze, hypertenze s metabolickými odchylkami a u hypertenze při diabetu mellitu. Methyldopa stále zůstává hlavním lékem pro perorální léčbu hypertenze v těhotenství. Často užívaný typ centrálně působících antihypertenziv představují agonisté imidazolinových receptorů I1 v CNS (moxonidin, rilmenidin), způsobují méně nežádoucích účinků (sedace, sucho v ústech) a při náhlém vysazení nenavozují rebound fenomén. Podávají se v jedné denní dávce a jsou metabolicky neutrální.
Alfablokátory
Blokátory periferních alfareceptorů (doxazosin, terazosin, prazosin) jsou indikovány v kombinaci s ostatními antihypertenzivy v léčbě těžké nebo rezistentní hypertenze. Na základě výsledků studie ALLHAT není doxazosin doporučován jako antihypertenzivum prvé linie. Pravděpodobně to bude platit i pro ostatní léky této skupiny. Doxazosin by rozhodně neměl být podáván nemocným s manifestním nebo latentním srdečním selháním. U prazosinu brání širšímu rozšíření prudký počáteční pokles TK (syndrom první dávky). V současné době preferujeme alfablokátory s delším poločasem účinku (doxazosin, terazosin).
Urapidil
Urapidil se nověji užívá k léčbě závažné a rezistentní hypertenze včetně parenterálního podání u hypertenzní krize.
Antihypertenziva s přímým vazodilatačním účinkem
Jejich antihypertenzní účinek je zprostředkován poklesem periferní cévní rezistence. Využívají se v léčbě esenciální hypertenze jen jako součást kombinační léčby. Vzhledem k časté reflexní tachykardii a zvýšeným metabolickým nárokům na myokard kombinujeme antihypertenziva s přímým vazodilatačním účinkem výhradně s betablokátory, případně ještě s diuretiky. U nemocných s ICHS nejsou vhodná bez kombinace s bradykardizujícími látkami (betablokátory, verapamil, diltiazem).
Minoxidil (denní dávka 2,5–5 mg, postupně zvyšovat až na 20–50 mg/den) je velmi účinné vazodilatační antihypertenzivum, ale vzhledem k velkému množství nežádoucích účinků je indikován jen u úporné rezistentní hypertenze jako součást kombinační léčby (vždy s betablokátory a diuretiky).Parenterální nitráty (nitroglycerin, isosorbid-dinitrát, nitroprusid sodný) se používají především v léčbě hypertenzní krize.
Metabolické poruchy spojené s progresí CKD
Reziduální diuréza a poruchy elektrolytů
Diuréza nemocných v chronické renální insuficienci má většinou normální objem, nebo se v důsledku porušené koncentrační schopnosti ledvin může vyskytnout i polyurie. Není vzácností, že denní diuréza se pohybuje okolo 2–3 l, v ojedinělých případech může být i vyšší. Obvykle to bývá v případech s výrazným porušením tubulárních funkcí (např. u některých nemocných s polycystickými ledvinami či tubulointersticiální nefritidou). Oligoanurie bývá přítomna v konečných stadiích chronického selhání ledvin, především u nemocných již delší dobu dialyzovaných v chronickém programu [9].
V případech, kdy dochází k polyurii, mají nemocní i polydipsii a jsou náchylní k dehydrataci. Celkové ztráty Na močí mohou být vysoké, močová koncentrace sodíku (UNa) se však trvale pohybuje okolo 60–70 mmol/l
(polyurická izostenurie). Z metabolického hlediska je důležité, že náhlé omezení příjmu NaCl v potravě může být pro tyto nemocné nebezpečné. Zvýšené ztráty sodíku močí trvají (zvýšená hodnota frakční exkrece sodíku do moči – FENa) a dochází k závažné dehydrataci, poklesu GFR a vzestupu hodnot sérových koncentrací kreatininu (SKr) a urey (Surea).
Pro posouzení bilance sodíku je nutné stanovit odpady sodíku močí za 24 hodin. Jestliže nemá nemocný žádné významné extrarenální ztráty (průjmy, zvracení, nadměrné pocení), představuje močové vylučování prakticky veškeré vylučování Na z organismu. U nemocných v pokročilejším stadiu CKD se hodnota UNa většinou pohybuje okolo 60–70 mmol/l. Sérová koncentrace draslíku může zůstat v rozmezí normy až do velmi pokročilého stadia CKD.
Přesnější informaci o stavu kaliové bilance umožní denní měření vylučování kalia. Za běžných podmínek se denní vylučování kalia pohybuje kolem 20–40 mmol. Vylučování draslíku lze při sklonu k hyperkalemii zvýšit podáním diuretik, především kličkových (furosemid), a to ve větších dávkách (40–120 mg/den) při kontrole odpadů kalia do moči. U nemocných v pokročilých stadiích CKD dochází většinou ke zvýšenému fekálnímu vylučování draslíku.
Poruchy acidobazické rovnováhy
U nemocných v pokročilejších stadiích renálních onemocnění se narušuje rovnováha vnitřního prostředí a vzniká metabolická acidóza. Tato metabolická odchylka je podmíněna snížením GFR a změnami tubulárních funkcí reziduálních nefronů. Snížení GFR podmiňuje snížené vylučování fosfátů a sulfátů. Při poklesu GFR pod hodnoty 15–20 ml/min (0,24–0,33 ml/s) však již zmíněné kompenzační mechanismy nestačí a vzniká metabolická acidóza se zvětšující se aniontovou mezerou. Pojmem aniontová mezera (anion gap) se rozumí rozdíl mezi běžně měřenými kationty a anionty /(Na+ +K+) – (Cl- + HCO3-)/, který je dán množstvím neměřených aniontů, především fosfátů, sulfátů a organických kyselin. Za fyziologických podmínek činí hodnota aniontové mezery 16 ± 2 mmol/l.
Z metabolického hlediska je však důležité, že metabolická acidóza se uvolňováním kalcia z kostí podílí na rozvoji renální osteopatie a vysoce významně zvyšuje intenzitu katabolických procesů. Snažíme se proto terapií dosáhnout toho, aby deficit bází nepřesahoval 5 mmol/l (většinou perorálním podáváním „jedlé sody" – hydrogenuhličitanu sodného v dávce 1–2 g/den).
Hyperurikemie
Epidemiologické studie prokazují častou asociaci mezi hyperurikemií a KVO. Etiologie nebyla jednoznačně objasněna. Také progrese CKD je spojena s hyperurikemií, která však je ve většině případů sekundární, nicméně její ovlivnění allopurinolem stabilizuje hyperurikemii a zabrání depozici urátových krystalů v ledvinném tubulointersticiu i cévní stěně. Léčebně hyperurikemii ovlivňujeme podáváním allopurinolu.
Diety s upraveným příjmem proteinů
Příznivé účinky diet s upraveným – sníženým – obsahem proteinů jsou známy více než padesát let (Addis, Giorgano, Giovanetti, Kluthe, Bergström, Aparicio, Lin, Kopple, Mitch atd.). V současné době se většinou ustoupilo od přísně nízkobílkovinných diet a pozornost je věnována tzv. optimálnímu příjmu a složení diety jako celku, tedy včetně proteinů [10]. Složení diety z hlediska kvalitativního může významně snížit i přítomnou hyperlipidemii (zvýšené zastoupení nasycených mastných kyselin a esenciálních mastných kyselin) a tím ovlivnit nepříznivý účinek aktivních lipoproteinových partikulí při progresi CKD (nepřímo je ovlivněna i tvorba prostaglandinů). Zvýšené zastoupení polysacharidů a vlákniny stabilizuje sacharidový metabolismus a ovlivní i hladinu triacylglycerolů. Dieta se podílí svojí energetickou hodnotou i na vyrovnané dusíkové bilanci a prevenci katabolismu [11, 12]. Dieta s upraveným příjmem proteinů významně snižuje příjem fosfátů a tím příznivě ovlivňuje hyperfosfatemii. Snižuje se tzv. kalcio-fosfátový produkt, je snížena produkce parathormonu.
Nelze pochybovat o příznivém účinku adekvátního příjmu bílkovin na metabolický stav organismu. Dle řady nálezů je zřejmé, 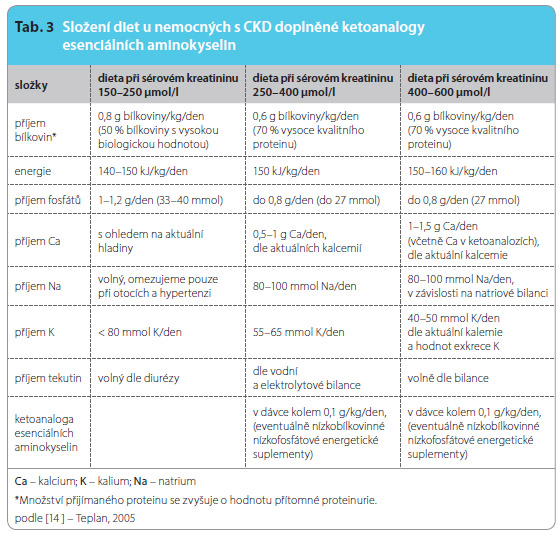 že je nutno omezit příjem bílkovin dříve, než dojde k těžkému poškození ledvin [13, 14]. Dietologická úprava příjmu bílkovin a energie je určována individuálně dle stupně snížení renálních funkcí a metabolického stavu nemocného (tab. 3).
že je nutno omezit příjem bílkovin dříve, než dojde k těžkému poškození ledvin [13, 14]. Dietologická úprava příjmu bílkovin a energie je určována individuálně dle stupně snížení renálních funkcí a metabolického stavu nemocného (tab. 3).
Kontraindikací dietní redukce příjmu proteinů jsou známky malnutrice a pokročilého uremického syndromu (polyneuropatie, uremická perikarditida, gastrointestinální uremické obtíže, retence tekutin při oligoanurii, těžká metabolická acidóza s katabolismem). Základní podmínkou je dobrá compliance a adherence k dietnímu režimu. Je nutná edukace nemocných, nejlépe zkušenou nutriční terapeutkou. Dodržování dietního režimu je též nutné pravidelně kontrolovat jak po stránce klinické (anamnéza, tělesná hmotnost, eventuálně antropometrie), tak laboratorně: kreatinin, urea, Na, K, Ca, P, vyšetření krevních plynů (Astrup), proteinurie, krevní obraz, odpady urey do moči/24 h (vydělením hodnoty odpadů urey do moči v mmol číslovkou 4 získáme odhad metabolizovaného proteinu, neboť z 1 g proteinu vzniká cca 5 mmol urey a 80 % urey se vylučuje močí), případně odpady fosforu do moči/24 h (neměly by přesáhnout hodnotu 1000–1200 mg, tj. cca 25–40 mmol/den).
Použití ketoanalog esenciálních aminokyselin
Významným pokrokem bylo nahrazení plnohodnotných esenciálních aminokyselin jejich ketoanalogy a hydroxyanalogy. Uskutečněné studie využily mechanismu reverzibilní transaminace vybraných esenciálních aminokyselin. Podávání bezdusíkatých „uhlíkových skeletů“ esenciálních aminokyselin ve formě jejich keto a hydroxyanalog vedlo jak k výraznému snížení příjmu exogenního dusíku do organismu, tak k využití části dusíku retinované močoviny k aminaci těchto aminokyselin. Formou ketoanalog byly podávány aminokyseliny leucin, izoleu-
cin, valin, fenylalanin a methionin. Ostatní esenciální aminokyseliny byly podávány ve své L-formě (lysin, threonin a tryptofan), neboť jejich aminace v organismu byla metabolicky náročná a méně efektivní. V sestavě aminokyselin byly doplněny histidin a tyrosin. V našich podmínkách nebyly většinou prokázány snížené hladiny histidinu, ale jeho využitelnost vázne. Histidin významně zlepšuje dusíkovou bilanci a podílí se i na stabilizaci krevního obrazu.
Ketoanaloga se spolu s nízkobílkovinnými dietami také podílejí na snížení albuminurie a proteinurie tím, že snižují intraglomerulární hypertenzi a zmírňují endoteliální dysfunkci. U nás dostupné přípravky mají ketoanaloga vázána ve formě kalciových solí, což znamená při obsahu např. 50 mg kalcia v jedné tabletě přípravku nezanedbatelný přísun kalcia. Ketoanaloga se podávají při jídle nebo bezprostředně po něm. Významně snižují i resorpci fosfátů ve střevě [15, 16].
Diabetes mellitus 2. typu CKD stadia G3–5
Ledviny jsou nejenom cílových orgánem postižení ve formě diabetického onemocnění ledvin, ale zasahují i do procesů regulace glykemie. Při hyperglykemii a překročení renálního prahu pro glukózu (tzv. střední práh pro glukózu je kolem 10 mmo/l) se objevuje glykosurie, která může být spojena s osmotickou polyurií a nebezpečím dehydratace. Při dlouhodobé glykosurii je častý výskyt močových infekcí.Ledviny se podílejí i na glukoneogenezi a degradaci inzulinu. Při renální insuficienci s obezitou může naopak převládnout inzulinová rezistence. Vzhledem k často přítomné renální anémii a zkrácenému poločasu přežívání erytrocytů bývá porušena syntéza hemu, a proto parametr glykovaného hemoglobinu (HbA1c) nekoreluje zcela lineárně s kompenzací diabetu [17]. Racionální farmakoterapie nemocných s diabetem mellitem (DM) a renální insuficiencí je společným úkolem diabetologů a nefrologů [18].
Léčebná opatření a nejčastěji podávaná antidiabetika
Upravená dieta s definovaným obsahem a složením živin (sacharidy, proteiny, lipidy, obsah NaCl, K, Ca a P) patří k základním opatřením při léčbě diabetiků 2. typu s renální insuficiencí a často vyžaduje spolupráci zkušené nutriční terapeutky.
Biguanidy
Metformin je výhodným lékem pro nemocné s DM 2. typu s výrazným potenciálem kombinace s dalšími antidiabetiky, téměř absencí rizika hypoglykemie, prevencí makrovaskulárních komplikací, eventuálně i příznivým vlivem na tělesnou hmotnost. Jeho výrazným omezením je užití pouze pro nemocné s CKD stadia G2–3 a limitem GFR 1 ml/s (60 ml/min). Použití metforminu u výrazné renální insuficience může vést k rozvoji závažné až potenciálně fatální laktátové acidózy. Pro možnost rozvoje průjmů asi u 10 % případů je nutno vzít v úvahu i riziko dehydratace a zhoršení renální funkce.
Thiazolidindiony
Pioglitazon je lékem druhé volby určeným především do kombinace s metforminem, ale i s deriváty sulfonylurey a s inzulinem. Efekt na glykemii je dán snížením inzulinové rezistence v tukové tkáni, svalech a játrech. V případě, že jsou při preskripci dodržena doporučení týkající se kontraindikací (srdeční selhání, hepatopatie), může být pioglitazon velmi účinným antidiabetikem pro pacienty s inzulinovou rezistencí. Thiazolidindiony se metabolizují v játrech a při renální insuficienci CKD stadia G3–5 nejsou kontraindikovány.
Deriváty sulfonylurey
Glibenklamid, gliklazid, gliquidon, glipizid a glimepirid patří mezi sekretagoga a spolu s metforminem představují nejčastěji užívaná perorální antidiabetika (PAD), která jsou často podávána jako součást kombinované léčby. Nevýhody derivátů sulfonylurey zahrnují riziko hypoglykemie, které se zvyšuje u renální insuficience a též při sníženém příjmu potravy. S výjimkou gliquidonu a gliklazidu se ostatní přípravky nedoporučuje podávat při poklesu GFR pod 0,67 ml/s (40 ml/min). Nejčastěji se podává při snížené renální funkci gliquidon.
Glinidy
Repaglinid a nateglinid řadíme stejně jako deriváty sulfonylurey mezi sekretagoga. Vyznačují se kratším účinkem, proto se podávají 3krát denně k hlavním jídlům. Jde o léky druhé volby (po metforminu), které se podávají i v kombinaci s ostatními PAD i s inzulinem. Mezi nežádoucí účinky léčby patří riziko hypoglykemie; glinidy mají řadu lékových interakcí, ale vylučují se játry, a proto je možné jejich užití i v pokročilejších fázích renální insuficience.
Gliptiny
Inhibitory dipeptidyl peptidázy 4 (DPP-4) blokují degradaci GLP-1 ze střeva, čímž stimulují při hyperglykemii (po jídle) sekreci inzulinu a inhibují sekreci glukagonu. Přestávají působit při dosažení euglykemie. Dále zpomalují evakuaci žaludku a vedou k pocitu nasycení. Užívají se především v kombinaci s metforminem. Zkušenosti u pacientů s renální insuficiencí jsou omezené, proto zatím nejsou podávány (s možnou výjimkou linagliptinu) ve stadiu CKD G5. Sitagliptin a saxagliptin lze s opatrností užívat do stadia CKD G3–4, vildagliptin pouze do stadia CKD G2 [17]. Všechny jsou vylučovány renálně s výjimkou linagliptinu.
GLP-1 mimetika
Exenatid a liraglutid mají účinky podobné gliptinům. Nevedou k hypoglykemiím, mohou se kombinovat s ostatními PAD, při jejich užívání dochází k poklesu tělesné hmotnosti. Kontraindikací podání z hlediska renálního je pokles GFR pod hodnotu 0,5 ml/s (30 ml/min).
Inhibitory absorpce glukózy
Akarbóza má příznivý vliv na tělesnou hmotnost a velký potenciál v kombinaci s ostatními PAD. U renální insuficience je možné použití do hodnoty GFR 0,5 ml/s (30 ml/min). Toto léčivo však zatím u nemocných s CKD stadia G3–5 nenachází širší uplatnění.
Inzulin
CKD ovlivňuje komplexně i kinetiku exogenně podaného inzulinu. S progresí renální insuficience potřeba inzulinu většinou klesá, ale bývá přítomna i častější labilita DM. Z inzulinů se většinou preferují krátkodobě působící přípravky, nejlépe analoga inzulinů, která lze použít v kombinaci s PAD. Inzuliny s prodlouženým účinkem (NPH) jsou problematičtější vzhledem k riziku vzniku hypoglykemie, s výhodou lze použít i inzulinová analoga.
Poruchy metabolismu lipidů
U pacientů s normální funkcí ledvin koreluje kardiovaskulární mortalita s plazmatickou koncentrací cholesterolu. U nemocných s CKD ve stadiu G3–5 však bylo paradoxně pozorováno, že kardiovaskulární mortalita se neměnila se zvyšováním hladin cholesterolu až k hodnotám 9 mmol/l, a naopak – její vzestup byl zaznamenán při poklesu cholesterolu pod 3,8 mmol/l. Tento paradox byl vysvětlen malnutricí, jejímž jedním markerem byl i cholesterol [19]. Pacienti s CKD s poklesem hodnot GFR nižším než 0,9 ml/s mají charakteristickou dyslipidemii (tzv. uremická dyslipidemie). Poruchy lipidového spektra u nemocných bez nefrotického syndromu jsou charakterizovány zvýšenou hodnotou celkových triacylglycerolů (TG), lipoproteinů o velmi nízké denzitě (VLDL) a částečně i lipoproteinů o nízké denzitě (LDL). Sérové koncentrace vysokodenzitních lipoproteinů (HDL) i HDL cholesterolu jsou nízké. Hladina celkového cholesterolu je většinou v mezích normálu či lehce zvýšená a nebývají přítomny ani výraznější změny v koncentracích LDL cholesterolu. U nemocných s nefrotickým syndromem je navíc významně zvýšena hladina celkového LDL cholesterolu.
Uvedené nálezy se vyskytují u vysokého procenta nemocných (30–70 %). Zajímavé je zjištění, že změny lipidového spektra jsou identické bez ohledu na základní ledvinné onemocnění. Pro nefrotický syndrom s velkou proteinurií, hypoalbuminemií a poruchami koagulace je typická výrazně zvýšená hladina celkového cholesterolu, LDL cholesterolu a snížení hladiny HDL cholesterolu. Dyslipidemie se vyskytuje již při snížení GFR na méně než 1 ml/s (60 ml/min).
Úloha ledvin v mechanismu syntézy či katabolismu lipoproteinů není dosud plně objasněna. Ledviny se podílejí na degradaci řady hormonů, které významně ovlivňují metabolismus (inzulin, glukagon, růstový hormon, adrenalin, parathormon apod.). Experimentální studie ale ukazují, že hyperlipoproteinemie není v korelaci s úbytkem ledvinné tkáně (a tedy snížením metabolické funkce), ale je výsledkem sekundárních biochemických změn souvisejících se snížením exkreční schopnosti ledvin. Vzhledem k tomu, že nejsou k dispozici validní data z prospektivních kontrolovaných klinických randomizovaných multicentrických studií u pacientů s CKD, jsou pro tyto nemocné doporučovány stejné cílové hodnoty sérového cholesterolu jako pro pacienty s vysokým kardiovaskulárním rizikem.
U pacientů s CKD stadia G3–5 dosud nedialyzovaných by léčba statiny, eventuálně i jinými hypolipidemiky, mohla ovlivnit i progresi ledvinného onemocnění. Dle retrospektivní analýzy americké databáze dialyzovaných pacientů měli pacienti léčení statiny o 32 % nižší celkovou a o 36 % nižší kardiovaskulární mortalitu. Studie ALERT s fluvastatinem zaměřená na sledování pacientů po transplantaci ledviny ve srovnání s placebem nesnížila celkovou kardiovaskulární morbiditu, ale významně se snížil výskyt závažných kardiovaskulárních příhod (o 28 %), kardiovaskulární mortality (o 38 %) a nefatálního infarktu myokardu (o 32 %).
U dialyzovaných pacientů byly v krátké době po sobě uskutečněny tři velké studie (4D u dialyzovaných diabetiků s atorvastatinem, AURORA s rosuvastatinem a největší z nich, studie SHARP [20] s podáním kombinace 20 mg simvastatinu a 10 mg ezetimibu). Zatímco v první studii nebyl prokázán jednoznačný efekt na kardiovaskulární riziko u zvýšeně rizikových nemocných diabetiků na dialýze (i když byl snížen počet cévních mozkových příhod), studie SHARP jasně potvrdila, že snížení hladiny LDL cholesterolu je pro pacienty s CKD stejně přínosné jako pro jiné skupiny nemocných. Tento nález je významný i z toho aspektu, že patogeneze kardiovaskulárních příhod u pacientů s již přítomným chronickým selháním ledvin je nepochybně odlišná. Zatímco v běžné populaci jednoznačně převažuje ateroskleróza, u nefrologických pacientů se uplatňuje i mediokalcinóza, hypertrofie levé komory srdeční, arytmie a srdeční selhání. Přestože tyto mechanismy nemohou statiny přímo ovlivnit, studie SHARP prokázala efekt dlouhodobého snížení hodnoty LDL cholesterolu i u těchto pacientů. Navíc, u pacientů s normální či lehce sníženou renální funkcí bylo snížení rizika kardiovaskulárních komplikací přímo úměrné snížení hodnoty LDL cholesterolu.
Hypolipidemická léčba
Léčba hyperlipidemie by měla začít úpravou životního stylu, tedy změnou diety a zvýšením tělesné aktivity. V závislosti na tíži renálního postižení tato opatření sníží hladiny triacylglycerolů u více než poloviny pacientů. Při volbě léků pomůže podrobnější zhodnocení lipidového profilu.
Statiny
Nejúčinnějšími léky pro snížení koncentrace LDL cholesterolu jsou statiny (inhibitory hydroxymethylglutaryl-CoA reduktázy), které přímo ovlivňují metabolickou tvorbu cholesterolu. U nefrologických nemocných, především u pacientů s nefrotickým syndromem, dochází v glomerulech k influxu makrofágů, zvětšení velikosti glomerulů, expanzi mezangiální matrix, depozici lipidů a k tvorbě pěnových buněk se zvýšením exprese kolagenu IV, fibronektinu a lamininu. U těchto pacientů lze příznivý efekt statinů vysvětlit ovlivněním hypercholesterolemie a dalších poruch lipidového metabolismu [6].
Kromě tohoto evidentního mechanismu nefroprotektivního působení statinů však, obdobně jako u KVO, přibývá experimentálních i klinických studií popisujících příznivý účinek statinů dříve, než dojde ke snížení koncentrace cholesterolu, nebo u stavů s normální koncentrací cholesterolu. Tyto tzv. pleiotropní účinky, tj. účinky statinů nezávislé na koncentraci cholesterolu, jsou intenzivně studovány v souvislosti s léčbou KVO a přibývá rovněž informací o jejich existenci v nefrologické literatuře. Jde především o účinek nefroprotektivní (snížení proteinurie, zmírnění endoteliální dysfunkce), snížení zánětlivé odpovědi v cévách a jejich imunomodulační účinky. Nežádoucí účinky léčby se vyskytují u 2–4 % nemocných. Nejčastějšími jsou gastrointestinální potíže (zácpa nebo průjem, flatulence, nauzea, břišní křeče), u některých nemocných může dojít ke zvýšení aktivity jaterních enzymů. Nejzávažnější nežádoucí účinek představuje myotoxicita.
Fibráty
U pacientů s nízkou koncentrací LDL i HDL cholesterolu a hypertriglyceridemií jsou lékem volby fibráty. Lze užít i kombinace statinu a fibrátu, ale s výrazně zvýšeným rizikem nežádoucích účinků, především s možností rhabdomyolýzy u rizikových nemocných (diabetici, nemocní po transplantaci ledviny). Fibráty aktivují nukleární transkripční faktory, které ovlivňují syntézu několika apolipoproteinů a lipoproteinové lipázy. Zvyšují aktivitu lipoproteinové lipázy a tím dochází k urychlení katabolismu VLDL. Zvýšená aktivita lipoproteinové lipázy je patrně také příčinou zvýšeného odbourávání LDL částic cestou LDL receptorů. Snižují syntézu VLDL a LDL v játrech, snižují sekreci apolipoproteinu B, vedou ke snížené tvorbě VLDL v játrech a ke zvýšenému vylučování cholesterolu do žluče. Zvýšení plazmatické a tkáňové aktivity lipoproteinové lipázy a snížený obsah apoC-III v lipoproteinech bohatých na triglyceridy může přispívat k účinku fibrátů. Malé denzní LDL částice vykazují sníženou afinitu vůči LDL receptorům. Jejich přeměna na větší LDL částice působením fibrátů je činí vnímavější pro LDL receptory. Fibráty také významně zvyšují tvorbu apoA-I a apoA-II v játrech.
Fibráty snižují hladinu triglyceridů, zvyšují hladinu HDL cholesterolu a lze je použít u mírné až středně závažné hypercholesterolemie. Je třeba monitorovat jaterní testy. Fibráty jsou lékem volby u hypertriglyceride-
mie. Ta bývá často provázena nižší hladinou HDL cholesterolu, tvorbou malých LDL částic, které jsou snáze oxidovatelné a jeví větší proaterogenní působení, postprandiální lipemií a zvýšenou hladinu inhibitoru plazminogenu (PAI-1). Nežádoucí účinky fibrátů jsou podobné jako u statinů. Nejčastějšími jsou gastrointestinální potíže (viz výše), u některých nemocných může dojít ke zvýšení aktivity jaterních enzymů. K myotoxicitě může vést kombinace fibrátů a statinů.
Poruchy kalcio-fosfátového metabolismu, renální osteopatie
Chronické snížení renálních funkcí je spojeno s abnormalitami v metabolismu Ca a P, parathormonu (PTH) a vitaminu D. S poklesem GFR stoupá hladina PTH a klesá hladina 1,25-dihydroxycholekalciferolu (kalcitriol). Tyto změny jsou pravděpodobně způsobeny iniciální retencí P spojenou s poklesem GFR a průvodním poklesem ionizovaného Ca. Pokud nejsou hypokalcemie a hyperfosfatemie řádně léčeny (i když jsou zprvu asymp-
tomatické), vedou k rozvoji:
- renální osteopatie s vysokým kostním obratem typu sekundární hyperparatyreózy–renální osteodystrofie (osteitis fibrosa),
- renální osteopatie s nízkým kostním obratem (osteomalacie či aplastická/adynamická/ forma kostní choroby),
- smíšené formy zahrnující obě složky.
Vzestup hladiny PTH bývá zachycen již při poklesu GFR na 50 % normální hodnoty, nejspíše jako reakce na hypokalcemii. V návaznosti na to se zjišťují poruchy v hydroxylaci vitaminu D3 na 1,25-dihydroxyvitamin D3 (kalcitriol). Teprve pokles GFR pod 0,6 ml/s je provázen pravidelně zhoršenou mineralizací skeletu, jednoznačným deficitem kalcitriolu, poklesem střevní absorpce kalcia a počátkem zvýšené stimulace sekrece PTH.
Závažným způsobem se ve vývoji renální osteopatie typu sekundární hyperparatyreózy uplatňuje retence fosfátů. Jejich sérová koncentrace není zvýšená, pokud GFR neklesne k hodnotě 0,25 ml/s. Adaptivní nárůst exkrece fosfátů v reziduálních nefronech zajišťuje normofosfatemii. Současně se začíná na skeletu objevovat nepříznivý vliv metabolické acidózy a zvyšující se sérové koncentrace vitaminu A. V konečné fázi CKD převládá vliv extracelulární retence fosfátů, podporující nepřímým či přímým mechanismem sekreci PTH. Zároveň se v organismu hromadí magnesium, fluor a hliník – prvky podmiňující vývoj osteomalacie [21–23].
Léčebné postupy
V průběhu progrese CKD ve stadiu G3b–5 je častým jevem vývoj negativní kalciové bilance, kterému je třeba předcházet ještě před zjištěním hypokalcemie. Děje se tak při GFR < 0,8 ml/s, kdy je průkazný nedostatek kalcitriolu, klesá střevní resorpce kalcia a hladiny PTH dále narůstají. Není-li současně zvýšena fosfatemie, podáváme effervescentní formy kalcia, ne ale v kombinaci s citráty (které podporují absorpci hliníku) a s fluorem pro nebezpečí retence fluoru a jejího nepříznivého vlivu na skelet. Ve fázi rozvinuté ledvinové nedostatečnosti s hyperfosfatemií podáváme uhličitan nebo octan vápenatý. Ketoanaloga esenciálních aminokyselin, jejichž podávání představuje součást nutričních opatření, obsahují až 50 mg kalcia v jedné tabletě. Běžnou dávkou kalcitriolu nepřesahující 0,5 mg/den per os (p.o.) se podporuje střevní absorpce kalcia (ale i fosforu).
Hyperkalcemie je méně častým jevem, ale o to závažnějším. Objevuje se jako možný důsledek iatrogenně vyvolaného předávkování výše uvedenými léky nebo je projevem pokročilé sekundární hyperparatyreózy. Po jejím zjištění se redukuje (až vysazuje) stávající dávka kalcia a kalcitriolu a snažíme se zvýšit mineralizaci skeletu kalcitoninem (intravenózně nebo v méně pokročilých případech intranazálně) a/nebo bisfosfonáty typu klodronátu, lépe v pomalé infuzi než p.o. Nejistý je význam kortikosteroidů při potlačení absorpce kalcia. Nejzávažnější urgentní stavy je nutné řešit hemodialýzou se sníženým obsahem kalcia v dialyzačním roztoku a v případě dekompenzované hyperparatyreózy s eventuálními metastatickými kalcifikacemi i urgentní paratyreoidektomií. V současné době se však s úspěchem podávají agonisté kalciových receptorů (kalcimimetika), takže paratyreoidektomie je z této indikace spíše výjimečná.
Hyperfosfatemie je nejproblémovější, život limitující abnormalitou vnitřního prostředí s dopadem na vývoj sekundární hyperparatyreózy, metastatických kalcifikací nejen makroskopických, ale i mikrokalcifikací ve stěně tepen a je snížena účinnost léčení vitaminem D. Recentní nálezy potvrzují, že fibroblastický růstový faktor 23 (FGF-23)
je úzce spojen s ovlivněním metabolismu fosfátů u nemocných s CKD. Při poklesu GFR jeho hladina stoupá a ovlivňuje fosfaturii. Hyperfosfatemie je velmi časnou známkou počínající dekompenzace chronické renální insuficience a jejího přechodu do počínajícího uremického stavu.
Soubor opatření zaměřených proti nárůstu fosfatemie začíná omezením přísunu bílkovin a potravin s vysokým obsahem fosforu (dieta s obsahem bílkovin do 0,8 g/kg tělesné hmotnosti nemocného/den, příjem fosfátů do 1000 mg/den). Přitom v zažívacím traktu se absorbuje 60–70 % z požitých fosfátů. Nedílnou součástí terapie hyperfosfatemie je použití některého ze střevních vazačů fosfátů.V současné době se pozornost věnuje vazačům fosfátů. Hlavním zástupcem je syntetický neabsorbovatelný polymer sevelamer hydrochlorid. Tento přípravek na bázi pryskyřice má i vedlejší příznivý efekt – snižuje hladinu LDL cholesterolu. Pozornost je třeba věnovat podávání v dostatečných dávkách společně s jídlem. Dalším možným absorbentem fosfátů je uhličitan lanthanu. Podává se v dávkách 700–3000 mg/den. Resorpci fosfátů ve střevě omezují i ketoanaloga esenciálních aminokyselin.
Kalcitriol
Poznatky o receptorech pro kalcitriol v sekrečních buňkách příštítných tělísek byly léčebně využity. Konvenční způsob terapie kalcitriolem (0,25–0,50 µg/den) pokrývá jeho nedostatečnou produkci v ledvinách. Předpokládá se, že vysokými dávkami farmaka podaného nárazově p.o. nebo i.v. lze dosáhnout hladiny kalcitriolu v cirkulaci účinné natolik, že je schopna potlačit zvýšenou syntézu a sekreci PTH nezávisle na sérovém kalciu. V současnosti je tento postup nahrazován léčbou účinným analogem kalcitriolu paricalcitolem – selektivním aktivátorem receptoru vitaminu D.U nemocných s nepostiženým jaterním parenchymem byl kalcitriol nahrazen podáváním 1α(OH)D3 p.o. (alfakalcidol).
Analoga kalcitriolu
Možnosti farmakologického léčení sekundární hyperparatyreózy nejsou vyčerpány kalcitriolem. Jsou syntetizována nová analoga kalcitriolu, jejichž předností je méně výrazná hyperkalcemická (i hyperfosfatemická) reakce při potlačení sekrece PTH na vzájemně téměř srovnatelné úrovni. Náleží k nim 1α-(OH)D2 (doxercalciferol), který je stejně jako výše zmíněný alfakalcidol konvertován v játrech na dihydroxyderivát, a dále 22-oxakalcitriol (OCT, maxacalcitol), a především 19-nor-l,25(OH)2D2 (paricalcitol).
Kalcimimetika
Identifikace extracelulárních kalciových receptorů uložených mj. na membráně buněk příštítných tělísek a příprava kalcimimetik jako látek zvyšujících citlivost těchto calcium-sensing receptorů (CaSR) vůči iontům kalcia v cirkulaci jsou významným pokrokem v chápání mechanismů některých poruch kalciové homeostázy a jejich léčení. V případě primární i sekundární hyperparatyreózy působí kalcimimetika jako agonisté kalciových receptorů. Jejich vlivem narůstá intracelulární koncentrace kalcia v příštítných tělískách sledovaná poklesem sekrece PTH. V parafolikulárních C-buňkách štítné žlázy je prostřednictvím těchto receptorů stimulována sekrece kalcitoninu, v ledvinném tubulu se pravděpodobně zvyšuje reabsorpce kalcia. Z hlediska chemické struktury se jedná v současné době o deriváty fenylalkylaminu. Přípravkem, s nímž jsou největší zkušenosti, je cinakalcet. V terapii sekundární hyperparatyreózy se používá v dávce 30–180 mg/den.
Antiresorpční léčba
U pacientů léčených pro CKD imunosupresivy a s přibývajícím počtem pacientů po transplantaci ledviny vystupuje v posledních letech do popředí problematika glukokortikoidy indukované demineralizace skeletu, navíc za těchto podmínek ovlivněné ostatními faktory renální osteopatie. Při vyloučení podílu závažné hyper- i hypoparatyreózy podáváme u pacientů s onemocněním ledvin a s denzitometricky prokázanou osteopenií (T-skóre –1,0 až –2,5) kombinaci vápníku a alfakalcidolu (případně kalcitriolu u nemocných se současným postižením jaterního parenchymu); a při DXA (dual-energy X-ray absorptiometry) nálezu T-skóre pod hodnotou –2,5 pak k této terapii přidáváme i některý z antiresorpčních přípravků běžně používaných při léčbě sekundární osteoporózy, jako jsou bisfosfonáty risedronát nebo alendronát, kalcitonin ve formě nazálního spreje, u postmenopauzálních žen pak eventuálně selektivní modulátor estrogenových receptorů (SERM) raloxifen nebo hormonální léčbu (HRT). Léčbu zahajujeme v případě mírné nebo střední renální insuficience zpravidla bisfosfonáty.
Renální anémie
Většina pacientů s CKD stadia G4 a G5 vykazuje různý stupeň normochromní, normocytární anémie. I když je hlavní příčinou vzniku anémie snížená tvorba erytrocytů v důsledku poruchy sekrece erytropoetinu, může se na vzniku anémie podílet řada dalších faktorů. Závažná metabolická acidóza spolu s tzv. uremickými toxiny mohou vést k hemolýze a tím ke sníženému přežívání erytrocytů o třetinu až polovinu. Na tí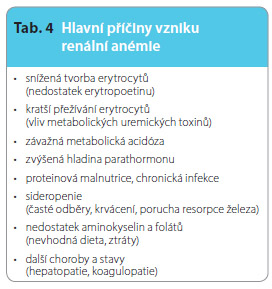 ži anémie se uplatňuje i zvýšená hladina PTH při sekundární hyperparatyreóze a také proteinová malnutrice [24].Hlavní příčiny renální anémie jsou v přehledu shrnuty v tab. 4.Před zahájením léčby anémie při CKD stadia G3–5 je třeba podrobné vyšetření jejích příčin, aby bylo možno předejít rezistenci vůči léčbě. V anamnéze je potřeba pátrat po případném krvácení. Dále je třeba zjistit velikost sleziny. Je nutné řádné zhotovení krevního obrazu včetně počtu trombocytů, diferenciálního rozpočtu leukocytů a počtu retikulocytů. Je zapotřebí vyšetřit hladinu železa, TIBC (total iron-binding capacity), eventuálně feritinu, zhodnotit funkci jater a hemokoagulační poměry [25].Vyšetřovat příčiny anémie bychom měli začít za situace, kdy koncentrace hemoglobinu (Hb) klesne pod hodnotu 115 g/l u premenopauzálních žen, pod 120 g/l u postmenopauzálních žen a mužů starších 70 let a pod 135 g/l u mužů mladšího věku. Jako hlavní příčina anémie se bude renální složka vyskytovat u nemocných s poklesem GFR pod hodnotu nižší než 0,5 ml/s v případě nediabetiků a pod hodnotu nižší než 0,75 ml/s u diabetiků. U diabetiků se anémie vyskytuje 2–3krát častěji než u nediabetiků s renálním postižením [26].
ži anémie se uplatňuje i zvýšená hladina PTH při sekundární hyperparatyreóze a také proteinová malnutrice [24].Hlavní příčiny renální anémie jsou v přehledu shrnuty v tab. 4.Před zahájením léčby anémie při CKD stadia G3–5 je třeba podrobné vyšetření jejích příčin, aby bylo možno předejít rezistenci vůči léčbě. V anamnéze je potřeba pátrat po případném krvácení. Dále je třeba zjistit velikost sleziny. Je nutné řádné zhotovení krevního obrazu včetně počtu trombocytů, diferenciálního rozpočtu leukocytů a počtu retikulocytů. Je zapotřebí vyšetřit hladinu železa, TIBC (total iron-binding capacity), eventuálně feritinu, zhodnotit funkci jater a hemokoagulační poměry [25].Vyšetřovat příčiny anémie bychom měli začít za situace, kdy koncentrace hemoglobinu (Hb) klesne pod hodnotu 115 g/l u premenopauzálních žen, pod 120 g/l u postmenopauzálních žen a mužů starších 70 let a pod 135 g/l u mužů mladšího věku. Jako hlavní příčina anémie se bude renální složka vyskytovat u nemocných s poklesem GFR pod hodnotu nižší než 0,5 ml/s v případě nediabetiků a pod hodnotu nižší než 0,75 ml/s u diabetiků. U diabetiků se anémie vyskytuje 2–3krát častěji než u nediabetiků s renálním postižením [26].
Léčebné postupy
Léčba prostřednictvím ESA (erythropoietic stimulating agents) by u anémie s převažující renální složkou měla být zahájena při poklesu koncentrace Hb pod hodnotu 110 g/l. Při vyšších hladinách Hb se ESA podávají za situace, kdy jsou u nemocného přítomny symptomatické projevy anémie, např. dušnost či angina pectoris. Cílové hodnoty Hb při léčbě by měly být vyšší než 110 g/l a udržovány v rozmezí 110–120 g/l. Hodnoty Hb vyšší než 130 g/l jsou již považovány za nebezpečné, zejména u kardiaků.
Při podávaní ESA, které stimulují zvýšenou syntézu erytrocytů, je nutné zajištění adekvátních zásob železa. Hodnota feritinu by měla být vyšší než 100 µg/l. Při kalkulaci dávek železa se počítá se spotřebou 150 mg železa pro vzestup Hb o 10 g. U nemocných v predialýze podáváme železo p.o. Pokud je množství hypochromních erytrocytů vyšší než 10 %, je nutné podat 1000 mg železa i.v. během 6–10 týdnů k doplnění jeho zásob. Hladiny železa je potřeba kontrolovat v rozmezí 4–6 týdnů v iniciální fázi léčby ESA či při změně jeho dávek, za stabilizovaného stavu po 3 měsících.
Iniciální dávky ESA se liší podle podávaného přípravku. U epoetinu alfa je to 50 IU/kg 2krát týdně, u epoetinu beta 40 IU/kg 2krát týdně, u darbepoetinu alfa 0,45 µg/kg/týden a u methoxypolyethylenglykolepoetinu beta (pegepoetin) 120 µg za měsíc. Lze doporučit i další účinné přípravky ESA, např. epoetin zeta, který se v korekční fázi dávkuje 50 IU/kg 3krát týdně, v udržovací fázi 75–300 IU/kg týdně. Pokud jsou zásoby železa v doporučeném rozmezí, je vyloučena infekce a krvácení do GIT, a přesto je hodnota Hb nižší než 110 g/l, zvyšujeme dávku ESA o 50 % oproti dávkám původním. Za rezistenci (hyporesponzivitu) na terapii ESA považujeme stav, kdy dávky epoetinu přesahují 300 IU/kg/týden (20 000 IU). Kromě deficitu železa je nutné vyloučit další faktory, především chronickou infekci a malnutrici, které k tomuto stavu mohou vést.U nemocných se selháním ledvin, kteří jsou současně onkologicky nemocní a léčení chemoterapií, se může objevit kombinovaná anémie vyžadující vyšší dávky ESA. Současně též není vzácností závažná leukopenie, která vedle standardního postupu někdy vyžaduje i podávání přípravků obsahujících růstové faktory těchto hematopoetických řad.
Závěr
Onemocnění ledvin probíhají velmi často dlouhodobě a jejich průběh a prognózu mohou významně ovlivnit zvolené léčebné postupy. Základní farmakologicky ovlivnitelné léčebné postupy zahrnují normalizaci tlaku krve, snížení albuminurie/proteinurie, úpravu glykemie, dyslipidemie, poruch Ca-P metabolismu, renální anémie, úpravu acidobazické rovnováhy a hyperurikemie. Významnou roli hrají také upravené nízkobílkovinné diety se suplementy esenciálních aminokyselin a jejich ketoanalog.
Seznam použité literatury
- [1] Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease, KDIGO, 2013, dostupné na http://kdigo.org (navštíveno 20. 7. 2014)
- [2] Turner JM, Bauer C, Abramowitz K, et al. Treatment of chronic kidney disease. Kidney Int 2012; 81: 351–362.
- [3] Teplan V. Nefrologické minimum pro klinickou praxi. Aeskulap, Mladá fronta, Praha, 2013, 317 s.
- [4] Tesař V. Léčba hypertenze u renální insuficience a dialýzy. Interní Med 2010; 12: 270–274.
- [5] Zoungas S, De Galan BE, Ninomyia T, et al. Combined effect of routine blood pressure lowering and intensive glukose control on macrovascular and microvascular outcomes in patients with type 2 diabetes: New results from ADVANCE trial. Diabetes Care 2009; 32: 2068–2074.
- [6] The Gisen Group: randomized placebo-controlled trial of effect of ramipril on decline in GFR and risk of terminal renal failure in proteinuric, non-diabetic nephropathy. Lancet 1997; 349: 1857–1863.
- [7] Lewiss EJ, Hinsicker LG, Clarke WR, et al. Renoprotective effect of the angiotensin receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2000; 345: 855–860.
- [8] Monhart V. Hypertenze a ledviny. Praha, Triton, 2004, 130 s.
- [9] Teplan V. Metabolismus a ledviny. Praha, Grada Publishing 2000, 412 s.
- [10] Aparicio M, Bellizi V, Chauveau P, et al. Protein restricted diet plus keto/amino acids – a valid therapeutic approach for chronic kidney disease. J Ren Nutr 2012; 22 (Suppl 2): S1–S24.
- [11] Fouque D, Laville M, Boissel JP. Low protein diets for chronic kidney disease in nondiabetic adults. Cochrane Database Syst Rev 2006; 19: CD 001892.
- [12] Mitch WE. Beneficial response to modified diets in treating patients with chronic kidney disease. Kidney Int 2005; Suppl 94: 133–135.
- [13] Teplan V, Mengerová O. Dieta a nutriční opatření u chorob ledvin a močových cest. Aeskulap, Mladá fronta, Praha, 2010, 353 s.
- [14] Teplan V. Pharmacological features of a keto amino acids. Am J Nephrol 2005; 25 (Suppl 1): 13–14.
- [15] Teplan V. Keto/Amino acids in the treatment of chronic kidney disease patients: 30 years experience in 3,000 patients. Am J Nephrol 2005; 25 (Suppl 1): 8–10.
- [16] Aparicio M, Bellizi V, Chauveau P, et al. Do ketoanalogues still have a role in delaying dialysis initiation in CKD predialysis patients? Sem Dial 2013; 26: 714–719.
- [17] Vachek J, Zakiyanov O, Tesař V. Farmakoterapie diabetes mellitus 2. typu u pacientů s chronickým onemocněním ledvin. Kazuistiky v diabetologii 2011; 5: 10–13.
- [18] Haneda M, Morikawa A. Which hypoglycaemic agents to use in type 2 diabetic subjects with CKD and how? Nephrol Dial Transpl 2009; 24: 338–341.
- [19] Tesař V. Dyslipidemie u renálních onemocnění. Farmakoterapie 2006; 2: 201–204.
- [20] Baigent C, Landray MJ, Reith C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Sharp): a randomized placebo-controlled trial. Lancet 2011; 377: 2181–2192.
- [21] Dusilová-Sulková S. Renální osteopatie. Praha, Maxdorf Jessenius, 2007, 204 s.
- [22] Dusilová-Sulková S, Opatrná S, Ryšavá R, et al. KDIGO doporučení pro diagnostiku a léčbu CKD-MBD: komentovaný návod pro klinickou praxi. Aktuality v nefrologii 2010; 16: 113–116.
- [23] Sotorník I, Bubeníček P. Léčeba renální osteopatie, in Teplan V. a kol. Praktická nefrologie. Praha, Grada Publishing, 2006: 103–105.
- [24] Ryšavá R. Anemie v predialýze a možnosti její korekce, in Viklický O, et al. Predialýza. Praha, Maxdorf Jessenius, 2013: 98–108.
- [25] Zahálková J. Anemie u chronického selhání ledvin. Postgrad Med 2003; 5: 1009–1014.
- [26] Solomon SD, Uno H, Lewis EF, et al. Erythropoietic response and outcomes in kidney disease and type 2 diabetes. N Engl J Med 2010; 363: 1146–1155.