Chronický kardiorenální syndrom a glifloziny – pohled kardiologa
Souhrn
Kořínek J, Dobiáš M. Chronický kardiorenální syndrom a glifloziny – pohled kardiologa. Remedia 2023; 33: 250–257.
Chronický kardiorenální syndrom (KRS) představuje jeden z pěti typů KRS, kdy dochází k postižení funkce ledvin u pacientů trpících chronickým srdečním selháním (HF). Srdeční selhání i chronické onemocnění ledvin (CKD) jsou provázeny a priori vysokou mortalitou i morbiditou, které mohou být dále potencovány jejich vzájemnou kombinací, přičemž mohou být terapeuticky obtížně ovlivnitelné. Glifloziny, inhibitory SGLT2 (sodíko‑glukózového kotransportéru 2), se na základě velkých randomizovaných studií ukázaly jako účinná terapeutika v léčbě všech tří fenotypových forem HF (s redukovanou, mírně redukovanou a zachovanou ejekční frakcí), přičemž rovněž potvrdily svoji efektivitu v léčbě pacientů s CKD. Jejich kardioprotektivní a renoprotektivní působení je velmi komplexní a nabízí tak u pacientů s chronickým KRS nové léčebné možnosti, které jsou diskutovány v tomto přehledovém článku.
Klíčová slova: kardiorenální syndrom – srdeční selhání – chronické onemocnění ledvin – glifloziny.
Summary
Korinek J, Dobias M. Chronic cardiorenal syndrome and gliflozins – a cardiologist's view. Remedia 2023; 33: 250–257.
Chronic cardiorenal syndrome (CRS) represents one of the five CRS in which renal dysfunction occurs in patients with chronic heart failure (HF). HF and chronic kidney disease (CKD) are a priori accompanied with high mortality and morbidity that can be further potentiated by their combination, while these conditions might be difficult to treat. Gliflozins (SGLT2 inhibitors – sodium‑glucose co‑transporter‑2) have been shown, based on results of large randomized trials, to be very effective therapeutics in treatment of all three phenotypic forms of HF (with reduced, mildly reduced and preserved ejection fraction, EF) and moreover have demonstrated their effectiveness in the treatment of patients with CKD. Their cardioprotective and renoprotective actions are very complex and offer novel treatment options in patients with chronic CRS that are discussed in this review article.
Key words: cardiorenal syndrome – heart failure – chronic kidney disease – gliflozins.
Úvod
Srdeční selhání (heart failure, HF) je komplexní syndrom, který je spojen s vysokou mortalitou, morbiditou a snížením kvality života pacientů [1,2]. Onemocnění je často doprovázeno poruchou funkce ledvin se snížením glomerulární filtrace (GF) a eventuálně albuminurií či proteinurií, přičemž až 30 % pacientů s HF má středně těžkou až těžkou renální dysfunkci hodnocenou pomocí odhadované rychlosti GF (estimated glomerular filtration rate, eGFR) [3]. Přítomnost chronického onemocnění ledvin (chronic kidney disease, CKD) u pacientů s HF dále zhoršuje jejich stav i prognózu [4] a může představovat značnou terapeutickou výzvu [3].
Srdce a ledvina jsou patofyziologicky velmi komplexně propojeny na základě hemodynamických, neurohumorálních, imunitních/zánětlivých, biochemických a mnoha dalších interakcí a zpětných vazeb, což může vést k situaci, kdy onemocnění jednoho orgánu může zapříčinit či potencovat poruchu funkce orgánu druhého a obráceně [3,5].
 Pro tento stav se používá termín kardiorenální syndrom (KRS), který se dělí dále podle toho, který orgán byl postižen první (zda srdce, či ledvina), jak rychle tento stav vznikl (akutně, či chronicky) a zda postižení srdce či ledviny je primární, či sekundární. Rozlišujeme tak celkem pět typů KRS, a to akutní a chronický KRS, akutní a chronický renokardiální syndrom a sekundární KRS [3] (viz tab. 1).
Pro tento stav se používá termín kardiorenální syndrom (KRS), který se dělí dále podle toho, který orgán byl postižen první (zda srdce, či ledvina), jak rychle tento stav vznikl (akutně, či chronicky) a zda postižení srdce či ledviny je primární, či sekundární. Rozlišujeme tak celkem pět typů KRS, a to akutní a chronický KRS, akutní a chronický renokardiální syndrom a sekundární KRS [3] (viz tab. 1).
Tento přehledový článek se zabývá potenciálními přínosy gliflozinů, inhibitorů sodíko-glukózového kotransportéru 2 (sodium‑glucose co‑transporter‑2, SGLT2), v léčbě pacientů s druhým typem KRS – chronickým kardiorenálním syndromem.
Chronický kardiorenální syndrom
Chronický KRS představuje ve výše zmíněné klasifikaci druhý typ, kdy se předpokládá, že rozvoj a progrese HF indukují renální dysfunkci s iniciací CKD či podílem na jeho progresi. Pouhá přítomnost CKD u chronického HF nemusí být dostatečná k etablování diagnózy chronického KRS v pravém slova smyslu, protože nemusí být zřejmá časová souvislost mezi oběma patologiemi.
Lze tedy teoreticky rozlišovat dva scénáře. Prvním je renální dysfunkce, která je reálně navozena HF a jeho progresí – tedy nejdříve dochází k rozvoji HF, který je následován renální dysfunkcí s progresí CKD. Pro tento případ je typická mnohem větší variabilita kolísání eGFR zejména ve vztahu ke kompenzaci a dekompenzaci HF. Druhým scénářem je pak chronické CKD, které bylo přítomno před rozvojem HF, nicméně nebylo před diagnózou HF včas rozpoznáno. Rozvoj HF tak přichází do terénu již probíhajícího CKD a je pro něj typičtější postupná progrese zhoršení eGFR s menšími výchylkami vázanými na stav HF.
V klinické praxi nemusí být rozlišení těchto situací vždy jednoznačné, pokud např. nemáme k dispozici informace o zhoršení eGFR před rozvojem HF. Celou situaci může komplikovat i přítomnost rizikových faktorů, které jsou pro obě nemoci společné, jako například arteriální hypertenze, obezita, diabetes mellitus či již etablované aterosklerotické postižení cévního řečiště; tyto rizikové faktory mohou ovlivnit patogenezi obou klinických jednotek.
Etiologicky se u HF v rámci chronického KRS mohou uplatnit prakticky všechny popisované příčiny HF, jako jsou například ischemická choroba srdeční, arteriální hypertenze, chlopenní vady, různé typy kardiomyopatií (dilatační, hypertrofická a další), infiltrativní (např. amyloidóza) a střádavá onemocnění (například Fabryho choroba), onemocnění perikardu a endokardu, infekční onemocnění a mnohá další, která jsou podrobněji popsána v současnosti platných evropských doporučeních z roku 2021 [1] a v jejich české variantě publikované v roce 2022 [6].
Srdeční selhání je fenotypicky děleno podle ejekční frakce (EF) levé komory na tři podskupiny: se sníženou (redukovanou) EF (≤ 40 %) – HFrEF, s mírně redukovanou EF (41–49 %) – HFmrEF – a se zachovanou EF (≥ 50 %) – HFpEF [1]. I když toto dělení je široce využíváno v klinické praxi, není schopno postihnout rozsáhlou fenotypovou problematiku u HF. Nicméně je aplikováno v četných studiích u HF, kdy často bývají skupiny HFmrEF a HFpEF zahrnovány do společných studií a analýz, a to včetně studií s glifloziny (pro účely tohoto článku se zkratkou HFmr/pEF).
Prevalence CKD se u jednotlivých podtypů HF poněkud liší [7]. Dle švédského registru prevalence CKD (hranice eGFR < 60 ml/min/1,73 m2) narůstá se zvyšující se EF: u HFrEF byla 45 %, u HFmrEF 48 % a u HFpEF 56 % [8]. Jednoletá celková mortalita byla zvýšena u všech typů HF, pokud bylo CKD přítomno (u HFpEF 22,6 % vs. 13,4 %, u HFmrEF 22,4 % vs. 7,8 % a u HFrEF 23,0 % vs. 8,0 %), přičemž silněji bylo s CKD asociováno HFrEF a HFmrEF než HFpEF [7,8].
Jak již bylo zmíněno v úvodu, v rozvoji chronického KRS se uplatňuje velké množství patogenetických mechanismů, které však mohou být u jednotlivých fenotypů HF různě kombinovány, mohou být různé intenzity a případně se i lišit.
Z hemodynamických faktorů se zde například uplatňuje snížený srdeční výdej či zvýšení centrálního žilního tlaku, dále dochází k aktivaci neurohumorálního systému s aktivací sympatického nervového systému (SNS), osy renin‑angiotenzin‑aldosteron (RAAS), s aktivací natriuretického systému, nicméně s jeho nedostatečným účinkem. Častá je přítomnost endoteliální dysfunkce, zvýšení oxidačního stresu, fibrózy, anémie a mnoha dalších vlivů včetně působení zánětlivých faktorů s dysregulací produkce cytokinů a imunitní reakce [3,5].
Časová souslednost složek chronického KRS je důležitá nejen z patofyziologického pohledu, ale i z hlediska diagnostického a léčebného. Například diagnóza jiné etiologie CKD, než je jen vlastní HF, může vést k odlišnému managementu původce CKD nezávisle na HF. Na druhou stranu přítomnost CKD (zejména v pokročilejších stadiích) může vést k odlišné iniciaci, titraci, či až k přerušení některých léčebných přístupů u HF [3]. Pacienti s pokročilým CKD mohou mít i zhoršenou odpověď na léčbu diuretiky, což činí management HF obtížnějším [3].
Avšak je třeba uvést, že existují terapeutické možnosti, které mohou cílit na obě složky chronického KRS – HF i CKD – a které mohou být relativně nezávislé na časové souslednosti. Příkladem jsou inhibitory angiotenzin konvertujícího enzymu (angiotensin‑converting enzyme, ACE) nebo sartany, které interferují s RAAS, jehož dysregulace je jednou z patogenetických cest u HF i CKD. Inhibitory ACE i sartany jsou tak využívány v léčbě HF i CKD, přičemž mohou mít pozitivní vliv na rozvoj a zpomalení progrese CKD u HF a vice versa, čímž mohou ovlivnit, případně zpozdit i rozvoj chronického KRS.
Základní farmakoterapeutické přístupy u jednotlivých typů HF se mohou podobat, nicméně v současné době dle doporučení pro léčbu HF máme nejvíce důkazů ve vysoké třídě a úrovni IA či IB u HFrEF, což je v kontrastu s HFpEF a HFmrEF. Například u HFpEF byly ve třídě a úrovni důkazů IC doporučeny screening a léčba etiologií HF, kardiovaskulárních (KV) a nekardiovaskulárních komorbidit u HF a je doporučena diuretická léčba u pacientů s HF a kongescí k úlevě od symptomů [1]. K ostatním třídám léčiv, která využíváme u HFrEF, se doporučení pro HFpEF příliš nevyjadřují, a to i vzhledem k nedostatku a nejisté kvalitě dostupných dat o jednotlivých typech medikamentózní léčby.
Tato situace se v současné době může změnit díky výsledkům studií s glifloziny u pacientů s HFmr/pEF, přičemž ke změně u HFrEF již došlo a glifloziny jsou v léčbě pacientů s HFrEF doporučovány ve třídě a úrovni důkazů IA [1]. U pacientů s HFrEF prokázaly glifloziny svou bezpečnost a účinnost ve studiích s dapagliflozinem (DAPA‑HF) [9] a empagliflozinem (EMPEROR‑Reduced) [10] a v kombinované populaci HFmrEF a HFpEF pak ve dvou velkých randomizovaných studiích EMPEROR‑Preserved [11] s empagliflozinem a DELIVER [12] s dapagliflozinem.
Navíc již máme k dispozici pozitivní výsledky studií s glifloziny u CKD, což může být velmi důležité i pro pacienty s chronickým KRS. Přínos byl iniciálně doložen při terapii s kanagliflozinem u populace diabetiků s CKD (studie CREDENCE) [13]. Následně byly dokladovány účinnost a bezpečnost léčby též v populacích zahrnujících nediabetiky i diabetiky s CKD ve studiích s dapagliflozinem (studie DAPA‑CKD) [14] a recentně též u empagliflozinu (studie EMPA‑KIDNEY) [15].
Patofyziologický potenciál gliflozinů u chronického KRS
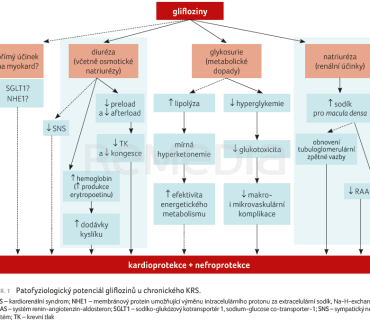 Glifloziny vykazují kardioprotektivní i nefroprotektivní účinky (obr. 1). Mechanismy působení gliflozinů jsou intenzivně studovány, nejsou však plně objasněny. Je ale zřejmé, že jejich účinek je multifaktoriální a odehrává se na mnoha úrovních, z čehož vyplývá i komplexnost jejich efektu a terapeutického potenciálu u HF i CKD. Je možné, že část těchto účinků může mít větší váhu v patofyziologii HF (a to ještě členěného dle EF) než u CKD nebo být pro srdce unikátní, což může platit i naopak.
Glifloziny vykazují kardioprotektivní i nefroprotektivní účinky (obr. 1). Mechanismy působení gliflozinů jsou intenzivně studovány, nejsou však plně objasněny. Je ale zřejmé, že jejich účinek je multifaktoriální a odehrává se na mnoha úrovních, z čehož vyplývá i komplexnost jejich efektu a terapeutického potenciálu u HF i CKD. Je možné, že část těchto účinků může mít větší váhu v patofyziologii HF (a to ještě členěného dle EF) než u CKD nebo být pro srdce unikátní, což může platit i naopak.
Ať jsou již mechanismy známé, či neznámé, přínosy gliflozinů na základě předpokládaného či prokázaného patofyziologického působení jsou podpořeny pozitivními výsledky řady velkých randomizovaných studií u HF i CKD. To naznačuje interferenci gliflozinů s patologickými procesy, které se účastní rozvoje a progrese HF i CKD, a ukazuje tak jejich potenciál nejen v léčbě HF a CKD, ale také u pacientů s chronickým KRS.
Potenciální kardioprotektivní účinky gliflozinů
Glifloziny inhibují SGLT2 v ledvině, čímž navodí glykosurii a natriurézu, které jsou provázeny diuretickým efektem a díky glykosurii zejména osmotickou diurézou [16]. Glifloziny jsou tak schopny snížením objemu tekutin zasáhnout hemodynamicky, kdy snižují preload („předtížení“) i afterload („dotížení“) se snížením krevního tlaku [17].
Snížením afterloadu snižují práci myokardu a nároky myokardu na palivo a kyslík, což je přínosné pro selhávající levou komoru. Redukcí preloadu snižují objemové přetížení srdce u HF. Ve srovnání s klasickými diuretiky typu furosemidu více ovlivňují extravaskulární (intersticiální) objem tekutin než intravaskulární [18], což vede jednak k nižší reaktivní aktivaci sympatického nervstva spouštěné redukcí intravaskulárního objemu, jednak k výraznějšímu snížení známek kongesce, jež je dána hromaděním tekutin mimo cévní řečiště. Tento účinek je zřejmě zprostředkován zejména díky osmotické diuréze při glykosurii.
Kardioprotektivní efekt přináší i omezení glukotoxicity. Děje se tak díky antihyperglykemickému účinku gliflozinů navozenému glykosurií s následným ovlivněním mnoha patologických procesů uplatňujících se zejména u diabetu, jako je ovlivnění hladiny oxidačního stresu a glykace molekul [19,20]. Z dlouhodobého hlediska tak glifloziny mohou ovlivňovat jak makrovaskulární komplikace s aterogenezí [21], tak i komplikace mikrovaskulární, přičemž oboje se mohou podílet na patofyziologii HF.
Glifloziny jsou schopny ovlivnit i energetický metabolismus selhávajícího myokardu, zvyšují nabídku cirkulujících ketonů jako paliva pro myokard [22,23]. Navíc při terapii glifloziny stoupá koncentrace hemoglobinu v krvi, což zvyšuje nabídku kyslíku tkáním včetně myokardu (a také ledvinám). Částečně se může uplatňovat hemokoncentrace navozená vyšší diurézou, nicméně se zdá, že z větší části se může podílet zvýšení hematopoezy díky zvýšené produkci erytropoetinu při terapii glifloziny [24,25].
Léčba glifloziny moduluje i neurohumorální aktivaci systémů RAAS [26] a SNS [27], jež jsou aktivovány zejména u pacientů s HFrEF. Blokádou SGLT2 glifloziny zvýší nabídku sodíku pro macula densa v glomerulu, čímž ovlivňují aktivitu RAAS přímo v ledvině. Patogeneze snížení aktivity sympatiku není zcela objasněna. Glifloziny v porovnání s furosemidem relativně méně snižují intravaskulární objem, čímž i méně aktivují SNS, který na úbytek intravaskulárního objemu reaguje zvýšenou aktivitou. Podílet se může schopnost gliflozinů snižovat aferentní signály SNS z ledviny při snížené reabsorpci glukózy, jejíž zvýšená absorpce může naopak sympatikus stimulovat.
Glifloziny jsou do určité míry schopny modulovat inflamatorní [28] a fibrotické procesy [29], které se mohou podílet na patogenezi HF, a to zejména u HFpEF. Glifloziny mohou mít i přímý účinek na myokard – například ovlivněním fungování Na‑H‑exchangeru 1 (NHE1) [30] s následnými změnami hladin sodíku v myokardu. V samotném myokardu nejsou SGLT2 přítomny, nicméně prokazatelně jsou zde SGLT1. To naznačuje možnost, že méně selektivní glifloziny mohou skrze inhibici SGLT1 myokard ovlivňovat i přímo. Inhibice SGLT2 může rovněž redukovat masu myokardu a ovlivnit tak patologickou hypertrofii a remodelaci, podílet se může i redukce afterloadu navozená glifloziny, nicméně mechanismus tohoto účinku není plně objasněn.
Potenciální renoprotektivní účinky gliflozinů
Podobně jako u kardioprotektivního efektu gliflozinů se i u nefroprotektivních účinků zřejmě bude jednat o komplexní děj probíhající na několika úrovních.
Jedním z důležitých podkladů renoprotektivního účinku je schopnost gliflozinů snížit nadměrnou tubulární reabsorpci a redukovat glomerulární hyperfiltraci, přičemž tento efekt je nezávislý na snížení glykemie, takže může fungovat univerzálněji než pouze u diabetiků [31].
Inhibice SGLT2 normalizuje přísun sodíku k macula densa glomerulu snížený při jeho zvýšené reabsorpci navozené glomerulární hyperfiltrací. Následkem toho se zvýší produkce adenosinu s indukcí vazokonstrikce aferentní arterioly, což vede ke snížení tlaku a k redukci glomerulární hyperfiltrace [31]. Glifloziny tak obnovují tubuloglomerulární zpětnou vazbu a mají potenciál omezit negativní patologické dopady glomerulární hyperfiltrace, jako jsou poškození a hypertrofie podocytů, poškození a zesílení glomerulární bazální membrány, glomerulární a tubulární hypertrofie, hypoxie, inflamatorní procesy intersticia a fibrózy.
Vyjma přímého zlepšení renální hemodynamiky může být renoprotektivní efekt částečně zprostředkován i výše zmíněnými kardioprotektivními mechanismy, které se mohou uplatnit i v ledvině. Lze si představit, že ovlivnění systémové hemodynamiky glifloziny s redukcí krevního tlaku při snížení afterloadu a preloadu s redukcí centrálního žilního tlaku bude mít dopady i na renální hemodynamiku a také bude představovat z dlouhodobého hlediska pozitivní renoprotektivní efekt.
Podobně jako u kardioprotektivních účinků může mít ovlivnění aktivace intrarenálního a systémového RAAS i SNS renoprotektivní účinky [32]. Obdobně mohou i v ledvině působit na metabolismus, zánětlivé patologické pochody a zřejmě na mnohé další [32].
Studie s glifloziny u HF a CKD – implikace pro chronický KRS
V současnosti nemáme k dispozici výsledky velkých randomizovaných studií, které by zkoumaly glifloziny se zaměřením přímo na pacienty s KRS a byly by schopny hodnotit i časovou souslednost rozvoje HF a CKD.
Nicméně nejnověji jsou k dispozici výsledky studií zaměřených na jednu ze složek – HF, nebo CKD, přičemž do těchto studií byli zařazeni pacienti i s druhou složkou KRS. S určitým omezením lze v těchto studiích studovat v sekundárních cílových parametrech či závažných nežádoucích událostech (serious adverse events, SAE) i druhou složku KRS či identifikovat subpopulace, které trpí oběma patologiemi – HF a CKD – současně. Na základě patofyziologie kardioprotektivních i renoprotektivních účinků gliflozinů lze spekulovat, že by glifloziny mohly mít efekt jak na primárně studovanou složku KRS, tak i na složku druhou.
Studie s glifloziny u HF a efekt na KV výstupy
 Do současné doby byly publikovány čtyři velké randomizované studie s glifloziny (s dapagliflozinem a empagliflozinem) u chronického HF, které mají v uspořádání rozdělení dle EF – na HFrEF s EF ≤ 40 % (studie DAPA‑HF a EMPEROR‑Reduced) a studie zahrnující kombinaci pacientů s HFmr/pEF, tedy HF s EF > 40 % (DELIVER a EMPEROR‑Preserved) (viz obr. 2).
Do současné doby byly publikovány čtyři velké randomizované studie s glifloziny (s dapagliflozinem a empagliflozinem) u chronického HF, které mají v uspořádání rozdělení dle EF – na HFrEF s EF ≤ 40 % (studie DAPA‑HF a EMPEROR‑Reduced) a studie zahrnující kombinaci pacientů s HFmr/pEF, tedy HF s EF > 40 % (DELIVER a EMPEROR‑Preserved) (viz obr. 2).
Primárním cílovým ukazatelem studií byl kombinovaný KV cíl zahrnující hospitalizace z důvodu HF (či u některých zhoršení HF) a úmrtí z KV příčin. Vedle jiných sekundárních cílových ukazatelů byly ve studiích rovněž hodnoceny určité renální parametry či renální závažné nežádoucí události spolu s vývojem eGFR a hodnocením sklonu jeho poklesu.
V případě HfrEF byla jako první – v roce 2019 – publikována studie DAPA‑HF [9] s přidáním dapagliflozinu ke standardní farmakologické léčbě HFrEF (inhibitory ACE nebo sartany nebo sakubitril/valsartan, betablokátory, antagonisté mineralokortikoidních receptorů, popřípadě diuretika), přičemž 45 % pacientů zařazených do studie trpělo diabetes mellitus. V roce 2020 následovala publikace studie EMPEROR‑Reduced [10] s empagliflozinem, který byl rovněž přidán ke standardní terapii HFrEF s mírně vyšším podílem zařazených diabetiků (50 %).
V obou studiích došlo k redukci výskytu primárního kompozitního cílového ukazatele; ve studii DAPA‑HF (cílový ukazatel: KV úmrtí + hospitalizace či urgentní návštěva lékaře s intravenózní léčbou HF) o 26 % a ve studii EMPEROR‑Reduced (KV úmrtí + hospitalizace pro HF) o 25 %, přičemž redukce primárního cílového ukazatele byla podobná u diabetiků a nediabetiků, což potvrdilo předpoklad, že efekt gliflozinů u HFrEF je nezávislý na přítomnosti diabetu. Navíc ve studii DAPA‑HF došlo k výrazné redukci počtu KV úmrtí a ke snížení celkové mortality o 18 % a 17 %, podobný trend (pokles o 8 %) byl pozorován i ve studii EMPEROR‑Reduced. Následná metaanalýza obou studií ukázala signifikantní redukci KV mortality o 14 % (poměr rizik [HR] 0,86; 95% interval spolehlivosti [CI] 0,76–0,98) i celkové mortality o 13 % (HR 0,87; 95% CI 0,77–0,98) [33] s velmi rychlým dopadem na doporučení pro léčbu HF, kdy se glifloziny dostaly na třídu a úroveň důkazů IA v léčbě HFrEF [1].
Po úspěších gliflozinů u HFrEF byly recentně publikovány i výsledky dvou studií u kombinované populace HFmr/pEF – studie EMPEROR‑Preserved [11] s empagliflozinem v roce 2021 a studie DELIVER [12] s dapagliflozinem v roce 2022.
Podobně jako ve studiích s HFrEF došlo k redukci primárního kompozitního cílového ukazatele ve studii EMPEROR‑Preserved (KV úmrtí a hospitalizace pro HF) o 21 % (HR 0,79; 95% CI 0,69–0,90) a ve studii DELIVER (KV úmrtí a zhoršení HF – neplánovaná hospitalizace pro HF či urgentní návštěva lékaře pro HF) o 18 % (HR 0,82; 95% CI 0,73–0,92). V obou studiích téměř polovina zařazených pacientů měla diabetes (49 % ve studii EMPEROR‑Preserved a 45 % ve studii DELIVER), přičemž analogicky jako u HFrEF nebyl patrný výraznější rozdíl v efektu léčby glifloziny mezi diabetiky a nediabetiky.
Jak ukazují výsledky nedávno publikované metaanalýzy [34], ve srovnání s výsledky u HFrEF se zdá být účinek gliflozinů na celkovou a KV mortalitu u HFmr/pEF nižší. Analýza zahrnující studii DELIVER i EMPEROR‑Preserved ukázala hraniční redukci KV mortality o 12 % (HR 0,88; 95% CI 0,77–1,00), přičemž celková mortalita byla ovlivněna minimálně s redukcí o 3 % (HR 0,88; 95% CI 0,88–1,06). Mortalitní výsledky u HFmr/pEF nejsou příliš překvapivé, vezmeme‑li v úvahu, že ve srovnání s HFrEF zejména pacienti s HFpEF častěji umírají z nekardiálních příčin. Navíc ani jedna studie nebyla navržena k eventuálnímu průkazu redukce izolovaně celkové či KV mortality.
Z hlediska primárních cílových ukazatelů lze účinky gliflozinů u HF považovat za konzistentní napříč spektrem EF, což vede k úvaze, zda tyto účinky mohou být relativně nezávislé na EF levé komory. Podrobnější analýza pacientů ve výše zmíněných čtyřech studiích rozřazených do čtyř skupin dle EF (EF ≤ 40 %, EF 41–49 %, EF 50–59 % a EF ≥ 60 %) ukázala mírný pokles redukce primárního cílového ukazatele směrem k vyšším EF (25 %, 22 %, 21 % a 19 %), nicméně redukce je stále signifikantní [34]. Z hlediska chronického KRS je zřejmé, že glifloziny mají velmi dobrou schopnost ovlivnit jeho KV složku.
Studie s glifloziny u HF a efekt na renální výstupy
Do studií s glifloziny, které byly cíleny na HF, byli samozřejmě zařazováni pacienti s CKD a sníženou eGFR. Hraniční hodnoty eGFR pro zařazení do studií s HFrEF a HFmr/pEF byly podobné: ≥ 30 ml/min/1,73 m2 (DAPA‑HF), ≥ 20 ml/min/1,73 m2 (EMPEROR‑Reduced) ve studiích HFrEF a ve studiích HFmr/pEF ≥ 25 ml/min/1,73 m2 (DELIVER) a ≥ 20 ml/min/1,73 m2 (EMPEROR‑Preserved) [4].
Tíže CKD z hlediska průměrné eGFR se mezi klinickými hodnoceními mírně lišila: u studií HFrEF činila 65,8 ml/min/1,73 m2 (DAPA‑HF) a 62,2 ml/min/1,73 m2 (EMPEROR‑Reduced) a u HFmr/pEF pak 61,0 ml/min/1,73 m2 (DELIVER) a 60,6 ml/min/1,73 m2 (EMPEROR‑Preserved) [34]. Prevalence pacientů s eGFR < 60 ml/min/1,73 m2 byla poměrně vysoká a mezi studiemi se rovněž mírně lišila: DAPA‑HF 41 %, EMPEROR‑Reduced 48 %, DELIVER 49 %, EMPEROR‑Preserved 50 %.
V rámci úvahy o potenciálních renálních přínosech gliflozinů a z hlediska KRS si lze položit tři základní otázky: zda vstupní CKD (eGFR ≥ nebo < 60 ml/min/1,73 m2) ovlivnilo KV výstupy navozené léčbou glifloziny; zda mají glifloziny efekt na pokles eGFR a zda jsou schopny ovlivnit sekundární renální kompozitní cílové ukazatele zahrnující i klinické výstupy (většinou se jednalo o různou kombinaci setrvalého poklesu eGFR, úmrtí z renálních příčin, konečné fáze onemocnění ledvin či náhradu funkce ledvin) nebo renální závažné nežádoucí události.
Recentní metaanalýza čtyř studií u HFrEF a HFmr/pEF (DAPA‑HF, EMPEROR‑Reduced, DELIVER a EMPEROR‑Preserved) ukázala konzistentní redukci primárního KV cílového ukazatele HF studií (hospitalizace pro HF a KV mortalitu) u pacientů s eGFR < 60 ml/min/1,73 m2 o 22 % (HR 0,78; CI 0,71–0,84) a u HF pacientů s eGFR ≥ 60 ml/min/1,73 m2 o 23 % (HR 0,77; CI 0,70–0,85), přičemž hodnota p pro heterogenitu byla 0,81 a 0,34 a p pro efekt léčby shodně méně než 0,0001 [34].
Tato data ukazují, že pozitivní efekt gliflozinů na KV kompozitní cílové ukazatele je podobný u pacientů s eGFR vyšší i nižší než 60 ml/min/1,73 m2. Je však potřeba zmínit, že výše popsaná hraniční hodnota eGFR pro zařazení do studií limituje aplikovatelnost výsledků pro skupinu pacientů s eGFR < 20 (resp. < 25 či 30 ml/min/1,73 m2 dle studie) vzhledem k tomu, že pacienti pod touto hranicí do studií prakticky zařazeni nebyli.
Glifloziny po typickém mírném poklesu eGFR po zahájení léčby (dáno změnami v intraglomerulárních tlacích) [4] prokázaly zpomalení progrese redukce eGFR, které bylo hodnoceno rozdílem sklonů křivek poklesu eGFR (slope) v čase. Ve všech výše zmíněných studiích došlo ke statisticky významnému rozdílu (p < 0,001) ve sklonu eGFR (v ml/min/1,73 m2 za rok): ve studiích u HFrEF DAPA‑HF o 1,73 (95% CI 1,10–2,37), podobně v EMPEROR‑Reduced o 1,73 (95% CI 1,10–2,37); o něco menší redukce (ale stále signifikantní) bylo dosaženo ve studiích u HFmr/pEF – ve studii DELIVER o 1,40 (95% CI 1,00–1,80), ve studii EMPEROR‑Preserved o 1,36 (95% CI 1,06–1,66) [4].
Nicméně otázkou bylo, zda se tento pozitivní vývoj v poklesu eGFR u pacientů léčených glifloziny „propíše“ také do redukce výskytu klinických renálních cílových ukazatelů.
K signifikantnímu snížení renálního cílového ukazatele došlo ve studii EMPEROR‑Reduced (hodnoceno jako trvalý pokles eGFR nebo náhrada renálních funkcí), a to o 50 % (HR 0,50; 95 % CI 0,32–0,77). Trend k redukci (o 29 %) byl patrný i ve studii DAPA‑HF (HR 0,71; 95 % CI 0,44–1,16), přičemž následná metaanalýza studií HFrEF ukázala, že primární složený renální cílový ukazatel byl redukován o 38 % (HR 0,62; 95% CI 0,43–0,90, hodnota p pro heterogenitu = 0,42 a p pro celkový léčebný efekt = 0,0128) [33].
Poněkud komplikovanější je situace v klinickém hodnocení u HFmr/pEF. Ve studii EMPEROR‑Preserved byl pouze náznak trendu ke snížení: o 5 % (HR 0,95; 95% CI 0,73–1,24) a ve studii DELIVER pak náběh trendu (o 8 %) opačného (HR 1,08; 95% CI 0,79–1,49) [4], nicméně vše bylo nesignifikantní. Je však nutno poznamenat, že renální události ve studii DELIVER byly k dispozici ve formě závažných nežádoucích událostí nebo událostí vedoucích k vysazení léku, což ztěžuje srovnání s dalšími studiemi a případnou metaanalýzu studií u HFmr/pEF zaměřenou na renální výsledky, která zatím provedena nebyla [34].
Z výše popsaných výsledků dosavadních studií u HF a z hlediska chronického KRS vyplývá, že glifloziny mají konzistentní efekt na KV kompozitní cílový ukazatel, a to relativně nezávisle na iniciální eGFR, přičemž je nutno vzít v úvahu limit eGFR v každé studii pro zařazení pacientů.
Dále glifloziny mohou ovlivnit renální složku u pacientů s HF snížením progrese poklesu eGFR, přičemž o něco menší efekt byl doložen u pacientů trpících HFmr/pEF. Navíc jsou glifloziny schopny ovlivnit i klinické cílové ukazatele v podobě renálních kompozitních parametrů u HFrEF. Co se týče klinických renálních přínosů gliflozinů u HFmr/pEF, není situace zcela jasná, současné výsledky studií tento benefit neprokazují.
Na druhou stranu tyto studie nebyly na průkaz efektu gliflozinů na klinické renální parametry navrženy a zřejmě neměly ani dostatečnou sílu, přičemž jak bylo zmíněno výše, je společná analýza dat v rámci případné metaanalýzy problematická. Je možné, že příznivý účinek na klinické renální cílové ukazatele bychom u HFmr/pEF mohli očekávat v dlouhodobějším horizontu vzhledem k potenciálnímu menšímu efektu na sklon redukce eGFR. Nicméně pokud nebudou publikovány studie přímo zaměřené na tuto problematiku, bude zhodnocení obtížné. Určitá data a posun v této problematice by mohly v budoucnu poskytnout registry.
Studie s glifloziny u CKD a efekt na renální a KV cíle
Na možné ovlivnění obou složek KRS u pacientů s CKD upozornila již studie CREDENCE [13] s kanagliflozinem, která zahrnovala pouze diabetiky s hodnotou eGFR v rozmezí 30–90 ml/min/1,73 m2 a přítomnou albuminurií (poměr albumin/kreatinin v moči, urine albumin‑creatinine ratio [UACR] 300–5 000 mg/g) a v níž došlo k významné redukci primárního kompozitního cílového ukazatele (onemocnění ledvin v konečném stadiu, zdvojnásobení sérové koncentrace kreatininu a úmrtí z renálních či KV příčin) o významných 30 % (HR 0,70; 95% CI 0,59–0,82; p < 0,001) a renálního kompozitního cílového ukazatele o 34 % (HR 0,66; 95 % CI 0,53–0,81; p < 0,001). Kanagliflozin rovněž redukoval významně počet hospitalizací pro HF – o 39 % (HR 0,61; 95% CI 0,47–0,80; p < 0,001).
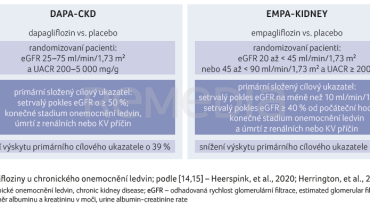 V kombinované populaci diabetiků a nediabetiků máme u CKD k dispozici výsledky dvou velkých studií – DAPA‑CKD s dapagliflozinem a EMPA‑KIDNEY s empagliflozinem, které hodnotily renální i KV výstupy (obr. 3). V rámci studie DAPA‑CKD byla publikována i analýza rozdělující pacienty na subpopulaci s HF a bez HF.
V kombinované populaci diabetiků a nediabetiků máme u CKD k dispozici výsledky dvou velkých studií – DAPA‑CKD s dapagliflozinem a EMPA‑KIDNEY s empagliflozinem, které hodnotily renální i KV výstupy (obr. 3). V rámci studie DAPA‑CKD byla publikována i analýza rozdělující pacienty na subpopulaci s HF a bez HF.
Studie s glifloziny u CKD – renální výstupy
Do studie DAPA‑CKD s dapagliflozinem byli zařazeni pacienti s CKD s eGFR v rozmezí 25–75 ml/min/1,73 m2 a UACR mezi 200 a 5 000 mg/g, přičemž diabetem trpělo přibližně 67 % studované populace [14].
Primární složený cílový ukazatel (≥ 50% trvalý pokles eGFR; konečné stadium onemocnění ledvin a úmrtí z renálních nebo KV příčin) byl dapagliflozinem významně snížen – o 39 % (HR 0,61; 95% CI 0,51–0,72; p < 0,001), přičemž samotný renální (sekundární cíl) bez KV mortality byl rovněž významně redukován, a to o 44 % (95% CI 0,45–0,68; p < 0,001). Významně snížena byla i celková mortalita – o 31 % (HR 0,69; 95% CI 0,53–0,88; p = 0,004).
V celkové populaci studie DAPA‑HF trpělo HF 11 % pacientů. U pacientů s CKD a HF došlo k redukci primárního kompozitního cílového ukazatele o 42 % (HR 0,58; 95% CI 0,37–0,91) a u pacientů s CKD, ale bez HF bylo dosaženo 38% redukce (HR 0,62; 95% CI 0,51–0,75; p pro interakci = 0,59) [35]. Podobně došlo k redukci sekundárního renálního kompozitního cílového ukazatele u pacientů s HF – o 55 % (HR 0,45; 95% CI 0,23–0,87) a u pacientů bez HF o 43 % (HR 0,57; 95% CI 0,46–0,71; p pro interakci = 0,36) [35].
Recentně byla publikována studie s empagliflozinem EMPA‑KIDNEY u pacientů s CKD (s eGFR ≥ 20 až < 45 a s eGFR ≥ 45 až < 90 ml/min/1,73 m2 s přítomnou albuminurií, UACR ≥ 200 mg/g), přičemž podíl diabetiků činil 46 % [15]. Primární složený cílový ukazatel (trvalý pokles eGFR < 10 ml/min/1,73 m2, trvalý pokles eGFR ≥ 40 %, konečné stadium onemocnění ledvin a úmrtí z renálních nebo KV příčin) byl empagliflozinem významně snížen o 28 % (HR 0,72; 95% CI 0,64–0,82; p < 0,001). Samotná progrese CKD byla empagliflozinem výrazně ovlivněna, s redukcí o 29 % (HR 0,71; 95% CI 0,62–0,81). Celková mortalita byla ovlivněna nesignifikantně – s trendem k redukci (HR 0,87; 95% CI 0,70–1,08; p = 0,21).
Studie s glifloziny u CKD – KV výstupy
Ve studii DAPA‑HF byl samostatný KV cílový ukazatel (HF hospitalizace a úmrtí z KV příčin) významně redukován – o 29 % (HR 0,71; 95% CI 0,55–0,92; p = 0,009) [14]. Na základě subanalýzy byl patrný trend k redukci tohoto sekundárního cílového ukazatele i u pacientů s HF – o 32 % (HR 0,68; 95% CI 0,44–1,05). Došlo k redukci kompozitního KV cílového ukazatele u pacientů s CKD a bez HF – o 30 % (HR 0,70; 95% CI 0,51–0,97; p pro interakci = 0,90). Nadto došlo k redukci počtu úmrtí ze všech příčin u pacientů s HF o 44 % a u pacientů bez HF o 27 % (HR 0,73; 95% CI 0,54–0,97; p pro interakci = 0,39) [35].
Ve studii EMPA‑KIDNEY byl patrný nesignifikantní trend k 16% redukci (HR 0,84; 95% CI 0,67–1,05; p = 0,15) samostatného sekundárního KV cílového ukazatele (HF hospitalizace a KV úmrtí). Podobně byl naznačen trend k redukci KV mortality o 16 % (HR 0,84; 95% CI 0,60–1,19).
Tato data tedy ukazují, že glifloziny (dapagliflozin a empagliflozin) jsou schopny u pacientů s CKD redukovat výskyt primárních kompozitních cílových ukazatelů složených z renálních parametrů a KV mortality, což dále podporuje jejich potenciální využití u chronického KRS.
Dapagliflozin u CKD měl vedle snížení primárního kompozitního cílového ukazatele pozitivní efekt i na redukci samostatného sekundární renálního cílového ukazatele, KV parametrů a také mortality. Sekundární renální cílové ukazatele má dapagliflozin potenciál redukovat u pacientů již léčených pro HF a rovněž u pacientů bez HF. Vedle toho navíc ovlivňuje v pozitivním slova smyslu i KV ukazatele, a to bez závislosti na HF, což dále podporuje jeho eventuální využití u KRS. Cílená subanalýza u pacientů s HF a bez HF zatím u studie EMPA‑KIDNEY publikována nebyla a v budoucnu bude zajímavá i metaanalýza těchto studií stran subpopulací s HF a bez něj.
Závěr
Glifloziny byly sice vyvíjeny jako nová antidiabetika, nicméně velké randomizované studie ukázaly jejich kardioprotektivní a renoprotektivní účinky, které jsou nezávislé na přítomnosti diabetu a jsou nyní využívány v léčbě srdečního selhání napříč ejekčními frakcemi levé komory a také u pacientů s chronickým onemocněním ledvin.
I když nemáme k dispozici velké randomizované studie s glifloziny cílené na KRS, je možné na jejich potenciál v léčbě chronického KRS poukázat z analýz a subanalýz studií zaměřených na jednotlivé komponenty KRS – HF a CKD. Glifloziny mají výrazný efekt na redukci primárních kompozitních cílových ukazatelů u HF a CKD studií, které jsou konzistentní s dosud známými patofyziologickými koncepty jejich mechanismu účinku.
U studií s HF vykazují glifloziny KV přínos relativně nezávisle na eGFR, a navíc mají pozitivní vliv na pokles eGFR u HFrEF i HFmr/pEF. U HFrEF navíc zlepšují klinické renální sekundární cílové ukazatele.
Ve studiích s CKD byl prokázán příznivý účinek podávání gliflozinů na renální cílové parametry u dapagliflozinu i empagliflozinu, přičemž kompozitní KV cílový ukazatel (hospitalizace pro HF a KV úmrtí) byl významně redukován u dapagliflozinu s trendem k redukci u empagliflozinu.
S vědomím výše zmíněných limitací tak glifloziny představují pro léčbu chronického KRS terapeutika, která mají schopnost pozitivně ovlivnit jeho kardiální i renální složku.
Je možné, že se v budoucnu dočkáme výzkumu přímo zaměřeného na KRS a glifloziny, a budeme tak mít možnost jejich účinky přímo ověřit u těchto komplikovaných pacientů.
Literatura
[1] McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42: 3599–3726.
[2] Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37: 2129–2200.
[3] Jang SY, Yang DH. Prognostic and Therapeutic Implications of Renal Insufficiency in Heart Failure. Int J Heart Fail 2022; 4: 75.
[4] Monzo L, Ferrari I, Cicogna F, et al. Sodium‑glucose co‑transporter 2 inhibitors in heart failure: an updated evidence‑based practical guidance for clinicians. Eur Heart J Suppl 2023; 25(Suppl C): C309–315.
[5] Rangaswami J, Bhalla V, Blair JEA, et al. Cardiorenal Syndrome: Classification, Pathophysiology, Diagnosis, and Treatment Strategies: A Scientific Statement From the American Heart Association. Circulation 2019; 139: e840–878.
[6] Málek F, Veselý J, Pudil R, et al. (Summary of 2021 ESC Guidelines for the diagnosis and treatment of heart failure). Cor et Vasa 2022; 64: 121–162.
[7] Schuett K, Marx N, Lehrke M. The Cardio‑Kidney Patient: Epidemiology, Clinical Characteristics and Therapy. Circulation Research 2023; 132: 902–914.
[8] Löfman I, Szummer K, Dahlström U, et al. Associations with and prognostic impact of chronic kidney disease in heart failure with preserved, mid‑range, and reduced ejection fraction. Eur J Heart Fail 2017; 19: 1606–1614.
[9] McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med 2019; 381: 1995–2008.
[10] Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med 2020; 383: 1413–1424.
[11] Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med 2021; 385: 1451–1461.
[12] Solomon SD, McMurray JJV, Claggett B, et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med 2022; 387: 1089–1098.
[13] Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med 2019; 380: 2295–2306.
[14] Heerspink HJL, Stefansson BV, Correa‑Rotter R, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2020; 383: 1436–1446.
[15] Herrington WG, Staplin N, Wanner C, et al. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2023; 388: 117–127.
[16] Hallow KM, Helmlinger G, Greasley PJ, et al. Why do SGLT2 inhibitors reduce heart failure hospitalization? A differential volume regulation hypothesis. Diabetes Obes Metab 2018; 20: 479–487.
[17] Ferrannini E, Muscelli E, Frascerra S, et al. Metabolic response to sodium‑glucose cotransporter 2 inhibition in type 2 diabetic patients. J Clin Invest 2014; 124: 499–508.
[18] Lambers Heerspink HJ, de Zeeuw D, Wie L, et al. Dapagliflozin a glucose‑regulating drug with diuretic properties in subjects with type 2 diabetes. Diabetes Obes Metab 2013; 15: 853–862.
[19] Vallon V, Verma S. Effects of SGLT2 Inhibitors on Kidney and Cardiovascular Function. Annu Rev Physiol 2021; 83: 503–528.
[20] Verma S, McMurray JJV. SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state‑of‑the‑art review. Diabetologia 2018; 61: 2108–2117.
[21] Nasiri‑Ansari N, Dimitriadis GK, Agrogiannis G, et al. Canagliflozin attenuates the progression of atherosclerosis and inflammation process in APOE knockout mice. Cardiovasc Diabetol 2018; 17: 106.
[22] Verma S, Rawat S, Ho KL, et al. Empagliflozin Increases Cardiac Energy Production in Diabetes: Novel Translational Insights Into the Heart Failure Benefits of SGLT2 Inhibitors. JACC Basic Transl Sci 2018; 3: 575–587.
[23] Santos‑Gallego CG, Requena‑Ibanez JA, San Antonio R, et al. Empagliflozin Ameliorates Adverse Left Ventricular Remodeling in Nondiabetic Heart Failure by Enhancing Myocardial Energetics. J Am Coll Cardiol 2019; 73: 1931–1944.
[24] Ghanim H, Abuaysheh S, Hejna J, et al. Dapagliflozin Suppresses Hepcidin And Increases Erythropoiesis. J Clin Endocrinol Metab 2020; 105: dgaa057.
[25] Mazer CD, Hare GMT, Connelly PW, et al. Effect of Empagliflozin on Erythropoietin Levels, Iron Stores, and Red Blood Cell Morphology in Patients With Type 2 Diabetes Mellitus and Coronary Artery Disease. Circulation 2020; 141: 704–707.
[26] Ansary TM, Nakano D, Nishiyama A. Diuretic Effects of Sodium Glucose Cotransporter 2 Inhibitors and Their Influence on the Renin‑Angiotensin System. Int J Mol Sci 2019; 20: 629.
[27] Verma S. Are the Cardiorenal Benefits of SGLT2 Inhibitors Due to Inhibition of the Sympathetic Nervous System? JACC Basic Transl Sci 2020; 5: 180–182.
[28] Kondo H, Akoumianakis I, Badi I, et al. Effects of canagliflozin on human myocardial redox signalling: clinical implications. Eur Heart J 2021; 42: 4947–4960.
[29] Kang S, Verma S, Hassanabad AF, et al. Direct Effects of Empagliflozin on Extracellular Matrix Remodelling in Human Cardiac Myofibroblasts: Novel Translational Clues to Explain EMPA‑REG OUTCOME Results. Can J Cardiol 2020; 36: 543–553.
[30] Uthman L, Baartscheer A, Bleijlevens B, et al. Class effects of SGLT2 inhibitors in mouse cardiomyocytes and hearts: inhibition of Na(+)/H(+) exchanger, lowering of cytosolic Na(+) and vasodilation. Diabetologia 2018; 61: 722–726.
[31] Kim NH, Kim NH. Renoprotective Mechanism of Sodium‑Glucose Cotransporter 2 Inhibitors: Focusing on Renal Hemodynamics. Diabetes Metab J 2022; 46: 543–551.
[32] Hou Y‑C, Zheng C‑M, Yen T‑H, Lu K‑C. Molecular Mechanisms of SGLT2 Inhibitor on Cardiorenal Protection. Int J Mol Sci 2020; 21: 7833.
[33] Zannad F, Ferreira JP, Pocock SJ, et al. SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta‑analysis of the EMPEROR‑Reduced and DAPA‑HF trials. Lancet 2020; 396: 819–829.
[34] Vaduganathan M, Docherty KF, Claggett BL, et al. SGLT‑2 inhibitors in patients with heart failure: a comprehensive meta‑analysis of five randomised controlled trials. Lancet 2022; 400: 757–767.
[35] McMurray JJV, Wheeler DC, Stefánsson BV, et al. Effects of Dapagliflozin in Patients With Kidney Disease, With and Without Heart Failure. JACC Heart Fail 2021; 9: 807–820.