Co se děje v současnosti kolem statinů?
V posledních měsících se v návaznosti na stanovisko americké lékové agentury FDA doporučující změnu uvádění některých informací u statinů zaměřila pozornost nejen medicínské veřejnosti na problematiku nežádoucích účinků terapie statiny. Přestože tato léčba patří k nejlépe tolerovaným a dokumentovaným, i ona je provázena nežádoucími účinky. Kliniky znepokojily zejména informace o narůstající incidenci diabetu 2. typu u uživatelů statinů. Opět se diskutuje staré téma svalového poškození, hepatotoxicity a rizika nádorových bujení v souvislosti s léčbou statinem. Zaměřujeme se na působení statinů na úrovni ledvinných funkcí, vracíme se k posuzování této léčby v kontextu poruch mnestických funkcí. Článek se snaží najít odpovědi na otázky, na jakých podkladech je často dramatická argumentace o nežádoucích účincích statinů vystavěna, zda se v současnosti opravdu kolem statinů děje něco, čím bychom se měli znepokojovat.
Úvod
Statiny, objevené v sedmdesátých letech minulého století, se staly neodmyslitelnou součástí prevence a léčby vaskulárních onemocnění a v současnosti představují vůbec nejpředepisovanější léčiva. Díky přibývajícím zkušenostem, dokončovaným klinickým studiím i pozorováním z denní praxe se dále rozrůstá databáze znalostí dokumentující účinky statinů v různých klinických situacích. Proto můžeme souhlasit s tvrzením, že u statinů disponujeme nejrozsáhlejším důkazním materiálem, který opravňuje k jejich použití u osob se zvýšeným rizikem aterotrombotických komplikací v (téměř) každé situaci. Je docela logické, že současně s pozorností věnovanou přínosům podávání statinů si všímáme i ceny, kterou za ně musí pacient zaplatit v podobě nežádoucích účinků léčby. Takové zprávy ostatně periodicky plní i stránky laického tisku a jsou vděčně přijímány skeptiky, kteří na význam snižování plazmatických koncentrací cholesterolu v prevenci srdečně-cévních onemocnění nevěří (přestože tento vztah už lépe prokázat není možné).
V poslední době se ale stále více diskutují nežádoucí účinky statinů i na odborném fóru. Svůj příspěvek k tématu přinesly také regulační autority formulováním nových varovných informací povinně přidaných ke značení statinů. Nežádoucí účinky provázejí každou účinnou farmakoterapii a vznikají samozřejmě i při podávání statinů. Zamysleme se nyní nad tím, co o nežádoucích účincích spojených s podáváním těchto léčiv skutečně víme a zdali z toho vyplývá nutnost změny zavedené léčebné praxe.
Statiny a diabetes
Považujeme za prokázané, že terapie statinem zvyšuje riziko vzniku diabetu 2. typu přibližně o 10 %, viz graf 1 [1].
Poslední výzkumy naznačují, že hlavní příčinu statiny indukovaného diabetu představuje zhoršení funkcí β-buněk pankreatu a prohloubení inzulinové deficience. Beta-buňka pod vlivem statinu zvyšuje expresi LDL (low-density lipoprotein) receptorů na svém povrchu a dochází tak ke zvýšení intracelulární koncentrace cholesterolu. Ta pravděpodobně působí toxicky a přispívá k apoptóze s následným poklesem schopnosti pankreatu produkovat ![Graf 1 Riziko nově vzniklého diabetu a výskytu kardiovaskulárních příhod v metaanalýze statinových studií; podle [1] – Sattar, et al., 2010. CI – interval spolehlivosti; I2 – míra (stupeň) heterogenity; n – počet kardiovaskulárních příhod; N – počet účastníků studie; OR – odds ratio (poměr šancí)](https://www.remedia.cz/photo-a-29303---.jpg) dostatečné množství inzulinu [2]. Přirozeně je toto riziko vyšší u osob s dalšími rizikovými faktory pro vznik diabetu (např. osoby s metabolickým syndromem nebo s pozitivní rodinnou anamnézou výskytu diabetu) a také u těch, kteří užívají vysoké dávky statinů, nejvíce pak rosuvastatinu.
dostatečné množství inzulinu [2]. Přirozeně je toto riziko vyšší u osob s dalšími rizikovými faktory pro vznik diabetu (např. osoby s metabolickým syndromem nebo s pozitivní rodinnou anamnézou výskytu diabetu) a také u těch, kteří užívají vysoké dávky statinů, nejvíce pak rosuvastatinu.
Musíme ale zdůraznit, že diabetogenní účinek mají všechny molekuly z této lékové skupiny. Rosuvastatinová studie JUPITER však byla první, která na zvýšené riziko vzniku diabetu u uživatelů statinů upozornila. Nedávná analýza dat z téže studie potvrdila výše uvedený předpoklad. Osoby s rizikovými faktory diabetu 2. typu (metabolický syndrom, zvýšení glykemie nalačno, BMI (body mass index) > 30 kg/m2 anebo g![Obr. 1 Vliv terapie statiny na sledované ukazatele podle přítomnosti rizikových faktorů pro diabetes mellitus (analýza studie JUPITER); podle [3] – Ridker, et al., 2012. AP – angina pectoris; CMP – cévní mozková příhoda; DM – diabetes mellitus; HR – hazard ratio (poměr rizik); IM – infarkt myokardu](https://www.remedia.cz/photo-a-29304---.jpg) lykovaný hemoglobin > 6 % při vstupu do studie) měly během terapie rosuvastatinem riziko vzniku diabetu vyšší o 28 % ve srovnání s placebem [3]. Naopak u účastníků studie bez rizikových faktorů diabetu nebyl zaznamenán vůbec žádný vzestup rizika (obr. 1).
lykovaný hemoglobin > 6 % při vstupu do studie) měly během terapie rosuvastatinem riziko vzniku diabetu vyšší o 28 % ve srovnání s placebem [3]. Naopak u účastníků studie bez rizikových faktorů diabetu nebyl zaznamenán vůbec žádný vzestup rizika (obr. 1).
Faktory zvyšujícími riziko diabetu se zabývala rovněž analýza studií s vysoce dávkovaným atorvastatinem. V této analýze představovalo zvýšení hodnot glykemie nalačno nejsilnější prediktor zvyšující riziko spojené s podáváním statinu, a to téměř šestinásobně. Druhé místo v pořadí důležitosti zaujalo zvýšení BMI spojené s téměř trojnásobným nárůstem rizika. Hypertriglyceridemičtí pacienti měli při podávání atorvastatinu dvojnásobné riziko rozvoje diabetu oproti nemocným v placebové větvi studie, nepatrně nižší byl vzestup rizika pozorovaný u hypertoniků (zvýšení relativního rizika o 60 %) [4].
V kategorii vysoce a velmi vysoce rizikových nemocných však prospěch z léčby jednoznačně výrazně převyšuje toto riziko, a proto není důvod přehodnocovat praxi indikace statinů [5]. Přítomnost známek zvýšeného rizika vzniku diabetu ale musí v případě indikace statinu u takových nemocných vést k pečlivému monitorování glukózové homeostázy a k ještě naléhavějšímu prosazování režimových opatření. Současně v případě stanovení diagnózy prediabetu považujeme za žádoucí zahájit terapii metforminem v souladu s doporučeními diabetologů z poslední doby [6].
Statiny a myopatie
Svalové poškození (od myalgie po rhabdomyolýzu) provází podávání statinů od počátku jejich užívání a zcela jistě nejde o problém, který bychom měli přehlížet. Na druhé straně si připomeňme, že i při použití nejvyšších dávek statinů je frekvence výskytu závažných svalových poškození (rhabdomyolýz) extrémně vzácná. V metaanalýze hodnotící výskyt rhabdomyolýzy u 170 tisíc osob léčených intenzivní statinovou terapií zaznamenali autoři celkem 28 případů výskytu v aktivně léčených skupinách a 15 ve skupinách kontrolních [7]. Většina nárůstu rizika závažné myotoxicity byla zjištěna u pacientů užívajících 80 mg simvastatinu. Tento nález spolu s obdobným pozorováním ze simvastatinové studie SEARCH vedl regulační autority k doporučení vyvarovat se u nových pacientů léčby simvastatinem podávaným v dávce 80 mg [8, 9]. Tento příklad může opět dobře posloužit k demonstraci faktu, že mezi jednotlivými statiny jsou prakticky důležité rozdíly, přestože i v oblasti nežádoucích účinků jde zpravidla o nežádoucí účinky celé třídy (tzv. class effect).
Nejúčinnější statiny (atorvastatin a rosuvastatin) jsou s ohledem na studiemi dokumentovaný výskyt svalového poškození srovnatelné. Je ale pravda, že v případě atorvastatinu disponujeme (podobně jako v jiných případech) i v této oblasti větším množstvím důkazů, které dokládají jeho bezpečnost i při použití vysokých dávek, např. i v rizikovější populaci starších nemocných [10]. Pravděpodobnost statinem indukované myopatie se zvyšuje s dávkou, dále při anamnéze onemocnění svalově-kosterního aparátu nebo u endokrinopatie (dysfunkce štítné žlázy, hyperkortizolismus) či při současném používání léků ovlivňujících biologickou dostupnost statinů.
Vzhledem k rozšiřujícímu se spektru pacientů léčených statiny je pravděpodobné, že se budeme i s nežádoucími účinky této léčby setkávat relativně častěji. Z praktického hlediska je třeba upozornit zejména na zvýšení rizika myopatií při lékových interakcích na úrovni resorpce, transformace a distribuce statinů. Zde jsou významné rozdíly mezi hydrofilními a lipofilními statiny i mezi lipofilními statiny navzájem. Tato problematika však přesahuje zaměření tohoto článku.
Symptomy svalového poškození u nemocných léčených statiny je třeba i nadále aktivně vyhledávat. Vyskytnou-li se, musí být léčba přerušena a po odeznění symptomů má smysl zkoušet jiný typ statinu. Než pacienta prohlásíme za „statiny netolerujícího“, měli bychom vyzkoušet nejméně tři různé molekuly, které naštěstí pro takové nemocné máme k dispozici. Ideální se v tomto případě jeví spolupráce praktického lékaře se specialistou, který má možnost takové nemocné lépe a častěji monitorovat.
Pokud jde o laboratorní monitoring svalového poškození, v klinické praxi nadále využíváme nespecifický ukazatel – aktivitu kreatinkinázy (CK). Podle posledních doporučení pro léčbu dyslipidemií vyšetřujeme tento parametr před zahájením terapie a poté vždy při zvýšení dávky nebo při klinických symptomech svalového poškození [11]. Léčbu přerušíme u asymptomatického nemocného s elevací hodnot CK převyšující pětinásobek horního limitu normálního rozmezí, u symptomatického pacienta přerušujeme nebo upravujeme léčbu vždy bez ohledu na aktivitu CK. Důležitou změnu v nových doporučeních představuje zrušení „povinnosti“ pravidelného testování aktivity CK u pacientů léčených hypolipidemiky. Nepřináší totiž nic jiného než vyšší náklady.
Statiny a jaterní funkce
Ve zprávě FDA (Food and Drug Administration) z února 2012, která se věnovala několika otázkám bezpečnosti léčby statiny, poněkud zanikla zajímavá informace o vyjmutí povinnosti testovat pravidelně jaterní funkce u pacientů užívajících statiny [9]. Po pečlivé analýze dostupných dat FDA uzavřela, že „všechny v současnosti používané statiny mají velmi nízké riziko závažné jaterní toxicity“, a proto vůbec nedoporučuje rutinní vyšetřování transamináz u osob léčených statiny. Závěr to jistě není překvapující. Možnost poškození jaterních funkcí při podávání hypolipidemik se spíše traduje, než že by byla závažným klinickým problémem. Srovnání dvou nejúčinnějších statinů ukazuje mírně vyšší výskyt elevace hladin transamináz provázející podávání atorvastatinu oproti rosuvastatinu. V posledním přímém srovnání provedeném ve studii SATURN byl výskyt elevace ALT (alaninaminotransferáza) na více než trojnásobek horního limitu normy v atorvastatinové skupině 2 % a 0,7 % u nemocných léčených rosuvastatinem [12]. Tedy opět důkaz, že použití obou nejúčinnějších statinů je možné z hlediska hepatotoxicity považovat za bezpečné. Metaanalýza studií sledujících účinnost i bezpečnost intenzivní léčby statiny ve srovnání s „běžnou“ léčbou ukázala zvýšení výskytu elevací hladin transamináz, který byl přibližně 4krát častější ve skupinách pacientů léčených intenzivní léčbou. Přesto byl i v intenzivních ramenech klinických studií vzestup hladin transamináz pozorován většinou u méně než 4 % léčených osob a přerušení léčby z těchto důvodů je vzácné [13]. Jak uvádí výše komentovaná analýza FDA, ukončování léčby statiny z důvodů asymptomatického zvýšení hladin ALT a/nebo AST (aspartátaminotransferáza) do trojnásobku horní hranice normálních hodnot nemá význam, a naopak zvyšuje kardiovaskulární riziko takových nemocných.
Praktické doporučení pro vyšetřování hodnot jaterních testů shrnuje recentně publikované stanovisko České společnosti pro aterosklerózu k posledním evropským doporučením pro diagnostiku a léčbu dyslipidemií. Uvádí, že stanovení ALT má být provedeno před zahájením léčby a během léčby pouze na základě klinického podezření na možné jaterní poškození. Vzestup hladin ALT nad trojnásobek horní hranice normy při léčbě bývá nejčastěji projevem abúzu alkoholu a je třeba jej ověřit kontrolním stanovením hodnot jaterních testů. Teprve trvající elevace hladin ALT nad uvedenou hranici může být důvodem pro přerušení či eventuální změnu léčby [14].
Statiny a ledvinné funkce
Při hledání rozdílů mezi statiny v kontextu nežádoucích účinků léčby se nelze nezmínit o odlišnostech v jejich působení na úrovni funkce ledvin. Již delší dobu víme, že rosuvastatin zejména v úvodu terapie může mírně snížit glomerulární filtraci a zvýšit podíl nemocných s proteinurií (nejspíše tubulárního původu). Tomu odpovídá i kontraindikace podávání maximální dávky rosuvastatinu u nemocných s chronickým onemocněním ledvin klasifikovaným stupněm 3 a výše (glomerulární filtrace, eGFR 30–59 ml/min a nižší) [15]. Naproti tomu podávání atorvastatinu považujeme u těchto skupin pacientů za bezpečné. Přítomnost renálního onemocnění nebo zvýšené riziko jeho výskytu tedy může být kritériem, které napomůže při rozhodování o typu statinové léčby.
Pokud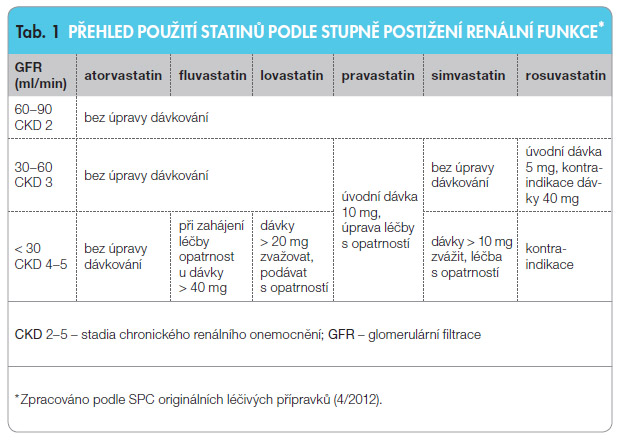 jde o vliv statinů na renální funkce a progresi jejich poklesu, ta byla zkoumána v řadě klinických studií s ne zcela jednoznačnými závěry. Většina studií prokázala spíše pozitivní vliv podávání statinu hodnocený zpomalením poklesu glomerulární filtrace ve srovnání osob léčených statiny a placebem. Podobný byl i pozorovaný vliv statinové terapie na výskyt proteinurie. Můžeme tedy uzavřít, že podávání statinů lze z hlediska funkce ledvin považovat za bezpečné. Mezi jednotlivými molekulami jsou z hlediska vhodnosti použití u nemocných s chronickým renálním onemocněním rozdíly, jež reflektují i preskripční doporučení shrnutá z tohoto hlediska v tab. 1.
jde o vliv statinů na renální funkce a progresi jejich poklesu, ta byla zkoumána v řadě klinických studií s ne zcela jednoznačnými závěry. Většina studií prokázala spíše pozitivní vliv podávání statinu hodnocený zpomalením poklesu glomerulární filtrace ve srovnání osob léčených statiny a placebem. Podobný byl i pozorovaný vliv statinové terapie na výskyt proteinurie. Můžeme tedy uzavřít, že podávání statinů lze z hlediska funkce ledvin považovat za bezpečné. Mezi jednotlivými molekulami jsou z hlediska vhodnosti použití u nemocných s chronickým renálním onemocněním rozdíly, jež reflektují i preskripční doporučení shrnutá z tohoto hlediska v tab. 1.
Statiny a nádorová onemocnění
Delší dobu známá pozorování z epidemiologických studií o nepřímé úměrnosti mezi koncentrací cholesterolu v plazmě a výskytem nádorových onemocnění stále provokují diskusi o možné rizikovosti aktivního snižování plazmatických koncentrací aterogenních lipidů z hlediska kancerogeneze. Nutno znovu připomenout, že observační studie dokládající výše popsanou souvislost často zaměňují příčinu s důsledkem. Latentně probíhající závažné onemocnění (např. nádorové) může vést k poklesu cholesterolemie, což však není příčinou, ale symptomem základní choroby. Není však divu, že u uživatelů hypolipidemik (a nejvíce statinů) byl výskyt nádorových onemocnění vždy bedlivě sledován.
Výsledky některých studií ukázaly zvýšení výskytu malignit při terapii statinem; např. v pravastatinové studii PROSPER u starší populace zaznamenali autoři vyšší výskyt gastrointestinálních tumorů [16]. I přesto máme v současnosti dostatek důkazů, abychom prohlásili, že při terapii statinem nebylo zvýšené riziko maligních onemocnění potvrzeno. Poslední metaanalýza 27 studií zahrnujících více než 170 000 pacientů, publikovaná v roce 2012, ukázala, že ani u podskupiny dosahující při léčbě statinem koncentrací LDL cholesterolu v průměru 1,3 mmol/l se neobjevila incidence nádorového onemocnění [17].
Na druhé straně ani domněnky o možném příznivém ovlivnění průběhu maligních onemocnění užíváním statinů také nebyly jednoznačně potvrzeny. V literatuře z poslední doby se opět objevily zprávy, které naplňují optimismem gastroenterology, neboť uvádějí snížení rizika vzniku karcinomu jater či jícnu u uživatelů statinů [18, 19]. Zcela nedávná metaanalýza zahrnující i poslední práce k tématu zase dokumentovala pokles rizika karcinomu prostaty u léčených statiny [20]. Zatím se ale zdá, že bude jistější být opatrnými skeptiky. Jak ukázala výše uvedená a dosud největší metaanalýza, statiny nesnižují riziko vzniku ani nezlepšují prognózu žádného typu nádorového bujení v žádném orgánovém systému. Zatím se spíše kloníme k názoru, že podávání statinů (a související pokles plazmatických koncentrací LDL cholesterolu) má z hlediska maligního bujení neutrální působení.
Statiny a kognitivní funkce
Další zdvižený prst z několikrát zmíněného dokumentu FDA, jímž byla aktualizována informace o léčivech s obsahem statinů, se týkal jejich možného nepříznivého působení na kognitivní funkce. Téma vztahu mezi hladinou sérového cholesterolu, případně léčbou hypercholesterolemie, a kognitivními schopnostmi přitahuje pozornost delší dobu. Nízká hladina cholesterolu je dávána do souvislosti s rizikem rozvoje poklesu mentální výkonnosti v důsledku neurodegenerativních onemocnění, a naopak vysoká plazmatická koncentrace cholesterolu představuje uznaný rizikový faktor pro vaskulární změny vedoucí k demenci [21]. Tato kontroverze poutající pozornost zastánců obou názorů umožnila nashromáždění řady důkazů různé úrovně.
Na jedné straně stojí spíše kazuistická sdělení a data z postmarketingových sledování tolerance léčby statiny, v nichž nalezneme zprávy o přechodném poklesu mentální výkonnosti a zhoršení paměti u uživatelů statinů [22]. Problém představuje nejednotnost hodnocení a subjektivita takových informací. Dalším zdrojem informací mohou být dlouhodobá populační sledování. Ta opět mají své limitace, ale například zjištění z více než 25letého sledování populačního vzorku v baltimorské studii ukázalo ochranný vliv terapie statinem z hlediska rozvoje demence [23]. Podíváme-li se však na problematiku optikou nejpádnějších důkazů z randomizovaných klinických studií, které byly organizovány v naději, že podávání statinů má potenciál ke snížení rizika mentální deteriorace, dojdeme ke stejnému závěru jako u malignit. V žádné řádně uspořádané statinové studii nebyl zjištěn protektivní účinek podávání statinů na vznik a progresi demence a kognitivního deficitu, stejně jako nebyl potvrzen ani žádný vliv negativní [24, 25]. Opět můžeme uzavřít, že ovlivnění mentálního výkonu statiny není prokázané a nepředstavuje klinicky významný důvod pro změnu jejich použití.
Závěr
I přestože se tento komentář týká především posledních zpráv o možných nežádoucích účincích použití statinů, je vhodné na závěr připomenout, že statiny jsou hypolipidemiky volby, která jsou indikována u všech osob nedosahujících při nefarmakologických opatřeních cílových hodnot celkového a LDL cholesterolu pro danou kategorii rizika. U nemocných s vysokým a velmi vysokým rizikem je podáváme prakticky vždy; indikace je v těchto případech jednoznačná. Ani nově dostupné informace o nežádoucích účincích provázejících terapii statiny nejsou důvodem ke změně jejich použití a při pečlivém rozboru těchto informací zjistíme, že skutečných rizik spojených s touto léčbou je nemnoho.
Práce je částečně podpořena grantem IGA MZ ČR: NT 11307.
Seznam použité literatury
- [1] Sattar N, Preiss D, Murray HM, et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet 2010; 375: 735–742.
- [2] Sampson UK, Linton MF, Fazio S. Are statins diabetogenic? Curr Opin Cardiol 2011; 26: 342–347.
- [3] Ridker PM, Pradhan A, MacFadyen JG, et al. Cardiovascular benefits and diabetes risks of statin therapy in primary prevention: an analysis from the JUPITER trial. Lancet 2012; 380: 565–571.
- [4] Waters DD, Ho JE, Boekholdt S, et al. Cardiovascular event reduction versus new-onset diabetes during atorvastatin therapy: effect of baseline risk factors for diabetes. J Am Coll Cardiol 2013; 61: 148–152.
- [5] Preiss D, Sattar N. Statins and the risk of new-onset diabetes: a review of recent evidence. Curr Opin Lipidol 2011; 22: 460–466.
- [6] Rydén L, Standl E, Bartnik M, et al. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. Eur Heart J 2007; 28: 88–136.
- [7] Cholesterol Treatment Trialists’ (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376: 1670–1681.
- [8] SEARCH Collaborative Group. SLCO1B1 Variants and Statin-Induced Myopathy – A Genomewide Study. N Engl J Med 2008; 359: 789–799.
- [9] FDA Drug Safety Communication: Important safety label changes to cholesterol-lowering statin drugs, 28. 2. 2012. Dostupné na: http://www.fda.gov/Drugs/DrugSafety/ucm293101.htm
- [10] Hey-Hadavi JH, Kuntze E, Luo D. Tolerability of atorvastatin in a population aged > or = 65 years: a retrospective pooled analysis of results from fifty randomized clinical trials. Am J Geriatr Pharmacother 2006; 4: 112–122.
- [11] Catapano AL, Reiner Z, De Backer G, et al. ESC/EAS Guidelines for the management of dyslipidaemias. Atherosclerosis 2011; 217: 3–46
- [12] Nicholls SJ, Borgman M, Nissen SE. Impact of statins on progression of atherosclerosis: rationale and design of SATURN (Study of Coronary Atheroma by InTravascular Ultrasound: effect of Rosuvastatin versus Atorvastatin). Curr Med Res Opin 2011; 27: 1119–1129.
- [13] Chan DK, O‘Rourke F, Shen Q, et al. Meta-analysis of the cardiovascular benefits of intensive lipid lowering with statins. Acta Neurol Scand 2011; 124: 188–195.
- [14] Soška V, Vaverková H, Vrablík M, et al. Stanovisko výboru ČSAT k EAS/ESC doporučením pro diagnostiku a léčbu dyslipidemií z roku 2011. Vnitř Lék 2013; 59: 120–126.
- [15] Souhrn údajů o přípravku, dostupné na http://www.js-partner.cz/wp-content/uploads/SPC-Rosuvastatin-JS-Partner-5+10+15+20+30+40--mg.pdf
- [16] Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): randomised controlled trial. Lancet 2002; 360: 1623–1630.
- [17] Cholesterol Treatment Trialists’ (CTT) Collaboration, Emberson JR, Kearney PM, Blackwell L, et al. Lack of effect of lowering LDL cholesterol on cancer: meta-analysis of individual data from 175,000 people in 27 randomised trials of statin therapy. PLoS One 2012; 7: e29849.
- [18] Singh S, Singh PP, Singh AG, et al. Statins Are Associated With a Reduced Risk of Hepatocellular Cancer: A Systematic Review and Meta-analysis. Gastroenterology 2012 Oct 12.
- [19] Singh S, Singh AG, Singh PP, et al. Statins Are Associated with Reduced Risk of Esophageal Cancer, Particularly in Patients with Barrett’s Esophagus: A Systematic Review and Meta-Analysis. Clin Gastroenterol Hepatol 2013 Jan 25.
- [20] Zhang Y, Zang T. Association between Statin Usage and Prostate Cancer Prevention: A Refined Meta-Analysis Based on Literature from the Years 2005-2010. Urol Int 2012 Oct 9.
- [21] Levine DA, Langa KM. Vascular cognitive impairment: disease mechanisms and therapeutic implications. Neurotherapeutics 2011; 8: 361–373.
- [22] Evans MA, Golomb BA. Statin-associated adverse cognitive effects: survey results from 171 patients. Pharmacotherapy 2009; 29: 800–811.
- [23] Beydoun MA, Beason-Held LL, Kitner-Triolo MH. Statins and serum cholesterol’s associations with incident dementia and mild cognitive impairment. J Epidemiol Community Health 2011; 65: 949–957.
- [24] Trompet S, van Vliet P, de Craen AJ, et al. Pravastatin and cognitive function in the elderly. Results of the PROSPER study. J Neurol 2010; 257: 85–90.
- [25] Feldman HH, Doody RS, Kivipelto M, et al. Randomized controlled trial of atorvastatin in mild to moderate Alzheimer disease: LEADe. Neurology 2010; 74: 956–964.