Co znamená sdílené rozhodování mezi lékařem a pacientem u nemocných s psoriatickou artritidou?
Souhrn:
Šedová L, Tomasová‑Studýnková J, Štolfa J. Co znamená sdílené rozhodování mezi lékařem a pacientem u nemocných s psoriatickou artritidou? Remedia 2020; 30: 13–16.
V roce 2012 (s následnou aktualizací v roce 2015) publikovala Evropská liga proti revmatismu doporučení přístupu k péči o pacienty s psoriatickou artritidou ve snaze zajistit optimální standardizovanou péči o pacienty s tímto onemocněním založenou na důkazech. Jedním z hlavních předpokladů této standardizované péče je sdílené rozhodování pacienta a lékaře o všech aspektech této komplexní nemoci, což si vyžádá zevrubné informování nemocného. Tento článek se zabývá významem sdíleného rozhodování pro zlepšení spolupráce pacienta a lékaře, adherence k léčbě a schopností udělat informované rozhodnutí.
Summary:
Sedova L, Tomasova‑Studynkova J, Stolfa J. What does it mean to make shared decisions between physician and patient in patients with psoriatic arthritis? Remedia 2020; 30: 13–16.
In 2012, the European League against Rheumatism published recommendations for the management of psoriatic arthritis patient care in an effort to ensure optimal, standardized, evidence‑based care. In 2015, an update of these recommendations was published. One of the main assumptions for this standardized care is the shared decision between the patient and physician on all aspects of this comprehensive disease, which requires detailed information about the patient and his or her awareness about the complexity of the disease. This article discusses the importance of shared decision‑making for the improvement of patient‑physician collaboration, adherence to treatment, and the ability to make informed decisions.
Key words: guidelines for the management of psoriatic arthritis, shared decision, treat‑to‑target, standards of care.
Úvod
Dlouhodobě se předpokládalo, že jen lékaři sami mohou správně rozhodovat o terapeutickém postupu v léčbě pacientů s revmatickými chorobami, protože mají k tomu potřebné vzdělaní, dokážou tak problémy identifikovat, charakterizovat a najít i provést nejlepší řešení. Tento předpoklad se opíral také o přesvědčení, že pacienti a lékaři mají stejná očekávání od léčby [1]. V posledních letech vznikla řada publikací poukazujících na to, že existuje výrazná diskrepance mezi očekáváním pacientů a cílem lékařů při léčbě revmatických nemocí. Nejdříve se v revmatologii začaly na toto téma objevovat práce týkající se revmatoidní artritidy (RA).
Například Wolfe a Michaud ve své práci prokázali, že:
- 53,3 % pacientů s RA nechce měnit stanovenou terapii, protože jsou spokojeni se stávající aktivitou onemocnění,
- 72,5 % pacientů s RA si nepřeje riskovat nežádoucí účinky, které by mohly vzniknout v důsledku užívání nových léků,
- 68,1 % pacientů s RA se obává, že nová léčba nemusí být tak účinná jako stávající, a že by proto mohli ztratit kontrolu nad chorobou,
- 66,3 % pacientů s RA není přesvědčeno o tom, že jsou k dispozici lepší léky než ty, které používají,
- 35,7 % nemocných se bojí užívat léky v podkožních nebo nitrožilních injekcích.
Tyto postoje však často neodpovídají aktivitě a funkčnímu stavu RA [2]. Publikace vydané převážně pacientskými organizacemi také naznačovaly, že některé oblasti zdraví, které jsou pro pacienty důležité, jsou lékaři podceňovány.
Od začátku nového tisíciletí se proto postupně zvyšuje zájem o hodnocení revmatických onemocnění z pohledu pacienta – tzv. PROs (patient reported outcomes) – a počet publikací na toto téma exponenciálně roste od 1 211 v roce 1991 ke 22 345 v září 2019 (zdroj PubMed).
Historie pojmu sdílené rozhodování
Pod pojmem sdílené rozhodování se rozumí, že cíle léčby a jejich zdůvodnění jsou stanovovány v úzké spolupráci s pacientem a je pak také spolu s ním sestaven plán, jak těchto cílů dosáhnout, a způsob hodnocení účinnosti léčby.
V roce 2010 publikovala Evropská liga proti revmatismu (European League Against Rheumatism, EULAR) doporučení pro léčbu RA; tento dokument obsahoval tři obecné principy a 15 doporučení týkajících se způsobu sledování a hodnocení aktivity a prognózy nemoci, očekávaných cílů léčby a konkrétních terapeutických postupů. Jako druhý obecný princip („B“) byla zmíněna nutnost „…usilovat o zajištění nejlepší péče o pacienty s RA na základě sdíleného rozhodování nemocného a ošetřujícího revmatologa…“ a tento výraz byl v textu rozebrán velmi podrobně [3].
Update těchto doporučení EULAR z roku 2013 pokročil ještě dál a v obecných principech posunul dle důležitosti otázku sdíleného rozhodování z bodu B do bodu A. V tomto smyslu se zde uvádí, že je nutné informovat pacienta o účincích, ale i o rizicích léčby a o výhodách dosažení cílů léčby (remise, nízká aktivita nemoci). Zdůrazňuje se zde potřeba vzájemného sdělování názorů mezi lékařem a pacientem na cíl léčby a plán k jeho dosažení a je zde dán prostor pro pacientovy osobní preference [4].
V roce 2010 se také poprvé objevily publikace týkající se tzv. léčby k cíli u RA [5]. Smyslem této strategie je zajištění optimální péče o nemocné s RA. Vztahuje se na nemocné léčené syntetickými i biologickými chorobu modifikujícími léky (DMARDs, disease-modifying antirheumatic drugs) a je založena na pravidelném sledování aktivity onemocnění pomocí kompozitních indexů a na odpovídajících úpravách léčby. Prvním obecným principem léčby k cíli bylo již tehdy, že léčba RA má být založena na společném rozhodování pacienta a revmatologa, avšak poslední z 10 doporučení, které se týkalo právě tohoto principu, stavělo pacienta do pasivní role, protože zde bylo uvedeno, že pacient by měl být správně informován o cílech léčby a o plánu, jako tohoto cíle dosáhnout pod vedením revmatologa.
O pět let později byl zpracován update, který ukládá revmatologovi, aby zapojil pacienta s RA do procesu stanovení cílů léčby a strategie k jejich dosažení [6]. Zapojení pacienta do diskuse a společné rozhodování o postupu léčby ovšem předpokládá, že pacient bude zejména revmatologem adekvátně informován nejen o charakteru choroby a její prognóze, ale i o rizicích léčby (či „neléčby“), což znamená o rizicích a přínosech jednotlivých přípravků. Toto umožní nemocnému učinit informované rozhodnutí a mělo by pomoci k lepší adherenci k terapii [7−12].
Například dotazníková anketa ohledně ochoty zkusit redukovat dávky biologické léčby, která zahrnula bezmála 4 000 respondentů s RA z Nizozemska, dokazuje, že pacienti se stavějí k úpravě terapie − např. převod na jiný (switch) nebo na biosimilární přípravek, redukce dávek biologické léčby − pozitivně, pokud jsou informováni. Pro pacienty je důležitá i jistota ohledně možnosti návratu k původnímu léku nebo dávkování při eventuálním zhoršení funkce a bolesti. Neméně podstatný je pak pro ně i názor revmatologa [13,14].
Pro správné sdílené rozhodování je nutné probrat s nemocným nejen již zmíněné cíle léčby, konkrétní chorobu modifikující i adjuvantní terapii, hodnocení její účinnosti, charakter a prognózu nemoci, ale i komorbidity ovlivňující volbu léků, vlastní potřeby, očekávání a osobní pocity pacienta. Díky tomu lze dosáhnout lepší adherence, ale také zjednodušení budoucího rozhodování ohledně případné intenzifikace léčby. Ve zmíněném bodě 10 je také uvedeno, že informace podané pacientovi, způsob jeho zapojení do rozhodování, cíl léčby a mechanismy sledování účinnosti se mají řádně dokumentovat za účelem zavést srovnatelné standardy pro péči o nemocné s RA ve všech evropských státech.
Vypracováním standardů péče
(standards of care, SOC) byla pověřen Eumusc.net. (The
European Musculoskeletal Conditions Surveillance and Information
Network). Jedná se o projekt financovaný komisí
Evropské unie (EU) a EULAR, jehož cílem je právě zavést
ve všech zemích EU srovnatelné standardy pro péči
o muskuloskeletální zdraví, které by byly srozumitelné
nejen pro odborníky, ale i pro pacienty v celé Evropě.
Jejich implementace by měla proběhnout co nejdříve, nejpozději
však do roku 2020 (tab. 1)
[15].
Sdílené rozhodování u psoriatické
artritidy
Doporučení EULAR pro léčbu psoriatické artritidy (PsA) z roku 2012 poprvé zmiňují pojem sdílené rozhodování také jako obecný princip „B“ [16], což zůstává nadále v platnosti včetně poslední revidované verze doporučení z roku 2016 [17].
V roce 2014 publikovala EULAR doporučení ke strategii léčby k cíli pro spondyloartritidy axiální i periferní, zejména psoriatickou artritidu, kde se pojem sdílené rozhodnutí mezi lékařem a pacientem objevil stejně jako u RA již jako první obecný princip „A“. V konkrétních doporučeních se uvádí, že „…pacient by měl být přiměřeně informován a zapojen do diskuse o léčebném cíli, riziku a přínosu strategie plánované k dosažení tohoto cíle…“ [18]. Stejná dikce se objevuje i v update z roku 2017 [19].
Co všechno znamená sdílené
rozhodování u PsA?
Spektrum projevů PsA je mnohem širší než u RA. Kromě samotné artritidy jsou časté i jiné muskuloskeletální příznaky jako entezitidy, daktylitidy a postižení axiálního skeletu. Navíc PsA je často doprovázena i extraartikulárními extraskeletálními manifestacemi, především kožní psoriázou, ale i např. kardiovaskulárními chorobami, metabolickým syndromem, iridocyklitidou nebo Crohnovou chorobou. To vedlo k používání širšího výrazu „psoriatická nemoc“. Je tedy nasnadě, že se o pacienta s PsA musí postarat multidisciplinární tým, který může pokrýt všechny aspekty choroby, v popředí s revmatologem a dermatologem.
V centru zájmů lékařů jsou při hodnocení choroby především objektivně měřitelné parametry, jako jsou reaktanty akutní fáze, počty oteklých a bolestivých kloubů při vyšetření, rentgenologický nález, prognostické ukazatele či jiné biomarkery, kdežto pro pacienta jsou ve středu zájmu spíše subjektivní aspekty, jako jsou kromě bolesti jeho funkční, pracovní a rekreační schopnost, pocit únavy, spánkové poruchy, deprese, úzkost, strach, nejistota, rozpaky a ostych, pocit nepohodlí, rodinné a sexuální vztahy, schopnost se s nemocí vyrovnat a z hlediska kožních projevů i estetická stránka, svědění, olupování kůže, ale i množství léků, které musí užívat [20]. Tyto subjektivní stesky mohou mít však podklad v konkrétních objektivních příznacích nemoci. Například multicentrická studie Gudua a kol. ukázala, že vyšší počty oteklých a citlivých kloubů jsou asociovány s vyšší únavou [21], podobně výsledky hodnocení registru CORRONA prokázaly, že nemocní s entezitidou, resp. daktylitidou byli též častěji unavení [22].
Velká dotazníková studie provedená National Psoriasis Foundation v roce 2013, která zahrnovala 1 712 pacientů s psoriázou, ukázala, že 45,5 % nemocných je z různých důvodů nespokojeno s terapií [23]. Ve své práci z roku 2014 Gossecová a kol. hodnotili důležitost oblasti projevů nemoci a zjistili, že pro 84 % pacientů je prioritní bolest; kožní problémy, funkční a pracovní schopnost jsou považovány za prioritní zhruba u 50 % nemocných a více než čtvrtina pacientů považuje za nejdůležitější PsA navozené psychologické problémy, únavu a komplikace v rodinných vztazích [24] a je otázkou, do jaké míry se tyto priority setkávají s léčebnými cíli lékařů. Existují práce, které ukazují na rozpor mezi těmito prioritami, kdy pro lékaře jsou důležitější především objektivní a měřitelné parametry [25].
Tato diskrepance mezi způsobem hodnocení choroby lékařem a pacientem vede k tomu, že léčba je pak nastavena převážně dle parametrů určených lékařem, neuspokojuje proto plně potřeby pacienta a ve svém důsledku může vést ke špatné adherenci k terapii, a tudíž i k její nedostatečné účinnosti. Compliance a adherence k terapii jsou přitom přímo závislé na úrovni informovanosti pacienta a na dobré interakci a vztahu mezi pacientem a revmatologem [26].
To navozuje otázku, do jaké míry se v klinické praxi pacient skutečně podílí na rozhodování o léčbě svého onemocnění, resp. jaké jsou v tomto směru jeho preference a jak ve skutečnosti svůj podíl na tomto rozhodování vnímá. Tuto otázku řešila na základě dotazníkové akce průřezová studie nizozemských autorů z roku 2014 u 894 pacientů s RA, PsA a ankylozující spondylitidou [27]. Většina pacientů (59–63 %) preferovala sdílené rozhodování o léčbě, zatímco vnímání svého podílu na rozhodování o léčbě udávalo jen 26–55 %. Pacientovy preference tak byly splněny v 54 %. To se týkalo především prvního zavedení léčby DMARDs, méně snížení dávky či přerušení léčby. Nicméně malé, ale významné množství pacientů preferovalo přenechání rozhodnutí o léčbě výhradně na lékaři (32 %). Zatímco malá participace na léčebném rozhodování vedla k nespokojenosti pacienta, větší nikoliv. Plyne z toho tedy, že lékař by měl vždy usilovat o větší zapojení pacienta do léčebného rozhodování. Mimo jiné lze od tohoto přístupu očekávat i lepší compliance pacienta.
Cílem léčby PsA by měla být remise (definována jako nepřítomnost klinických a laboratorních známek zánětu, současně je předpokladem i nepřítomnost entezitid a daktylitid), ale v poslední době se jako léčebný cíl uznává i dosažení tzv. minimální aktivity onemocnění (MiDA, minimal disease activity). Parametry měřící tyto cíle jsou komplexní a snaží se zahrnout více klinických manifestací psoriatické nemoci a pojmout ji celistvě [28,29].
Posouzení MiDA zahrnuje kromě
kloubních parametrů (počet oteklých kloubů z 66 a počet
bolestivých kloubů z 68) i hodnocení onemocnění
pacientem (kloubní bolest a globální hodnocení onemocnění
pacientem na vizuální analogové škále 100 mm) a dále
počet míst s entezitidou, povrch kůže postižený lupénkou
(BSA, body surface area) a funkční postižení dle Health
Assessment Questionaire, tabulka 2. Tento ukazatel byl validován v několika studiích
[30].
V současnosti je k dispozici pro léčbu PsA řada přípravků, od nesteroidních antirevmatik přes glukokortikoidy, konvenční DMARDs, cílené syntetické až po originální a biosimilární biologické přípravky [31] s různým potenciálem ovlivnění jednotlivých příznaků (tab. 3) [32].
Terapeutická volba by měla být
určena převládajícími příznaky choroby a měla by také
pokrýt co největší počet domén. V úvahu je třeba brát
i předchozí terapii, pacientovy preference, další projevy
nemoci a komorbidity; účinnost léčby je nutné pravidelně
hodnotit a přizpůsobit stavu.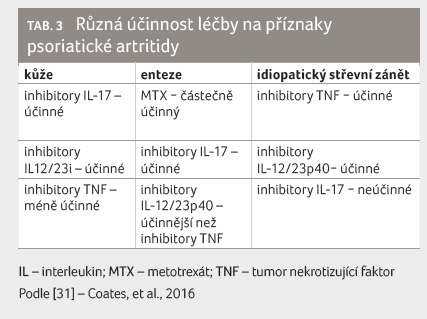
Závěr
Snaha o co nejkvalitnější péči o pacienty s revmatickými onemocněními ustavičně roste a terapeutické možnosti jsou stále lepší. Od doby vzniku doporučení EULAR a doporučení České revmatologické společnosti pro léčbu PsA [16,17,29] přibyly ještě další přípravky k její terapii. Léčivých přípravků máme tedy dostatek. Nyní je proto nutné se spíše soustředit na změnu přístupu k pacientům a změnu přístupu pacientů k léčbě, což si vyžádá i nové speciální vzdělávací programy pro revmatology i pro nemocné.
V běžné klinické praxi je dosaženo remise u PsA zhruba jen v 50−60 % případů a je otázkou, jestli je to proto, že léčba není dostatečně účinná, nebo proto, že existují překážky k naplnění cílů léčby jak ze strany lékařů, tak i pacientů. Strategie léčby k cíli se zaměřuje mimo jiné právě na to, aby byl pacient dostatečně informován o cílech terapie a snažil se jich dosáhnout.
Základní podmínkou pro sdílené rozhodování je adekvátní informovanost pacienta i lékaře. Je nutné společně probrat cíle léčby, frekvence a rozsah kontrol a shodnout se na konsenzuálním postupu. Lékař by měl také znát všechny subjektivní obtíže nemocného a rozptýlit jeho obavy z možných nežádoucích účinků, stejně jako možnost nocebo efektu při změně terapie [33]. Takto nastavená vzájemná komunikace přispívá k adherenci k léčbě a pomáhá optimalizovat její výsledky.
Znamená to ovšem vypracovat systém umožňující v krátkém čase, který je plátcem vyhrazen ke kontrole pacienta s PsA, zevrubně a srozumitelně seznamovat nemocné se širokou problematikou tohoto onemocnění, jeho dopadu na fyzické i mentální zdraví a s možnostmi jeho léčby.
Podporováno výzkumným projektem Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace 00000023728.
Seznam použité literatury
- [2] Wolfe F, Michaud K. Resistance of rheumatoid arthritis patients to changing therapy: discordance between disease activity and patients' treatment choices. Arthritis Rheum 2007; 56: 2135−2142.
- [3] Smolen J, Landewé R, Breedveld F, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease‑modifying antirheumatic drugs. Ann Rheum Dis 2010; 69: 964–975.
- [4] Smolen J, Landewé R, Breedveld F, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease‑modifying antirheumatic drugs. Ann Rheum Dis 2014; 73: 492–509.
- [5] Smolen JS, Aletaha D, Bijlsma JWJ, et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis 2010; 69: 631–637.
- [6] Smolen JS, Breedveld FC, Burmester GR, et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force. Ann Rheum Dis 2016; 75: 3−15.
- [7] Kvien TK, Heiberg T. Patient perspective in outcome assessmentsperceptions or something more? J Rheumatol 2003; 30: 873−876.
- [8] Kobue B, Moch S, Watermeyer J. “It's so hard taking pills when you don't know what they're for”: a qualitative study of patients’ medicine taking behaviours and conceptualization of medicines in the context of rheumatoid arthritis. BMC Health Serv Res 2017; 17: 303.
- [9] Wabe N, Wiese MD. Treating rheumatoid arthritis to target: physician and patient adherence issues in contemporary rheumatoid arthritis therapy. J Eval Clin Pract 2017; 23: 486−493.
- [10] Fraenkel L, Peters E, Charpentier P, et al. Decision tool to improve the quality of care in rheumatoid arthritis. Arthritis Care Res (Hoboken) 2012; 64: 977–985.
- [11] Barton JL, Imboden J, Graf J, et al. Patient‑physician discordance in assessments of global disease severity in rheumatoid arthritis. Arthritis Care Res 2010; 62: 857–864.
- [12] Smolen JS, Strand V, Koenig AS, et al. Discordance between patient and physician assessments of global disease activity in rheumatoid arthritis and association with work productivity. Arthritis Res Ther 2016; 18: 114.
- [13] Verhoef LM, Selten EMH, Vriezekolk JE, et al. The patient perspective on biologic DMARD dose reduction in rheumatoid arthritis: a mixed methods study. Rheumatology 2018; 57: 1947–1955.
- [14] Tweehuysen L, Huiskes VBJ, van den Bemt BJF, et al. Higher acceptance and persistence rates after biosimilar transitioning in patients with a rheumatic disease after employing an enhanced communication strategy. Ann Rheum Dis 2017; 76(Suppl 2): 557.
- [15] Stoffer MA, Smolen JS, Woolf A, et. al. Development of patient‑centred standards of care for rheumatoid arthritis in Europe: the eumusc.net project. Ann Rheum Dis 2014; 73: 902−905.
- [16] Gossec L, Smolen JS, Gaujoux‑Viala C, et al. European League Against Rheumatism recommendations for the management of psoriatic arthritis with pharmacological therapies. Ann Rheum Dis 2012; 71: 4−12.
- [17] Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016; 75: 499−510.
- [18] Smolen JS, Braun J, Dougados M, et al. Treating spondyloarthritis, including ankylosing spondylitis and psoriatic arthritis, to target: recommendations of an international task force. Ann Rheum Dis 2014; 73: 6−16.
- [19] Smolen JS, Schöls M, Braun J, et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis 2018; 77: 3−17. Erratum in: Ann Rheum Dis 2018; 77: 472.
- [20] Coates LC, Helliwell PS. Comment on: Efficacy and safety of anti‑TNF therapies in psoriatic arthritis: an observational study from the British Society for Rheumatology Biologics Register. Rheumatology 2010; 49: 1793–1794.
- [21] Gudu T, Etcheto A, de Wit M. Fatigue in psoriatic arthritis – a cross‑sectional study of 246 patients from 13 countries. Joint Bone Spine 2016; 83: 439−443.
- [22] Mease PJ, Karki C, Palmer JB, et al. Clinical Characteristics, Disease Activity, and Patient‑Reported Outcomes in Psoriatic Arthritis Patients with Dactylitis or Enthesitis: Results from the Corrona Psoriatic Arthritis/Spondyloarthritis Registry. Arthritis Care Res (Hoboken) 2017; 69: 1692−1699.
- [23] Armstrong AW, Robertson AD, Wu J, et al. Undertreatment, treatment trends, and treatment dissatisfaction among patients with psoriasis and psoriatic arthritis in the United States: findings from the National Psoriasis Foundation surveys, 2003‑2011. JAMA Dermatol 2013; 149: 1180‑5. Erratum in: JAMA Dermatol 2014; 150: 103. JAMA Dermatol 2014; 50: 337.
- [24] Gossec L, de Wit M, Kiltz U, et al. A patient‑derived and patient‑reported outcome measure for assessing psoriatic arthritis: elaboration and preliminary validation of the Psoriatic Arthritis Impact of Disease (PsAID) questionnaire, a 13‑country EULAR initiative. Ann Rheum Dis 2014; 73: 1012−1019.
- [25] Hewlett SA. Patients and clinicians have different perspectives on outcomes in arthritis. J Rheumatol 2003; 30: 877−879.
- [26] Viller F, Guillemin F, Briançon S, et al. Compliance to drug treatment of patients with rheumatoid arthritis: a 3‑year longitudinal study. J Rheumatol 1999; 26: 2114−2122.
- [27] Nota I, Drossaert C, Taal E, et al. Patient participation in decisions about disease modifying anti‑rheumatic drugs: a cross‑sectional survey. BMC Musculoskelet Disord 2014; 15: 333.
- [28] Coates LC, Fransen J, Helliwell PS. Defining minimal disease activity in psoriatic arthritis: a proposed objective target for treatment. Ann Rheum Dis 2010; 69: 48–53.
- [29] Štolfa J, Vencovský J, Pavelka K. Doporučené léčebné postupy pro psoriatickou artritidu. Česká revmatologie 2016; 24: 142−152.
- [30] Coates LC, Helliwell PS. Validation of minimal disease activity (MDA) criteria for psoriatic arthritis using interventional trial data. Arthritis Care Res 2010; 62: 965–969.
- [31] Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheumatol 2016; 68: 1060−1071.
- [32] Van den Bosch F, Coates L. Clinical management of psoriatic arthritis. Lancet 2018; 391: 2285−2294.
- [33] Planès S, Villier C, Mallaret M. The nocebo effect of drugs. Pharmacol Res Perspect 2016; 4: e00208.