Cushingův syndrom a možnosti jeho řešení v roce 2012
Cushingův syndrom je závažné onemocnění způsobené autonomní nadprodukcí kortizolu. Je charakterizován těžkým komplexním systémovým postižením s významně zvýšenou morbiditou a mortalitou. Proto je nezbytně nutné včasné stanovení etiologicky správné diagnózy a volba odpovídající léčby. I když léčbou první volby je u většiny příčin Cushingova syndromu chirurgické řešení, v řadě případů je nezbytné využití léčby medikamentózní. Možnosti této terapie však nejsou zcela uspokojivé ani přes určité pokroky, jichž bylo v poslední době dosaženo. V tomto článku je podán základní přehled současných možností medikamentózní léčby Cushingova syndromu.
Definice a výskyt
Cushingův syndrom (CS) byl popsán Harveyem Cushingem v roce 1932 [1]. CS je soubor příznaků, který vzniká jako následek protrahované expozice organismu nadměrnému množství cirkulujícího kortizolu v důsledku jeho autonomní nadprodukce. CS patří mezi vzácná onemocnění s odhadovanou incidencí 2–4 případy na jeden milion obyvatel a jeden rok [2].
Etiologie
C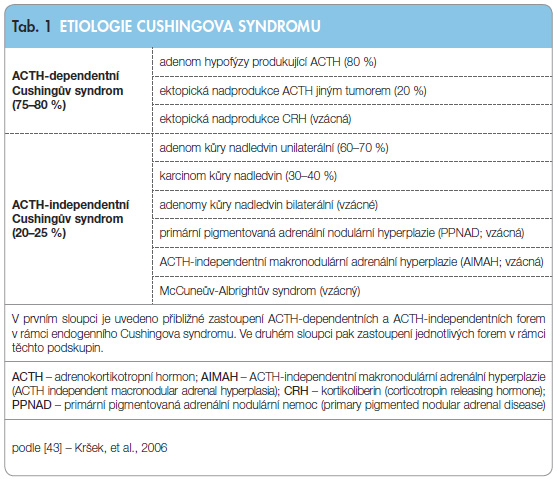 S dělíme na tzv. ACTH (adrenokortikotropní hormon)-dependentní CS, způsobený primárně nadprodukcí ACTH, a ACTH-independentní CS, způsobený primárně nadprodukcí kortizolu v kůře nadledvin [3]. ACTH-dependentní CS představuje asi 75 % všech případů onemocnění Cushingovým syndromem. Dále ho dělíme na tzv. Cushingovu nemoc (CD) neboli centrální CS, způsobený nadprodukcí ACTH tumorem hypofýzy, v naprosté většině případů adenomem hypofýzy produkujícím ACTH, a na tzv. paraneoplastický CS či ektopický ACTH syndrom, při kterém je ACTH produkován jinými tumory. Byla popsána řada tumorů s nadprodukcí ACTH, nejčastěji se jedná o tumory v oblasti plic a mediastina, převažuje malobuněčný plicní karcinom a bronchiální karcinoid.
S dělíme na tzv. ACTH (adrenokortikotropní hormon)-dependentní CS, způsobený primárně nadprodukcí ACTH, a ACTH-independentní CS, způsobený primárně nadprodukcí kortizolu v kůře nadledvin [3]. ACTH-dependentní CS představuje asi 75 % všech případů onemocnění Cushingovým syndromem. Dále ho dělíme na tzv. Cushingovu nemoc (CD) neboli centrální CS, způsobený nadprodukcí ACTH tumorem hypofýzy, v naprosté většině případů adenomem hypofýzy produkujícím ACTH, a na tzv. paraneoplastický CS či ektopický ACTH syndrom, při kterém je ACTH produkován jinými tumory. Byla popsána řada tumorů s nadprodukcí ACTH, nejčastěji se jedná o tumory v oblasti plic a mediastina, převažuje malobuněčný plicní karcinom a bronchiální karcinoid.
ACTH-independentní CS představuje přibližně 25 % všech případů endogenního CS. Zhruba v 98 % je jeho příčinou tumor kůry nadledvin, převažují adenomy nad karcinomy přibližně v poměru 2–3 : 1. Pouze asi ve 2 % se jedná o vzácnou bilaterální hyperplazii nadledvin, buď o tzv. ACTH-independentní makronodulární adrenální hyperplazii (AIMAH) [4], nebo o primární pigmentovanou nodulární adrenální nemoc (PPNAD) [5]. Přehled etiologie Cushingova syndromu je uveden v tab. 1.
Klinický obraz
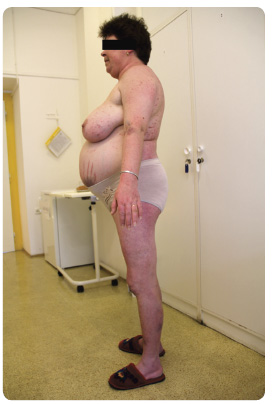 CS je závažné onemocnění obvykle charakterizované obezitou centrálního typu, akumulací tuku v obličeji (moon face), v supraklavikulárních prostorách, v oblasti krku (buffalo hump), která kontrastuje s tenkými končetinami. Kůže je tenká, snadno zranitelná, je patrný sklon k infekcím a hematomům. Charakteristický je výskyt strií, které jsou typicky tlusté a purpurově zbarvené, kromě břicha se mohou vyskytovat v axilách, na stehnech, hýždích (obr. 1). Častý je výskyt sekundární hypertenze, poruchy glukózové tolerance, dyslipidemie, retence tekutin, hypokalemie, hyperkoagulačního stavu, dochází k úbytku kostní hmoty (osteoporóza, osteopenie). CS komplexně postihuje své nositele a oproti běžné populaci má přibližně 4krát vyšší morbiditu a mortalitu, především díky vysokému kardiovaskulárnímu riziku [6, 7].
CS je závažné onemocnění obvykle charakterizované obezitou centrálního typu, akumulací tuku v obličeji (moon face), v supraklavikulárních prostorách, v oblasti krku (buffalo hump), která kontrastuje s tenkými končetinami. Kůže je tenká, snadno zranitelná, je patrný sklon k infekcím a hematomům. Charakteristický je výskyt strií, které jsou typicky tlusté a purpurově zbarvené, kromě břicha se mohou vyskytovat v axilách, na stehnech, hýždích (obr. 1). Častý je výskyt sekundární hypertenze, poruchy glukózové tolerance, dyslipidemie, retence tekutin, hypokalemie, hyperkoagulačního stavu, dochází k úbytku kostní hmoty (osteoporóza, osteopenie). CS komplexně postihuje své nositele a oproti běžné populaci má přibližně 4krát vyšší morbiditu a mortalitu, především díky vysokému kardiovaskulárnímu riziku [6, 7].
Diagnostika a diferenciální diagnostika
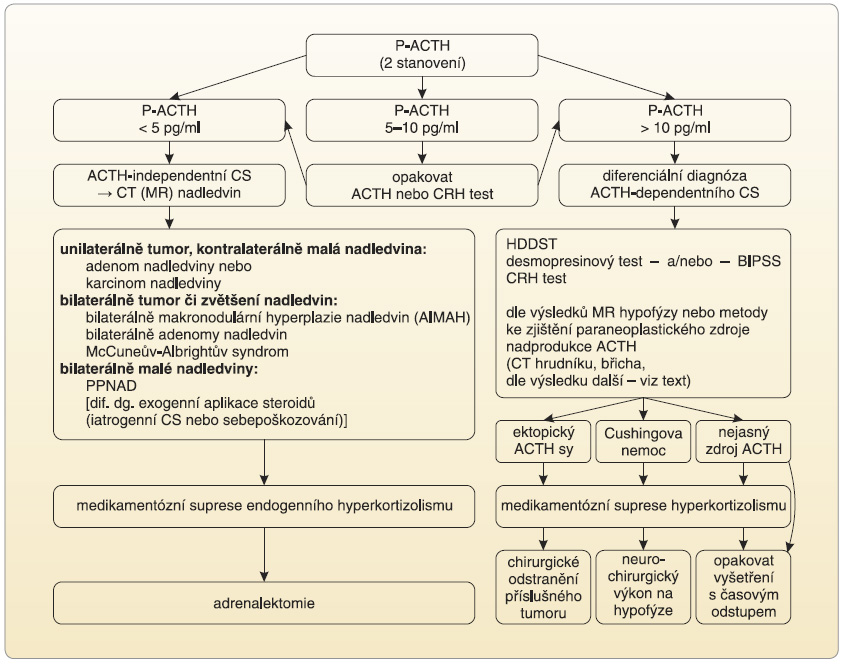
![Obr. 2 Algoritmus vyšetření u pacientů s podezřením na Cushingův syndrom; podle [9] – Nieman, et al., 2008. CRH-DEX test – test s kortikoliberinem po dexametazonové supresi; CS – Cushingův syndrom; DST – dexametazonový supresní test; P – plazmatický; S – slinný (kortizol)](https://www.remedia.cz/photo-a-29101---.jpg) Vzhledem k závažnosti CS je nezbytná časná a etiologicky správná diagnostika a diferenciální diagnostika. Její podrobný popis přesahuje rámec této publikace. Zjednodušené schéma diagnostiky CS je uvedeno na obr. 2, schéma diferenciální diagnostiky a léčby pak na obr. 3. Podrobněji je diagnostika a diferenciální diagnostika CS uvedena v řadě publikací, např. [8, 9].
Vzhledem k závažnosti CS je nezbytná časná a etiologicky správná diagnostika a diferenciální diagnostika. Její podrobný popis přesahuje rámec této publikace. Zjednodušené schéma diagnostiky CS je uvedeno na obr. 2, schéma diferenciální diagnostiky a léčby pak na obr. 3. Podrobněji je diagnostika a diferenciální diagnostika CS uvedena v řadě publikací, např. [8, 9].
Volba terapie
Volba léčby závisí především na etiologii CS.
Cushingova nemoc
Metodou první volby v léčbě CD je neurochirurgické odstranění tumoru hypofýzy, které se dnes provádí většinou tzv. transsfenoidálním přístupem. U mikroadenomů (≤ 1 cm) je operace úspěšná přibližně v 80 %, u makroadenomů (> 1 cm) je to pouze přibližně v 50 %. Při neúspěchu operace přichází v úvahu reoperace nebo stereotaktické ozáření, v ČR obvykle Leksellovým gama nožem. U pacientů s trvající hormonální aktivitou používáme léčbu medikamentózní. U jinak neřešitelných případů s vysokou hormonální aktivitou máme k dispozici provedení bilaterální adrenalektomie. Tento zákrok vede k definitivnímu vyřešení hyperkortizolismu, nevýhodou je, že neřeší základní příčinu onemocnění, a navíc vede k nutnosti doživotní substituce hypokortikalismu. Bilaterální adrenalektomie také vede často k rozvoji tzv. Nelsonova syndromu, pro který je charakteristický rychlý invazivní růst adenomu hypofýzy produkujícího ACTH.
Nadledvinové formy
Metodou volby v léčbě tumorů nadledvin je adrenalektomie, dnes ve většině případů laparoskopická. U AIMAH je v některých případech možno zkusit efekt specifické medikamentózní léčby. Při neúspěchu medikamentózní léčby je indikována bilaterální adrenalektomie. U PPNAD je metodou volby provedení bilaterální adrenalektomie. V případě reziduálního onemocnění u karcinomu nadledvin je indikována chemoterapie. Základem chemoterapeutických režimů je mitotan.
Paraneoplastické formy
V případě ektopické nadprodukce ACTH závisí léčba na druhu a lokalizaci příslušného tumoru, základem je v naprosté většině případů chirurgická léčba. Při jejím neúspěchu nebo nemožnosti provedení používáme léčbu medikamentózní či specifickou chemoterapii či radioterapii dle druhu tumoru. Jinak neovlivnitelnou vysokou hormonální aktivitu můžeme řešit bilaterální adrenalektomií.
Medikamentózní léčba
Medikamentózní léčbou CS v užším slova smyslu rozumíme léčbu, jejímž cílem je snížení hormonální aktivity onemocnění, tedy snížení produkce kortizolu.
Medikamentózní léčbu používáme v následujících případech:
- Při trvající hormonální aktivitě po neúspěšném chirurgickém řešení a u pacientů, kteří prodělali neurochirurgickou operaci s reziduem adenomu hypofýzy, byla u nich provedena r
 adioterapie a čekáme na nástup jejího účinku.
adioterapie a čekáme na nástup jejího účinku. - K normalizaci nebo snížení hormonální aktivity v případech, kdy se nám nedaří identifikovat zdroj nadprodukce ACTH, jako dočasné řešení mezi vyšetřovacími procedurami nebo kontrolními vyšetřeními.
- K normalizaci nebo snížení hormonální aktivity u pacientů, u nichž by byla v případě neúspěchu medikamentózní terapie indikována bilaterální adrenalektomie.
- Jako paliativní léčbu u inoperabilních stavů a u metastazujících tumorů produkujících kortizol či ACTH.
- Zvláštní indikací je léčba před chirurgickým řešením. Medikamentózní snížení hormonální aktivity předoperačně vede ke korekci metabolických odchylek, ke zlepšení klinického stavu pacientů a pravděpodobně i ke snížení perioperační a pooperační morbidity a mortality.
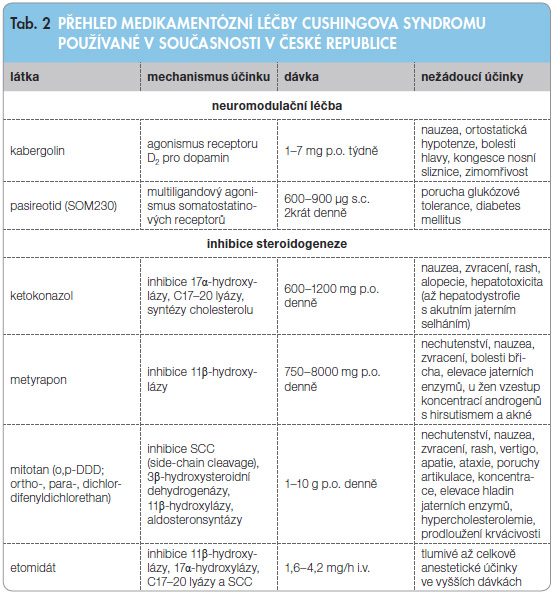
Medikamentózní léčbu Cushingova syndromu dělíme podle místa, na kterém zasahuje, na léčbu neuromodulační, adrenolytickou a na léčbu antagonisty glukokortikoidních receptorů (tab. 2) [10].
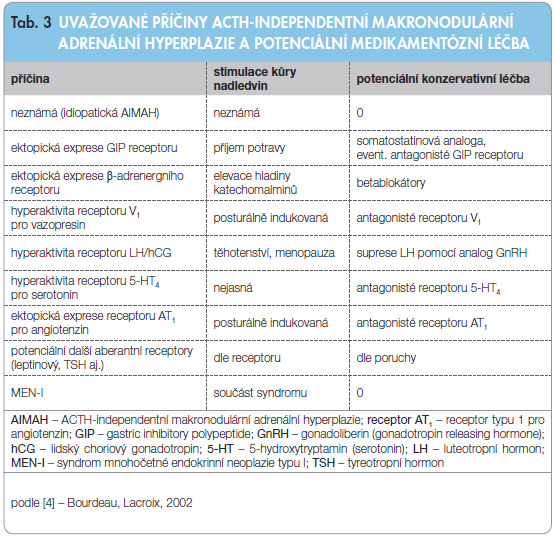
Zvláštním druhem medikamentózní léčby je terapeutické ovlivnění aktivity aberantních receptorů u AIMAH (tab. 3) [4].
Neuromodulační léčba
Pomocí neuromodulační léčby ovlivňujeme různými mechanismy na neuroendokrinní (hypotalamo-hypofyzární) úrovni sekreci ACTH.
Agonisté dopaminu
 Agonisty dopaminu primárně využíváme v léčbě prolaktinomů a hyperprolaktinemie. Tyto látky jsou schopny snižovat i sekreci ACTH. Není zcela jasné, zdali sekreci ACTH snižují přímo, nebo prostřednictvím snížení sekrece kortikoliberinu (hormonu uvolňujícího kortikotropin, CRH). Nejpoužívanějšími látkami z této skupiny jsou kabergolin a bromokriptin [11].
Agonisty dopaminu primárně využíváme v léčbě prolaktinomů a hyperprolaktinemie. Tyto látky jsou schopny snižovat i sekreci ACTH. Není zcela jasné, zdali sekreci ACTH snižují přímo, nebo prostřednictvím snížení sekrece kortikoliberinu (hormonu uvolňujícího kortikotropin, CRH). Nejpoužívanějšími látkami z této skupiny jsou kabergolin a bromokriptin [11].
V minulosti nečastěji používaný bromokriptin vedl k významnému snížení sekrece kortizolu a ke zlepšení klinického stavu jen u variabilního množství pacientů, obvykle spíše jen u malého počtu jedinců. Pouze v jedné práci s vysokými dávkami až 40 mg denně bylo zaznamenáno zlepšení klinického stavu až u 50 % pacientů [10, 12].
Podávání vysokých dávek bromokriptinu je však provázeno vysokým výskytem nežádoucích účinků (nauzea, ortostatická hypotenze, bolesti hlavy, kongesce nosní sliznice, halucinace).
V současnosti v indikaci léčby CD preferenčně používáme kabergolin, který je účinnější a jeho podávání je provázeno menším výskytem nežádoucích účinků. Podle některých recentních studií je kabergolin schopen normalizovat vylučování volného močového kortizolu (urinary free cortisol, UFC) až u 36 % pacientů s CD, snížit je až u 75 % pacientů, avšak při jeho dlouhodobém použití dochází až u 20 % k významnému snížení až vymizení účinnosti kabergolinu [13]. Používané dávky kabergolinu se obvykle pohybovaly mezi 1–6 mg týdně. Dobrý účinek na snížení sekrece ACTH byl popsán i u pacientů s neuroendokrinním tumorem produkujícím ACTH a u pacientů s Nelsonovým syndromem, u jejichž části bylo zaznamenáno i zmenšení adenomu hypofýzy produkujícího ACTH [14, 15]. Souhrnně ale můžeme konstatovat, že data týkající se dlouhodobé léčby CD kabergolinem jsou v současnosti nedostatečná a jeho použití v této indikaci je v současnosti limitováno na omezený počet pacientů.
Kromě obecných nežádoucích účinků agonistů dopaminu, které jsou u kabergolinu málo časté, je potřeba zmínit teoretickou možnost poškození chlopenního aparátu při dlouhodobém podávání vysokých dávek kabergolinu. Proto je doporučováno u léčených pacientů každoroční provedení echokardiografického vyšetření [16].
Analoga somatostatinu
Superaktivní analoga somatostatinu jsou klasicky používána k léčbě akromegalie. V této indikaci používáme lanreotid a oktreotid, které se váží především na 2. podtyp somatostatinových receptorů a s menší afinitou na 5. podtyp somatostatinových receptorů. Adenomy hypofýzy produkující ACTH však exprimují všechny typy somatostatinových receptorů, většina pak preferenčně 5. podtyp. Kortizol navíc vede k potlačení exprese především 2. podtypu somatostatinových receptorů. To je pravděpodobně příčinou toho, že léčba lanreotidem a oktreotidem u naprosté většiny pacientů s CD selhává, částečné úspěchy byly zaznamenány u pacientů s Nelsonovým syndromem, kde odpadá supresivní vliv hyperkortizolemie na expresi somatostatinových receptorů [17]. Částečné úspěchy byly zaznamenány i při léčbě tumorů s ektopickou sekrecí ACTH [18].
Nově máme v léčbě CD k dispozici multiligandový analog somatostatinu pasireotid (SOM 230). Pasireotid se váže na všechny podtypy somatostatinových receptorů, nejvíce pak právě na 5. podtyp, ke kterému má 40krát vyšší afinitu než oktreotid [19]. Studie 2. fáze s pasireotidem prokázala, že dvoutýdenní léčba snižovala vylučování UFC celkem u 76 % pacientů s CD, přičemž u 17 % došlo k normalizaci UFC a u 38 % k významnému (≥ 50 %) poklesu hladiny UFC [20]. Multicentrická studie 3. fáze s dlouhodobou léčbou CD pasireotidem u 162 pacientů v dávkách 600 μg s.c. 2krát denně, respektive 900 μg s.c. 2krát denně, prokázala po 12 měsících normalizaci hodnoty UFC u 19,1 % pacientů (13,4 % při dávce 600 μg 2krát denně; 25 % při dávce 900 μg 2krát denně) a u 9,3 % (2,5 %, resp. 15,9 %) došlo k významnému poklesu hodnoty UFC (≥ 50 %). Lepších výsledků bylo dosaženo u pacientů s nižší hormonální aktivitou. Spolu s aktivitou onemocnění posuzovanou podle UFC docházelo i ke snížení koncentrací ACTH, snížení krevního tlaku, k poklesu hmotnosti, zlepšení lipidového spektra a zvýšení kvality života léčených pacientů. Při léčbě se vyskytovaly nežádoucí účinky společné pro somatostatinová analoga (cholecystolitiáza, bolesti břicha, průjem, nauzea, zvracení, slabost, únavnost, hypotenze, vertigo, bolesti hlavy, elevace hladin jaterních enzymů) přibližně ve stejné frekvenci jako při podávání lanreotidu a oktreotidu. Oproti nim však navíc při léčbě pasireotidem dochází k poměrně vysokému výskytu hyperglykemie, poruchy glukózové tolerance a ke vzniku nebo zhoršení diabetu mellitu (dohromady až v 73 % případů). Příčinou je pravděpodobně inhibice sekrece inzulinu a hormonů stimulujících sekreci inzulinu. Takto vzniklou poruchu glukózového metabolismu lze nejlépe ovlivnit podáním analog GLP-1 nebo inhibitorů DPP-4 [21].
Agonisté PPAR-γ
Nukleární receptory PPAR-γ (peroxisome proliferator-activated receptor-γ) jsou přítomny v buňkách tumorů secernujících ACTH [22]. Na základě poměrně úspěšných experimentů in vitro a částečně i in vivo na zvířecích modelech s tumory produkujícími ACTH bylo provedeno několik malých klinických studií u pacientů s CD a s Nelsonovým syndromem. Výsledky těchto studií však byly neuspokojivé. Příčiny selhání této léčby u lidí nejsou jasné, jednou z nich může být potřeba podávání vysokých dávek, jež by ale bylo provázeno četnými nežádoucími účinky. Léčba CD agonisty PPAR-γ není v současnosti doporučována, i když nelze vyloučit, že u některých jednotlivých pacientů by zvláště v kombinaci s jinými léky význam mít mohla [23, 24].
Antagonisté receptoru pro serotonin
Do této skupiny řadíme především cyproheptadin (neselektivní antagonista receptoru pro 5-HT – 5-hydroxytryptamin; serotonin) a ritanserin (selektivní antagonista receptoru 5-HT2). Obě tyto látky snižují sekreci ACTH, přičemž není zcela jasné, zdali přímo na úrovni hypofýzy, nebo na úrovni hypotalamické prostřednictvím snížení sekrece CRH. Výsledky studií s použitím antagonistů receptoru pro 5-HT u nemocných s CD či Nelsonovým syndromem však nebyly příliš uspokojivé a dobrého efektu léčby bylo dosaženo jen u části pacientů, proto nedošlo k jejich většímu rozšíření v této indikaci [25, 26].
Valproát sodný
Valproát sodný je agonista kyseliny gama-aminomáselné (GABA), používá se jako antiepileptikum a zároveň je schopný snižovat sekreci ACTH. Výsledky studií s valproátem sodným u pacientů s CD jsou však rozporuplné. Data z některých starších studií svědčila pro příznivý vliv dávky 600 mg denně na sekreci ACTH [27], výsledky dalších studií však tento příznivý účinek již neprokázaly [28]. Valproát proto není obecně doporučován k léčbě CD, avšak je možné, že u některých jednotlivých pacientů, zvláště v kombinaci s jinými léky, by mohl být vhodný.
Kyselina retinová
Deriváty kyseliny retinové jsou používány v dermatologii k léčbě akné a psoriázy a v onkologii k léčbě některých malignit. Kyselina retinová je ligandem Nur77/Nurr1 receptoru, který se kromě jiného účastní procesu sekrece ACTH stimulované CRH. Kyselina retinová v experimentech in vitro inhibuje proliferaci buněk tumorů produkujících ACTH a indukuje jejich smrt [29]. Tyto účinky nejsou prokazatelné u normálních kortikotrofních buněk zdravé hypofýzy. Kromě hypofýzy ovlivňuje rovněž buňky kůry nadledvin, na myším modelu inhibuje sekreci kortikosteronu a buněčnou proliferaci. Studie s podáním kyseliny retinové v dávce 10 mg/kg hmotnosti byly úspěšné rovněž v experimentech na psech [30]. Studie s podáním kyseliny retinové pacientům s CD však dosud nebyly provedeny.
Adrenolytická léčba
Adrenolytická léčba je primárně zaměřena na buňky kůry nadledvin a inhibici adrenální steroidogeneze. I přes některé pokroky, jichž bylo v poslední době dosaženo, stále zůstává základem medikamentózní léčby CS různé etiologie.
Ketokonazol
Ketokonazol je derivát imidazolu běžně používaný jako antimykotikum. Při systémovém podání inhibuje v kůře nadledvin syntézu sexuálních steroidů a kortizolu mechanismem inhibice 17α-hydroxylázy a C17–20 lyázy. Dále inhibuje i syntézu cholesterolu [31]. V indikaci inhibice steroidogeneze se podává v dávkách výrazně vyšších, než jsou dávky antimykotické. Začínáme obvykle dávkou 400 mg denně, účinné dávky se většinou pohybují v rozmezí 600–1200 mg denně rozdělených do 3–4 denních podání. V takto vysokých dávkách je léčba ketokonazolem provázena řadou nežádoucích účinků, zejména gastrointestinálních (nauzea, zvracení) a kožních (rash, alopecie). Nejzávažnější je hepatotoxicita, vzácně může docházet i k závažnému postižení jater charakteru hepatodystrofie s akutním jaterním selháním [32]. Nutností jsou laboratorní kontroly jaterních parametrů. Inhibici syntézy androgenů lze využít u žen, naopak u mužů může podávání ketokonazolu vést k poklesu libida a ke vzniku gynekomastie. Pro optimální vstřebávání je nezbytná přítomnost kyselého prostředí v žaludku, účinnost ketokonazolu je proto významně snížena u pacientů s achlorhydrií. Nástup účinku ketokonazolu trvá několik týdnů.
Metyrapon
Metyrapon působí jako inhibitor 11β-hydroxylázy, enzymu, který katalyzuje poslední stupeň syntézy kortizolu, přeměnu 11-deoxykortizolu na kortizol. Metyrapon je nejúčinnějším inhibitorem steroidogeneze s rychlým nástupem účinku, který se projeví v prvních třech dnech podávání. Léčbu obvykle zahajujeme dávkou 750 mg denně, kterou podáváme rozděleně ve třech denních dávkách, a podle účinnosti ji titrujeme, v některých případech až do dávky 3–8 g denně rozdělené do čtyř denních dávek [33]. Nežádoucí účinky nejsou časté, nicméně zejména při podávání vysokých dávek se může objevit nechutenství, nauzea, zvracení, bolesti břicha, elevace hladin jaterních enzymů, u žen se v důsledku vzestupu koncentrací androgenů může objevit hirsutismus a akné.
Mitotan
Mitotan (o,p-DDD; ortho-, para-dichlordifenyldichlorethan) snižuje syntézu kortizolu mechanismem blokády SCC (side-chain cleavage), 3β-hydroxysteroidní dehydrogenázy, 11β-hydroxylázy a syntézu aldosteronu mechanismem blokády aldosteronsyntázy. Od roku 1960 až dodnes je vzhledem ke svým adrenocytostatickým účinkům základním lékem používaným v léčbě karcinomu kůry nadledvin. Nástup účinku mitotanu je pomalý, ale jeho působení je protrahované se supresí funkce kůry nadledvin až několik měsíců po vysazení léčby. U pacientů s karcinomem kůry nadledvin terapii obvykle začínáme dávkami 1–1,5 g denně a dávku zvolna zvyšujeme podle efektu na steroidogenezi a podle míry nežádoucích účinků, respektive tolerance léčby, až do dávky 6–10 g denně. Vhodné je monitorovat koncentraci mitotanu v krvi, za terapeutické rozmezí jsou považovány koncentrace 14–20 mg/l. Při léčbě mitotanem je třeba počítat s četnými nežádoucími účinky, jako je především nechutenství, nauzea, zvracení, rash, vertigo, apatie, ataxie, dále jsou to poruchy artikulace a koncentrace [34]. Laboratorně může docházet k elevaci hladin jaterních enzymů, hypercholesterolemii a k prodloužení krvácivosti. V indikaci inhibice steroidogeneze používáme mitotan zřídka, a pokud jsme nuceni ho použít, podáváme obvykle nižší dávky než při léčbě adenokortikálního karcinomu.
Etomidát
Etomidát je celkové anestetikum, chemicky derivát imidazolu. Inhibice steroidogeneze je jeho vedlejším účinkem a probíhá na úrovni 11β-hydroxylázy, 17α-hydroxylázy a v menší míře C17–20 lyázy a SCC. V indikaci inhibice steroidogeneze je podáván v „neanestetických“ dávkách 1,6–4,2 mg/h i.v. V těchto dávkách je účinným inhibitorem steroidogeneze s rychlým nástupem účinku, jeho nevýhodou je nutnost parenterální aplikace. U některých těžkých případů CS může být jeho použití indikované a účinné, zvláště u těžkých případů v podmínkách jednotek intenzivní péče [35, 36].
Aminoglutethimid
Aminoglutethimid byl původně používán jako antikonvulzivum, později i v léčbě karcinomu prsu. Kromě toho blokuje přeměnu cholesterolu na pregnenolon (SCC), inhibuje 11β-hydroxylázu, 18-hydroxylázu a aromatázu. Byl proto zkoušen i v léčbě CS. Byl však méně účinný než výše uvedené léky a jeho účinnost se dále během léčby snižovala v důsledku zvýšení produkce ACTH, která překonávala vliv blokády steroidogeneze, navíc docházelo i k indukci jaterních enzymů se zvýšením clearance aminoglutethimidu. Mezi nežádoucí účinky patřil centrální útlum (slabost, únavnost, ataxie) a rash. Z těchto důvodů není aminoglutethimid v současnosti v léčbě CS používán [37, 38].
Trilostan
Trilostan je inhibitor 3β-hydroxysteroidní dehydrogenázy, který je používán jako vysoce účinný inhibitor steroidogeneze ve veterinární medicíně. Výsledky jeho použití v humánní medicíně byly ale neuspokojivé především proto, že jeho podávání bylo provázeno řadou nežádoucích účinků. Proto není v současnosti v léčbě CS u lidí používán [39].
Blokátory glukokortikoidního receptoru
V klinické praxi byl zkoušen a v některých zemích je k léčbě CS registrován antagonista glukokortikoidních a progesteronových receptorů mifepriston (RU486) [40]. Jeho podání vede k zablokování glukokortikoidního receptoru a ke zvýšení produkce CRH, ACTH a kortizolu. V humánní praxi byl použit především při léčbě ektopického CS [41]. Nevýhodou této léčby je však praktická nemožnost jejího laboratorního monitorování, proto se používání mifepristonu v klinické praxi nerozšířilo.
Kombinační léčba
V medikamentózní léčbě často používáme kombinaci několika látek. Kombinační léčba nám v řadě případů umožní snížení dávek jednotlivých látek a tím snížení frekvence výskytu nežádoucích účinků za současného zvýšení účinnosti léčby. Z adrenolyticky působících látek nejčastěji kombinujeme ketokonazol s metyraponem, v léčbě CD se jako perspektivní jeví kombinace pasireotidu s kabergolinem a ketokonazolem, jejímž podáváním je pravděpodobně možno dosáhnout normalizace hormonální aktivity u většiny pacientů s CD [42].
Monitorování medikamentózní terapie
Monitorování medikamentózní léčby CS je nutné, abychom na jedné straně dosáhli dostatečného snížení hormonální aktivity, ale abychom na druhé straně nevyvolali hypokortikalismus. V současné době neexistuje zcela spolehlivý laboratorní test k monitorování léčby. Některými autory je doporučováno stanovení vyloučeného množství UFC, které částečně ukazuje na dostatečnost suprese hormonální aktivity CS, jinými autory je však vyšetření UFC považováno za nepříliš vhodné a spolehlivé. Někteří doporučují stanovení denního profilu kortizolemie (alespoň 5 stanovení) a zjištění průměru těchto hodnot, přičemž jeho doporučované rozmezí je 150–300 nmol/l. Stanovení kortizolemie nám poslouží i k odhalení vzniku hypokortikalismu při medikamentózní léčbě. Jak bylo uvedeno, terapii mifepristonem spolehlivě monitorovat nelze [43].
Závěr
Medikamentózní léčba CS je stále poměrně obtížná a problematická a vyžaduje zkušenosti, proto by měla být prováděna ve specializovaných centrech. Je také nutné zdůraznit, že s výjimkou pasireotidu jsou všechny léky, které používáme při medikamentózní léčbě CS, používany tzv. off-label, tedy nejsou registrovány v indikaci léčby CS.
Seznam použité literatury
- [1] Cushing HW. The basophil adenomas of the pituitary body and their clinical manifestations (pituitary basophilism). Bull Johns Hopkins Hosp 1932; 50: 137–195.
- [2] Lahera Vargas M, da Costa CV. Prevalence, etiology and clinical findings of Cushing‘s syndrome. Endocrinol Nutr 2009; 56: 32–39.
- [3] Cavagnini F, Pecori Giraldi F. Adrenal Causes of Hypercortisolism. In. De Groot LJ, Jameson JL. (Eds) Endocrinology, 5th Edition, 2006, Elsevier Saunders, Philadelphia, USA, 2353–2386.
- [4] Bourdeau I, Lacroix A. Aberrant hormone receptors in adrenal Cushing‘s syndrome. Curr Opin Endocrinol Diab 2002; 9: 230–236.
- [5] Carney JA, Gordon H, Carpenter PC, et al. The complex of myxomas, spotty pigmentation, and endocrine overactivity. Medicine (Baltimore) 1985; 64: 270–283.
- [6] Bertagna X, Guignat L, Groussin L, Bertherat J. Cushing´s disease. Best Pract Res Clin Endocrinol Metab 2009; 23: 607–623.
- [7] Ross EJ, Linch DC. Cushing’s syndrome-Killing disease: Discriminatory value of signs and symptoms aiding early diagnosis. Lancet 1982; 2: 646–649.
- [8] Newell-Price J, Trainer P, Bessser M, Grossman A. The diagnosis and differential diagnosis of Cushing’s syndrome and pseudo-Cushing’s states. Endocrine Reviews 1998; 19: 647–672.
- [9] Nieman LK, Biller BMK, Findling JW, et al. The Diagnosis of Cushing´s Syndrome: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2008; 93: 1526–1540.
- [10] Morris D, Grossman A. The medical management of Cushing’s syndrome. Ann N Y Acad Sci 2002; 970: 119–133.
- [11] Lamberts SW, Klijn JG, de Quijada M, et al. The mechanisms of the suppressive action of bromocryptine on adrenocorticotropin secretion in patiens with Cushing’s disease and Nelson’s syndrome. J Clin Endocrinol Metab 1980; 51: 307–311.
- [12] Mercado-Asis LB, Yasuda K, Murayama M, et al. Beneficial effects of high daily dose bromocryptin treatment in Cushing’s disease. Endocrinol Jpn 1992; 39: 385–395.
- [13] Godboud A, Manavela M, Danilowicz K, et al. Cabergoline monotherapy in the long-term treatment of Cushing’s disease. Eur J Endocrinol 2010; 165: 709–716.
- [14] Pivonello R, Ferrone D, de Herder WW, et al. Dopamine receptor expression and function in corticotroph ectopic tumors. J Clin Endocrinol Metab 2007; 92: 65–69.
- [15] Casulari LA, Naves LA, Mello PA, et al. Nelson’s syndrome: complete remission with cabergoline but not with bromocriptine or cyproheptadine treatment. Horm Res 2004; 62: 300–305.
- [16] Valassi E, Klibanski A, Biller BM. Clinical review: Potential cardiac valve effects of dopamine agonists in hyperprolactinemia. J Clin Endocrinol Metab 2010; 95: 1025–1033.
- [17] Lamberts SW, Uitterlinden P, Klijn JM. The effect of the long-acting somatostatin analogue SMS 201-995 on ACTH secretion in Nelson’s syndrome and Cushing’s disease. Acta Endocrinol (Copenh) 1989; 120: 760–766.
- [18] Bertagna X, Favrod-Coune C, Escourolle H, et al. Suppression of ectopic adrenocorticotropin secretion by the long-acting somatostatin analog octreotide. J Clin Endocrinol Metab 1989; 68: 988–991.
- [19] Hofland LJ, van der Hoek J, Feelders R, et al. The multi-ligand somatostatin analogue SOM230 inhibits ACTH secretion by cultured human corticotroph adenomas via somatostatin receptor type 5. Eur J Endocrinol 2005; 152: 645–654.
- [20] Boscaro M, Ludlam WH, Atkinson B, et al. Treatment of pituitary-dependent Cushing’s disease with the multireceptor ligand somatostatin analog pasireotide (SOM230): a multicenter, phase II trial. J Clin Endocrinol Metab 2009; 94: 115–122.
- [21] Colao A, Petersenn S, Newell-Price J, et al. A 12-month phase 3 study of pasireotide in Cushing‘s disease. N Engl J Med 2012; 366: 914–924.
- [22] Heaney AP, Fernando M, Yong WH, et al. Functional PPAR-gamma receptor is a novel therapeutic target for ACTH-secreting pituitary adenomas. Nat Med 2002; 8: 1281–1287.
- [23] Suri D, Weiss RE. Effect of pioglitazone on adrenocorticotropic hormone and cortisol secretion in Cushing’s disease. J Clin Endocrinol Metab 2005; 90: 1340–1346.
- [24] Munir A, Song F, Ince P, et al. Ineffectiveness of rosiglitazone therapy in Nelson’s syndrome. J Clin Endocrinol Metab 2007; 92: 1758–1763.
- [25] Waveren Hogervorst CO, Koppeschaar HP, Zelissen PM, et al. Cortisol secretory patterns in Cushing’s disease and response to cyproheptadine treatment. J Clin Endocrinol Metab 1996; 81: 652–655.
- [26] Sonino N, Fava GA, Fallo F, et al. Effect of the serotonin antagonists ritanserin and ketanserin in Cushing’s disease. Pituitary 2000; 3: 55–59.
- [27] Koppeschaar HP, Croughs RJ, Thijssen JH, et al. Sodium valproate and cyproheptadine may independently induce a remission in the same patient with Cushing’s disease. Acta Endocrinol (Copenh) 1983; 104: 160–163.
- [28] Colao A, Pivonello R, Tripodi FS, et al. Failure of long-term therapy with sodium valproate in Cushing’s disease. J Endocrinol Invest 1997; 20: 387–392.
- [29] Paez-Pereda M, Kovalovsky D, Hopfner U, et al. Retinoic acid prevents experimental Cushing’s syndrome. J Clin Invest 2001; 108: 1123–1131.
- [30] Castillo V, Giacomini D, Paez-Pereda M, et al. Retinoic acid as a novel medical therapy for Cushing’s disease in dogs. Endocrinology 2006; 147: 4438–4444.
- [31] Angeli A, Frairia R. Ketoconazole therapy in Cushing’s disease. Lancet 1985; 1: 821.
- [32] Knight TE, Shikuma CY, Knight J. Ketoconazole-induced fulminant hepatitis necessitating liver transplantation. J Am Acad Dermatol 1991; 25: 398–400.
- [33] Verhelst JA, Trainer PJ, Howlett TA, et al. Short and long-term responses to metyrapone in the medical management of 91 patients with Cushing’s syndrome. Clin Endocrinol (Oxf) 1991; 35: 169–178.
- [34] Haak HR, Hermans J, van de Velde CJ, et al. Optimal treatment of adrenocortical carcinoma with mitotane: results in consecutive series of 96 patients. Br J Cancer 1994; 69: 947–951.
- [35] Allolio B, Schulte HM, Kaulen D, et al. Nonhypnotic low-dose etomidate for rapid correction of hypercortisolaemia in Cushing’s syndrome. Klin Wocheschr 1988; 66: 361–364.
- [36] Drake WM, Perry LA, Hinds CJ, et al. Emergency and prolonged use of intravenous etomidate to control hypercortisolaemia in a patient with Cushing’s syndrome and peritonitis. J Clin Endocrinol Metab 1998; 83: 3542–3544.
- [37] Misbin RI, Canary J, Willard D. Aminoglutethimide in the treatment of Cushing’s syndrome. J Clin Pharmacol 1976; 16: 645–651.
- [38] Sonino N, Boscaro M. Medical therapy for Cushing’s disease. Endocrinol Metab Clin North Am 1999; 28: 211–222.
- [39] Dewis P, Anderson DC, Bullock DE, et al. Experience with trilostane in the treatment of Cushing’s syndrome. Clin Endocrinol (Oxf) 1983; 18: 533–540.
- [40] Baulieu EE. The steroid hormone antagonist RU486. Mechanisms at the cellular level and clinical applications. Endocrinol Metab Clin North Am 1991; 20: 873–891.
- [41] Nieman LK, Chrousos GP, Kellner C, et al. Successful treatment of Cushing’s syndrome with the glucocorticoid antagonist RU 486. J Clin Endocrinol Metab 1985; 61: 536–540.
- [42] Feelders RA, de Bruin C, Pereira AM, et al. Pasireotide alone or with cabergoline and ketoconazole in Cushing‘s disease. N Engl J Med 2010; 362: 1846–1848.
- [43] Kršek M, Hána V, et al. Cushingův syndrom. Galén, Praha, 2006, 144 s.