Denosumab: nová možnost prevence a léčby kostní nádorové choroby
Zhoubná nádorová onemocnění často metastazují do kostí. S rozdílnou frekvencí u jednotlivých malignit pak dochází nejen ke vzniku algického syndromu, ale i k výskytu kostních komplikací, patologických zlomenin, kompresí míšních, hyperkalcemií a eventuálně ke karcinomatóze kostní dřeně s důsledky pro krvetvorbu. Výskyt kostních metastáz a jejich komplikací koreluje s přežitím nemocných. K léčbě osteolýzy a k oddálení výskytu kostních komplikací jsou používány bisfosfonáty, a to jak perorální, tak i intravenózní. Jednoznačné postavení mají v léčbě hyperkalcemie. Po vyhodnocení klinických studií ve srovnání se současným standardem schválily regulační úřady v USA a Evropě (FDA – Food and drug administration, EMA – Evropská léková agentura) novou molekulu – denosumab – v indikaci léčby pacientů s úbytkem kostní hmoty navozeným hormonální léčbou (CTIBL – cancer treatment-induced bone loss) a v indikaci léčby maligní osteolýzy, tedy v prevenci kostních příhod u nemocných s metastatickým postižením u solidních nádorů. Monoklonální protilátka denosumab se liší od bisfosfonátů mechanizmem účinku, bezpečnostním profilem i způsobem podání. Denosumab je možné podat i nemocným, u kterých pro kontraindikace nebylo možné zahájit léčbu bisfosfonáty a nebo bylo nutné jejich dávkování redukovat.
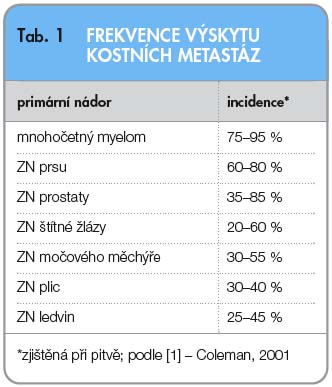 Metastatické postižení kosti s vysokou prevalencí provází solidní zhoubná nádorová onemocnění. Vysokou míru postižení vykazují hormonálně dependentní, ale i další malignity (tab. 1) [1]. Kostní postižení významným způsobem ovlivňuje soběstačnost pacienta a tím i jeho kvalitu života, ale navíc i zásadně koreluje s jeho přežitím.
Metastatické postižení kosti s vysokou prevalencí provází solidní zhoubná nádorová onemocnění. Vysokou míru postižení vykazují hormonálně dependentní, ale i další malignity (tab. 1) [1]. Kostní postižení významným způsobem ovlivňuje soběstačnost pacienta a tím i jeho kvalitu života, ale navíc i zásadně koreluje s jeho přežitím.
Klinicky dominuje kostnímu postižení algický syndrom. U velkého počtu postižených dochází ke kostním komplikacím (SRE, skeletal-related events), tedy především k patologickým zlomeninám a při postižení obratlů i k míšním lézím. Riziko kostních komplikací je různě vysoké, např. u karcinomu prostaty dosahuje 49 % a riziko léze míšní až 8 % [2]. Karcinomatóza kostní dřeně vede k myelosupresi. V souvislosti s osteolýzou se pak objevuje život ohrožující hyperkalcemie.
Hormonální suprese u mužů s karcinomem prostaty zvyšuje obecně mortalitu nemocných. Potlačení hormonálních hladin analogy LHRH (event. LHRH antagonisty) nebo chirurgickou kastrací vede nejen ke zvýšení rizika kardiovaskulárních onemocnění či ovlivnění psychiky, ale i k úbytku kostní hmoty a možnému vzniku patologických zlomenin také u pacientů bez kostní generalizace (CTIBL, cancer treatment-induced bone loss). Endokrinní léčba karcinomu prostaty je spojena s úbytkem kostní hmoty dvakrát vyšším než v případě postmenopauzálních žen [3].
V léčbě a prevenci komplikací maligní osteolýzy jsou farmakologicky používány bisfosfonáty v kombinaci s kalciem a vitaminem D. Podání kalcia a vitaminu D je nedílnou součástí léčby, avšak bez bisfosfonátů nebo jiné účinné léčby je pro léčbu metastatické kostní choroby nedostatečné [4].
Mechanizmus účinku denosumabu
![Obr. 1 Interakce mezi nádorovými buňkami a kostní tkání; volně podle [8] – Roodman, 2004; RANK – receptor activator of nuclear factor kB](https://www.remedia.cz/photo-a-28684---.jpg) Pojivovou tkání s biomechanickou pevností obdobnou oceli je kost. Její kolagenní matrix impregnují minerální soli. Hlavním proteinem kostní matrix, ale i kůže, šlach a dalších pojiv je kolagen I. typu. Remodelace kosti, tedy odbourávání a novotvorba, je řízena koordinovanou činností osteoklastů a buněk osteoblastické řady (osteoblasty, osteocyty a „lining cells“) v intervalu přibližně 100 dní. Procesem remodelace procházejí všechny kosti, ale doba trvání se u různých typů kostí liší. Blokáda vazby RANK ligandu (RANKL, receptor activator of nuclear factor kB ligand) na receptor RANK vede k inhibici tvorby, funkce a životnosti osteoklastů, čímž snižuje osteoresorpci a brání destrukci kosti způsobené nádorovým bujením. RANKL existuje ve formě transmembránového nebo solubilního proteinu a je nepostradatelný pro tvorbu, funkci a životnost osteoklastů, jediného typu buněk zodpovědného za resorpci kostní tkáně. Zvýšená aktivita osteoklastů, kterou stimuluje RANKL, je klíčovým prostředkem destrukce kostí při jejich metastatickém postižení u solidních tumorů i mnohočetného myelomu (obr. 1). Signální cesta RANKL se uplatňuje i při vzniku osteopenie až osteoporózy indukované androgenní supresí [5] nebo u syndromu z nedostatku androgenů. Ty mají schopnost inhibovat produkci RANKL a M-CSF. Dlouhodobé snížení hladin androgenů vede k vyšší aktivitě RANKL a osteoklastů. Dojde-li k poruše remodelace, dochází ke snížení mechanické odolnosti kosti a ke zvýšení rizika zlomenin.
Pojivovou tkání s biomechanickou pevností obdobnou oceli je kost. Její kolagenní matrix impregnují minerální soli. Hlavním proteinem kostní matrix, ale i kůže, šlach a dalších pojiv je kolagen I. typu. Remodelace kosti, tedy odbourávání a novotvorba, je řízena koordinovanou činností osteoklastů a buněk osteoblastické řady (osteoblasty, osteocyty a „lining cells“) v intervalu přibližně 100 dní. Procesem remodelace procházejí všechny kosti, ale doba trvání se u různých typů kostí liší. Blokáda vazby RANK ligandu (RANKL, receptor activator of nuclear factor kB ligand) na receptor RANK vede k inhibici tvorby, funkce a životnosti osteoklastů, čímž snižuje osteoresorpci a brání destrukci kosti způsobené nádorovým bujením. RANKL existuje ve formě transmembránového nebo solubilního proteinu a je nepostradatelný pro tvorbu, funkci a životnost osteoklastů, jediného typu buněk zodpovědného za resorpci kostní tkáně. Zvýšená aktivita osteoklastů, kterou stimuluje RANKL, je klíčovým prostředkem destrukce kostí při jejich metastatickém postižení u solidních tumorů i mnohočetného myelomu (obr. 1). Signální cesta RANKL se uplatňuje i při vzniku osteopenie až osteoporózy indukované androgenní supresí [5] nebo u syndromu z nedostatku androgenů. Ty mají schopnost inhibovat produkci RANKL a M-CSF. Dlouhodobé snížení hladin androgenů vede k vyšší aktivitě RANKL a osteoklastů. Dojde-li k poruše remodelace, dochází ke snížení mechanické odolnosti kosti a ke zvýšení rizika zlomenin.
![Obr. 2 Mechanismus účinku denosumabu a bisfosfonátů při metastatickém postižení kosti; volně podle [8] – Roodman, 2004; RANK – receptor activator of nuclear factor kB](https://www.remedia.cz/photo-a-28685---.jpg) Denosumab je humánní monoklonální protilátka IgG2 produkovaná savčí buněčnou linií (CHO, Chinese Hamster Ovary cells) pomocí technologie rekombinantní DNA. Denosumab se s vysokou specificitou i afinitou zaměřuje a váže na RANKL a neutralizuje jej [6], viz obr. 2. Ve srovnání s terapeutickými protilátkami, které obsahují jiné než lidské peptidové sekvence, má jen minimální schopnost vyvolat tvorbu protilátek. V rámci klinických studií byl prakticky pozorován výskyt neutralizujících protilátek v méně než 1 %. Jejich přítomnost neovlivnila účinnost léčiva [7].
Denosumab je humánní monoklonální protilátka IgG2 produkovaná savčí buněčnou linií (CHO, Chinese Hamster Ovary cells) pomocí technologie rekombinantní DNA. Denosumab se s vysokou specificitou i afinitou zaměřuje a váže na RANKL a neutralizuje jej [6], viz obr. 2. Ve srovnání s terapeutickými protilátkami, které obsahují jiné než lidské peptidové sekvence, má jen minimální schopnost vyvolat tvorbu protilátek. V rámci klinických studií byl prakticky pozorován výskyt neutralizujících protilátek v méně než 1 %. Jejich přítomnost neovlivnila účinnost léčiva [7].
Markery kostního obratu (resorpce či novotvorby) umožňují laboratorní sledování metabolizmu kosti. Dříve se uplatňovaly pouze markery kostní novotvorby – alkalická fosfatáza (ALP), později její kostní frakce (B-ALP). V posledních dekádách se diagnosticky uplatňují markery signalizující zvýšenou resorpci kostní matrix – 1CTP (C-terminální telopeptid kolagenu v séru), NTx (N-terminální telopeptid kolagenu I v moči), b-CTx (oktapeptidový fragment C-terminálního telopeptidu kolagenu I) nebo deriváty PYR (3-hydroxypyridin a pyridinolin) a DPYR (deoxypyridinolin v moči). Osteoblastická aktivita vede k elevaci sérových hladin osteokalcinu, již zmíněného kostního izoenzymu ALP či P1CP (C-terminálního propeptidu prokolagenu typu I) a P1NP (N-terminálního propeptidu prokolagenu typu I). K novým markerům kostní remodelace, které však zatím v klinické praxi nenašly uplatnění, patří osteoprotegerin (OPG), sRANKL (soluble receptor activator of nuclear factor kB ligand) a hodnota poměru sRANKL/OPG [4].
Vliv denosumabu na kostní mikroarchitekturu
Vliv denosumabu na kostní mikroarchitekturu byl zkoumán ve dvou studiích u pacientek s postmenopauzální osteoporózou, nepředléčených (studie FREEDOM – Fracture REduction Evaluation of Denosumab in Osteoporosis every 6 Months) a předléčených (studie STAND – Study of Transitioning from AleNdronate to Denosumab) alendronátem. V obou studiích dostávaly pacientky denosumab v dávce 60 mg jednou za 6 měsíců. Ve studii FREEDOM byly z lopaty kosti kyčelní pacientek zařazených do klinického sledování odebrány bioptické vzorky po dvou a třech letech, u pacientek ve studii STAND po 12 měsících. Architektura kosti byla fyziologická, bez průkazu defektů mineralizace, vláknité kosti či fibrózy kostní dřeně. Histomorfometrická analýza prokázala signifikantní pokles známek kostní formace i resorpce ve srovnání s placebem i ve srovnání s alendronátem [9, 10].
Zařazení denosumabu do palety léčiv ovlivňujících kostní metabolizmus
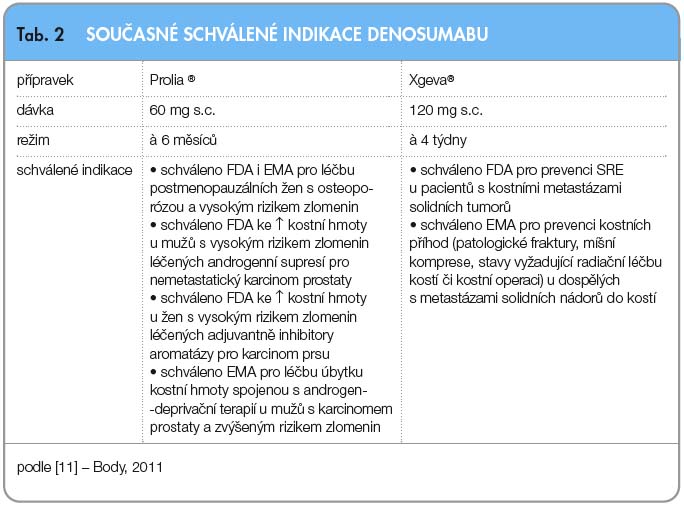 Denosumab je novou molekulou z armamentária léčiv s antiresorpčním účinkem. Zatímco v léčbě osteoporózy či v prevenci kostních příhod při metastatickém kostním postižení rozšiřuje paletu léčiv, pro prevenci kostního úbytku navozeného hormonální léčbou představuje zcela novou možnost (tab. 2) [11]. Velká část těchto nemocných, především se zhoubnými nádory prostaty, byla ohrožena kostní patologií a byla léčena neadekvátně nebo vůbec.
Denosumab je novou molekulou z armamentária léčiv s antiresorpčním účinkem. Zatímco v léčbě osteoporózy či v prevenci kostních příhod při metastatickém kostním postižení rozšiřuje paletu léčiv, pro prevenci kostního úbytku navozeného hormonální léčbou představuje zcela novou možnost (tab. 2) [11]. Velká část těchto nemocných, především se zhoubnými nádory prostaty, byla ohrožena kostní patologií a byla léčena neadekvátně nebo vůbec.
Léčba osteoporózy u postmenopauzálních žen se zvýšeným rizikem zlomenin
Denosumab signifikantně snižuje riziko vzniku vertebrálních kompresivních fraktur, nevertebrálních zlomenin a zlomenin kyčle.
Účinnost a bezpečnost denosumabu (v dávce 60 mg subkutánně) podávaného jednou za 6 měsíců po dobu 3 let byla studována u postmenopauzálních žen v registrační studii FREEDOM [12]. Zařazeno bylo 7808 žen ve věku 60–91 let se vstupním T-skóre denzity kostního minerálu (BMD) bederní páteře nebo celé kyčle v rozmezí -2,5 až -4,0 a střední absolutní pravděpodobností zlomeniny za 10 let 18,60 % (7,9–32,4 %) pro hlavní osteoporotické zlomeniny a 7,22 % (1,4–14,9 %) pro zlomeninu kyčle. Ženy měly pravidelnou denní suplementaci kalciem (1000 mg) a vitaminem D (nejméně 400 IU).
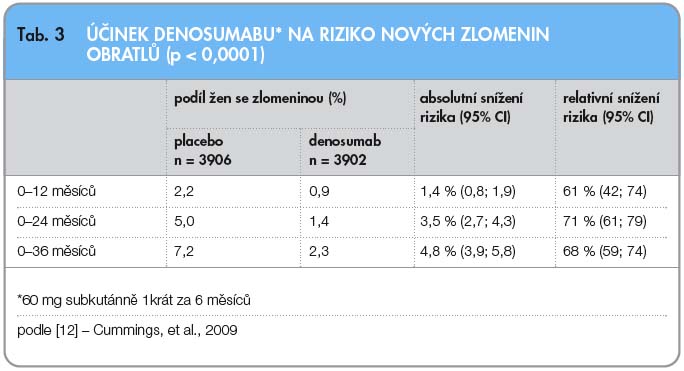 Primárním cílem studie byl průkaz incidence nových vertebrálních fraktur, a to jak symptomatických, tak i verifikovaných pouze zobrazovacími metodami. Po 36 měsících byl výskyt nových vertebrálních kompresí 2,3 % v léčené skupině a 7,2 % ve skupině s placebem (tab. 3).
Primárním cílem studie byl průkaz incidence nových vertebrálních fraktur, a to jak symptomatických, tak i verifikovaných pouze zobrazovacími metodami. Po 36 měsících byl výskyt nových vertebrálních kompresí 2,3 % v léčené skupině a 7,2 % ve skupině s placebem (tab. 3).
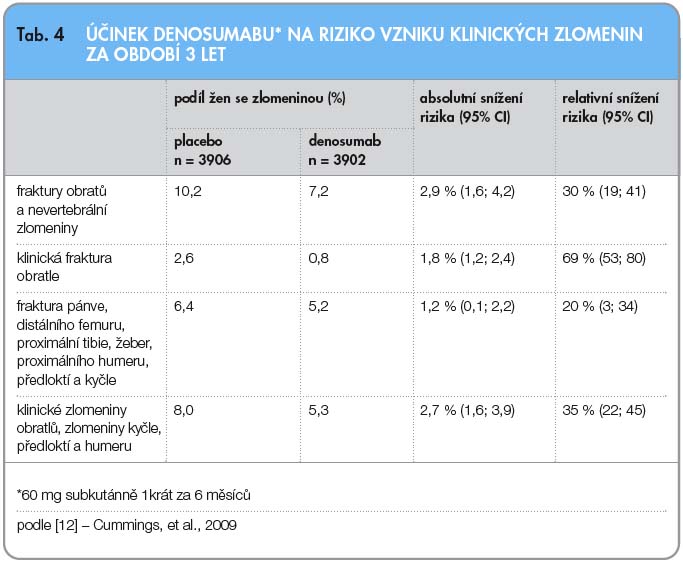 Sekundárním cílem bylo stanovení doby do první nevertebrální zlomeniny a zlomeniny proximálního konce femuru. Dalším sledovaným parametrem byla incidence klinických zlomenin (tab. 4). U pacientek léčených denosumabem došlo ve srovnání s pacientkami s placebem ke snížení rizika zlomeniny kyčle o 40 % a rizika jakékoliv osteoporotické nevertebrální zlomeniny o 20 %. Pacientkám byla po ukončení 3letého sledování nabídnuta účast v prodlouženém otevřeném sledování. Výsledky pětiletého sledování byly zatím formou abstrakta zveřejněny v roce 2011 [13]. Sledování dokládá další vzestup BMD a pokračující účinnou supresi markerů kostního metabolizmu. Incidence nových fraktur je nízká.
Sekundárním cílem bylo stanovení doby do první nevertebrální zlomeniny a zlomeniny proximálního konce femuru. Dalším sledovaným parametrem byla incidence klinických zlomenin (tab. 4). U pacientek léčených denosumabem došlo ve srovnání s pacientkami s placebem ke snížení rizika zlomeniny kyčle o 40 % a rizika jakékoliv osteoporotické nevertebrální zlomeniny o 20 %. Pacientkám byla po ukončení 3letého sledování nabídnuta účast v prodlouženém otevřeném sledování. Výsledky pětiletého sledování byly zatím formou abstrakta zveřejněny v roce 2011 [13]. Sledování dokládá další vzestup BMD a pokračující účinnou supresi markerů kostního metabolizmu. Incidence nových fraktur je nízká.
Léčba úbytku kostní hmoty (CTIBL) v souvislosti s androgen-deprivační léčbou
Účinnost a bezpečnost denosumabu (v dávce 60 mg subkutánně) podávaného jednou za 6 měsíců byla hodnocena v placebem kontrolovaných klinických studiích fáze II a III u 1468 mužů ve věku 48–97 let s nemetastatickým karcinomem prostaty, se zvýšeným rizikem vzniku zlomeniny (definováno jako věk > 70 let nebo < 70 let s T-skóre BMD bederní páteře, celé kyčle nebo krčku kosti stehenní < -1,0 nebo s osteoporotickou zlomeninou v anamnéze), kteří byli léčeni farmakologickou (analoga LHRH) nebo chirurgickou kastrací. Všichni muži užívali každý den vápník (1000 mg) a vitamin D (nejméně 400 IU). Za 3leté období léčby se ve skupině léčené denosumabem oproti placebu signifikantně zvýšila BMD ve všech měřených klinických místech (v bederní páteři o 7,9 %, v celé kyčli o 5,7 %, v krčku kosti stehenní o 4,9 %, v trochanteru o 6,9 %, v distální třetině radia o 6,9 % a v celém těle o 4,7 % (ve všech uvedených případech byla hodnota p < 0,0001).
V prospektivně plánované explorativní analýze byl zaznamenán signifikantní vzestup BMD v bederní páteři, celé kyčli, trochanteru a krčku kosti stehenní již za 1 měsíc po podání úvodní dávky.
Aplikace denosumabu vedla k signifikantnímu snížení rizika nových zlomenin obratlů po prvním roce léčby: 85% snížení (1,6% absolutní snížení rizika) po 1 roce, 69% (2,2% snížení absolutního rizika) po 2 letech a 62% (2,4% snížení absolutního rizika) po 3 letech [14].
Léčba denosumabem v prevenci kostních příhod u pacientů se solidními nádory metastazujícími do kosti
![Obr. 3 Design studií, které sledovaly účinnost denosumabu (v dávce 120 mg s.c. každé 4 týdny) u pacientů s metastatickou formou nádorového onemocnění (design byl shodný pro všechny tři studie); podle [15–17] – Stopeck, et al., 2010; Fizazi, et al., 2011; Henry, et al., 2011](https://www.remedia.cz/photo-a-28689---.jpg) Účinnost denosumabu (v dávce 120 mg subkutánně každé 4 týdny) v prevenci kostních příhod (SRE, skeletal-related events) u pacientů s metastatickou formou nádorového onemocnění, které postihuje kosti, byla zkoumána ve třech rozsáhlých mezinárodních randomizovaných, aktivním komparátorem kontrolovaných, dvojitě zaslepených klinických hodnoceních fáze III s identickým designem. Pacienti nebyli předléčeni bisfosfonáty. SRE byly definovány jako jedna z následujících situací: patologická fraktura, míšní komprese, stavy vyžadující chirurgický zákrok na kosti nebo stavy vyžadující ozáření kosti. Pacienti byli zařazeni v poměru 1 : 1 do ramene se subkutánním denosumabem v dávce 120 mg a intravenózním placebem, jež byly podávány každé 4 týdny, nebo do ramene s kyselinou zoledronovou v dávce 4 mg aplikované nitrožilní infuzí po dobu alespoň 15 minut a subkutánním placebem, jež byly podávány každé 4 týdny (obr. 3). Dávkování intravenózního přípravku bylo upraveno v závislosti na vstupní hladině clearance kreatininu ≤ 60 ml/min a dávka byla vynechána při zhoršení ledvinných funkcí do doby opětovného dosažení vstupní hodnoty kreatininu v rozmezí 10 %. U denosumabu nebyly úprava ani vynechání dávky požadovány. Všem pacientům byla důrazně doporučena denní suplementace kalciem a vitaminem D. V zaslepené fázi léčby bylo pokračováno buď 2letým sledováním přežití, nebo 2letým otevřeným sledováním; 2leté otevřené sledování a sledování přežití (pouze u těch pacientů, kteří nebyli zahrnuti do otevřené fáze) nadále probíhá. Mezním datem primární analýzy byl výskyt SRE u 745. pacienta.
Účinnost denosumabu (v dávce 120 mg subkutánně každé 4 týdny) v prevenci kostních příhod (SRE, skeletal-related events) u pacientů s metastatickou formou nádorového onemocnění, které postihuje kosti, byla zkoumána ve třech rozsáhlých mezinárodních randomizovaných, aktivním komparátorem kontrolovaných, dvojitě zaslepených klinických hodnoceních fáze III s identickým designem. Pacienti nebyli předléčeni bisfosfonáty. SRE byly definovány jako jedna z následujících situací: patologická fraktura, míšní komprese, stavy vyžadující chirurgický zákrok na kosti nebo stavy vyžadující ozáření kosti. Pacienti byli zařazeni v poměru 1 : 1 do ramene se subkutánním denosumabem v dávce 120 mg a intravenózním placebem, jež byly podávány každé 4 týdny, nebo do ramene s kyselinou zoledronovou v dávce 4 mg aplikované nitrožilní infuzí po dobu alespoň 15 minut a subkutánním placebem, jež byly podávány každé 4 týdny (obr. 3). Dávkování intravenózního přípravku bylo upraveno v závislosti na vstupní hladině clearance kreatininu ≤ 60 ml/min a dávka byla vynechána při zhoršení ledvinných funkcí do doby opětovného dosažení vstupní hodnoty kreatininu v rozmezí 10 %. U denosumabu nebyly úprava ani vynechání dávky požadovány. Všem pacientům byla důrazně doporučena denní suplementace kalciem a vitaminem D. V zaslepené fázi léčby bylo pokračováno buď 2letým sledováním přežití, nebo 2letým otevřeným sledováním; 2leté otevřené sledování a sledování přežití (pouze u těch pacientů, kteří nebyli zahrnuti do otevřené fáze) nadále probíhá. Mezním datem primární analýzy byl výskyt SRE u 745. pacienta.
Studie 20050136 porovnávala účinnost denosumabu ve srovnání s kyselinou zoledronovou ve smyslu oddálení a prevence kostních příhod (SRE) u pacientek s karcinomem prsu metastazujícím do kostí [15], studie 20050103 u pacientů s kastračně rezistentním karcinomem prostaty s prokázanými kostními metastázami [16], studie 20050244 u pacientů se solidními nádory (s výjimkou ZN prsu a prostaty) a mnohočetným myelomem s generalizací do kostí [17]. Primárním cílem bylo zjištění noninferiority, sekundárním pak zjištění superiority denosumabu ve smyslu prodloužení doby do první SRE a doby do první a další SRE. Bezpečnostní cíle sledovaly výskyt nežádoucích účinků, změny laboratorních hodnot a případný výskyt vazebných a neutralizujících protilátek. Shodný design všech tří studií umožnil integrovat data 5723 pacientů do jedné předem plánované integrované analýzy [18].
![Graf 1 Doba do první kostní příhody (SRE, skeletal-related event) ve studiích srovnávajících denosumab s kyselinou zoledronovou (A) u pacientek s karcinomem prsu metastazujícím do kostí, (B) u pacientů s kastračně rezistentním karcinomem prostaty s prokázanými kostními metastázami a (C) u pacientů se solidními nádory (s výjimkou ZN prsu a prostaty) a mnohočetným myelomem s generalizací do kostí; podle [15–17] – Stopeck, et al., 2010; Fizazi, et al., 2011; Henry, et al., 2011](https://www.remedia.cz/photo-a-28690---.jpg) Nejvýznamnější prodloužení doby do první SRE ve srovnání s kyselinou zoledronovou bylo dosaženo u pacientek s karcinomem prsu. Medián činil 26,4 měsíce u pacientek se zoledronátem a nebylo ho dosaženo v průběhu sledovaného období u žen léčených denosumabem. V obou dalších studiích byl medián doby do výskytu první SRE prodloužen – u mužů s kastračně refrakterním karcinomem prostaty o 3,6 měsíce a u pacientů s ostatními solidními nádory ještě o další měsíc (graf 1) [15–17]. V integrované analýze tří studií s 5723 pacienty dosáhl rozdíl v mediánu doby do první SRE mezi nemocnými léčenými denosumabem a kyselinou zoledronovou 8,2 měsíce a léčba denosumabem vedla k 17% snížení rizika výskytu SRE (graf 2) [18]. Navíc je z výsledků studií zřejmé, že k oddálení výskytu kostní komplikace vede léčba denosumabem i u pacientů s již předcházející kostní příhodou, viz graf 3 [18].
Nejvýznamnější prodloužení doby do první SRE ve srovnání s kyselinou zoledronovou bylo dosaženo u pacientek s karcinomem prsu. Medián činil 26,4 měsíce u pacientek se zoledronátem a nebylo ho dosaženo v průběhu sledovaného období u žen léčených denosumabem. V obou dalších studiích byl medián doby do výskytu první SRE prodloužen – u mužů s kastračně refrakterním karcinomem prostaty o 3,6 měsíce a u pacientů s ostatními solidními nádory ještě o další měsíc (graf 1) [15–17]. V integrované analýze tří studií s 5723 pacienty dosáhl rozdíl v mediánu doby do první SRE mezi nemocnými léčenými denosumabem a kyselinou zoledronovou 8,2 měsíce a léčba denosumabem vedla k 17% snížení rizika výskytu SRE (graf 2) [18]. Navíc je z výsledků studií zřejmé, že k oddálení výskytu kostní komplikace vede léčba denosumabem i u pacientů s již předcházející kostní příhodou, viz graf 3 [18].
![Graf 2 Výsledky integrované analýzy, ve které bylo hodnoceno prodloužení doby do první kostní příhody (SRE, skeletal-related event) po podání denosumabu ve srovnání s kyselinou zoledronovou; podle [18] – Lipton, et al., 2010](https://www.remedia.cz/photo-a-28691---.jpg) Podání denosumabu nemělo vliv na celkové přežití ani na dobu do progrese nádorového onemocnění. Výsledky studií naznačují, že snížením algického syndromu působí denosumab příznivě na kvalitu života nemocných [19].
Podání denosumabu nemělo vliv na celkové přežití ani na dobu do progrese nádorového onemocnění. Výsledky studií naznačují, že snížením algického syndromu působí denosumab příznivě na kvalitu života nemocných [19].
Bezpečnostní profil denosumabu podávaného v dávce 120 mg každé 4 týdny vychází ze studií fáze I a II i z integrované analýzy studií fáze III u více než 5900 pacientů. U pacientů léčených denosumabem není potřeba úpravy dávkování podle renálních funkcí. Obdobně jako léčba aminobisfosfonáty může i podávání denosumabu vést ke vzniku osteonekrózy čelisti (ONJ). Její výskyt je po podání denosumabu ve srovnání s kyselinou zoledronovou dokonce o něco vyšší (1,8 vs. 1,3 %), rozdíl však není statisticky významný [18]. Degradace denosumabu buňkami retikuloendotelového systému umožňuje návrat kostní remodelace vedoucí pravděpodobně k rychlejšímu zhojení ONJ u vyššího procenta pacientů. Tím se denosumab odlišuje od bisfosfonátů ireverzibilně vázaných na kostní matrix. Hypokalcemie byla pozorována u 9,6 % nemocných léčených denosumabem ve srovnání se zoledronátem (5,0 %). Snížení hladin kalcia v souboru nemělo klinické dopady, i v běžné klinické praxi je však třeba dbát na compliance pacientů při suplementaci kalciem.
![Graf 3 Výskyt první kostní příhody (SRE, skeletal-related event) po podání denosumabu, resp. kyseliny zoledronové, v závislosti na výskytu předchozí kostní příhody; podle [18] – Lipton, et al., 2010](https://www.remedia.cz/photo-a-28692---.jpg) Na zmíněné registrační studie navazuje sledování v otevřené extenzi u pacientek s karcinomem prsu a pacientů s kastračně refrakterním karcinomem prostaty, jež poskytne data o účinnosti denosumabu u pacientů předléčených bisfosfonáty, ale i studie s použitím denosumabu u vysoce rizikových pacientek se zhoubným nádorem prsu v adjuvanci.
Na zmíněné registrační studie navazuje sledování v otevřené extenzi u pacientek s karcinomem prsu a pacientů s kastračně refrakterním karcinomem prostaty, jež poskytne data o účinnosti denosumabu u pacientů předléčených bisfosfonáty, ale i studie s použitím denosumabu u vysoce rizikových pacientek se zhoubným nádorem prsu v adjuvanci.
Závěr
Denosumab rozšiřuje možnosti jak léčby pacientů s osteoporotickými změnami na podkladě fyziologických hormonálních změn i změn navozených hormonální manipulací při léčbě hormonálně dependentních nádorů prsu a prostaty, tak i v prevenci a léčbě kostního postižení na podkladě metastatického šíření. Ve srovnání se současnou léčbou je přínosný především pro svoji nízkou nefrotoxicitu a podstatně nižší výskyt reakcí akutní fáze, ale i jednoduchou aplikační formu v podobě subkutánní injekce do horní části paže, event. břicha či stehna. Především však jednoznačně prodlužuje dobu do výskytu první i další kostní komplikace u pacientů s metastatickým postižením. Ovlivněním bolesti vede ke zlepšení kvality života. Odlišný mechanismus účinku umožňuje léčbu i pacientům, které nebylo možno léčit pro kontraindikace podání bisfosfonátů.
Seznam použité literatury
- [1] Coleman RE. Metastatic bone disease: Clinical features, pathophysiology and treatment strategies. Cancer Treat Rev 2001; 27: 165–176.
- [2] Lipton A, Steger GG, Figueroa J, et al. Extended efficacy and safety of denosumab in breast cancer patients with bone metastases not receiving prior bisphosphonate therapy. Clin Cancer Res 2008; 14: 6690–6696.
- [3] Hirbe A, et al. Skeletal Complications of Breast Cancer Therapies. Clin Cancer Res 2006; 12 (20 Pt2): 6312s–6314s.
- [4] Matoušková M, Hanuš M. Bisfosfonáty v léčbě kostních metastáz v urologii. Urol pro praxi 2009; 10: 282–286.
- [5] Babjuk M. Denosumab v léčbě kostního postižení u karcinomu prostaty. Farmakoterapie 2010; 6: 272–275.
- [6] Skácelová S. Denosumab. Remedia 2011; 21: 230–237.
- [7] Tabrizi MA, Tseng CL, Roskos LK. Elimination mechanisms of therapeutic monoclonal antibodies. Drug Discovery Today 2006; 11: 81–88.
- [8] Roodman GD. Mechanisms of bone metastasis. N Engl J Med 2004; 350: 1655–1664.
- [9] Reid IR, Miller PD, Brown JR, et al. Effects of denosumab on bone histomorphometry: the FREEDOM and STAND studies. J Bone Miner Res 2010; 25: 2256–2265.
- [10] Kendler DL, Roux C, Benhamou CL, et al. Effects of denosumab on bone mineral density and bone turnover in postmenopausal women transitioning from alendronate therapy. J Bone Miner Res 1010; 25: 72–81.
- [11] Body JJ. Denosumab for the management of bone disease in patients with solid tumors. Expert Rev Anticancer Ther 2011 Dec 22. [Epub ahead of print].
- [12] Cummings SR, San Martin J, McClung MR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009; 361: 756–765.
- [13] Papapoulos S, Chapuriat R, Brandi MR, et al. Five-year denosumab treatment of postmenopausal women with osteoporosis: results from the first two years of the FREEDOM extension. 289 Abstract for ECCEO 2011.
- [14] Smith MR, Egerdie B, Toriz HN, et al. Denosumab in men receiving androgen deprivation therapy for prostate cancer. N Engl J Med 2009; 361: 745–755.
- [15] Stopeck AT, Lipton A, Body JJ, et al. Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer: a randomized, double-blind study. J Clin Oncol 2010; 28: 5132–5139.
- [16] Fizazi K, Carducci M, Smith M, et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 2011; 377: 813–822.
- [17] Henry DH, Costa L, Goldwasser F, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer (excluding breast and prostate cancer) or multiple myeloma. J Clin Oncol 2011; 29: 1125–1132.
- [18] Lipton A, Siena S, Rader M, et al. Comparison of denosumab versus zoledronic acid (ZA) for treatment of bone metastases in advanced cancer patients: an integrated analysis of 3 pivotal trials [Abstract 1249P]. Ann Oncol 2010; 21 (Suppl 8): viii379. Poster presented at ESMO 35; Milan, Italy; 8–12 October, 2010.
- [19] Janet E, Brown C, Cleeland L, et al. Pain Outcomes in Patients With Bone Metastases From Castrate-Resistant Prostate Cancer: Results From a Phase 3 Trial of Denosumab vs Zoledronic Acid, 26th Annual EAU Congress, Vienna; 18–22 March, 2011, Abstract #1091.