Deprese a diabetes
Epidemiologické studie prokázaly, že nemocní s diabetem mají zvýšenou prevalenci deprese. Patogeneze deprese při diabetu je komplexní a zahrnuje celou škálu příčin. Podílejí se na ní negativní životní události, průběh a komplikace diabetu, neuroendokrinní a neuroimunitní změny, genetické a osobnostní faktory. Riziko vzniku deprese u nemocných s diabetem mellitem je větší v porovnání se zdravými lidmi, a naopak deprese může zvyšovat riziko rozvoje diabetu 2. typu. Kombinace diabetu a deprese může stupňovat riziko mortality. S depresí a diabetem také souvisí významně zvýšené riziko vzniku kardiovaskulárních i cerebrovaskulárních poruch a demencí. Systematická péče o pacienty s diabetem a depresí musí být komplexní a měla by zahrnovat psychologickou podporu i farmakologickou léčbu. Zvolená farmakologická léčba by zejména neměla zhoršovat kompenzaci diabetu nežádoucími metabolickými důsledky. Vhodná jsou psychofarmaka ze skupiny SSRI, dále venlafaxin a trazodon. V léčbě diabetických pacientů s depresí nepatří mezi léky volby tricyklická antidepresiva. Jejich podávání je limitováno anticholinergními účinky, především kardiotoxicitou. V indikaci léčby diabetické neuropatie je registrováno antidepresivum duloxetin. Dlouhodobé užívání antidepresiv však může zvýšit riziko rozvoje diabetu 2. typu.
Epidemiologie
Celoživotní riziko vzniku depresivní poruchy dosahuje 15 %. U lidí trpících tělesnými nemocemi je prevalence depresivní poruchy vyšší. U pacientů s diabetem mellitem (DM) je riziko onemocnění depresivní poruchou (DP) přibližně dvakrát vyšší než v běžné populaci [1, 2]; DP trpí přibližně 30 % nemocných s DM (28 % diabetických žen a 18 % diabetických mužů – převaha žen s DP je obdobná jako v nediabetické populaci). Hrachovinová se spolupracovníky [3] zjistili dotazníkovým šetřením, že čtvrtina ze skupiny 213 diabetických nemocných dosahuje v subjektivním dotazníku vysokých skórů, které lze interpretovat jako příznaky klinické deprese.
Patogenetické vztahy deprese a diabetu mellitu
S depresí jsou spojeny neurochemické změny, které se týkají snížené dostupnosti neurotransmiterů (noradrenalin, serotonin a částečně také dopamin) v mozku. Biologická podstata deprese má souvislost s molekulárními ději na synaptické membráně a s přenosem signálu, který v konečné fázi redukuje genovou expresi s následným narušením modulace neuronálních sítí v mozku. Výzkumy z posledních let přinesly důkazy o roli neurogeneze v patogenezi depresivních poruch a účinku antidepresivní léčby [4].
Ve vztahu k diabetu jsou nejčastěji testovány dvě hypotézy [5]: a) deprese vzniká neurochemickými změnami způsobenými diabetem nebo jeho léčbou;
b) deprese je následkem psychosociální zátěže, které jsou nemocní s diabetem vystaveni.
Talbot a Nouwen [5] ověřovali platnost obou hypotéz. Zjistili, že je nepravděpodobné, že by první epizoda deprese vznikla jako následek diabetu mellitu 2. typu (DM2). Rozvoj depresivní poruchy často o mnoho let předchází manifestaci DM2, avšak depresivní symptomatika může riziko rozvoje DM2 zvyšovat. Kawakami a kol. [6] v populaci japonských mužů, podobně jak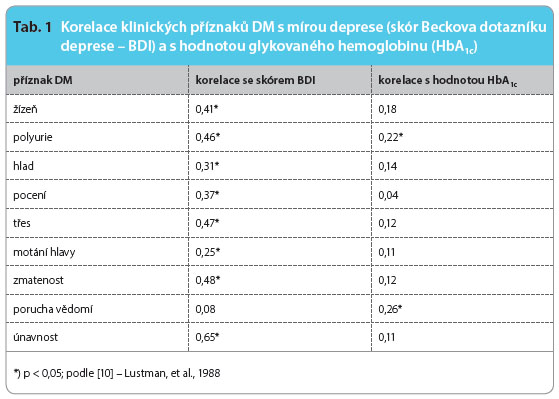 o Eaton a kol. [7] v obecné populaci, zjistili, že nejvýznamnějšími rizikovými faktory pro rozvoj DM2 jsou obezita a deprese. Zdá se tedy, že u pacientů s DM2 není deprese jen sekundární emoční odpovědí na chronické a komplikované tělesné onemocnění, ale že se jedná o nezávislý rizikový faktor. Časový vztah deprese a diabetu mellitu 1. typu (DM1) je jiný. Depresivní symptomatika se často objevuje již v průběhu prvního roku klinické manifestace DM1.
o Eaton a kol. [7] v obecné populaci, zjistili, že nejvýznamnějšími rizikovými faktory pro rozvoj DM2 jsou obezita a deprese. Zdá se tedy, že u pacientů s DM2 není deprese jen sekundární emoční odpovědí na chronické a komplikované tělesné onemocnění, ale že se jedná o nezávislý rizikový faktor. Časový vztah deprese a diabetu mellitu 1. typu (DM1) je jiný. Depresivní symptomatika se často objevuje již v průběhu prvního roku klinické manifestace DM1.
Průběh depresivní poruchy při DM bývá charakterizován vyšší frekvencí relapsů a delším trváním epizod nemoci [8, 9]. Průběhové charakteristiky depresivní poruchy nejsou ovlivněny typem diabetu [5]. Klinické příznaky diabetu při komo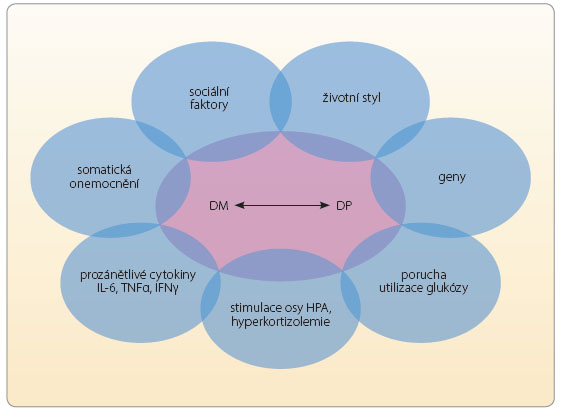 rbiditě s depresí lépe korelují s mírou deprese než s hodnotou glykovaného hemoglobinu (tab. 1) [10]. Z biologického hlediska se deprese a diabetes setkávají na několika úrovních. Zřejmě nejvýznamnější je úroveň endokrinních, neurotransmiterových a imunitních změn. Patří mezi ně především snížení dostupnosti neurotransmiterů (serotonin, noradrenalin, dopamin), zvýšení hladin glukokortikoidů, růstového hormonu a glukagonu, které působí regulačně proti hypoglykemickému účinku inzulinu [11]. U nemocných s DP je často zjišťována nadprodukce kortikotropního hormonu a zvýšená hladina kortizolu. Dysregulace hypotalamo-hypofyzární osy a zvýšená koncentrace prozánětlivých faktorů jsou spojovány se zvýšenou inzulinovou rezistencí [12]. Inzulinová rezistence zvyšuje kortizolovou neurotoxicitu v hipokampu (oblasti regulace aktivity hypotalamo-hypofyzární osy), což může stát v pozadí endokrinního ovlivnění nálady a kognitivních funkcí. Schematický vztah mezi depresí a diabetem lze vyjádřit graficky (obr. 1).
rbiditě s depresí lépe korelují s mírou deprese než s hodnotou glykovaného hemoglobinu (tab. 1) [10]. Z biologického hlediska se deprese a diabetes setkávají na několika úrovních. Zřejmě nejvýznamnější je úroveň endokrinních, neurotransmiterových a imunitních změn. Patří mezi ně především snížení dostupnosti neurotransmiterů (serotonin, noradrenalin, dopamin), zvýšení hladin glukokortikoidů, růstového hormonu a glukagonu, které působí regulačně proti hypoglykemickému účinku inzulinu [11]. U nemocných s DP je často zjišťována nadprodukce kortikotropního hormonu a zvýšená hladina kortizolu. Dysregulace hypotalamo-hypofyzární osy a zvýšená koncentrace prozánětlivých faktorů jsou spojovány se zvýšenou inzulinovou rezistencí [12]. Inzulinová rezistence zvyšuje kortizolovou neurotoxicitu v hipokampu (oblasti regulace aktivity hypotalamo-hypofyzární osy), což může stát v pozadí endokrinního ovlivnění nálady a kognitivních funkcí. Schematický vztah mezi depresí a diabetem lze vyjádřit graficky (obr. 1).
Glukóza je důležitý m![Obr. 2 Schematicky znázorněné působení indolamin 2,3-dioxygenázy, nedostatku serotoninu a katabolitů tryptofanu v patofyziologii deprese. IDO je na periferii indukována prostřednictvím IL-1, IL-6, IFNγ a TNFα, aktivitu IDO dále zvyšuje oxidativní stres, lipopolysacharidy a zvýšená hladina kortizolu. Periferní aktivace IDO přispívá ke snížení plazmatických hladin tryptofanu a tím ke snížení množství serotoninu v mozku a současně ke zvýšení hladin katabolitů tryptofanu (kynurenin, kyselina chinolinová), které působí depresogenně a neurotoxicky. Periferními buňkami zprostředkovaná imunitní aktivace může přispívat k ovlivnění mikroglií, jež mohou produkovat prozánětlivé cytokiny (IL-6, IFNγ, TNFα) a volné kyslíkové radikály. Všechny tyto působky mohou indukovat aktivitu IDO v mozku a napomáhat tak ke zvýšení produkce katabolitů tryptofanu a v konečném důsledku přispívat k rozvoji depresivní symptomatiky; volně podle [14] – Maes, et al., 2011. IDO – indolamin 2,3-dioxygenáza; 5-HT – serotonin; IL-1 – interleukin 1; IL-6 – interleukin 6; IFNγ – interferon gama; NMDA receptor – receptor pro N-methyl-D- -aspartát; TNFα – tumor nekrotizující faktor alfa](https://www.remedia.cz/photo-a-29657---.jpg) etabolický a energetický substrát pro mozkové buňky. Utilizace glukózy v mozkových tkáních je indikátorem neuronální aktivity, kterou lze kvantifikovaně sledovat pomocí pozitronové emisní tomografie nebo funkční magnetické rezonance. V porovnání se zdravými kontrolními osobami je u depresivních nemocných popisována snížená utilizace glukózy v levém laterálním prefrontálním kortexu. Ačkoliv u jiných neuropsychiatrických chorob (Huntingtonova chorea, Alzheimerova choroba) byly popsány poruchy buněčných glukózových transportérů (GLUT), u depresivní poruchy není jasné, zda porucha utilizace glukózy souvisí s poruchami GLUT [13].
etabolický a energetický substrát pro mozkové buňky. Utilizace glukózy v mozkových tkáních je indikátorem neuronální aktivity, kterou lze kvantifikovaně sledovat pomocí pozitronové emisní tomografie nebo funkční magnetické rezonance. V porovnání se zdravými kontrolními osobami je u depresivních nemocných popisována snížená utilizace glukózy v levém laterálním prefrontálním kortexu. Ačkoliv u jiných neuropsychiatrických chorob (Huntingtonova chorea, Alzheimerova choroba) byly popsány poruchy buněčných glukózových transportérů (GLUT), u depresivní poruchy není jasné, zda porucha utilizace glukózy souvisí s poruchami GLUT [13].
Spojení mezi depresí a diabetem může být rovněž zprostředkováno prozánětlivými cytokiny [13]. Hladiny cytokinů (interleukiny a tumor nekrotizující faktor alfa – tumor necrosis factor alpha – TNFα) jsou zvýšeny u obou onemocnění a mohou vyvolávat depresivní příznaky změnou metabolizace tryptofanu. Důsledkem těchto změn je deficit serotoninu a zvýšení koncentrace neurotoxické, depresogenní kyseliny chinolinové (obr. 2).
Egede a Zheng [15] analyzovali klinická data 1810 diabetických nemocných a nalezli následující nezávislé faktory, které zvyšovaly v hodnoceném souboru riziko výskytu depresivní poruchy:
- věk vyšší než 64 let;
- ženské pohlaví;
- nižší mzda;
- subjektivní vnímání zhoršení zdraví;
- kouření.
- rozvod;
- ovdovění;
- fyzické a sexuální zneužívání v dětství;
- ztráta matky před 11. rokem života;
- významné nepříznivé životní události;
- zneužívání návykových látek;
- sociální izolace.
- předchozí historie deprese;
- náhlé zhoršení diabetu, komplikace;
- stres při chirurgických výkonech;
- chronická bolest při diabetických neuropatiích;
- progresivně se zhoršující fyzický handicap.
- depresivní somaticky nemocný člověk se sám považuje za více tělesně nemocného než stejně somaticky nemocný bez deprese;
- depresivní somaticky nemocný člověk proto častěji vyhledává lékařské služby, zůstává déle v lůžkové péči a je častěji vyšetřován pomocnými a laboratorními metodami, častěji mu jsou podávány vyšší dávky léků a tím se zvyšuje riziko výskytu nežádoucích vedlejších účinků a lékových interakcí;
- deprese prohlubuje funkční postižení;
- deprese zhoršuje adherenci pacienta k léčbě;
- deprese zvyšuje mortalitu na somatická onemocnění.
Deprese, diabetes a kardiovaskulární onemocnění
Nemocní s komorbiditou deprese a diabetu mají v porovnání s diabetiky bez deprese třikrát vyšší výskyt kardiovaskulárních rizikových faktorů [17]. Jak deprese, tak DM jsou spojeny s vyšším rizikem kardiovaskulárních a cerebrovaskulárních poruch [18]. Komorbidita diabetu a deprese zvyšuje mortalitu po infarktu myokardu [19]. Ve studii kardiovaskulárních determinant demence (CASCADE Study) byla vyšetřením magnetickou rezonancí nalezena významná asociace diabetu s atrofizací mozku u osob s hypertenzí [20].
Deprese, diabetes a demence
Deprese a diabetes mellitus patří mezi nejčastější onemocnění osob vyššího věku. Obě choroby se vzájemně ovlivňují a obě jsou rizikovými faktory rozvoje vaskulární i neurodegenerativní demence [21, 22]. Kognitivní deficit a demence se vyskytují častěji u nemocných s DM než v obecné populaci. Častější a závažnější kognitivní postižení je spojeno s DM 2. typu. Diabetes může být patogenetickým faktorem vzniku některých sporadických forem Alzheimerovy choroby. Inzulinový deficit a inzulinová rezistence zvyšují koncentraci amyloidového prekurzorového proteinu, stimulují beta-sekretázu 1 a tím podporují v animálních modelech vznik beta-amyloidu v mozku a hyperfosforylaci TAU proteinu [23, 24]. Patogenetický vztah je tak úzký, že někteří autoři navrhují pro tyto sporadické formy Alzheimerovy choroby název diabetes 3. typu [25].
Psychologická podpora a léčba u depresivních poruch
Klinické vedení začíná vznikem terapeutického vztahu mezi lékařem a pacientem. Z psychologických prostředků je důležité použít psychoedukaci nemocného i jeho rodiny, a to jak ve vztahu k diabetu (diabetická edukace), tak ve vztahu k depresi. Psychoedukace spočívá ve vysvětlení podstaty poruchy, jejího průběhu a plánované léčby. Časově limitovaná psychologická podpora by měla být soustředěna na strategii léčby obou onemocnění, na současné problémy a na pomoc při řešení zatěžujících životních událostí [26]. V léčbě deprese a pro prevenci relapsu mohou být užitečné některé metody systematické psychoterapie (například kognitivně-behaviorální nebo interpersonální terapie). Kognitivně-behaviorální psychoterapie může stabilizovat glykemii u diabetických nemocných s depresí účinněji než monoterapie antidepresivem sertralinem [27]. Je však nezbytné, aby systematickou psychoterapii vedl kvalifikovaný psychoterapeut.
Farmakoterapie depresivních poruch při DM
Antidepresiva se vzájemně neliší antidepresivní účinností (průměrně lze očekávat dobrou odpověď u 60–70 % depresivních nemocných), jednotlivé skupiny antidepresiv však mají klinicky odlišné nežádoucí účinky (tab. 2). Pro výběr antidepresiva je proto převážně určujícím hlediskem profil nežádoucích účinků. V úvahu je nutno brát somatický stav nemocného vzhledem ke kontraindikacím léčby jednotlivými antidepresivy.
Při léčbě diabetických depresivních nemocných byl již v šedesátých letech 20. století popsán efekt snižování plazm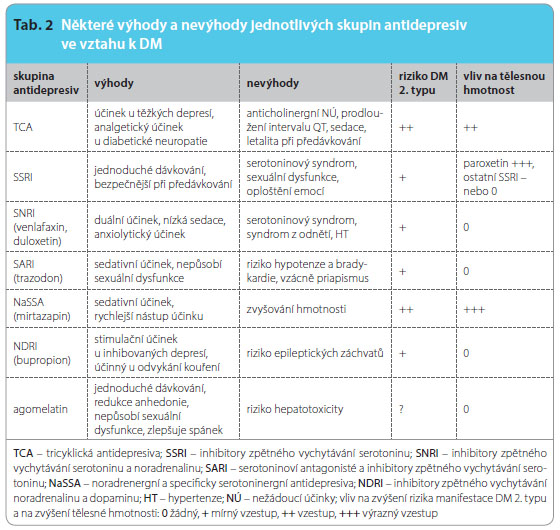 atické koncentrace glukózy při podávání ireverzibilních inhibitorů monoaminooxidázy (IMAO; fenelzin, izokarboxazid). Užití ireverzibilních IMAO však bývá spojeno se vzestupem tělesné hmotnosti a s rizikem hypertenzní krize. V současné době nejsou do České republiky ireverzibilní IMAO dováženy a v léčbě se nepoužívají.
atické koncentrace glukózy při podávání ireverzibilních inhibitorů monoaminooxidázy (IMAO; fenelzin, izokarboxazid). Užití ireverzibilních IMAO však bývá spojeno se vzestupem tělesné hmotnosti a s rizikem hypertenzní krize. V současné době nejsou do České republiky ireverzibilní IMAO dováženy a v léčbě se nepoužívají.
Tricyklická antidepresiva (TCA) se vyznačují dobrým antidepresivním efektem, a navíc i analgetickým působením, jehož lze využít v léčbě neuropatické bolesti, ale jsou zatížena kardiotoxicitou a nežádoucími metabolickými účinky. TCA jsou pro svůj anticholinergní účinek kontraindikována při ischemické chorobě srdeční, glaukomu, hypertrofii prostaty, ileózních stavech. Tato skupina antidepresiv je rovněž nevhodná pro starší nemocné, a to kvůli negativnímu vlivu na kognitivní funkce (zhoršení paměti, zmatenost). Tricyklická a heterocyklická antidepresiva jsou rizikovější při předávkování, proto by neměla být volena u nemocných s rizikem sebevražedného jednání; TCA mohou aktivovat sympatický nervový systém a tímto mechanismem zhoršovat hypertyreózu nebo vést k závažným reakcím typu serotoninového a noradrenergního syndromu při kombinaci se sympatomimetiky a látkami zvyšujícími serotoninergní transmisi centrálně. Alkohol potencuje sedativní účinek některých TCA. V léčbě diabetických pacientů s depresí nepatří mezi léky volby a jejich podávání těmto nemocným je považováno za rizikové, především z hlediska kardiotoxicity. Účinnost některých TCA byla ověřována ve dvojitě slepých kontrolovaných studiích. Lustman a kol. [28] zjistili, že nortriptylin ovlivňuje depresivní symptomatiku u nemocných s DM1 i DM2 významně lépe než placebo, jeho podání však může vést ke zvýšení glykemie.Příznivější profil nežádoucích účinků mají antidepresiva III. a IV. generace. Proto jsou doporučována jako léky prvé volby.
Dobrý metabolický efekt fluoxetinu u nemocných s obezitou při DM2 potvrdila randomizovaná studie, kterou vedl O´Kane a kol. [29]. Při léčbě fluoxetinem došlo (v porovnání s placebem) v průběhu jednoročního sledování k poklesu tělesné hmotnosti průměrně o 5,8 kg. Do šesti měsíců došlo rovněž k významnému snížení příjmu sacharidů. Lustman a kol. [30] ověřili v dvojitě slepé studii kontrolované placebem dobrý antidepresivní účinek fluoxetinu u depresivních diabetických pacientů s DM1 i DM2. V některých studiích byl popsán hypoglykemický efekt fluoxetinu [29, 31, 32].
Při ordinování antidepresiv je třeba zvažovat i potenciální lékové interakce, některé mohou být klinicky významné. Například kombinace fluoxetinu s betablokátory může vést, zvláště u starších lidí, k bradykardii. Fluoxetin může zvyšovat plazmatickou koncentraci a účinnost antikoagulancií (warfarin) s rizikem zvýšené krvácivosti. Společné podávání se serotonergními přípravky (např. tramadol, triptany) může zvýšit riziko vzniku serotoninového syndromu. Některá antidepresiva ze skupiny SSRI, která inhibují izoenzym 3A4 cytochromového systému P450
(fluoxetin, fluvoxamin), mohou ovlivnit metabolismus perorálních antidiabetik [13].
Při zahajování léčby antidepresivy je nezbytné nemocného upozornit na oddálený nástup účinku těchto léků (10–14 dní). Je vhodné přechodně podávat nemocným trpícím úzkostí a nespavostí benzodiazepinová anxiolytika a/nebo hypnotika (nejlépe nebenzodiazepinová – zolpidem, zopiklon, zaleplon). Pokud po 3–4 týdnech nedojde k alespoň částečnému ústupu psychopatologie, je doporučována změna terapie s volbou léku z jiné skupiny.
Pokračující fáze léčby navazuje na léčbu akutní epizody obvykle v trvání šesti měsíců po odeznění akutních příznaků. Je to období s vysokým rizikem relapsu afektivní poruchy. Zvláště ohroženi jsou nemocní v nekvalitní remisi, nemocní s rekurentním průběhem poruchy a pacienti s předchozím chronickým průběhem depresivní poruchy.
V poslední době byly publikovány kohortové studie a metaanalýzy, které upozorňují na rizika vzniku DM2 při dlouhodobějším podávání antidepresiv. Patofyziologické mechanismy, které k tomu vedou, nejsou objasněny. Předpokládá se vliv serotoninu na glukózovou regulaci. Dalším možným mechanismem je inhibice inzulinové signální kaskády, to může vést k inzulinové rezistenci [33–35]. Riziko vzniku nebo zhoršení DM2 jsou limitujícími faktory dlouhodobého podávání antidepresiv u osob s dispozicí k diabetu a při léčbě diabetických nemocných. U nemocných, u kterých se nejedná o komorbiditu diabetu a periodické depresivní poruchy, by proto neměla být antidepresiva podávána déle než jeden rok. To se týká nemocných s diabetem a s rizikem diabetu, u nichž je deprese součástí adaptační poruchy, úzkostně-depresivní poruchy nebo organické afektivní poruchy.
Antidepresiva v analgetické léčbě diabetické neuropatie
Vodítka pro analgetickou léčbu diabetické neuropatie doporučovala ještě v devadesátých letech 20. století použití farmak v následujícím pořadí: tricyklická antidepresiva, antikonvulziva, opiáty. Současná doporučení léčby bolesti při diabetické neuropatii uvádějí jako první volbu antikonvulziva (pregabalin, gabapentin, lamotrigin a soli kyseliny valproové) a jako léky druhé volby antidepresiva ze skupiny SNRI (venlafaxin v rozsahu denního dávkování 75–225 mg nebo duloxetin v denním dávkování 60–120 mg) [36]. Duloxetin je jediným antidepresivem registrovaným v ČR v indikaci léčby diabetické neuropatie. Některá klinická vodítka stále doporučují využití analgetického potenciálu TCA [36]. V menších klinických studiích a v kazuistických sděleních je popisován analgetický efekt antidepresiv ze skupiny SSRI – escitalopramu, citalopramu, paroxetinu a fluvoxaminu. Inhibitory MAO – ireverzibilní i reverzibilní (moklobemid) – nebyly v indikaci diabetické bolestivé neuropatie klinicky zkoušeny. Analgetický efekt u pacientů s diabetickou neuropatií byl pozorován při užití nižších dávek trazodonu (50–100 mg) a při podání nefazodonu. Mirtazapin, bupropion a agomelatin v této indikaci nebyly testovány [37].
V léčbě závažnějších depresivních poruch se jako přídatná terapie k antidepresivům používají antipsychotika druhé generace. Některá však nejsou vhodná pro léčbu nemocných s DM vzhledem k metabolickým nežádoucím účinkům. Metabolicky relativně nejšetrnější jsou aripiprazol a ziprasidon [38]. Nejrizikovější ve vztahu k diabetu jsou antipsychotika olanzapin a klozapin [39]. Antipsychotika druhé generace jsou pro nemocné s DM riziková tím, že přispívají k inzulinové rezistenci, zvyšují chuť k jídlu s rizikem abdominální obezity a svým sedativním účinkem omezují fyzickou aktivitu.
Závěr
Prevalence depresivní poruchy je dvakrát vyšší mezi nemocnými s DM než v obecné populaci. Deprese je rizikovým faktorem rozvoje diabetu 2. typu, může zhoršovat některé diabetické komplikace, prohlubuje funkční postižení a může snižovat úroveň spolupráce nemocných při celoživotní léčbě DM. Deprese zvyšuje mortalitu diabetických nemocných. Vzájemné ovlivňování obou nemocí se odehrává na úrovni neuroendokrinních regulací a neurotransmiterových funkcí. Některá experimentální data naznačují narušení psychoneuroimunitních vztahů. Obě choroby zvyšují riziko vzniku kardiovaskulárních a cerebrovaskulárních poruch a riziko rozvoje demence. Výsledky kontrolovaných klinických studií naznačují lepší účinnost a snášenlivost léčby antidepresivy třetí a čtvrté generace (SSRI, SNRI) v porovnání s tricyklickými antidepresivy. Novější studie však upozorňují na riziko vzniku diabetu při dlouhodobém podávání antidepresiv. Ne u všech antidepresiv bylo takové riziko klinicky ověřováno.
Seznam použité literatury
- [1] Anderson R, Freedland KE, Clouse RE, Lustman PJ. The prevalence of comorbid depression in adults with diabetes. A meta analysis. Diabetes Care 2001; 24: 1069–1078.
- [2] Ali S, Stone MA, Peters JL, et al. The prevalence of co-morbid depression in adults with Type 2 diabetes: a systematic review and meta-analysis. Diabet Med 2006; 23: 1165–1173.
- [3] Hrachovinová T, Fejfarová V, Csémy L, et al. Míra deprese a úzkostnosti u nemocných DM 1. a 2. typu. Diabet Metabol Endokrinol Výživa 2001; 4 (suppl 1): 20–21.
- [4] Santarelli L, Saxe M, Gross C, et al. Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants. Science 2003; 301: 805–809.
- [5] Talbot F, Nouwen A. A review of the relationship between depression and diabetes in adults. Diabetes Care 2000; 23: 1556–1562.
- [6] Kawakami N, Takatsuka N, Shimizu H, Ishibashi H. Depressive symptoms and occurrence of type 2 diabetes among Japanese men. Diabetes Care 1999; 22: 1071–1076.
- [7] Eaton WW, Armenian H, Gallo J, et al. Depression and risk for onset of type II diabetes: a prospective population-based study. Diabetes Care 1996; 19: 1097–1102.
- [8] Kovacs M, Obrosky DS, Goldston D, Drash A. Major depressive disorder in youths with IDDM: a controlled prospective study of course and outcome. Diabetes Care 1997; 20: 45–51.
- [9] Lustman PJ, Griffith LS, Freedland KE, Clouse RE. The course of major depression in diabetes. Gen Hosp Psychiatry 1997; 19: 138–143.
- [10] Lustman PJ, Clouse RE, Carney RM. Depression and the reporting of diabetes symptoms. Int J Psychiatry Med 1988; 18: 295–303.
- [11] Sapolsky RM, Romero LM, Munck AU. How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulator and preparative actions. Endocr Rev 2000; 21: 55–89.
- [12] Champaneri S, Wand GS, Malhotra SS, et al. Biological basis of depression in adults with diabetes. Curr Diab Rep 2010; 10: 396–405.
- [13] Musselman DL, Betan E, Larsen H, Philips LS. Relationship of depression to diabetes types 1 and 2: epidemiology, biology, and treatment. Biol Psychiatry 2003; 54: 317–329.
- [14] Maes M, Leonard BE, Myini AM, et al. The new 5-HT hypothesis of depression: cell-mediated immune activation induces indoleamine 2,3-dioxygenase, which leads to lower plasma tryptophan and an increased synthesis od detrimental tryptophan catabolites (TRYCATs), both of which contribute to the onset of depression. Progress Neuro Psychopharmacol Biol Psychiatry 2011; 35: 702–721.
- [15] Egede L, Zheng D. Independent factors associated with major depressive disorder in a national sample of individuals with diabetes. Diabetes Care 2003; 26: 104–111.
- [16] Smith C, Sell L, Sudbury P. Key topics in psychiatry. Bios Scientific Publishers Ltd 1996: 363.
- [17] Katon WJ, Lin EH, Russo J, et al. Cardiac risk factors in patients with diabetes mellitus and major depression. J Gen Intern Med 2004; 19: 1192–1199.
- [18] Lin EH, Rutter CM, Katon WJ, et al. Depression and advanced complications of diabetes: a prospective cohort study. Diabetes Care 2010; 33: 264–269.
- [19] Bot M, Pouwer F, Zuidersma M, et al. Association of coexisting diabetes and depression with mortality after myocardial infarction. Diabetes Care 2012; 35: 503–509.
- [20] Schmidt R, Launer LJ, Nilsson LG, et. al. Magnetic resonance imaging of the brain in diabetes: The Cardiovascular Determinants of Dementia (CASCADE) Study. Diabetes 2004; 53: 687–692.
- [21] Knol MJ, Twisk JW, Beekman AT, et al. Depression as a risk factor for the onset of type 2 diabetes mellitus. A meta-analysis. Diabetologia 2006; 49: 837–845.
- [22] Mezuk B, Eaton WW, Albrecht S, Golden SH. Depression and type 2 diabetes over the lifespan: a meta-analysis. Diabetes Care 2008; 31: 2383–2390.
- [23] Devi L, Alldred MJ, Ginsberg SD, Ohno M. Mechanisms underlying insulin deficiency-induced acceleration of beta-amyloidosis in a mouse model of Alzheimer´s disease. PLoS One 2012; 7: 1–8.
- [24] Vignini A, Giulietti A, Nanetti L, et al. Alzheimer´s disease and diabetes: new insights and unifying therapies. Curr Diabetes Rev 2013; 9: 218–227.
- [25] Steen E. Terry BM, Rivera EJ, et al. Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer´s disease – is this type 3 diabetes? J Alzheimer´s Dis 2005; 7: 63–80.
- [26] Petrak F, Herpetz S, Albus C, et al. Psychosocial factors and diabetes mellitus: evidence-based treatment guidelines. Curr Diabetes Rev 2005; 1: 255–270.
- [27] Petrak F, Herpetz S, Albus C, et al. Study protocol of the Diabetes and Depression Study (DAD): a multi-center randomized controlled trial to compare the efficacy of a diabetes-specific cognitive behavioral group therapy versus sertraline in patients with major depression and poorly controlled diabetes mellitus. BMC Psychiatry 2013; 13: 1–14.
- [28] Lustman PJ, Griffith LS, Clouse RE, et al. Effects of nortriptyline on depression and glycemic control in diabetes: results of a double-blind, placebo controlled trial. Psychosom Med 1997; 59: 241–250.
- [29] O´Kane M, Wiles PG, Wales JK. Fluoxetine in the treatment of obese type 2 diabetic patients. Diabet Med 1994; 11: 105–110.
- [30] Lustman PJ, Freedland KE, Griffith LS, Clouse RE. Fluoxetine for depression in diabetes: a randomized double-blind placebo-controlled trial. Diabetes Care 2000; 23: 618–623.
- [31] Potter Van Loon BJ, Radder JK, Frölich M, et al. Fluoxetine increases insulin action in obese nondiabetic and in obese non-insulin-dependent diabetic individuals. Int J Obes Relat Metab Disord 1992; 16: 79–85.
- [32] Lustman PJ, Griffith LS, Freedland KE, et al. Cognitive behavior therapy for depression in type 2 diabetes: A randomized controlled trial. Ann Intern Med 1998; 129: 613–621.
- [33] Khoza S, Barner JC, Bohman TM, et al. Use of antidepressant agents and the risk of type 2 diabetes. Eur J Clin Pharmacol 2012; 68: 1295–1302.
- [34] Wu CS, Gau SSF, Lai MS. Long-term antidepressant use and the risk of type 2 diabetes mellitus: a population-based, nested case-report study in Taiwan. J Clin Psychiatry 2014; 75: 31–38.
- [35] Yoon JM, Cho EG, Lee HK, Park SM. Antidepressant use and diabetes mellitus risk: a meta-analysis. Korean J Fam Med 2013; 34: 228–240.
- [36] Callaghan BC, Cheng HT, Stables CL, et al. Diabetic neuropathy: clinical manifestations and current treatments. The Lancet Neurol 2012; 11: 521–534.
- [37] Zychowska M, Rojewska E, Przewlocka B, Mika J. Mechanisms and pharmacology of diabetic neuropathy – experimental and clinical studies. Pharmacol Rep 2013; 65: 1601–1610.
- [38] American Diabetes Association, et al. Consensus development conference on antipsychotic drugs and obesity and diabetes. Diabetes Care 2004; 27: 596–601.
- [39] De Hert M, Correll CU, Bobes J, et al. Physical illness in patients with severe mental disorders I. Prevalence, impact of medication and disparities in health care. World Psychiatry 2011; 10: 52–77.