Diabetes a nádorová onemocnění
Diabetici mají zhruba dvojnásobné a vyšší riziko karcinomu jater, pankreatu a endometria a o něco menší riziko kolorektálního karcinomu, karcinomu prsu a karcinomu močového měchýře oproti ostatní populaci. Prevalence diabetu u nově diagnostikovaných osob s karcinomem je např. v USA ve srovnání s populací více než dvakrát vyšší. Hyperinzulinismus a inzulinová rezistence ovlivňují buněčnou proliferaci a diferenciaci. Léčba metforminem byla spojena s nižším rizikem výskytu karcinomů než léčba inzulinem nebo deriváty sulfonylurey, a to zvláště u tumoru colon a pankreatu. Mortalita diabetiků s karcinomem je ve srovnání s nediabetiky podstatně vyšší – metaanalýza prací publikovaných do května 2008 prokázala souhrnné zvýšení rizika jak pro všechny typy karcinomů (hazard ratio – HR 1,41), tak pro endometrium (HR 1,76), pro karcinom prsu (HR 1,61) a pro kolorektální karcinom (HR 1,32). Možné příčiny zvýšené mortality diabetiků s karcinomem spočívají především ve faktu, že tito pacienti jsou méně agresivně léčeni jak onkologicky, tak diabetologicky. Důvodem méně agresivní léčby je nejen častá polymorbidita pacientů s diabetem, ale také více komplikací při onkologické léčbě, např. infekce nebo zvýšená perioperační mortalita. Za nejpodstatnější příčinu vyšší mortality onkologicky nemocných diabetiků považujeme zjišťování karcinomů až v pozdějších stadiích, protože je často opomíjen pravidelný screening. Podle České onkologické společnosti se provádí mamární screening, screening kolorektálního karcinomu a screening karcinomu hrdla děložního na základě indikace praktického lékaře nebo registrujícího gynekologa. Pacient by proto měl být odeslán diabetologem ke screeningu karcinomů k praktickému lékaři, pokud ho jinak pravidelně nenavštěvuje, praktický lékař by pak měl informovat diabetologa o výsledku screeningu. Spolupráce diabetologického týmu se specialisty při léčbě diabetika s nádorovým onemocněním může zlepšit dlouhodobou prognózu těchto nemocných.
Úvod
Častější současný výskyt diabetu a karcinomů je znám již od roku 1932 [1]. Tento fakt budí v poslední době řadu diskusí a je mu věnována pozornost jak na odborných kongresech, tak v řadě publikací včetně souhrnných metaanalýz. Americká diabetologická asociace uspořádala v prosinci 2009 konferenci zaměřenou na diabetes a karcinomy, jejímž výsledkem byl konsenzus publikovaný v červenci 2010 v časopise Diabetes Care [2]. V tomto dokumentu se experti pokusili dát odpověď na několik otázek:
- Existuje významná asociace mezi diabetem a incidencí a prognózou karcinomů?
- Které rizikové faktory jsou společné pro diabetes a karcinomy?
- Jaké jsou možné biologické souvislosti mezi diabetem a rizikem karcinomů?
- Může léčba diabetu ovlivnit riziko karcinomů nebo jejich prognózu?
Je třeba konstatovat, že na řadu aspektů této problematiky se ani skupině amerických expertů nepodařilo najít uspokojivé odpovědi, což sami přiznávají. Např. v případě studia asociace mezi diabetem a karcinomy zůstává nejasné, zda jde o přímou závislost na hyperglykemii, nebo zda zde hrají roli jiné faktory, jako např. inzulinová rezistence a hyperinzulinemie, nebo zda je závislost obou onemocnění nepřímá, založená na společných rizikových faktorech, např. obezitě. Při studiu možných biologických faktorů spojujících diabetes a karcinomy vyvstávají otázky, nakolik role inzulinové rezistence v rámci metabolického syndromu ovlivňuje procesy podporující růst buněk a zda se inzulinová rezistence projevuje i v nádorové tkáni.
Nejvíce pozornosti je věnováno možnému kancerogennímu efektu některých způsobů medikamentózní terapie diabetu. I zde však autoři upozorňují na nezodpovězené otázky a limitace: většina studií na toto téma má omezenou sílu detekovat případné asociace, a to zejména pro specifické typy karcinomů. Řada pacientů zařazených do observačních studií je léčena v průběhu života nebo i současně větším počtem perorálních antidiabetik či jejich kombinací s inzulinem a je prakticky nemožné v dlouhodobém sledování odlišit jejich jednotlivé asociace. Tato kombinovaná terapie je navíc ovlivněna přítomností dalších „zavádějících“ rizikových faktorů. Zřídka je sledována závislost kancerogenního rizika příslušné terapie na dávce léku nebo na době terapie a také osud pacientů po přerušení příslušné léčby. Navíc některé antidiabetické léky, jako např. thiazolidindiony, inkretiny či novější analoga inzulinu, jsou na trhu poměrně krátce a jejich kancerogenní efekt nelze spolehlivě posoudit.
Asociace mezi diabetem a výskytem karcinomů a příčiny zvýšené mortality diabetiků s karcinomem
Diabetes a karcinomy jsou diagnostikovány společně častěji, než by se dalo náhodně předpokládat, a to i po adjustaci na věk [2]. Např. prevalence diabetu v USA je 7 %, zatímco prevalence diabetu u osob s nově diagnostikovaným karcinomem se pohybuje mezi 8–18 % [3]. Převážně se jedná o asociace s diabetem 2. typu, u diabetu 1. typu je hodnocen pouze malý počet studií. Zhruba dvojnásobné a vyšší riziko mají diabetici pro karcinom jater, pankreatu a endometria a o něco nižší riziko (1,2–1,5krát vyšší než populace) pro kolorektální karcinom, karcinom prsu a karcinom močového měchýře. Proč je nejvyšší riziko pro karcinomy jater a pankreatu, vysvětlují američtí experti tím, že inzulin je transportován z pankreatických b-buněk portálním systémem do jater, kde teprve dochází k jeho metabolizaci, a tudíž játra i pankreas jsou vystaveny účinkům hyperinzulinismu nejvíce. Náchylnost ke karcinomu jater u diabetiků zvyšuje také non-alkoholická steatóza jater (nonalcoholic fatty liver disease) a případně i cirhóza. V případě vysvětlení asociace s karcinomem pankreatu je situace o to složitější, že se může jednat i o „reverzní kauzalitu“, tzn. že diabetes je důsledkem existujícího karcinomu pankreatu. Nicméně asociace obou onemocnění se potvrdila i v případech, u nichž diabetes předcházel diagnóze karcinomu pankreatu o více než 5 let.
Karcinom plic, který je ve světě nejčastěji diagnostikovaným karcinomem a také nejčastější příčinou úmrtí, se nezdá být asociován s diabetem, nejednotné jsou informace o asociaci diabetu s karcinomem ledvin a non-hodgkinskými lymfomy. Na druhé straně se objevily údaje o nižším riziku karcinomu prostaty u diabetiků, což se částečně přičítá nižší hladině testosteronu.
Velmi podstatné je, že diabetes zhoršuje prognózu pacientů s karcinomem, a to i s přihlédnutím k věku, a v některých studiích zvyšuje jejich mortalitu, která však může být dána i zvýšenou kardiovaskulární mortalitou diabetiků. Např. mortalita u diabetiček s karcinomem prsu byla 1,39krát vyšší než u žen bez diabetu [4, 5]. V časopise Diabetologia byl v roce 2010 publikován přehledný článek [6] hodnotící riziko úmrtí na karcinomy podle výsledku glykemie za 2 hodiny v orálním glukózovém tolerančním testu (oGTT), který vycházel z analýzy dat téměř 45 000 osob ze 17 evropských zemí v rámci studie DECODE. V porovnání s normoglykemickými osobami bylo tzv. hazard ratio (HR) zvýšené mortality na karcinomy u mužů s diabetem 1,71 a u žen s diabetem 1,43. Byla pozorována i závislost zvýšeného rizika mortality na stupni hyperglykemie při oGTT a pravděpodobném trvání diabetu (nejvyšší riziko se vztahovalo na již dříve diagnostikované diabetiky, dále pak na osoby s nově diagnostikovaným diabetem a ve srovnání s normoglykemickou populací sice zvýšeně, ale relativně nejméně ohrožovalo toto riziko osoby s prediabetem).
Jedna z metaanalýz [4] prokázala 1,41krát zvýšenou mortalitu u diabetiků se všemi typy karcinomů ve srovnání s normoglykemickými pacienty a z hlediska orgánově specifických karcinomů byla prokázána zvýšená mortalita pro karcinom endometria (HR 1,76), pro karcinom prsu (HR 1,61) a pro kolorektální karcinom (HR 1,32). Autoři této publikace shledávají následující příčiny zvýšené mortality diabetiků s karcinomy:
- Zvýšená proliferace nádorových buněk a zvýšené riziko vzniku metastáz u diabetiků v metabolickém prostředí hyperinzulinemie a hyperglykemie – např. cestou stimulace růstu buněk přímo inzulinem nebo prostřednictvím insulin-like růstových faktorů nebo zvýšením rizika metastáz při větší permeabilitě endotelu způsobené produkcí volných kyslíkových radikálů (reactive oxidative species – ROS) a změnami v bazální membráně při hyperglykemii.
- Podstatnou měrou přispívá ke zvýšené mortalitě diabetiků s karcinomy menší agresivita onkologické léčby, která je u pacientů s diabetem ovlivněna komorbiditami, jako jsou ischemická choroba srdeční, selhávání ledvin nebo následky diabetické neuropatie.
- Diabetici mají častější komplikace při onkologické léčbě, např. zvýšené riziko infekce nebo perioperační mortality.
- Diabetici mají diagnostikovány karcinomy až v pokročilejším stadiu, protože u nich není prováděn pravidelný screening!
- Diagnóza karcinomu u diabetiků může nepříznivě ovlivnit jejich terapii diabetu, hypertenze a hyperlipoproteinemie.
Mortalita na karcinomy byla téměř dvojnásobná u pacientů léčených inzulinem a 1,3násobná u pacientů léčených deriváty sulfonylurey ve srovnání s pacienty léčenými metforminem [7].
Biologický mechanismus vztahu mezi diabetem a karcinomy
Diabetes může ovlivnit kancerogenezi několika mechanismy – hyperinzulinemií (jak endogenní v důsledku inzulinové rezistence, tak exogenní při inzulinové léčbě nebo léčbě inzulinovými sekretagogy), hyperglykemií a chronickým zánětem [2].
Receptory pro inzulin a insulin-like growth factor (IGF) jsou exprimovány na řadě nádorových buněk. A-izoformy inzulinového receptoru mohou stimulovat mitogenezi i v buňkách, které mají deficit IGF-1 receptorů [8], a mohou stimulovat proliferaci nádorových buněk a jejich metastazování. Spotřeba glukózy nádorovými buňkami je vysoká a nezávislá na vazbě inzulinu na receptory, proto lze vysvětlit efekt hyperglykemie a aktivace inzulinových receptorů na 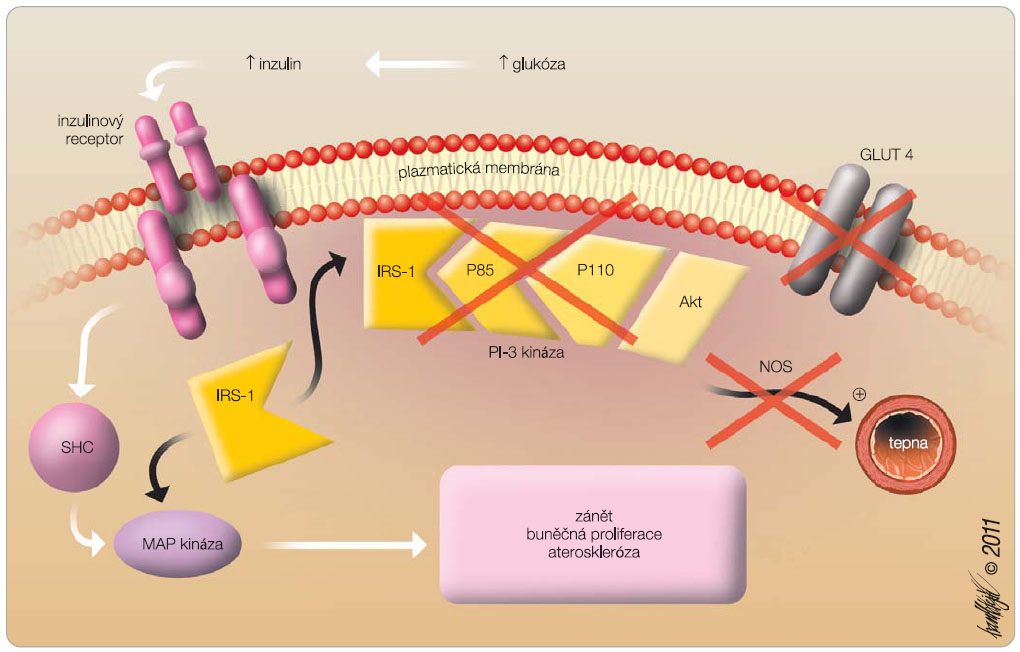 kancerogenezi z větší části účinkem na přežívání buněk a na mitogenezi než zvýšením spotřeby glukózy (tzv. Warburgova hypotéza). Postreceptorové děje po stimulaci inzulinových nebo IGF-1 receptorů vedou přes fosforylaci inzulinového receptorového substrátu (insulin receptor substrate, IRS) a přes mitogen-activated protein kinázu (MAP kinázu) k aktivaci signální cesty stimulující buněčnou proliferaci, snižující signály pro buněčnou apoptózu a vedoucí k růstu i šíření nádoru. Tato postreceptorová signální cesta vede nejen k buněčné proliferaci, ale i k akceleraci zánětu a aterosklerózy. Při inzulinové rezistenci a kompenzatorní hyperinzulinemii může být stimulována, protože inzulinová rezistence oslabuje výrazněji „kompetitivní“ postreceptorovou cestu přes fosfatidylinositol-3 kinázu (PI-3 kinázu), jež vyvolává aktivaci glukózových přenašečů, a ke zvýšené spotřebě glukózy (obr. 1).
kancerogenezi z větší části účinkem na přežívání buněk a na mitogenezi než zvýšením spotřeby glukózy (tzv. Warburgova hypotéza). Postreceptorové děje po stimulaci inzulinových nebo IGF-1 receptorů vedou přes fosforylaci inzulinového receptorového substrátu (insulin receptor substrate, IRS) a přes mitogen-activated protein kinázu (MAP kinázu) k aktivaci signální cesty stimulující buněčnou proliferaci, snižující signály pro buněčnou apoptózu a vedoucí k růstu i šíření nádoru. Tato postreceptorová signální cesta vede nejen k buněčné proliferaci, ale i k akceleraci zánětu a aterosklerózy. Při inzulinové rezistenci a kompenzatorní hyperinzulinemii může být stimulována, protože inzulinová rezistence oslabuje výrazněji „kompetitivní“ postreceptorovou cestu přes fosfatidylinositol-3 kinázu (PI-3 kinázu), jež vyvolává aktivaci glukózových přenašečů, a ke zvýšené spotřebě glukózy (obr. 1).
Jinou možností, jak může hyperinzulinemie ovlivňovat nádorový proces, je nepřímý efekt na IGF-1 snížením jaterní produkce jeho vazebného proteinu, a tudíž zvýšením podílu jeho volné frakce, čímž se zvyšuje možnost mitotické a antiapoptotické aktivity IGF. Dalším účinkem hyperinzulinemie na kancerogenezi může být její vliv na snížení produkce vazebných proteinů pro pohlavní hormony a zvýšení podílu jejich volných frakcí, které jsou asociovány především s vyšším rizikem vzniku postmenopauzálního karcinomu prsu a endometria [1, 2].
Vysvětlení vlivu hyperglykemie na kancerogenezi je založeno především na Warburgově hypotéze a na energetickém metabolismu karcinomů – vysoké spotřebě glukózy nádorovými buňkami, jež generují ATP na základě glykolýzy, která potřebuje mnohem více glukózy než klasická cesta oxidativní fosforylací. Tento princip mimo jiné využívá i znázorňování tumorů pomocí fluorodeoxyglukózové pozitronové emisní tomografie (FDG-PET). Vysoce efektivní systém nádorových buněk pro využití glukózy nezávisle na inzulinu však není výrazněji ovlivněn hyperglykemií, takže přímá souvislost mezi hyperglykemií a nádorovým růstem se většinou neprokazuje.
Zánětlivé cytokiny jsou třetí spojnicí mezi diabetem a kancerogenezí, především cytokiny uvolňované z tukové tkáně, které mohou stimulovat růst i přežívání nádorových buněk (např. IL-6 vedl k transformaci buněk karcinomu prsu ve více invazivní formu [9] a ovlivnil antitumorózní imunitní reakci [10]).
Rizikové faktory společné pro diabetes i karcinomy
Mezi potenciální rizikové faktory společné pro diabetes i karcinomy patří vliv věku, pohlaví, obezity, fyzické aktivity, diety, spotřeby alkoholu a kouření. Podobně jako v případě diabetu, výskyt karcinomů se zvyšuje s věkem, např. 78 % nově diagnostikovaných karcinomů je zaznamenáno u osob starších 55 let [11]. Obezita patří mezi rizikové faktory především pro postmenopauzální karcinom prsu, pro karcinom kolorektální, endometriální, karcinom pankreatu a jater, ale i pro karcinomy, které nejsou přímo asociovány s diabetem, jako je karcinom jícnu, ledviny, žlučníku či prostaty. Bariatrická chirurgická léčba obezity snížila riziko karcinomů ve srovnání s neléčenými obézními zhruba na polovinu ve třech studiích [12].
Dieta bohatá na vlákninu – ovoce, zeleninu, celozrnné výrobky – a na mononenasycené mastné kyseliny a chudá na červené maso měla v řadě studií protektivní vliv nejen na diabetes, ale i na karcinomy [13, 14]. Vyšší fyzická aktivita redukovala výskyt některých typů karcinomů – např. colon a postmenopauzálního karcinomu prsu a endometria [2, 15]. Kouření působí vznik až 71 % karcinomů dýchacích cest a je asociováno např. i s karcinomy vyskytujícími se častěji u diabetiků – např. pankreatu, močového měchýře, jater [2]. Spotřeba alkoholu zvyšuje riziko některých typů karcinomů, ale mírná spotřeba alkoholu je asociována s nižším rizikem diabetu [1].
Antidiabetická terapie a riziko karcinomů
Kancerogenní riziko antidiabetické terapie poutá nejvíce pozornosti. Předem je nutné zdůraznit, že při výběru terapie v diabetologii stále platí upřednostnění snahy o co nejlepší kompenzaci v rámci předcházení pozdním komplikacím diabetu.
V popředí zájmu je antikancerogenní efekt metforminu [16, 17]. Tento účinek může být ovlivněn výběrem pacientů užívajících metformin, k nimž patří především pacienti s počínajícím diabetem. Hlavním účinkem metforminu je snížení jaterní produkce glukózy, avšak v experimentu metformin inhiboval buněčnou proliferaci a parciálně zastavoval buněčné cykly nádorových buněk, např. mechanismem indukce AMP-aktivované proteinkinázy v nádorových buňkách, která snižuje proteosyntézu i nádorový růst [18, 19]. Zvýšená aktivita AMP-aktivované proteinkinázy může vést také k inhibici tzv. mTOR komplexu, jehož kinázy integrují buněčné signály různých růstových faktorů a jsou inhibovány také sirolimem (rapamycinem). Metformin také v experimentu restauroval tvorbu paměťových T-lymfocytů [7]. In vitro byl prokázán selektivní účinek metforminu na nádorové kmenové buňky a posílení účinku protinádorové léčby karcinomu prsu [20, 21]. Byly publikovány údaje o menším riziku karcinomů i nižší mortalitě u pacientů léčených metforminem ve srovnání s pacienty léčenými jinou antidiabetickou terapií [22, 23]. Efekt metforminu byl orgánově specifický, např. bylo zjištěno menší riziko tumorů colon a pankreatu a nezměněné riziko tumoru prsu a prostaty [22]. Při interpretaci výsledků těchto studií je ale nutné vzít v úvahu rozdíly v indikačních kritériích pacientů léčených různými antidiabetiky – metformin je indikován v monoterapii většinou u méně pokročilých stadií diabetu bez závažnějších komplikací.
Jen velmi málo studií našlo o něco vyšší výskyt karcinomů u pacientů léčených deriváty sulfonylurey ve srovnání s pacienty léčenými metforminem, avšak celkový výskyt nádorů byl i ve skupině léčené deriváty sulfonylurey nízký, navíc nebyly sledovány ani vztahy mezi dávkou preparátu, specifickými typy karcinomů apod. Nebyla nalezena žádná asociace mezi karcinomy a léčbou nesulfonylureovými sekretagogy – glinidy, což může být ovlivněno menším počtem pacientů léčených těmito léčivy [2].
Vztah thiazolidindionů k tumorům byl předmětem zájmu především v experimentálních studiích. In vitro studie prokázaly některé antitumorózní aktivity, např. inhibici růstu nádoru a indukci apoptózy a buněčné diferenciace [24], studie na hlodavcích ale naopak prokázaly některé kancerogenní aktivity [25]. Hodnocení klinických observačních studií spolu s daty z intervenčních prospektivních studií nejsou jednoznačná. Např. data ze studie RECORD a ADOPT jsou interpretována ve smyslu menšího rizika výskytu karcinomů u pacientů užívajících rosiglitazon nebo metformin než u pacientů léčených deriváty sulfonylurey se všemi již výše uvedenými limitacemi studií a post hoc analýz [26]. Práce Monamiho z roku 2008 [27] hodnotila 8 studií s rosiglitazonem ve srovnání s komparátory a neprokázala signifikantní změnu rizika karcinomů u pacientů léčených rosiglitazonem, i když incidence karcinomů v této skupině byla signifikantně nižší (0,23 vs. 0,44 případů/100 pacientoroků). Poslední metaanalýza studií s rosiglitazonem neprokázala asociaci s tumory, počet pacientů s nádory byl však poměrně malý [27].
Inkretiny jsou buďto analoga glukagonu podobného peptidu (glucagon-like peptide 1, GLP-1) exenatid a liraglutid nebo inhibitory enzymu dipeptidyl peptidázy 4 (DPP-4) a jsou zatím z hlediska kancerogeneze sledovány pouze krátce. V rámci této lékové skupiny se nejvíce diskutuje potenciální možnost asymptomatické chronické pankreatitidy a karcinomu pankreatu [28]. Liraglutid zvyšoval v preklinických studiích u hlodavců riziko medulárního karcinomu štítné žlázy a zvyšoval hladiny kalcitoninu (které jsou u tohoto karcinomu vyšší) u lidí [2]. Exenatid, liraglutid i inhibitory DPP-4 zvyšovaly proliferaci b-buněk pankreatu v experimentálních studiích, exenatid a inhibitor DPP-4 sitaglitptin vedly k hyperplazii pankreatických duktálních buněk [7, 29]. Dosud nebyly hlášeny žádné asociace terapie založené na inkretinech s karcinomy u lidí [2].
Terapie exogenními inzuliny je z hlediska možného kancerogenního efektu v popředí zájmu, subkutánní podávání inzulinu vede k vysokým nefyziologickým systémovým hladinám. Situace je o to složitější, že většina diabetiků 2. typu léčená inzulinem v pozdějších stadiích diabetu prošla v minulosti i obdobím endogenního hyperinzulinismu. Byla pozorována např. asociace léčby inzulinem s karcinomem pankreatu nebo kolorektálním karcinomem [30].
Jednu z prvních pozorností v souvislosti s kancerogenním účinkem vzbudilo stažení inhalačního rekombinantního inzulinu Exubery firmou Pfizer z trhu v roce 2007 pro 6 případů karcinomu plic hlášených u pacientů ve studiích s tímto inzulinem ve srovnání s jedním pacientem ve skupině léčené aktivním komparátorem, všichni tito pacienti byli kuřáci [7]. Velká lokální koncentrace inhalačního inzulinu v plicích ale není srovnatelná s koncentrací subkutánně podávaného inzulinu. Přesto začala budit pozornost biosyntéza lidských inzulinů a zejména jejich analog modifikující jejich efekt jak v rychlosti nástupu, tak především v délce účinku a současně prodlužující jejich vazbu na inzulinové receptory nebo zvyšující zkříženou reaktivitu s receptory IGF-1.
Nejvíce publikací je věnováno dlouhodobému inzulinovému analogu glarginu, a to zejména pro jeho vyšší vazebnou aktivitu k receptoru IGF-1 [7, 22, 31–35]. Inzulin glargin, u nějž sice byla in vitro prokázána 6–8krát větší receptorová afinita a mitogenita ve srovnání s humánním inzulinem [36], je však v podkoží a částečně i v cirkulaci parciálně degradován na metabolity, jejichž mitogenní aktivita je nízká, proto jeho účinek in vitro a in vivo není identický [7].
Na možnou asociaci inzulinu glarginu s karcinomy upozornila nejprve velká německá observační studie [33], která prezentovala údaje pojišťoven o výskytu tumorů u 127 031 pacientů léčených inzuliny (humánními ve srovnání s léčbou inzulinovými analogy – lispro, aspart a glargin, detemir ještě v té době nebyl dostatečně dlouho na trhu). Byla nalezena korelace mezi dávkou inzulinu a rizikem karcinomů bez ohledu na druh inzulinu. Průměrná dávka glarginu byla kolem 22 U, průměrná dávka humánních inzulinů 37 U a riziko karcinomů u osob léčených glarginem bylo menší než u osob dostávajících humánní inzuliny, avšak po adjustaci na dávku 50 U denně se riziko karcinomů u osob léčených glarginem zvýšilo na HR 1,31 ve srovnání s humánními inzuliny.
Následně byly publikovány výsledky registrů diabetu ve Švédsku a Skotsku a byly porovnány s místními registry karcinomů [31, 32]. Švédská studie [31] posuzovala 114 841 pacientů léčených inzulinem v roce 2005 a porovnala u nich výskyt karcinomů v následujících 2 letech, u pacientů léčených v době sledování pouze glarginem (5970 osob) však nebrala v úvahu délku inzulinové léčby ani předchozí typy inzulinů; nebyla sledována ani závislost na dávce inzulinu. Bylo zjištěno vyšší riziko karcinomu prsu u osob léčených pouze glarginem ve srovnání s osobami, které byly léčeny jinými inzuliny než glarginem – HR 1,99. Nebyly zjištěny rozdíly ve výskytu karcinomů mezi osobami léčenými glarginem v kombinaci s jiným inzulinem a osobami dostávajícími jiné inzuliny než glargin. Interpretace výsledků této studie musí být opatrná – výskyt karcinomů prsu byl v obou skupinách nízký a výsledky mohly být ovlivněny např. rozdílným věkem ve sledovaných skupinách.
Skotská studie [32] sledovala celkem 49 197 pacientů léčených inzulinem v letech 2002–2004 a srovnávala je s výskytem karcinomů dle registru do roku 2005. Pacienti byli rozděleni podobně jako ve švédské studii – na léčené pouze glarginem, léčené kombinací glarginu s jinými inzuliny a léčené jinými inzuliny než glarginem, mezi skupinami byly rozdíly ve věku (68, 41 a 60 let v průměru v jednotlivých výše uvedených skupinách). Pacienti, kteří dostávali pouze glargin, měli častěji diabetes 2. typu s metabolickým syndromem a bylo jich pouze 447 ve srovnání s 3512 pacienty léčenými glarginem v kombinaci s jinými inzuliny. Pacienti s glarginem měli vyšší riziko výskytu karcinomu ve srovnání s humánním inzulinem – HR 1,55, riziko karcinomu prsu v této skupině bylo 3,39 ve srovnání s pacienty bez glarginu.
Analýza pacientů z Velké Británie [22] založená na databázi THIN (The Health Information Network) byla ve srovnání s předchozími studiemi lépe definována a jejím hlavním nálezem je nižší výskyt karcinomů u pacientů léčených metforminem a fakt, že nepotvrdila asociace karcinomů s inzulinem glarginem.
Randomizovaná studie srovnávající během 5 let terapii glarginem a NPH inzulinem nenašla asociaci glarginu s karcinomy [37]. Probíhající studie ORIGIN je sice velmi rozsáhlá (týká se téměř 12 000 pacientů s poruchou glukózové tolerance či s nově zjištěným diabetem 2. typu léčených glarginem, nebo placebem) a mohla by objasnit vztah mezi glarginem a nádory, avšak její síla je plánována podle předpokládaného výskytu kardiovaskulárních ukazatelů, a proto ani tato studie nemusí mít dostatečnou sílu pro zjištění vztahu ke karcinomům.
Hlavním argumentem pro nejednotné závěry klinických studií asociací mezi terapií inzulinem nebo jeho jednotlivými druhy a karcinomy je tzv. bias, systematická chyba daná přítomností dalších rizikových faktorů kancerogeneze a komorbidit zvyšujících riziko výskytu karcinomů, které interferují s vlivem inzulinu.
Zásady screeningu karcinomů v České republice
Cílem screeningových programů je časnější záchyt zhoubných nádorů a přednádorových stavů a pokles úmrtnosti na tato onemocnění. Česká onkologická společnost na svých webových stránkách doporučuje v současnosti:
Mamární screening
Screening je určen pro ženy bez dalších rizik ve věku nad 45 let ve dvouletých intervalech a pro ženy se zvýšeným rizikem karcinomu prsu v individuálních intervalech. Za vysoké riziko zhoubného nádoru prsu se pokládá přítomnost některých genetických mutací (např. BRCA 1 a 2, p53), pozitivní rodinná anamnéza nebo osobní anamnéza s rizikem stanoveným genetikem přesahujícím 20 %, histologický nález atypické duktální a lobulární hyperplazie, ženy po radioterapii v oblasti hrudníku v dětství a mládí (do 18 let). Mamární screening je hrazen ze zdravotního pojištění na základě indikace praktického lékaře nebo gynekologa.
Screening kolorektálního karcinomu
- Asymptomatičtí jedinci ve věku 50–54 let mají mít proveden test na okultní krvácení (TOKS), a je-li negativní, má být opakován po roce. Je-li pozitivní, má být provedena kolonoskopie, pokud je její výsledek negativní, opakuje se vyšetření po 10 letech.
- Asymptomatičtí jedinci ve věku 55 a více let mohou být vyšetřeni testem na okultní krvácení; pokud je pozitivní, provádí se kolonoskopie, pokud je negativní, provádí se další screening za 2 roky. Jinou možností je provádět u osob nad 55 let rovnou primární screeningovou kolonoskopii; pokud je její výsledek negativní, provádí se další screeningové vyšetření po 10 letech.
- Individuálně se ordinuje kolonoskopie u rizikových jedinců s pozitivní rodinnou anamnézou nebo s rizikovou osobní anamnézou pro vznik kolorektálního karcinomu (např. hereditární polypóza, Lynchův syndrom, zánětlivá střevní onemocnění, inzulinová rezistence a obezita a zevní rizikové faktory, např. dieta s vysokým obsahem živočišných tuků).
Screeningový test TOKS lze získat u praktického lékaře či gynekologa.
Screening karcinomu hrdla děložního
Na preventivní vyšetření karcinomu děložního hrdla má právo každá dospělá žena. Screeningovým vyšetřením se rozumí cytologické vyšetření navazující na preventivní prohlídku u gynekologa jednou ročně u žen, které nemají jiné známky nebo vysoké riziko nádorového onemocnění.
Závěr
Na závěr bychom se podobně jako Smith a Gale v časopise Diabetologia [1] měli zamyslet nad otázkou, zda jsme připraveni řešit aktuální problémy, které se objevují v souvislosti s možnou asociací diabetu a karcinomů. V prvé řadě bychom se měli zaměřit na faktory, které mohou být rizikem jak pro diabetes, tak pro karcinomy a souvisejí s inzulinovou rezistencí, především na obezitu. Jak modifikovat terapii diabetu tak, aby nezvyšovala riziko karcinomů, nebo ho i příznivě ovlivňovala, zůstává otevřeným problémem. V této souvislosti se zvažuje především nutnost dalšího výzkumu příznivého efektu metforminu a naopak „rizikové“ léčby inzulinem, pro odlišení vlivu endogenního hyperinzulinismu a exogenně podávaného inzulinu je nutné analyzovat závislosti rizika karcinomů také na dávkách inzulinu. Na základě současných poznatků lze uzavřít, že výběr antidiabetické terapie není podle dostupných důkazů modifikován případným kancerogenním rizikem, avšak u osob s vysokým rizikem karcinomu nebo s rizikem rekurence karcinomu by k tomuto riziku při výběru antidiabetické terapie mělo být přihlédnuto. EASD (Evropská asociace pro studium diabetu) iniciovala rozsáhlý evropský program zaměřený na riziko karcinomů u diabetiků, jehož výsledky lze očekávat mezi lety 2011 a 2013.
Velmi podporujeme závěr skupiny expertů ze zasedání v Atlantě v prosinci 2009 (zástupci ADA – American Diabetes Association, EASD a European Cancer Organisation), aby doporučované screeningové vyšetření karcinomů bylo u osob s diabetem důsledně prováděno. V České republice je realizují převážně praktičtí lékaři a gynekologové. Diabetologové, v jejichž péči je převážná část diabetiků, by měli toto screeningové vyšetření podporovat a pacientům je při kontrolách připomínat. Praktický lékař by měl diabetologa upozornit na výsledky screeningu i na případnou non-compliance pacienta se screeningovým vyšetřením. Účast diabetologa v týmu pečujícím o onkologicky nemocného diabetika může zlepšit jeho prognózu.
Práce byla podporována VZ MZO 00023001.
Seznam použité literatury
- [1] Smith U, Gale EA. Cancer and diabetes: are we ready for prime time? Diabetologia 2010; 53: 1541–1544.
- [2] Giovannucci E, Harlan DM, Archer MC, et al. Diabetes and cancer: a consensus report. Diabetes Care 2010; 33: 1674–1685.
- [3] Ko C, Chaudhry S. The need for a multidisciplinary approach to cancer care. J Surg Res 2002; 105: 53–57.
- [4] Barone BB, Yeh HC, Snyder CF, et al. Long-term all-cause mortality in cancer patients with preexisting diabetes mellitus: a systematic review and meta-analysis. JAMA 2008; 300: 2754–2764.
- [5] Lipscombe LL, Hux JE, Booth GL. Reduced screening mammography among women with diabetes. Arch Intern Med 2005; 165: 2090–2095.
- [6] Zhou XH, Qiao Q, Zethelius B, et al. Diabetes, prediabetes and cancer mortality. Diabetologia 2010; 53: 1867–1876.
- [7] Smith U, Gale EA. Does diabetes therapy influence the risk of cancer? Diabetologia 2009; 52: 1699–1708.
- [8] Denley A, Carroll JM, Brierley GV, et al. Differential activation of insulin receptor substrates 1 and 2 by insulin-like growth factor-activated insulin receptors. Mol Cell Biol 2007; 27: 3569–3577.
- [9] Iliopoulos D, Hirsch HA, Struhl K. An epigenetic switch involving NF-kappaB, Lin28, Let-7 MicroRNA, and IL6 links inflammation to cell transformation. Cell 2009; 139: 693–706.
- [10] Yu H, Pardoll D, Jove R. STATs in cancer inflammation and immunity: a leading role for STAT3. Nat Rev Cancer 2009; 9: 798–809.
- [11] Garcia M, Jemal A, Ward E, et al. Global Cancer Facts and Figures. Atlanta, Georgia, American Cancer Society 2007.
- [12] Renehan AG. Bariatric surgery, weight reduction, and cancer prevention. Lancet Oncol 2009; 10: 640–641.
- [13] Craig WJ, Mangels AR. Position of the American Dietetic Association: vegetarian diets. J Am Diet Assoc 2009; 109: 1266–1282.
- [14] Tyrovolas S, Panagiotakos DB. The role of Mediterranean type of diet on the development of cancer and cardiovascular disease, in the elderly: a systematic review. Maturitas 2010; 65: 122–130.
- [15] Lee IM. Physical activity and cancer prevention–data from epidemiologic studies. Med Sci Sports Exerc 2003; 35: 1823–1827.
- [16] Duncan BB, Schmidt MI. Metformin, cancer, alphabet soup, and the role of epidemiology in etiologic research. Diabetes Care 2009; 32: 1748–1750.
- [17] Goodwin PJ, Ligibel JA, Stambolic V. Metformin in breast cancer: time for action. J Clin Oncol 2009; 27: 3271–3273.
- [18] Alimova IN, Liu B, Fan Z, et al. Metformin inhibits breast cancer cell growth, colony formation and induces cell cycle arrest in vitro. Cell Cycle 2009; 8: 909–915.
- [19] Liu B, Fan Z, Edgerton SM, et al. Metformin induces unique biological and molecular responses in triple negative breast cancer cells. Cell Cycle 2009; 8: 2031–2040.
- [20] Hirsch HA, Iliopoulos D, Tsichlis PN, Struhl K. Metformin selectively targets cancer stem cells, and acts together with chemotherapy to block tumor growth and prolong remission. Cancer Res 2009; 69: 7507–7511.
- [21] Vazquez-Martin A, Oliveras-Ferraros C, Menendez JA. The antidiabetic drug metformin suppresses HER2 (erbB-2) oncoprotein overexpression via inhibition of the mTOR effector p70S6K1 in human breast carcinoma cells. Cell Cycle 2009; 8: 88–96.
- [22] Currie CJ, Poole CD, Gale EA. The influence of glucose-lowering therapies on cancer risk in type 2 diabetes. Diabetologia 2009; 52: 1766–1777.
- [23] Landman GW, Kleefstra N, van Hateren KJ, et al. Metformin associated with lower cancer mortality in type 2 diabetes: ZODIAC-16. Diabetes Care 2010; 33: 322–326.
- [24] Ohta K, Endo T, Haraguchi K, et al. Ligands for peroxisome proliferator-activated receptor gamma inhibit growth and induce apoptosis of human papillary thyroid carcinoma cells. J Clin Endocrinol Metab 2001; 86: 2170–2177.
- [25] Rubenstrunk A, Hanf R, Hum DW, et al. Safety issues and prospects for future generations of PPAR modulators. Biochim Biophys Acta 2007; 1771: 1065–1081.
- [26] Home PD, Kahn SE, Jones NP, et al. Experience of malignancies with oral glucose-lowering drugs in the randomised controlled ADOPT (A Diabetes Outcome Progression Trial) and RECORD (Rosiglitazone Evaluated for Cardiovascular Outcomes and Regulation of Glycaemia in Diabetes) clinical trials. Diabetologia; 53: 1838–1845.
- [27] Monami M, Lamanna C, Marchionni N, Mannucci E. Rosiglitazone and risk of cancer: a meta-analysis of randomized clinical trials. Diabetes Care 2008; 31: 1455–1460.
- [28] Butler PC, Dry S, Elashoff R. GLP-1-based therapy for diabetes: what you do not know can hurt you. Diabetes Care 2010; 33: 453–455.
- [29] Butler PC. Insulin glargine controversy: a tribute to the editorial team at Diabetologia. Diabetes 2009; 58: 2427–2428.
- [30] Yang YX. Do diabetes drugs modify the risk of pancreatic cancer? Gastroenterology 2009; 137: 412–415.
- [31] Jonasson JM, Ljung R, Talback M, et al. Insulin glargine use and short-term incidence of malignancies – a population-based follow-up study in Sweden. Diabetologia 2009; 52: 1745–1754.
- [32] Colhoun HM. Use of insulin glargine and cancer incidence in Scotland: a study from the Scottish Diabetes Research Network Epidemiology Group. Diabetologia 2009; 52: 1755–1765.
- [33] Hemkens LG, Grouven U, Bender R, et al. Risk of malignancies in patients with diabetes treated with human insulin or insulin analogues: a cohort study. Diabetologia 2009; 52: 1732–1744.
- [34] Gerstein HC. Does insulin therapy promote, reduce, or have a neutral effect on cancers? JAMA 2010; 303: 446–447.
- [35] Pollak M, Russell-Jones D. Insulin analogues and cancer risk: cause for concern or cause celebre? Int J Clin Pract 2010; 64: 628–636.
- [36] Kurtzhals P, Schaffer L, Sorensen A, et al. Correlations of receptor binding and metabolic and mitogenic potencies of insulin analogs designed for clinical use. Diabetes 2000; 49: 999–1005.
- [37] Rosenstock J, Fonseca V, McGill JB, et al. Similar risk of malignancy with insulin glargine and neutral protamine Hagedorn (NPH) insulin in patients with type 2 diabetes: findings from a 5 year randomised, open-label study. Diabetologia 2009; 52: 1971–1973.
- [38] DeFronzo RA. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes 2009; 58: 773–795.