Diabetická retinopatie – možnosti farmakoterapie a pokroky v léčbě
Diabetická retinopatie (DR) a diabetický makulární edém (ME) jsou nejběžnějšími komplikacemi diabetu mellitu (DM) a nejčastější příčinou poklesu zrakové ostrosti a slepoty v populaci osob produktivního věku ve vyspělých zemích. Laserová koagulace a intenzivní kontroly glykemie sice zlepšují dlouhodobé výsledky léčby diabetického ME a proliferativní diabetické retinopatie (PDR), přesto však u některých pacientů dochází ke zrakovým ztrátám. Farmakologické možnosti léčby inhibitory vaskulárního endoteliálního růstového faktoru (Vascular Endothelial Growth Factor, VEGF) a intravitreálními kortikoidy představují nové a účinné metody léčby zejména u očí, které nereagují na běžnou terapii.
Úvod
Diabetická retinopatie (DR) a diabetický makulární edém (ME) jsou nejběžnějšími komplikacemi u pacientů s diabetem mellitem (DM) a také nejčastější příčinou poklesu zrakové ostrosti a vzniku slepoty v populaci osob produktivního věku ve vyspělých zemích. Významným rizikovým faktorem závažné ztráty zrakové ostrosti u nemocných s DM jsou neovaskularizace sítnice a komplikace proliferativní diabetické retinopatie (PDR) [1]. Přibližně 60 % pacientů s PDR reaguje příznivě na panretinální fotokoagulaci (PRF) regresí novotvořených cév v průběhu tří měsíců [2], avšak u některých nemocných je nutná další doplňující laserová léčba. Z výsledků ETDRS studie navíc vyplývá, že 4,5 % očí s PDR podstoupilo pro komplikace, které nastaly i přes úspěšnou PRF, vitreoretinální chirurgický zákrok, pars plana vitrektomii [3]. V mnohých případech lze zabránit těžkým ztrátám centrálního vidění u nemocných s DR úplnou PRF, tato metoda je však destruktivní, často bolestivá a je spojena s poklesem periferního vidění a se zvýšeným rizikem diabetického ME [4]. Diabetický ME se může vyskytovat v jakémkoliv stadiu neproliferativní DR či PDR, přičemž způsobuje (většinou) mírný pokles centrální zrakové ostrosti nemocných [5, 6]. Prevalence diabetického ME narůstá s délkou trvání DM. Epidemiologická studie DR v jižním Wisconsinu ukázala, že po 20letém trvání DM dosahuje prevalence diabetického ME 28 %, a to u pacientů s oběma typy DM [7]. Metaanalytické studie udávají, že ve světě trpí diabetickým ME nejméně 21 milionů lidí, což představuje celkovou prevalenci 6,81 % u osob s DM. Tato prevalence je vyšší u diabetiků 1. typu DM než u DM 2. typu [8]. V důsledku nárůstu prevalence DM (do roku 2030 se očekává vzestup počtu pacientů s DM o 22 %) ovšem stoupá rovněž incidence diabetického ME [9].
Růst prevalence DM vyžaduje zkvalitnit vyšetřování očního pozadí. Důraz je kladen na systematické uplatňování větší dostupnosti, pružnosti a selektivity u běžných pacientů a na spolupráci diabetologa a oftalmologa. Cílem mezioborové spolupráce je časný záchyt sítnicových komplikací, jejich finančně efektivnější a účinnější léčba pro většinu diabetiků. Obecně akceptovanými metodami ke snížení rizika ztráty zraku u pacientů s DR a diabetickým ME jsou kontroly krevního tlaku a glykemie, PRF, fokální/mřížková koagulace makuly u diabetického ME a pars plana vitrektomie. Mezníkem v léčbě diabetického ME byly na počátku 80. let minulého století výsledky klinické studie ETDRS. Tato rozsáhlá studie prokázala, že laserová koagulace u očí s klinicky signifikantním ME, který zasahuje či ohrožuje centrum makuly, může snižovat tříleté riziko ztráty vidění o 3 a více řádků na ETDRS optotypech nejméně o 50 % [10]. V důsledku fokální/mřížkové laserové léčby navíc klesá četnost přetrvávajícího ME a zvyšuje se naděje na zlepšené vidění. Léčebný účinek laserové koagulace u diabetického ME je stále podstatný, a to především za předpokladu, že budou optimalizovány technické parametry laseru. Využívání účinné nepoškozující podprahové a mikropulzní léčby totiž umožní ústup edému a úplnou funkční obnovu sítnice [11]. Přesné příčiny účinného mechanismu fokální/mřížkové laserové terapie diabetického ME zůstávají nejasné [12], přesto však laserová koagulace DR a diabetického ME zůstává dosud významnou součástí léčby sítnicových komplikací DM.
Farmakologická léčba sítnicových komplikací
Další podstatný pokrok v léčbě pacientů s DR a diabetickým ME byl učiněn v posledním desetiletí, kdy byla zavedena farmakologická léčba sítnicových komplikací pomocí inhibitorů vaskulárního endotelového růstového faktoru (VEGF) nebo steroidů. Tato farmakologická léčba, na rozdíl od konvenční laserové koagulace sítnice, není spojena s jakýmkoliv přímým poškozením neurosenzorické sítnice. Pokročilé stadium DR, charakterizované přítomností neovaskularizací, je způsobeno VEGF. Jeho podání do sklivce u zdravých primátů vyvolalo stejné patologické procesy, které pozorujeme u pacientů s DR, včetně vzniku mikroaneurysmat a vzestupu cévní propustnosti. VEGF byl identifikován jako hlavní regulátor angiogeneze, a to jak ve fyziologických, tak v patofyziologických procesech oka. Ve sklivci hladiny VEGF stoupají za hypoxických podmínek, jsou zvýšeny u ischemických retinopatií, a to včetně DR. VEGF jako permeabilní faktor zvyšuje propustnost sítnicových cév zvýšením fosforylace „tight junction“ proteinů [13]. Protože hladiny VEGF v oku korelují jak s růstem a aktivitou novotvořených cév, tak se závažností ME, předpokládalo se, že anti-VEGF léčba povede k podstatnému zmírnění ME. Experimentální práce potvrdily, že blokáda VEGF byla u primátů spojena s inhibicí neovaskularizací duhovky a s potlačením tvorby sítnicových neovaskularizací [14]. Tyto poznatky poskytly velmi racionální podklad pro anti-VEGF terapii sítnicových cévních onemocnění spojených s tvorbou neovaskularizací. Mezi blokátory VEGF používanými v léčbě PDR a ME různé etiologie patří pegaptanib, bevacizumab, ranibizumab a aflibercept.
Pegaptanib
Retrospektivní analýza randomizované studie Macugen Diabetic Retinopathy Study Group (2006) [15] poskytla unikátní příležitost ke zjištění, že pegaptanib sodium podávaný intravitreálně u pacientů s diabetickým ME (postihujícím centrum makuly) má přímý vliv na regresi sítnicových neovaskularizací. Pegaptanib specificky blokuje izoformu VEGF165. Pro léčbu diabetického ME a/nebo PDR není v ČR standardně používán, je indikován k léčbě neovaskulární (vlhké) formy věkem podmíněné makulární degenerace (VPMD) u dospělých.
Bevacizumab
Bevacizumab je rekombinantní protilátka proti solubilnímu VEGF. Ve studii, kterou publikoval Avery v roce 2006, byl zaznamenán ústup sítnicových neovaskularizací po injekci bevacizumabu do sklivce u pacientů s PDR [16]. Od této doby rychle stoupá počet studií, které prokazují účinnost léčby DR pomocí blokátorů VEGF. Velez-Montoya a kol. (2009) neprokázali v pilotní studii 23 pacientů s oboustranným difuzním diabetickým ME systémový vliv jednostranně intravitreálně podaného bevacizumabu na neléčené druhé oko [17]. Zajímavé výsledky byly publikovány v nedávné prospektivní studii (IBEPE study) 15 pacientů s aktivními sítnicovými neovaskularizacemi u DR bez odezvy na předchozí laserovou léčbu [18]. PRF byla provedena nejméně čtyři měsíce před zahájením léčby intravitreálně podaným bevacizumabem (1,5 mg/0,06 ml). Zraková ostrost pro zařazení do studie byla 20/40 a horší. Vylučujícími kritérii byly proběhlá tromboembolická příhoda, dekompenzovaná hypertenze, koagulopatie a současná antikoagulační léčba kromě léčby aspirinem. V této studii byl hodnocen vliv bevacizumabu na oblast prosakování fluoresceinu z aktivních neovaskularizací a jeho vliv na zrakovou ostrost v ročním sledování. Průměrný počet injekcí byl 2,16. Autoři studie zjistili, že intravitreální léčba bevacizumabem je spojena s rychlou a statisticky signifikantní regresí perzistujících neovaskularizací a se zlepšením zrakové ostrosti.
Solaiman a kol. (2013) zjišťovali v prospektivní studii u 22 očí s bilaterálním difuzním diabetickým ME [19], zda mřížková fotokoagulace makuly následující tři týdny po iniciální injekci bevacizumabu může poskytnout delší interval stabilizace a snižovat tak náklady na častější léčbu. Jedno oko bylo léčeno opakovanou intravitreální injekcí bevacizumabu, druhé oko kombinovanou terapií. Průměrně připadalo 3,27 injekce na jedno oko ve skupině léčené pouze bevacizumabem a 2,36 injekce na jedno oko ve skupině s kombinovanou terapií. Na konci sledování (průměrně 14,2 měsíce) byl zjištěn statisticky signifikantně nižší počet aplikací ve skupině s kombinovanou terapií. Naopak změny průměrné zrakové ostrosti v obou skupinách nebyly statisticky významné. Uvedení autoři potvrdili, že opakovaná intravitreální aplikace bevacizumabu může být dlouhodobě prospěšná v léčbě difuzního diabetického ME. Makulární mřížková koagulace provedená pouze jedenkrát za tři týdny po iniciální intravitreální injekci bevacizumabu může poskytnout delší interval stabilizace a snížit tak náklady na opakovanou léčbu. Použití bevacizumabu při léčbě diabetického ME a/nebo PDR je v České republice v režimu off-label.
Ranibizumab
Prvním registrovaným inhibitorem angiogenních růstových faktorů (VEGF, IGF-1) k redukci cé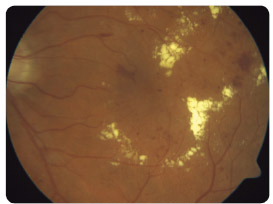 vního prosakování při léčbě diabetického ME je v současné době ranibizumab. Manousaridis a Talks (2012) se zabývali otázkou, zda může anti-VEGF terapie diabetického ME bevacizumabem či ranibizumabem potenciálně zhoršit makulární perfuzi a negativně ovlivnit zrakovou ostrost [20]. Anti-VEGF představuje účinnou terapii zlepšující zrakovou ostrost, avšak blokáda VEGF by mohla v některých případech poškodit cévní integritu. Na základě rozboru klinických dat prospektivních randomizovaných studií (BOLT study, RESOLVE study, DRCR net study, READ-2 study, RESTORE study) a dat nerandomizovaných studií dospěli tito autoři k závěru, že v dlouhodobém pohledu nelze vyloučit zhoršení makulární ischemie, a to zejména u očí s významnou ischemií před léčbou a po opakovaných nitroočních aplikacích. Navíc je u smíšené formy makulárního edému nesnadné určit podíl ischemie na pří
vního prosakování při léčbě diabetického ME je v současné době ranibizumab. Manousaridis a Talks (2012) se zabývali otázkou, zda může anti-VEGF terapie diabetického ME bevacizumabem či ranibizumabem potenciálně zhoršit makulární perfuzi a negativně ovlivnit zrakovou ostrost [20]. Anti-VEGF představuje účinnou terapii zlepšující zrakovou ostrost, avšak blokáda VEGF by mohla v některých případech poškodit cévní integritu. Na základě rozboru klinických dat prospektivních randomizovaných studií (BOLT study, RESOLVE study, DRCR net study, READ-2 study, RESTORE study) a dat nerandomizovaných studií dospěli tito autoři k závěru, že v dlouhodobém pohledu nelze vyloučit zhoršení makulární ischemie, a to zejména u očí s významnou ischemií před léčbou a po opakovaných nitroočních aplikacích. Navíc je u smíšené formy makulárního edému nesnadné určit podíl ischemie na pří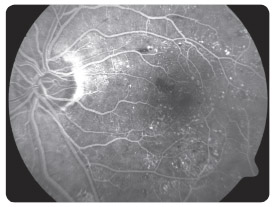 padném poklesu zrakové ostrosti. Proto byli pacienti s makulární ischemií ze studií vyloučeni v případě, že se v průběhu léčby prokázala neúčinnost anti-VEGF terapie. Bylo doporučeno, aby se u prolongované anti-VEGF léčby postupovalo individuálně a aby se v léčebném režimu hodnotila nejen výška ME, ale také fluoroangiograficky rozsah makulární ischemie u očí se smíšenou formou ME. Výsledky mezinárodních studií léčby ME podrobně shrnul ve své práci Studnička [21].
padném poklesu zrakové ostrosti. Proto byli pacienti s makulární ischemií ze studií vyloučeni v případě, že se v průběhu léčby prokázala neúčinnost anti-VEGF terapie. Bylo doporučeno, aby se u prolongované anti-VEGF léčby postupovalo individuálně a aby se v léčebném režimu hodnotila nejen výška ME, ale také fluoroangiograficky rozsah makulární ischemie u očí se smíšenou formou ME. Výsledky mezinárodních studií léčby ME podrobně shrnul ve své práci Studnička [21].
První klinické zkušenosti na naší Oční klinice (VFN v Praze a 1. LF UK) s intravitreální aplikací ranibizumabu v dávce 0,5 mg u 10 pacientů 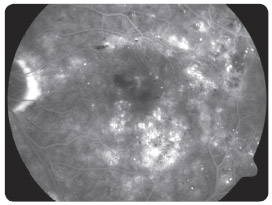 s diabetickým ME refrakterním na laserovou léčbu prokázaly, že po osmi měsících sledování se průměrná zraková ostrost zlepšila o 10,4 písmene na ETDRS optotypu, a dokonce u 4 pacientů o 15 a více písmen. ME se podle zjištění na OCT/SLO snížil průměrně o 110,5 μm. Naši pacienti, kteří byli zařazeni do prospektivní studie, splňovali indikační kritéria SPC. V souboru bylo 9 diabetiků 2. typu DM a jeden pacient 1. typu DM. Délka trvání ME nebyla delší než jeden rok, zraková ostrost byla v rozmezí 0,5–0,2, průměrně 0,32, výška ME byla vyšší než 300 μm, průměrně 465 μm, hladina glykovaného hemoglobinu (HbA1c) byla nižší než 60 mmol/mol, průměrně 51 mmol/mol. Vylučujícími kritérii pro zařazení pacientů do studie byly stav po iktu, TK vyšší než 140/90 mm Hg, diab
s diabetickým ME refrakterním na laserovou léčbu prokázaly, že po osmi měsících sledování se průměrná zraková ostrost zlepšila o 10,4 písmene na ETDRS optotypu, a dokonce u 4 pacientů o 15 a více písmen. ME se podle zjištění na OCT/SLO snížil průměrně o 110,5 μm. Naši pacienti, kteří byli zařazeni do prospektivní studie, splňovali indikační kritéria SPC. V souboru bylo 9 diabetiků 2. typu DM a jeden pacient 1. typu DM. Délka trvání ME nebyla delší než jeden rok, zraková ostrost byla v rozmezí 0,5–0,2, průměrně 0,32, výška ME byla vyšší než 300 μm, průměrně 465 μm, hladina glykovaného hemoglobinu (HbA1c) byla nižší než 60 mmol/mol, průměrně 51 mmol/mol. Vylučujícími kritérii pro zařazení pacientů do studie byly stav po iktu, TK vyšší než 140/90 mm Hg, diab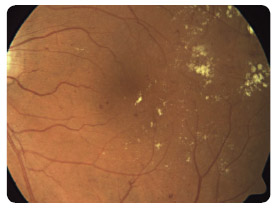 etická nefropatie s hladinou sérového kreatininu vyšší než 180 μmol/l a pokročilé komplikace PDR. Průměrný počet dávek v této studii byl 5,2 na jednoho pacienta během prvních osmi měsíců léčby. Bylo dodrženo schéma aplikací, tj. každý měsíc v dávce 0,5 mg ranibizumabu, dokud se zraková ostrost zlepšovala a/nebo stabilizovala a po tři po sobě jdoucí návštěvy byla stejná. Pokud nenastane zlepšení zrakové ostrosti po podání prvních tří injekcí, nedoporučuje se v léčbě pokračovat. Léčba je znovu zahájena, jestliže při kontrolách zjistíme, že se zraková ostrost opět zhoršila vlivem diabetického ME. Tato léčba je vždy omezena pouze na jedno oko a nedílnou součástí léčby ranibizumabem je compliance pacienta. V současné době léčíme na naší klinice ranibizumabem 40 pacientů (obr. 1 2a 2b 3 4 5).
etická nefropatie s hladinou sérového kreatininu vyšší než 180 μmol/l a pokročilé komplikace PDR. Průměrný počet dávek v této studii byl 5,2 na jednoho pacienta během prvních osmi měsíců léčby. Bylo dodrženo schéma aplikací, tj. každý měsíc v dávce 0,5 mg ranibizumabu, dokud se zraková ostrost zlepšovala a/nebo stabilizovala a po tři po sobě jdoucí návštěvy byla stejná. Pokud nenastane zlepšení zrakové ostrosti po podání prvních tří injekcí, nedoporučuje se v léčbě pokračovat. Léčba je znovu zahájena, jestliže při kontrolách zjistíme, že se zraková ostrost opět zhoršila vlivem diabetického ME. Tato léčba je vždy omezena pouze na jedno oko a nedílnou součástí léčby ranibizumabem je compliance pacienta. V současné době léčíme na naší klinice ranibizumabem 40 pacientů (obr. 1 2a 2b 3 4 5).
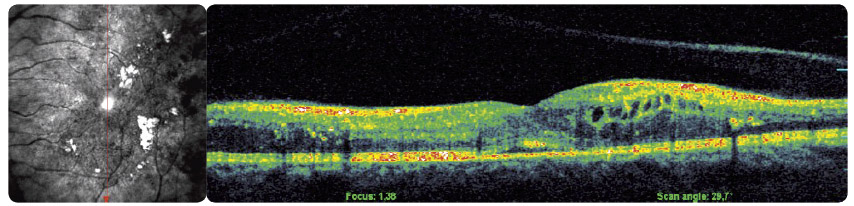 Intravitreální injekce inhibitorů VEGF jsou v současné době nejčastějšími výkony v oblasti sítnice a jejich aplikace do oka je nejčastěji prováděna v intervalu 4 až 8 týdnů. Nedávná experimentální práce Christoforidise a kol. (2013) se zabývala anatomick
Intravitreální injekce inhibitorů VEGF jsou v současné době nejčastějšími výkony v oblasti sítnice a jejich aplikace do oka je nejčastěji prováděna v intervalu 4 až 8 týdnů. Nedávná experimentální práce Christoforidise a kol. (2013) se zabývala anatomick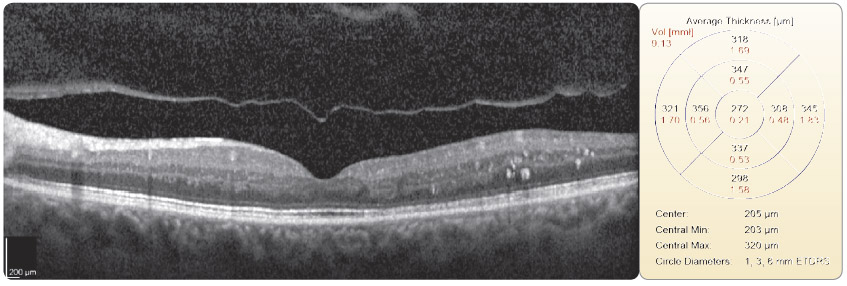 ými a farmakokinetickými vlastnostmi intravitreálně podaného bevacizumabu a ranibizumabu po vitrektomii a lensektomii [22]. Tito autoři zjistili, že u očí po provedené vitrektomii a lensektomii probíhá rychleji vyloučení intravitreálně podaného ranibizumabu než bevacizumabu a zároveň je tato eliminace v případě obou inhibitorů rychlejší než u neoperovaných očí. Proto je možné zvážit častější léčebný režim u těch vitrektomovaných očí, které nereagují na standardní léčbu.
ými a farmakokinetickými vlastnostmi intravitreálně podaného bevacizumabu a ranibizumabu po vitrektomii a lensektomii [22]. Tito autoři zjistili, že u očí po provedené vitrektomii a lensektomii probíhá rychleji vyloučení intravitreálně podaného ranibizumabu než bevacizumabu a zároveň je tato eliminace v případě obou inhibitorů rychlejší než u neoperovaných očí. Proto je možné zvážit častější léčebný režim u těch vitrektomovaných očí, které nereagují na standardní léčbu.
Aflibercept
Aflibercept je rekombinantně vytvořený fúzní protein, který obsahuje plně humánní solubilní VEGF receptor s unikátním mechanismem účinku. Jde o silný inhibitor angiogeneze, který váže VEGF-A pevněji než monoklonální protilátky. Blokuje všechny izoformy VEGF-A a placentární růstový faktor (placental growth factor, PIGF). Účinností a bezpečností intravitreálně aplikovaného afliberceptu u diabetického ME s postižením centra makuly se zabývaly dvě studie fáze III (VIVID-DME a VISTA-DME). Studie [23] zahrnovaly 406, respektive 466 pacientů s klinicky signifikantním diabetickým ME s postižením centra a se vstupní zrakovou ostrostí 20/40 až 20/320. Pacienti byli randomizováni do skupin v poměru 1 : 1 : 1. V těchto skupinách byl pacientům aplikován aflibercept v dávce 2 mg (2q4) každé čtyři týdny plus placebo-laser nebo aflibercept v dávce 2 mg každý osmý týden po 5 iniciálních měsíčních dávkách (2q8) a placebo-laser nebo laserová koagulace a intravitreální injekce placeba. Primárním cílem studií bylo definovat změny nejlépe korigované zrakové ostrosti v 52. týdnu oproti výchozímu stavu. Dalšími cíli bylo zjištění a) podílu pacientů, kteří získali 10 a více a 15 a více písmen na ETDRS optotypech v 52. týdnu oproti výchozímu stavu, b) podílu pacientů s dvoustupňovým a vyšším zlepšením podle ETDRS stupnice závažnosti diabetické retinopatie v 52. týdnu oproti výchozímu stavu, c) změn centrální tloušťky sítnice podle OCT v 52. týdnu oproti výchozímu stavu. Obě tyto studie prokázaly v 52. týdnu sledování významnou převahu nejlépe korigované zrakové ostrosti ve srovnání s laserovou koagulací, a to se stejnou účinností ve skupině 2q4 a 2q8. Intravitreálně aplikovaný aflibercept byl velmi dobře tolerován. Léčivý přípravek s účinnou látkou aflibercept je v současné době v ČR registrován pro léčbu vlhké formy věkem podmíněné makulární degenerace a pro poruchy zraku způsobené makulárním edémem v důsledku okluze centrální retinální žíly.
Biodegradabilní implantáty s obsahem kortikoidu
První rozsáhlá studie intravitreálního podání biodegradabilního implantátu s obsahem dexamethasonu byla provedena u pacientů s přetrvávajícím ME u DR, s žilními okluzemi, uveitidami a s Irvineovým-Gassovým syndromem. Kupperman (2007) oznámil výsledky léčby u 315 pacientů po šesti měsích sledování [24]. Primárním cílem bylo zlepšení zrakové ostrosti o 10 a více písmen na ETDRS optotypech 90 dnů po injekci. Tento autor zjistil velký podíl zlepšení u pacientů léčených intravitreálním implantátem 0,7 mg dexamethasonu ve srovnání s neléčenými kontrolami (35 % vs. 13 %, p < 0,001). Zlepšení nejlépe korigované zrakové ostrosti o 15 a více písmen bylo dosaženo u 18 % pacientů léčených dexamethasonovým implantátem, a to ve srovnání s 6 % neléčených kontrolních pacientů (p = 0,006). Nežádoucím účinkem této léčby však bylo (podle očekávání) zvýšení nitroočního tlaku. Po třech měsících sledování mělo 11 % léčených pacientů zvýšený nitrooční tlak o 10 mm Hg a více oproti 2 % neléčených pacientů. Ve všech studiích, při nichž byl použit dexamethasonový implantát v léčbě ME různé etiologie, představoval podíl zvýšení nitroočního tlaku o 10 mm Hg v porovnání s výchozím stavem 15–20 %. Toto zjištění je v určitém protikladu s tím, že přibližně 40 % pacientů s implantátem fluocinolon acetonidu podstoupilo antiglaukomovou filtrující operaci.
Léčba kortikoidními intravitreálními implantáty přináší kromě zvýšeného nitroočního tlaku ještě další potenciální komplikaci, a to vývoj katarakty. Obě uvedené komplikace se obvykle vyskytují, pokud léčba přesáhne období 6 měsíců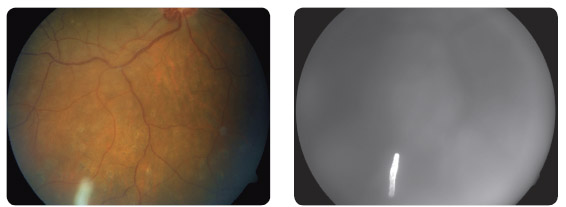 . Naopak studie Huron [25] prokázala, že podíl vyššího výskytu katarakty byl nesignifikantní u skupiny léčené 0,7 mg dexamethasonu v implantátu (11,8 %), a to ve srovnání s kontrolní skupinou (placebo, 5,3 %). V této studii byli pacienti léčeni intravitreálním implantátem dexamethasonu pro neinfekční intermediární nebo zadní uveitidu.
. Naopak studie Huron [25] prokázala, že podíl vyššího výskytu katarakty byl nesignifikantní u skupiny léčené 0,7 mg dexamethasonu v implantátu (11,8 %), a to ve srovnání s kontrolní skupinou (placebo, 5,3 %). V této studii byli pacienti léčeni intravitreálním implantátem dexamethasonu pro neinfekční intermediární nebo zadní uveitidu.
Biodegradabilní intravitreální implantát s obsahem 0,7 mg dexamethasonu je v České republice registrovaný pro pacienty s ME po uzávěru centrální sítnicové žíly (obr. 6a, 6b) nebo její větve a u pacientů se zadní uveitidou neinfekční etiologie, nikoliv však pro pacienty s diabetickým ME. V současné době dosud nejsou publikovány výsledky prací, které by u diabetického ME vyhodnotily dlouhodobou účinnost a bezpečnost po opakované intravitreální aplikaci implantátů s dexamethasonem. V ČR je nyní připravována multicentrická prospektivní, nerandomizovaná a nezaslepená studie léčby diabetického ME pomocí implantátu s obsahem 0,7 mg dexamethasonu, jejímž cílem je zjistit účinnost a bezpečnost této léčby.
Závěr
V léčbě očních komplikací DM zůstává standardem laserová koagulace sítnice u PDR a fokální/mřížková fotokoagulace u diabetického ME. Pokud tato léčba nevede ke stabilizaci sítnicového nálezu či ke zlepšení centrální zrakové ostrosti, je možné přistoupit k doplňující farmakologické léčbě intravitreálně aplikovanými inhibitory VEGF a intravitreálními implantáty kortikoidů. Farmakologická léčba inhibitory VEGF a kortikoidy představuje efektivní metodu zejména u očí, které nereagují na standardní terapii. Nejvhodnější léčba diabetického ME však dosud nebyla stanovena.
Poděkování: Za významnou pomoc při zpracování obrazové dokumentace děkujeme panu Ing. Martinovi Meliškovi.
Seznam použité literatury
- [1] Early Treatment Diabetic Retinopathy Study Research Group. Fundus photographic risk factors for progression of diabetic retinopathy. ETDRS report number 12. Ophthalmology 1991; 98: 823–833.
- [2] Vander JF, Duker JS, Benson WE, et al. Long-term stability and visual outcome after favorable inicial response of proliferative diabetic retinopathy to panretinal photocoagulation. Ophthalmology 1991; 98: 1575–1579.
- [3] Flynn HW Jr., Chew EY, Simons BD, et al. Pars plana vitrectomy in the Early Treatment Diabetic Retinopathy Study. ETDRS report number 17, Ophthalmology 1992; 99: 1351–1357.
- [4] Early Treatment Diabetic Retinopathy Study Research Group. Early photocoagulation for diabetic retinopathy. ETDRS report number 9, Ophthalmology 1991; 98: 766–785.
- [5] Zimmet P, Alberti KG, Shaw J. Global and societal implications of diabetes epidemic. Nature 2001; 414: 782–787.
- [6] Klein R, Moss SE, Klein BE, et al. The Wisconsin Epidemiologic study of diabetic retinopathy. XI. The incidence of macular edema. Ophthalmology 1989; 96: 1501–1510.
- [7] Klein R, Klein BE, Moss SE, et al. The Wisconsin Epide-miologic study of diabetic retinopathy. IV. Diabetic Macular edema. Ophthalmology 1984; 91: 1464–1474.
- [8] Yau JW, Rogers SL, Kawasaki R, et al. Global prevalence and major risk factors of diabetic retinopathy. Diabetes Care 2012; 35: 556–564.
- [9] International Diabetes Federation, IDF Atlas 5th edition, Brussels, Belgium. www.idf.org.2012
- [10] Early Treatment Diabetic Retinopathy Study Research Group. Photocoagulation for diabetic macular edema. ETDRS report number 1. Arch Ophthalmol 1985; 103: 1796–1806.
- [11] Mylonas G, Bolz M, Kriechbaum K, et al. Retinal architecture recovery after grid photocoagulation in diabetic macular edema observed in vivo by spectral domain optical coherence tomography. Retina 2013; 33: 717–725.
- [12] Cheung N, Mitchell P, Wong Y. Diabetic retinopathy. Lancet 2010; 376: 124–136.
- [13] Ferara N. Vascular endothelial growth factor: basic science and clinical progress. Endocr Rev 2004; 25: 581–611.
- [14] Adamis AP, Shima DT, Tolentino MJ, et al. Inhibition of vascular endothelial growth factor prevents retinal ischemia associated iris neovascularization in nonhuman primate. Arch Ophthalmol 1996; 114: 66–71.
- [15] Macugen Diabetic Retinopathy Study Group. Changes in retinal neovascularization after Pegaptanib (Macugen) therapy in daibetic Individuals. Opthalmol 2006; 113: 23–28.
- [16] Avery RL. Regression of retinal and iris neovascularization after intravitreal bevacizumab (Avastin) treatment. Retina 2006; 26: 352–354.
- [17] Velez-Montoya R, Fromow-Guerra J, Burgos O, et al. The effect of unilateral intravitreal bevacizumab (Avastin), in the treatment of diffuse bilateral diabetic macular edema. Retina 2009; 29: 20–26.
- [18] Cintra LP, Costa RA, Ribeiro JAS, et al. Intravitreal bevacizumab (Avastin) for persistent new vessels in diabetic retinopathy (IBEPE Study). Retina 2013; 33: 1109–1116.
- [19] Solaiman KAM, Diab Mohammad M, Dabour SA. Repeated intravitreal bevacizumab injection with and without macular grid photocoagulation for treatment of diffuse diabetic macular edema. Retina 2013; 33: 1623–1629.
- [20] Manousaridis K, Talks J. Macular ischaemia: a contraindication for anti-VEGF treatment in retinal vascular disease? Br J Ophthalmol 2012; 96: 179–184.
- [21] Studnička J. Indikace ranibizumabu v oftalmologii. Remedia 2012; 22: 341–344.
- [22] Christoforidis JB, Williams MM, Wang J, et al. Anatomic and pharmacokinetic properties of intravitreal bevacizumab and ranibizimab after vitrectomy and lensectomy. Retina 2013; 33: 946–952.
- [23] Schmidt-Erfurth U. Efficacy and safety of intravitreal aflibercept in DME: results of two phase III studies (VIVID-DME and VISTA-DME). Paper presented at: the 13th Euretina Congress; September 27, 2013; Hamburg, Germany. www.euretina.org
- [24] Kupperman BD, Blumenkranz MS, Haller JA for the Dexamethasone DDS Phase II Study Group. Randomized controlled study of an intravitreous dexamethasone drug delivery system in patients with persistent macular edema. Arch Ophthalmol 2007; 125: 309–317.
- [25] Lowder C, Belfort R, Lightman S for the Ozurdex Huron Study Group. Dexamethasone intravitreal implant for noninfectious intermediate or posterior uveitis. Arch Ophthalmol 2011; 129: 545–553.