Diabetické onemocnění ledvin a nová antidiabetika
Souhrn:
Kvapil M. Diabetické onemocnění ledvin a nová antidiabetika. Remedia 2019; 29: 205–212.
Nové třídy antidiabetik jsou nejen účinnou, ale také bezpečnou terapií diabetu. V klinických studiích s těmito léčivými látkami se prokázal jejich příznivý vliv na různé ukazatele renálního poškození. Agonisté receptoru pro glukagonu podobný peptid 1 (GLP‑1) dominantně kladně ovlivňují riziko vzniku a progrese albuminurie. Glifloziny (inhibitory SGLT2) zpomalují progresi poklesu odhadnuté glomerulární filtrace. První jednoznačný důkaz přinesla studie CREDENCE pro kanagliflozin. Všechna data však nasvědčují skutečnosti, že se jedná o tzv. efekt třídy. U velmi rizikové populace snižují také riziko terminálního renálního selhání.
Summary:
Kvapil M. Diabetic kidney disease and new antidibetics. Remedia 2019; 29: 205–212.
New classes of antidiabetics offer not only efficient but also safe therapy of diabetes. The beneficial influence on different markers of renal impairment was determined in clinical trials with these medicinal products. Glukagon‑like peptide 1 (GLP‑1) receptor agonists show prominent positive effect on the risk of development and progression of albuminuria. Gliflozins (SGLT2 inhibitors) slow down the progression of estimated glomerular filtration decrease. The body of evidence suggests that these are class‑specific effects. In high‑risk population, these drugs also decrease the risk of terminal renal failure.
Key words: diabetic kidney disease, diabetic nephropathy, GLP‑1 receptor agonists, SGLT2 inhibitors, estimated glomerular filtration, terminal renal failure, CREDENCE.
Úvod
Diabetická nefropatie (DN) byla dříve
označením pro specifické komplexní poškození ledvin u pacientů
trpících diabetes mellitus. Hlavní stadia DN popsal C. E. Mogensen
[1], základním sledovaným parametrem byla albuminurie, která
progredovala do proteinurie (obr. 1). Paralelně se vyvíjely změny glomerulární filtrace
(glomerular filtration rate, GFR). Typický vývoj onemocnění DN
byl popsán u pacientů s diabetem 1. typu (DM1T)
[2,3]. Situace se liší u pacientů s diabetem 2. typu
(DM2T). Intervence kardiovaskulárních rizikových faktorů snížily
mortalitu a morbiditu v důsledku těchto komplikací.
S prodloužením života diabetiků 2. typu díky primární
prevenci vzniku kardiovaskulárních komplikací se u této
skupiny pacientů prodloužila délka života s onemocněním.
Důsledkem bylo zvýšení počtu nemocných s terminálním
renálním selháním (end stage renal disease, ESRD).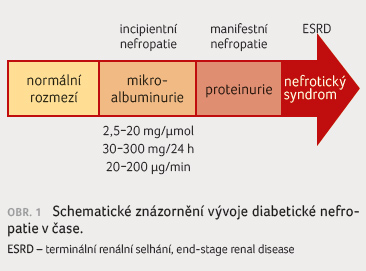
Pacienti s DM2T jsou z hlediska
možného vývoje poškození ledvin zatíženi větším počtem
rizikových faktorů v porovnání s diabetiky 1. typu.
U významného podílu nemocných se rozvíjí renální
insuficience z jiných příčin, než je pouze hyperglykemie
(obr. 2). Ukázalo se,
že typická DN, tedy poškození vznikající pouze v důsledku
hyperglykemie [4], je přítomna pouze u části nemocných.
Selhání ledvin vzniká často jako důsledek nefrosklerózy,
chronické intersticiální nefritidy, stenózy renálních arterií
a z dalších příčin [5]. V těchto případech je
zjištěna redukovaná GFR bez předchozí pozitivní
albuminurie/proteinurie [6]. Z klinického hlediska je důležitá
skutečnost, že v takovémto případě není rozhodující,
jaký má na nově zjištěném snížení GFR podíl DN,
protože vliv kompenzace diabetu na pokles GFR je minimální.
Těsná kompenzace diabetu prokazatelně snižuje riziko vzniku
mikroalbuminurie a riziko přechodu do manifestní DN,
na další progresi poškození ledvin však zásadní vliv nemá
[7]. Tato skutečnost byla racionálním důvodem zavedení termínu
diabetické onemocnění ledvin (diabetic kidney disease, DKD) [7].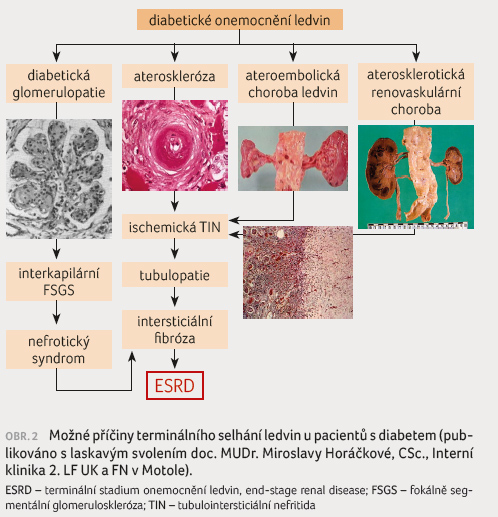
V primární i sekundární prevenci DKD má patrně hlavní roli ovlivnění krevního tlaku. Důsledná intervence hypertenze a použití farmak ze skupiny antihypertenziv ovlivňujících renin-angiotenzinový systém (inhibitory angiotenzin konvertujícího enzymu [ACE], sartany) sníží rychlost poklesu GFR ve stadiu manifestní DN (přítomná proteinurie) na polovinu, přesto nedovede progresi zastavit. V případě jiné etiologie, než je „čistá DN“, je možné GFR v některých případech stabilizovat léčebnou intervencí. Inhibitory ACE a sartany redukují riziko nově vzniklé DN a snižují progresi onemocnění v jakékoliv fázi (studie BENEDICT [8], RENAAL [9], IDNT [10]). Superponování antihypertenzního efektu této skupiny léčiv je vysvětlováno tím, že způsobují dilataci vas efferens glomerulu a snižují tak intraglomerulární tlak.
Přítomnost DN/DKD lze pro potřeby epidemiologického šetření hodnotit podle přítomnosti mikroalbuminurie, resp. proteinurie nebo podle vyšetření GFR. Za tímto účelem se do nedávné doby používala odhadnutá GFR (estimated GFR, eGFR) podle vzorce MDRD (Modification of Diet in Renal Disease) [5]. Takováto eGFR měla tu nevýhodu, že nadhodnocovala počet nemocných, kteří mají mírně redukovanou glomerulární filtraci, proto je v současnosti preferován výpočet podle vztahu CKD EPI (Chronic Kidney Disease Epidemiology Collaboration) [11].
Ačkoliv u pacientů s „čistou
DN“ koreluje vývoj albuminurie s eGFR,
u pacientů s DM2T nepodávají tato vyšetření stejnou
informaci. Podle citované práce [6] a jí předcházejícího
abstraktu [12], v nichž byl analyzován národní registr
pacientů s diabetem, mělo z 62 621 diabetiků 2. typu
renální insuficienci 9 308 pacientů (eGFR < 60 ml/min).
Z tohoto počtu bylo 58 % pacientů s normální
albuminurií. Až 60 % nemocných se podle této práce
dostává do stadia renální insuficience bez jakékoliv
možnosti intenzivního ovlivnění procesu, pokud by u pacientů
s diabetem 2. typu byla vyšetřována pouze albuminurie
nebo proteinurie bez stanovení koncentrace kreatininu v séru.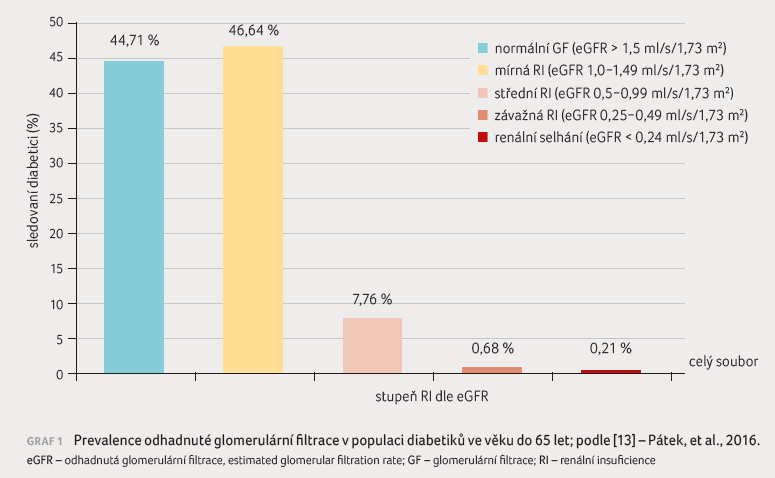
Tato data odpovídají údajům z České republiky [13]. V projektu IDN Micro bylo vyšetřeno 2 024 pacientů s diabetem ve věku do 65 let. Medián délky trvání diabetu byl šest let, medián sérové koncentrace kreatininu 74,9 μmol/l, medián hodnoty glykovaného hemoglobinu (HbA1c) 5,45 %; 1 888 pacientů mělo DM2T. Pozitivní mikroalbuminurie byla nalezena u 19,96 % vyšetřených a pozitivní proteinurie u 11,36 % osob. Glomerulární filtrace byla stanovena výpočtem (MDRD), rozložení je znázorněno v grafu 1. U osob s eGFR v rozmezí 0,5–0,99 ml/s/1,73 m2 byl nález mikroalbuminurie negativní v 63,23 % a proteinurie v 71,62 %, u osob s eGFR v rozmezí eGFR 0,25–0,49 ml/s/1,73 m2 byl negativní nález mikroalbuminurie v 15,38 % a proteinurie v 7,69 %.
Z klinického pohledu je důležitá vazba DKD ke kardiovaskulárnímu riziku, případně k mortalitě [14]. Kardiovaskulární riziko se zvyšuje s pokročilostí deteriorace GFR a se zvyšující se albuminurií/proteinurií [14]. Diabetické onemocnění ledvin je dnes u dlouhodobě dialyzovaných nemocných příčinou selhání ledvin ve 20–40 % a podle světových statistik je jednou z nejčastějších příčin selhání ledvin [15]. Orientační analýza databáze Všeobecné zdravotní pojišťovny ukazuje, že chronickou dialýzou je léčeno zhruba 1 700 pacientů s diabetem z celkového počtu 790 tisíc registrovaných. Intenzivní snaha najít farmakologickou intervenci, která by byla schopna alespoň zastavit progresi DKD, nebyla korunována úspěchem, vývoj řady molekul byl zastaven pro nežádoucí účinky, přesto jsou navrhovány nové terapeutické strategie vycházející z hlubších poznatků patofyziologie [16]. Léčba standardními antidiabetiky neovlivňovala riziko DKD jiným způsobem než zlepšením kompenzace. Toto se změnilo v souvislosti s novými třídami antidiabetik – agonisty receptoru pro GLP 1 (glucagon like peptide 1 receptor agonist, GLP 1RA) a glifloziny (inhibitory SGLT2).
Agonisté receptoru pro GLP 1
a diabetické onemocnění ledvin
Ke svému účinku využívají GLP 1RA aktivaci receptoru pro GLP 1. Jsou to účinná antidiabetika, jejichž zástupci se liší zejména farmakokinetikou, od ní pak odvozenou účinností. Jisté rozdíly se vyskytují i v incidenci nežádoucích účinků, ve vlivu na rychlost vyprazdňování žaludku a ve schopnosti ovlivnit pocit sytosti. Z hlediska ovlivnění DKD je významná i jejich schopnost lehce snížit krevní tlak, zvýšit natriurézu [17]. Průkaz ovlivnění kardiovaskulárního rizika je v současnosti nejsilnější u „zlatého standardu“ – liraglutidu [18]. Do studie LEADER bylo randomizováno 9 340 osob, medián sledování činil 3,84 roku. Primárním cílem studie bylo prokázat kardiovaskulární bezpečnost liraglutidu v porovnání s placebem. Liraglutid snížil riziko tzv. velkých kardiovaskulárních příhod (major adverse cardiac events, MACE) o 13 % (p = 0,01 pro superioritu). V aktivní větvi byla mírně lepší kompenzace diabetu a také mírně snížený systolický krevní tlak i tělesná hmotnost pacientů.
V klinické studii LEADER
liraglutid ovlivnil pozitivně tzv. renální výstup (renal
outcome), což je sdružený parametr, který hodnotí výskyt nově
vzniklé perzistující proteinurie, perzistující zdvojnásobení
koncentrace kreatininu v séru a rozvoj terminálního
selhání ledvin (ESRD) nebo úmrtí z renálních příčin.
Proti placebu snížil riziko tohoto kombinovaného ukazatele o 22 %
(p = 0,003).
Podrobnější rozbor však ukázal, že dominantním a statisticky
významným efektem bylo pouze ovlivnění rizika nově vzniklé
perzistující proteinurie. Liraglutid v této studii také
statisticky významně snížil – o 13 % –
riziko nově vzniklé perzistující mikroalbuminurie. Celkem
překvapivý je počet nově zjištěných případů (2 293 –
aktivní terapie, 2 498 – placebo). Grafické znázornění
(graf 2) vývoje
poměru albumin/kreatinin většinu těchto nálezů vysvětluje.
Glomerulární filtrace nebyla ovlivněna statisticky významně,
během studie došlo k jejímu pozvolnému poklesu v obou
větvích.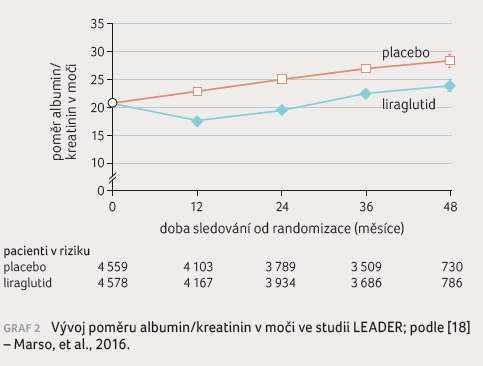
Autoři studie zdůrazňují, že ovlivnění rizika nově vzniklé proteinurie je klíčovým nálezem. S tím nelze než souhlasit, protože v případě proteinurie je další progrese do ESRD při intenzivní stávající terapii odhadována na přibližně 15 let. Vývoj albuminurie však ukazuje, že po prvotním zlepšení dochází k jejímu zvyšování souběžně v obou větvích (graf 2). Zdá se tedy, že liraglutid prostě posouvá křivku progrese albuminurie/proteinurie v čase o 3–4 roky, nicméně neovlivní její sklon. Toto vysvětlení by bylo v souladu s úvahami o komplexním vlivu liraglutidu, na němž se podílejí vlastnosti molekuly (resp. důsledky aktivace receptoru pro GLP 1) současně s ovlivněním kompenzace diabetu, krevního tlaku a hmotnosti. Nulový vliv na eGFR je v souladu s výsledky analýzy klinických studií s dulaglutidem [19] stejně jako se skutečností, že GLP 1RA neovlivňují renální hemodynamiku [20].
Gliptiny zvyšují koncentraci endogenního GLP 1 zpomalením jeho katabolismu prostřednictvím inhibice degradačního enzymu dipeptidyl peptidázy 4. Jejich vliv na DKD je diskutován spíše v teoretické rovině či na podkladě výsledků animálních studií [21]. I když v celkem malé, ale metodicky docela povedené studii snížilo podávání sitagliptinu albuminurii [22], ve studii TECOS hodnotící jeho kardiovaskulární bezpečnost [23] nebyl zaznamenán vliv na eGFR a vliv na albuminurii byl marginální (jednou z příčin takového výsledku bylo pouze 26 % pacientů, u kterých byla data dostupná).
Glifloziny a jejich vliv
na diabetické onemocnění ledvin
Glifloziny navozují osmotickou diurézu skrze inhibici zpětného transportu glukózy zprostředkovaného SGLT2 (sodium dependent glucose cotransporter 2, sodíko glukózový kotransportér 2), obrázek 3. Důsledkem je snížení glykemie, zvýšení hematokritu, mírně zvýšená natriuréza, snížení krevního tlaku a snížení hmotnosti, které je setrvalé po dobu léčby.
Empagliflozin překvapil výsledky ve studii kardiovaskulárně preventivní, kdy aktivní terapie vyvážila rizika spojená s intenzifikací terapie ve větvi placebové. Výsledkem byla statisticky významně nižší zejména mortalita kardiovaskulární (a to hlavně z příčiny srdečního selhání a náhlého úmrtí), dále nižší incidence hospitalizace pro srdeční selhání [24]. Celkem očekávaným důsledkem bylo zlepšení některých renálních ukazatelů. Očekávaným proto, že v populaci rizikových pacientů s nižším počtem manifestovaných srdečních selhání se nutně musí projevit nižší incidence deteriorace funkce ledvin z důvodu omezení rizika vzniku tzv. kardiorenálního syndromu [25,26].
Ponechme stranou kombinované cílové
ukazatele (endpointy) publikované v ex post navržené podrobné
analýze ovlivnění renálních parametrů v této studii. Pro
pochopení klinického významu je důležitý následující předem
navržený výstup: statisticky významně nižší pravděpodobnost
rozvoje prespecifikovaného kombinovaného endpointu incidentní nebo
zhoršené nefropatie o 39 % [27]. Tento ukazatel zahrnoval
progresi z mikroalbuminurie do proteinurie, zdvojnásobení
sérové koncentrace kreatininu, iniciaci eliminační metody nebo
úmrtí z renálních příčin. Aktivní léčba neovlivnila
riziko manifestace mikroalbuminurie (nový záchyt u 51,5 % pacientů
ze skupiny s aktivní léčbou vs. 51,2 % pacientů
z placebové skupiny). Významný rozdíl byl nalezen
v incidentní proteinurii (12,7 % ve skupině aktivní
léčby vs. 18,8 % ve skupině placeba). Rozdíl ve prospěch
terapie empagliflozinem byl také v parametru zdvojnásobení
sérové koncentrace kreatininu (44 %) a v iniciaci
eliminační metody (55 %). Za nejdůležitější nález však
považuji ovlivnění progresivního úbytku eGFR
(graf 3) –
po počátečním poklesu se rychlost poklesu v aktivní
větvi stabilizovala na průměrné hodnotě 0,18 ml/min ročně
proti progresivnímu poklesu v placebové větvi (1,67 ml/min
ročně).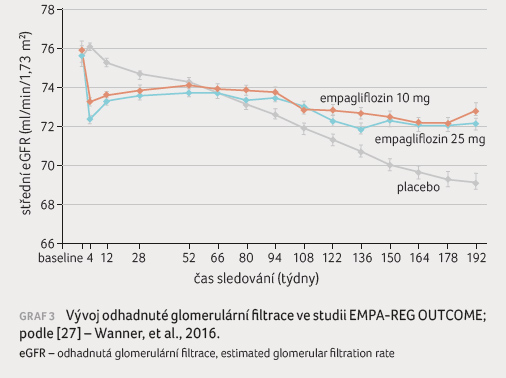
Protože výsledky nelze vysvětlit jako prostý důsledek léčby hyperglykemie, byl navržen jako vysvětlení již delší dobu známý a experimentálně ověřený mechanismus tzv. tubuloglomerulární zpětné vazby (interakce). Zjednodušené vysvětlení je následovné: zvýšení koncentrace sodíku ovlivňuje prostřednictvím buněk macula densa hemodynamiku glomerulu, vede ke snížení intraglomerulárního tlaku a ke snížení hyperfiltrace indukované hyperglykemií [28].
Mechanismus ovlivnění eGFR superponuje standardní terapii, což by mohlo být velmi významné pro prognózu nemocných. Otázkou, která není zcela vyřešena, je potenciál empagliflozinu (a ostatních gliflozinů) ovlivnit vývoj eGFR u pacientů s diabetem bez renálního onemocnění a bez zvýšeného kardiovaskulárního rizika definovaného v podstatě jako sekundární prevence. Je také třeba hodnotit a aplikovat výsledky ve vztahu k prospěchu u jednoho individuálního pacienta. Progrese v placebové větvi o přibližně 1,5 ml/min ročně proti aktivní terapii znamená, že u 60letého diabetika se vstupní hodnotou eGFR 60 ml/min dojde k poklesu na 30 ml/min v 80 letech. Souběžně s tím se zvyšuje riziko cévní katastrofy. Proto tento pacient velmi pravděpodobně nedospěje do fáze ESRD. To, co bychom potřebovali vědět, je, zdali snížení rychlosti progrese povede také ke snížení kardiovaskulárního rizika (odvozeného od progrese aterosklerózy, ne od rizika srdečního selhání). Většina autorů se shoduje na přímé patofyziologické vazbě mezi redukcí eGFR a poruchou kalciofosfátového metabolismu, která opět může indukovat progresi aterosklerózy.
Zajímavé by bylo hodnocení endpointů u subpopulace, která nevyvinula příznaky manifestního srdečního selhání. Pomohlo by to ozřejmit význam prevence srdečního selhání pro ovlivnění manifestace skutečně závažných renálních komplikací. Pro posouzení vztahu manifestace srdečního selhání a renálních komplikací by bylo příhodné publikování Kaplanových–Meierových křivek pravděpodobnosti pro jednotlivé komplikace samostatně. Na skutečnost, že by se takto mohli autoři přiblížit podrobnějšímu patofyziologickému pohledu na vztah aktivní terapie a změn terapie ve větvi placebové, upozorňuje právě sofistikovaně zvolený kombinovaný cílový ukazatel (navržený post hoc) s grafickým výstupem – renální endpoint v kombinaci s úmrtím z renálních příčin.
Další významné výsledky přinesla studie CANVAS [29]. Při dodržení přísných kritérií prespecifikované statistické analýzy (sekvenční testování hypotéz) sice nebyl vliv kanagliflozinu statisticky významný, ale v jednotlivých parametrech přinesla léčba kanagliflozinem významné snížení rizika progrese albuminurie o 27 % (bylo definováno jako progrese z normoalbuminurie do mikroalbuminurie, resp. z mikroalbuminurie do proteinurie, nebo progrese albuminurie o 30 %). Renální složený cílový ukazatel (40% redukce eGFR, nutnost eliminační metody nebo úmrtí z renálních příčin) byl snížen také významně – o 40 %. Změny v eGFR jsou překvapivé ‚ ale s jejich znalostí není překvapivý výsledek studie CREDENCE popsaný níže. V intervenované větvi se zlepšila eGFR v průměru o 0,33 ml/min ročně a ve větvi placebové se zhoršila průměrně o 1,13 ml/min ročně. Rozdíl byl statisticky významný ve všech podskupinách podle vstupní eGFR [30].
Aktuálně byla předčasně zastavena studie CREDENCE [31,32], která hodnotila právě vliv kanagliflozinu na progresi renálních parametrů, a to z důvodu jednoznačného průkazu přínosu terapie kanagliflozinem. Do studie byli zařazeni pacienti s nejvyšším rizikem – s kombinací pozitivní albuminurie a redukované eGFR. Protože výsledky této klinické studie jsou zásadní, věnuji jim samostatnou kapitolu.
Poslední v řadě velkých studií je DECLARE s dapagliflozinem [33]. Populace zahrnutá do této studie byla „nejméně“ riziková, protože v sekundární prevenci se nacházelo pouze 40,6 % osob. Prespecifikovaný kombinovaný renální ukazatel zahrnoval výskyt snížení eGFR o 40 % a více (pod hodnotu 60 ml/min), potřebu eliminační metody nebo úmrtí z renálních nebo kardiovaskulárních příčin. Léčba dapagliflozinem ovlivnila ve srovnání s placebem pozitivně tento endpoint – o 24 %. Pokud byla vzata v úvahu pouze úmrtí z renálních příčin, rozdíl představoval 47 % ve prospěch dapagliflozinu. V dostupných publikovaných výsledcích jsem nenalezl podrobnější údaje o vývoji eGFR ani o změnách albuminurie/proteinurie. Recentně byla publikována sekundární analýza ze studie EXSCEL, jejíž uspořádání je velmi blízké běžné praxi [34]. Vývoj eGFR při léčbě inhibitory SGLT2 byl pozitivní, zlepšení průměrně o 1,78 ml/min ročně, speciálně pak po podávání dapagliflozinu (zlepšení o 2,28 ml/min ročně). V poolované metaanalýze klinických studií s dapagliflozinem byl vývoj eGFR (zde počítané podle MDRD) obdobný, jako vidíme u jiných inhibitorů SGLT2 [35]. Po iniciálním poklesu se eGFR na konci 24. týdne vrací k původním hodnotám. Dapagliflozin také konzistentně kladně ovlivňuje albuminurii, ačkoliv individuální výsledek nelze běžnými postupy predikovat [36].
Zamotaná věda − úskalí
patofyziologické interpretace
Výsledky statistických analýz hovoří sice jednoznačně, ale stále jsou to průměry a pravděpodobnosti. Největší úspěchy medicíny jsou založeny na pochopení patofyziologie a definování ideálního postupu, který by u daného pacienta nebo u dané přesně patofyziologicky popsané poruchy ovlivnil právě patogenezi nemoci nebo komplikace. Prosté citace výsledků výše uvedených studií s glifloziny jsou důležité, ale pokusíme li se vhlédnout právě do patofyziologie mechanismu účinku, narazíme na řadu doposud nevysvětlitelných paradoxů. Naprostá většina popsaných účinků inhibitorů SGLT2 má charakter tzv. efektu třídy. Dominantně je zprostředkována osmotickou diurézou a natriurézou [37]. Proto jistě mohu ukázat interpretační obtíže modelově na empagliflozinu. Je to výhodné i z toho důvodu, že se k této molekule váže asi nejvíce vědeckých prací a komentářů [38].
Kladné ovlivnění mikroalbuminurie je zřejmě obecnou vlastností gliflozinů. Snížení krevního tlaku a ovlivnění intraglomerulárního tlaku by mělo stačit jako vysvětlení. Je proto překvapivé, že ve studii EMPA REG OUTCOME vliv empagliflozinu na riziko vývoje pozitivní albuminurie nebyl zjištěn, přestože by snížení krevního tlaku a intraglomerulární tenze mělo jednoznačně toto riziko zmenšit. Z podrobné analýzy je však zřejmé, že empagliflozin snížil riziko nově vzniklé proteinurie. Dalo by se očekávat, že při průkazu pozitivního vlivu na jeden parametr by mělo být dosaženo stejného vlivu i na druhý parametr, neboť ve své podstatě se jedná pouze o stejný proces v různé fázi vývoje.
Vliv empagliflozinu na intraglomerulární tlak je patrně zprostředkován zvýšenou natriurézou, jak bylo výše uvedeno. Vyšší koncentrace sodíku způsobuje cestou macula densa a juxtaglomerulárního aparátu konstrikci vas afferens. Inhibice SGLT2 zvyšuje natriurézu na rozdíl od hyperglykemií indukované osmotické diurézy, která naopak koncentraci sodíku v oblasti macula densa snižuje. Tento rozdíl může vysvětlit jednotlivé klinické důsledky glykosurie indukované hyperglykemií a inhibicí SGLT2. Nicméně glykosurický efekt je úměrný dávce empagliflozinu. Přesto byl vliv na renální komplikace při dávce 10 mg a 25 mg ve studii EMPA REG OUTCOME stejný [27]. Tato skutečnost nepodporuje vysvětlení opřené o tubuloglomerulární interakci jako jediné možné.
Pečlivý rozbor doložil následující nález. Diuretický efekt empagliflozinu se snižuje s eGFR a s dávkou. Ve skupinách rozdělených podle eGFR vzrostl hematokrit stejně po léčbě empagliflozinem, ve skupině s nižší eGFR bylo přidáno násobně více diuretik. V této skupině byl také trend k symptomatické dehydrataci na rozdíl od skupiny se zachovalou eGFR. Současně primární endpoint byl shodný v obou skupinách. Ve skupině s nižší eGFR bylo více pacientů s anamnézou srdečního selhání. Pokud je stejný efekt obou dávek (viz grafy v originální práci), pak to znamená, že nemůže být důsledkem navozené diurézy. Je třeba hledat vysvětlení, proč zvýšený obsah sodíku po podávání furosemidu [39] neovlivňuje stejným mechanismem cestou macula densa aferentní arteriolu stejně jako empagliflozin, jestliže furosemid taktéž zvyšuje množství sodíku, které se dostává do distálního tubulu. Není vyloučeno, že rozdíl v klinickém efektu je podmíněn vlivem na objem intracelulární tekutiny [40]. Pokud by bylo toto vysvětlení plauzibilní, jsou inhibitory SGLT2 těmi pravými diuretiky, která potřebujeme – zvýší diurézu, sníží volum extravazální tekutiny (se všemi pozitivními, ale i rizikovými důsledky) a zachovají tkáně „nevysušené“. Jsou to inhibitory SGLT2, na které medicína čekala.
Ve skupině s placebem byla častěji použita klasická diuretika. Použití diuretik mohlo vést frekventněji, stejně jako to vidíme v klinické praxi, v kombinaci s inhibitory ACE nebo sartany k selhání ledvin. Proto by měla být provedena podrobná analýza vztahu použití diuretik (dávky) k primárnímu endpointu stejně jako vztahu manifestovaného srdečního selhání k tomuto primárnímu cílovému ukazateli.
Přestože mechanismus účinku všech tří molekul je prakticky stejný (kanagliflozin navíc inhibuje v dávce 300 mg denně i SGLT1), výsledky citovaných studií nejsou zcela jednotné. O významu individuálního vlivu molekul se rádo spekuluje, osobně soudím, že nejednotnost vyplývá z různé charakteristiky intervenovaných souborů a z trochu jinak navržených cílových ukazatelů. Jestliže přijmeme představu, že DKD je heterogenní onemocnění z hlediska etiopatogeneze, lze předpokládat, že u různých „podtypů“ se manifestuje přínos gliflozinů různým způsobem. Společný budou mít vliv skrze redukci rizika srdečního selhání při intenzifikaci terapie, různý bude účinek prostřednictvím výše zmíněného mechanismu tubuloglomerulární interakce (zpětné vazby) u pacientů s glomerulární hyperfiltrací (a mikroalbuminurií) a u nemocných s primární prostou nefrosklerózou. Křivky popisující renální endpointy (bez zahrnutí parametrů derivovaných z rizika srdečního selhání) se většinou diferencují během začátku sledování a následně pokračují souběžně. Z klinického pohledu tedy vidím největší přínos v redukci rychlosti poklesu eGFR se všemi kladnými důsledky.
Závěrem této kapitoly bych rád zdůraznil, že při hodnocení eGFR se vychází ze sérové koncentrace kreatininu. Jeho hodnota je ovlivněna nejen vlastní funkcí ledvin, ale také příjmem zejména masa a hmotou vlastní svaloviny, taktéž hemodynamikou krevního oběhu. Nenašel jsem nikde analýzu, která by hodnotila případný vliv redukce hmotnosti (celkové i tzv. lean body mass) na eGFR u pacientů s diabetem, i když některé práce upozorňují, že vliv na výpočet odhadnuté glomerulární filtrace ze sérové koncentrace kreatininu nemusí být zanedbatelný.
CREDENCE: první studie uspořádaná pro zhodnocení vlivu gliflozinů (kanagliflozinu) na renální parametry
CREDENCE je dvojitě zaslepená prospektivní klinická studie, do níž bylo randomizováno 4 401 osob s diabetickým onemocněním ledvin, které bylo definováno jako eGFR 30–60 ml/min/1,73 m2 a současně přítomnost významné albuminurie vyšší než 300 mg/g kreatininu [41]. Důležitou skutečností byla podmínka zavedené léčby s látkami ovlivňujícími systém renin angiotenzin. Primární konečný ukazatel byl kombinovaný, zahrnoval zdvojnásobení koncentrace kreatininu, nutnost užití eliminační metody a úmrtí z renálních nebo kardiovaskulárních příčin.
Jako aktivní terapie byl použit
kanagliflozin v dávce 100 mg denně (dávka v České
republice plně hrazená ze zdravotního pojištění, maximální
dávka podle SPC je 300 mg denně). Primární ukazatel byl doložen
u 11 % pacientů ze skupiny aktivně léčených
oproti 15,5 % pacientů ze skupiny s placebem (graf 4). Kanagliflozin snížil relativní riziko o 30 %
na hladině významnosti p < 0,00001.
V aktivně léčené větvi byla zaznamenána mortalita nižší
o 17 %, také o 20 % nižší výskyt klasického
„kardiovaskulárního“ sdruženého ukazatele (infarkt myokardu,
cévní mozková příhoda a úmrtí z kardiovaskulárních
příčin, p = 0,01).
Podobně významně nižší – o 39 % – byl
počet hospitalizací pro srdeční selhání.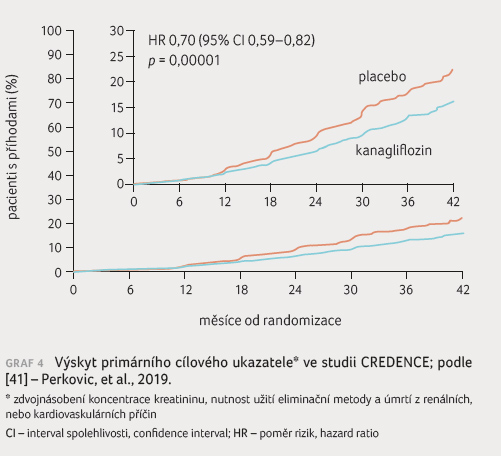
Z hlediska hodnocení významu studie však považuji za nejdůležitější nález zpomalení deteriorace eGFR. Rychlost poklesu se snížila odhadem téměř o polovinu. Tento nález tak velmi dobře koreluje s výše citovanými výsledky studie CANVAS.
Populace zavzatá do studie byla zatížena vysokým kardiovaskulárním rizikem (vyplývá to z přítomnosti proteinurie a současně redukované eGFR). Prespecifikován byl požadavek na zahrnutí nejméně 60 % pacientů s eGFR < 60 ml/min. Téměř 50 % pacientů mělo v anamnéze srdeční selhání a něco přes 50 % pacientů se nacházelo v „sekundární“ prevenci.
Výsledky studie CREDENCE budou patrně představovat přelom v možnostech reálné klinické intervence, která zpomalí progresi úbytku renálních funkcí.
Závěr
Tato práce hodnotí zejména možnosti ovlivnění klinicky významných parametrů DKD, které jsou spojeny s prognózou diabetiků 2. typu. Proto opomíjí podrobný popis etiopatogeneze DKD i podrobný rozbor standardní nefarmakologické a farmakologické intervence. Pro zařazení do kontextu klinické medicíny je třeba si uvědomit, že většina prací, které jsou citovány a které prokazují pozitivní ovlivnění parametrů DKD, byla realizována u populace s velmi vysokým kardiovaskulárním rizikem a s relativně nízkým věkem. Takových osob je v populaci diabetiků České republiky okolo 15–20 %, protože medián věku celé diabetické populace činí přibližně 68–69 let. Při zohlednění standardně udávané dynamiky progrese redukce glomerulární filtrace uplyne od prvního výskytu pozitivní albuminurie (pokud je příznakem DKD) do manifestace ESRD okolo 35 let. Albuminurie/proteinurie je zejména příznakem zvýšeného kardiovaskulárního rizika, jsou k dispozici pouze omezené znalosti o tom, zdali vlastní intervence tohoto parametru ovlivní kardiovaskulární riziko. Z etického hlediska ani takováto studie v podobě dvojitě zaslepené nemůže být provedena. U řady pacientů jsou z důvodu rozdílné etiopatogeneze pokles eGFR a progrese albuminurie/proteinurie na sobě nezávislými jevy.
U pacientů v sekundární prevenci (s vysokým kardiovaskulárním rizikem) trvá diabetes většinou delší dobu, pacienti nejsou uspokojivě kompenzováni, proto je snížena rezerva kardiální (z důvodu ischemické choroby srdeční, vyšší prevalence fibrilace síní, diastolické dysfunkce a diabetické kardiomyopatie). Podléčeni diuretiky tito nemocní snadno manifestují symptomatické kardiální selhávání. Z významné části je indukováno intenzifikací terapie inzulinem, která sníží osmotickou diurézu skrze snížení glykosurie, což vede k následné retenci tekutin. Inzulin má také natrium retenční účinek [42]. Proto by mělo být v popředí zájmu intenzivní studium kardiorenální interakce (která se odehrává nejen na úrovni hemodynamické, ale i humorální a dalších). Příznivý efekt inhibitorů SGLT2 inicioval další studie a výzkum s cílem přenést pozitivní efekty této terapie i na nediabetiky. Výsledky studie CREDENCE jsou příslibem, že tato skupina bude představovat první farmakologickou intervenci, která po několika desetiletích skutečně pomůže snížit riziko progrese do terminálního stadia DKD.
Prozatím je třeba plně využívat stávajících možností prevence – což se v České republice celkem daří. Podle předběžných analýz dat z diabetologického registru (Národní diabetologický informační systém, NDIS) je léčeno přípravky ovlivňujícími systém renin-angiotenzin téměř 80 % diabetiků. Horší je to s hypolipidemickou terapií – prevalence předpisu těchto léčivých látek nedosahuje ani 60 %.
Nové skupiny antidiabetik přinášejí nové možnosti terapie diabetu, a to nejen ve smyslu snížení glykemie, resp. zlepšení kompenzace. Přesto je třeba, soudím, stále zdůrazňovat patofyziologický pohled na mechanismus účinku těchto látek. Protože indikován má být pouze ten lék, který není zbytečný. Z tohoto pohledu je třeba rozlišovat indikaci antidiabetik jako intervenci snižující glykemii, nebo jako intervenci, která u vysoce rizikových pacientů ovlivní incidenci komplikací srdečně cévních, případně renálních, jež vyplývají z jejich nemoci.
Seznam použité literatury
- [1] Mogensen CE, Christensen CK, Vittinghus E. The stages in diabetic renal disease. With emphasis on the stage of incipient diabetic nephropathy. Diabetes 1983; 32(Suppl 2): 64–78.
- [2] Bakris GL. Recognition, pathogenesis, and treatment of different stages of nephropathy in patients with type 2 diabetes mellitus. Mayo Clin Proc 2011; 86: 444–456.
- [3] Warram JH, Scott LJ, Hanna LS, et al. Progression of microalbuminuria to proteinuria in type 1 diabetes: nonlinear relationship with hyperglycemia. Diabetes 2000; 49: 94–100.
- [4] Kvapil M. Význam farmakologické intervence diabetické nefropatie ve vztahu k epidemiologickým důsledkům. Farmakoterapie 2013; 9: 661–664.
- [5] Ahn SH, Susztak K. Getting a notch closer to understanding diabetic kidney disease. Diabetes 2010; 59: 1865–1857.
- [6] Svensson MK, Cederholm J, Eliasson B, et al.; Swedish National Diabetes Register. Albuminuria and renal function as predictors of cardiovascular events and mortality in a general population of patients with type 2 diabetes: a nationwide observational study from the Swedish National Diabetes Register. Diab Vasc Dis Res 2013; 10: 520–529.
- [7] Ruggenenti P, Fassi A, Parvanova Ilieva A, et al.; for the Bergamo Nephrologic Diabetes Complications Trial (BENEDICT) Investigators. Preventing Microalbuminuria in Type 2 Diabetes. N Engl J Med 2004; 351: 1941–1951.
- [8] Ruggenenti P, Iliev I, Costa GM, et al.; Bergamo Nephrologic Diabetes Complications Trial Study Group. Preventing left ventricular hypertrophy by ACE inhibition in hypertensive patients with type 2 diabetes: a prespecified analysis of the Bergamo Nephrologic Diabetes Complications Trial (BENEDICT). Diabetes Care 2008; 31: 1629–1634.
- [9] Brenner BM, Cooper ME, de Zeeuw D, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345: 861–869.
- [10] Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotective effect of the angiotensin‑receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345: 851–860.
- [11] Silveiro SP, Araújo GN, Ferreira MN, et al. Chronic Kidney Disease Epidemiology Collaboration (CKD‑EPI) equation pronouncedly underestimates glomerular filtration rate in type 2 diabetes. Diabetes Care 2011; 34: 2353–2355.
- [12] Svensson MK, Cederholm J, Eliasson B, et al.; Swedish National Diabetes Register. Albuminuria and renal function as predictors of cardiovascular events and mortality in a general population of patients with type 2 diabetes: a nationwide observational study from the Swedish National Diabetes Register. Diabetologia 2010; 53(Suppl 1): S473.
- [13] Pátek O, Horáčková M, Kvapil M. Prevalence of microalbuminuria in patients with diabetes mellitus in the Czech Republic: Project IDN‑Micro. Vnitr Lek 2016; 62(Suppl 6): 21–24.
- [14] McCullough PA, Bakris GL, Owen WF Jr, et al. Slowing the progression of diabetic nephropathy and its cardiovascular consequences. Am Heart J 2004; 148: 243–251.
- [15] de Boer IH, Rue TC, Hall IN, et al. Temporal trends in the prevalence of diabetic kidney disease in the United States. JAMA 2011; 305: 2532–2539.
- [16] Sharma D, Bhattacharya P, Kalia K, Tiwari V. Diabetic nephropathy: New insights into established therapeutic paradigms and novel molecular targets. Diabetes Res Clin Pract 2017; 128: 91–108.
- [17] Filippatos TD, Elisaf MS. Effects of glucagon‑like peptide‑1 receptor agonists on renal function. World J Diabetes 2013; 4: 190–201.
- [18] Marso SP, Daniels GH, Brown‑Frandsen K, et al.; LEADER Steering Committee; LEADER Trial Investigators. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375: 311–322.
- [19] Tuttle KR, McKinney TD, Davidson JA, et al. Effects of once‑weekly dulaglutide on kidney function in patients with type 2 diabetes in phase II and III clinical trials. Diabetes Obes Metab 2017; 19: 436–441.
- [20] Skov J, Pedersen M, Holst JJ, et al. Short‑term effects of liraglutide on kidney function and vasoactive hormones in type 2 diabetes: a randomized clinical trial. Diabetes Obes Metab 2016; 18: 581–589.
- [21] Cornel JH, Bakris GL, Stevens SR, et al.; TECOS Study Group. Effect of Sitagliptin on Kidney Function and Respective Cardiovascular Outcomes in Type 2 Diabetes: Outcomes From TECOS. Diabetes Care 2016; 39: 2304–2310.
- [22] Mori H, Okada Y, Arao T, Tanaka Y. Sitagliptin improves albuminuria in patients with type 2 diabetes mellitus. J Diabetes Investig 2014; 5: 313–319.
- [23] Mega C, Teixeira‑de‑Lemos E, Fernandes R, Reis F. Renoprotective Effects of the Dipeptidyl Peptidase‑4 Inhibitor Sitagliptin: A Review in Type 2 Diabetes. J Diabetes Res 2017; 2017: 5164292.
- [24] Zinman B, Wanner C, Lachin JM, et al.; EMPA‑REG OUTCOME Investigators. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015; 373: 2117–2228.
- [25] Ronco C, Di Lullo L. Cardiorenal syndrome. Heart Fail Clin 2014; 10: 251–280.
- [26] Takahama H, Kitakaze M. Pathophysiology of cardiorenal syndrome in patients with heart failure: potential therapeutic targets. Am J Physiol Heart Circ Physiol 2017; 313: H715–H721.
- [27] Wanner C, Inzucchi SE, Lachin JM, et al.; EMPA‑REG OUTCOME Investigators. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016; 375: 323–334.
- [28] Wanner C. EMPA‑REG OUTCOME: The Nephrologistʼs Point of View. Am J Cardiol 2017; 120(1S): S59–S67.
- [29] Neal B, Perkovic V, Mahaffey KW, et al.; CANVAS Program Collaborative Group. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med 2017; 377: 644–657.
- [30] Neuen BL, Ohkuma T, Neal B, et al. Cardiovascular and Renal Outcomes With Canagliflozin According to Baseline Kidney Function. Circulation 2018; 138: 1537–1550.
- [31] Jardine MJ, Mahaffey KW, Neal B, et al.; CREDENCE study investigators. The Canagliflozin and Renal Endpoints in Diabetes with Established Nephropathy Clinical Evaluation (CREDENCE) Study Rationale, Design, and Baseline Characteristics. Am J Nephrol 2017; 46: 462–472.
- [32] https://www.medscape.com/viewarticle/899424
- [33] Wiviott SD, Raz I, Bonaca MP, et al.; DECLARE–TIMI 58 Investigators. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2018 Nov 10. doi: 10.1056/NEJMoa1812389.
- [34] Clegg LE, Heerspink HJL, Penland RC, et al. Reduction of Cardiovascular Risk and Improved Estimated Glomerular Filtration Rate by SGLT2 Inhibitors, Including Dapagliflozin, Is Consistent Across the Class: An Analysis of the Placebo Arm of EXSCEL. Diabetes Care 2019; 42: 318–326.
- [35] Heerspink HJL, Sjöström CD, Inzucchi SE, et al. Dapagliflozin in patients with type 2 diabetes mellitus: A pooled analysis of safety data from phase IIb/III clinical trials. Diabetes Obes Metab 2018; 20: 620–628.
- [36] Stefansson BV, Sartipy P. Reduction in albuminuria with dapagliflozin cannot be predicted by baseline clinical characteristics or changes in most other risk markers. Diabetes Obes Metab 2018 Nov 9. doi: 10.1111/dom.13579.
- [37] Inzucchi SE, Zinman B, Fitchett D, et al. How Does Empagliflozin Reduce Cardiovascular Mortality? Insights From a Mediation Analysis of the EMPA‑REG OUTCOME Trial. Diabetes Care 2018; 41: 356–363.
- [38] Kvapil M. Renoprotektivní účinek empagliflozinu. Farmakoterapie 2016; 12: 597–598.
- [39] Edwards BR, Baer PG, Sutton RA, Dirks JH. Micropuncture study of diuretik effects on sodium and calcium reabsorption in the dog nephron. J Clin Invest 1973; 52: 2418–2427.
- [40] Ohara K, Masuda T, Murakami T, et al. Effects of the SGLT2 inhibitor dapagliflozin on fluid distribution: A comparison study with furosemide and tolvaptan. Nephrology (Carlton) 2018 Dec 22. doi: 10.1111/nep.13552
- [41] Perkovic V, Jardine MJ, Neal B, et al.; CREDENCE Trial Investigators. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med 2019; doi: 10.1056/NEJMoa1811744.
- [42] DeFronzo RA. The effect of insulin on renal sodium metabolism. A review with clinical implications. Diabetologia 1981; 21: 165–171.