Diagnostika a terapie infekce u pacientů se syndromem diabetické nohy
Infekční komplikace syndromu diabetické nohy jsou z pohledu klinika závažné, jelikož zvyšují počet amputací dolních končetin, počet hospitalizací, prodlužují jejich délku a stupňují náklady na léčbu. Infekci je třeba rychle a správně diagnostikovat a včasně a agresivně zahájit její terapii. Ta spočívá nejen v kontrole kompenzace diabetu a stavu nutrice nemocného, ale i v adekvátní lokální terapii, správné volbě odlehčení dolní končetiny zamezující progresi šíření infekce, v kontrole a eventuálním zlepšení cévního zásobení dolní končetiny, a zejména v podání antibiotické terapie, která může být zprvu empirická, ale poté by měla být při nedostatečné odpovědi cílena na kauzální agens. Antibiotická léčba musí být časná a agresivní, tedy aplikovaná v dostatečných dávkách po dostatečně dlouhou dobu. Tímto způsobem lze zvládnout většinu infekčních komplikací syndromu diabetické nohy a zamezit tak amputacím dolních končetin nebo sepsi ohrožující život pacienta.
Úvod
Nejvíce obávanou komplikací syndromu diabetické nohy (SDN) je infekce. Infekci v rámci SDN definujeme jako invazi a multiplikaci mikroorganismů v tkáních nohy [1] s následnou destrukcí tkání nohy (měkkých tkání, kostí) [2]. K rozvoji infekce predisponují pacienta hluboká a/nebo dlouhotrvající nebo recidivující ulcerace, imunologické abnormality (diabetes mellitus patří mezi sekundární imunodeficitní onemocnění) [3], užívání léčiv modulujících imunitní systém (kortikoidy, imunosupresiva), chronická renální insuficience či renální selhání a orgánová transplantace.Infekční komplikace v rámci SDN jsou často spojeny se zvýšenou morbiditou a mortalitou nemocných [4] a jsou častou příčinou hospitalizací těchto pacientů [5]. Navíc mnohdy stojí za vyšším výskytem amputací dolních končetin. Diabetici mají 8–24násobně vyšší pravděpodobnost amputace dolní končetiny oproti populaci bez diabetu mellitu [6]. Infekce a SDN bývají v rozvinutých zemích příčinou až 60 % všech amputací dolních končetin [1].
Také je prokázáno, že infekce SDN má ekonomické dopady nejen na pacienta samotného, ale i na zdravotní systém [7]. Vzhledem k infekci jsou pacienti často imobilizovaní, s amputacemi invalidizováni, což snižuje možnost jejich zaměstnávání a zhoršuje jejich sociální podmínky. Zdravotní systém je zatěžován častějšími kontrolami pacientů s infekcí ve zdravotnických zařízeních, antibiotickou (ATB) léčbou, vyššími počty a delšími průběhy hospitalizací, používáním různých nových prostředků hojení ran, které jsou schopny potlačit infekci (nové typy krytí obsahující antibakteriální látky, nová antiseptika, léčba podtlakem, larvami, ozonem apod.), předepisováním pomůcek určených k odlehčení a stabilizaci dolní končetiny, které mají zamezit další progresi infekce. Ze studie Eurodiale, která hodnotila a srovnávala úroveň terapie SDN v různých centrech po celé Evropě, vyplynulo, že výskyt infekce téměř zdvojnásobuje celkové náklady na léčbu pacientů s diabetickými ulceracemi. Pokud se vyskytuje současně infekce i ischemie, jsou tyto náklady téměř čtyřnásobné [7]. Nejnákladnější položky na seznamu výdajů byly spojeny s hospitalizacemi nemocných a aplikací ATB.
Je třeba zdůraznit, že při adekvátní a včasné léčbě infekce jsou náklady minimální, při nedostatečné a pozdní léčbě pak výrazně stoupají. V naší republice jsou náklady na hospitalizace pacientů se SDN vysoké a jejich úhrada DRG (Diagnosis Related Group) systémem je nedostatečná, což demonstrovala studie uskutečněná v našem centru [8], do níž byli zařazeni pacienti hospitalizovaní pro různé diagnózy v rámci SDN. Hospitalizace pacientů přijatých pro flegmonu a léčených konzervativně byly ztrátové – nemocní byli léčeni v průměru 11 dní, dle DRG systému dosahovala jejich relativní váha (RV) hodnoty v průměru 0,9, jejich výnosy činily přibližně 31 tisíc, ale náklady na jejich hospitalizace dosáhly více než 80 tisíc Kč [8].
Diagnóza infekce u pacientů se SDN
Infekce je u pacientů s diabetem zrádná hned z několika důvodů. První problém spatřujeme v diagnostice infekce, kdy se i při poměrně nenápadné lokální symptomatologii může jednat o závažnou infekci zhoršující prognózu hojení ran, nebo doko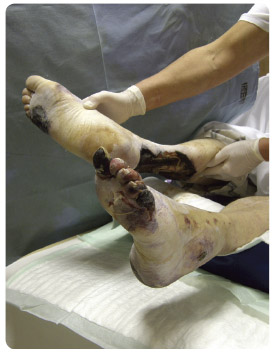 nce ohrožující dolní končetinu. Mezi lokální projevy infekce řadíme flegmonu, lokální otok, regionálně zvýšenou teplotu, bolestivost, zvýšenou sekreci/zápach z rány, hlubokou ulceraci, progresi lokálního nálezu [9]. Flegmona je vždy projevem hluboké infekce, častá je její záměna za erysipel. Streptokoková infekce je přitom u pacientů se SDN vzácná. Systémové projevy infekce nemusejí být i přes přítomnost klinicky závažné infekce plně manifestované (teplota, zvýšené laboratorní známky zánětu [9, 10]). Pokud se však objeví, jedná se mnohdy již o projevy sepse spojené často s ohrožením pacienta na životě (obr. 1). I malé zvýšení hodnot zánětlivých markerů nebo subfebrilie mohou být příznaky počínající sepse.
nce ohrožující dolní končetinu. Mezi lokální projevy infekce řadíme flegmonu, lokální otok, regionálně zvýšenou teplotu, bolestivost, zvýšenou sekreci/zápach z rány, hlubokou ulceraci, progresi lokálního nálezu [9]. Flegmona je vždy projevem hluboké infekce, častá je její záměna za erysipel. Streptokoková infekce je přitom u pacientů se SDN vzácná. Systémové projevy infekce nemusejí být i přes přítomnost klinicky závažné infekce plně manifestované (teplota, zvýšené laboratorní známky zánětu [9, 10]). Pokud se však objeví, jedná se mnohdy již o projevy sepse spojené často s ohrožením pacienta na životě (obr. 1). I malé zvýšení hodnot zánětlivých markerů nebo subfebrilie mohou být příznaky počínající sepse.
Diagnostiku infekce provádíme dle klinických příznaků (viz výše), laboratorních odběrů (zánětlivé parametry včetně CRP – C-reaktivní protein a/nebo hladina prokalcitoninu), dle zobrazovacích metod (např. RTG, CT – computed tomography, MR – magnetic resonance nebo izotopové vyšetření) a podle výsledků kultivací vzorků odebíraných z rány po debridementu, při chirurgickém výkonu, z kostí (kostní biopsie/odběr z resekátu), eventuálně z hemokultur. Kauzálními agens bývají nejčastěji:
- u mírných povrchových infekcí – obvykle grampozitivní koky (zejména S. aureus);
- chronické, hlubší a závažnější infekce jsou často polymikrobiální (směs s převahou gramnegativních a anaerobních bakterií [11, 12]);
- u osteomyelitid (OM) – většinou grampozitivní patogeny [13], nejsou ale vyloučeny ani patogeny gramnegativní.
V rámci SDN je nutné u diabetiků myslet i na jiná, méně typická kauzální agens včetně mykotických. Jedna z našich prací prokázala přítomnost mykotických patogenů až v 28 % chronických infikovaných ulcerací [14].
Největší terapeutické problémy míváme s infekcemi způsobenými rezistentními kmeny – např. s rezistentnějšími grampozitivními patogeny u transplantovaných (S. aureus, Enterococcus sp.) a s gramnegativními patogeny u dialyzovaných (Pseudomonas sp. [15]) pacientů. Dalšími problematickými bakteriemi z hlediska klinického průběhu a hojení ran jsou Klebsiella sp. či Escherichia coli ESBL+ (Extended Spectrum Beta-Lactamase), MRSA (methicillin rezistentní S. aureus), multirezistentní pseudomonády a výjimečně VAN (vankomycin)-rezistentní enterokoky.
Na základě sympto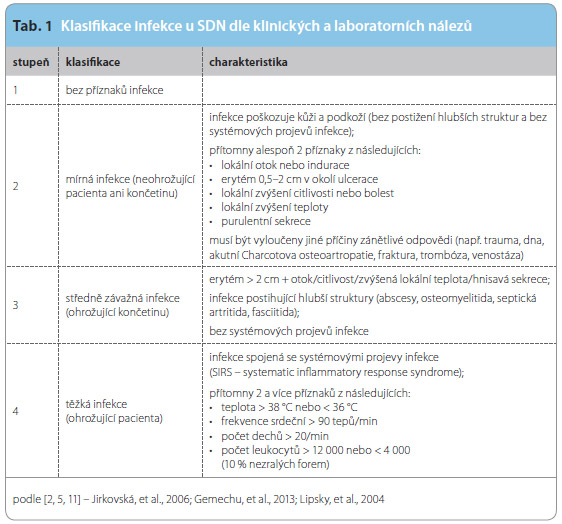 mů a laboratorních vyšetření můžeme infekci rozdělit do čtyř stupňů – stav bez infekce, mírná, středně závažná a těžká infekce (tab. 1). Tato klasifikace je využita i v tzv. PEDIS klasifikaci SDN, která lépe vyhovuje výzkumným účelům, je přesnější v určení tíže dané patologie a zohledňuje stav cirkulace (P – perfusion), velikost léze (E – extension), hloubku ulcerace (D – depth), přítomnost infekce (I – infection) a percepci na dolních končetinách (S – sensation) [16].
mů a laboratorních vyšetření můžeme infekci rozdělit do čtyř stupňů – stav bez infekce, mírná, středně závažná a těžká infekce (tab. 1). Tato klasifikace je využita i v tzv. PEDIS klasifikaci SDN, která lépe vyhovuje výzkumným účelům, je přesnější v určení tíže dané patologie a zohledňuje stav cirkulace (P – perfusion), velikost léze (E – extension), hloubku ulcerace (D – depth), přítomnost infekce (I – infection) a percepci na dolních končetinách (S – sensation) [16].
V rámci SDN považujeme za závažnou infekci ten stav, kdy se objevují některé z následujících příznaků:
- systémové známky zánětu (teploty, zimnice, hypotenze, zmatenost, dehydratace),
- rána je hluboká, směřující k fascii, šlaše, svalu, kloubu, kosti,
- je přítomna rychle progredující flegmona větší než 2 cm,
- je přítomen krepitus, buly, viditelná indurace, změna barvy, nekróza, gangréna, ekchymózy, petechie,
- laboratorně se objevuje zvýšená hladina CRP, leukocytóza, případně hyperglykemie, acidóza apod.
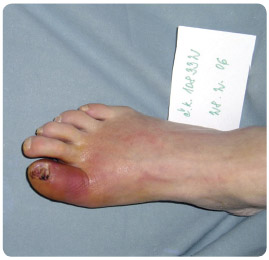 Dalším problémem je přítomnost osteomyelitidy (OM), viz obr. 2, a její diagnostika.
Dalším problémem je přítomnost osteomyelitidy (OM), viz obr. 2, a její diagnostika.Osteomyelitida
OM zhoršuje u pacientů se SDN hojení a je příčinou progrese onemocnění. Pacienti s OM mívají signifikantně delší hospitalizace, delší ATB terapii a více chirurgických intervencí [17]. OM zvyšuje počet amputací dolních končetin (dle naší studie více než 15krát) [18]. Pro podiatry je záludná i tím, že i když se zdá klinicky vyléčená, může OM perzistovat řadu týdnů a následně může dojít k jejímu relapsu. Ten bývá popisován až u 30 % nemocných [19]. Např. bodná poranění vedou po několika týdnech až měsících k OM, která byla klinicky němá, a je těžké zjistit její primární příčinu.
Diagnostiku OM bychom měli provádět dle doporučení Mezinárodního konsenzu o diabetické noze. Konsenzus uvádí, že podmínkou stanovení diagnózy OM je pozitivita minimálně tří z pěti kritérií určených pro infekci v ráně [9]. Mezi tato kritéria se řadí:
- flegmona;
- sondáž kosti na spodině defektu – pozitivní Probe to Bone test (PTB test) s poměrně vysokou senzitivitou (98 %), nižší specificitou (78 %) a vysokou pozitivní predikční hodnotou (95 %) [20]; spolehlivost PTB testu je dána zkušenostmi vyšetřujícího [21];
- pozitivní bakteriologický nález z hlubokých tkání [22]: nejčastějším kauzálním agens nalezeným u OM jsou grampozitivní patogeny, zejména S. aureus [23], což je dáno produkcí adherentních faktorů, např. stafylokokového proteinu A a exoproteinu, např. α-hemolyzinu, hyaluronidázy apod. [24];
- radiologické známky OM: otok měkkých tkání, destrukce kortikální zóny, kostní sekvestry; změny se rozvíjejí i řadu dnů, a proto je senzitivita tohoto vyšetření nízká (28–75 %) [25];
- pozitivní histologický nález [9].
K diagnostice OM mohou přispět i patologické zánětlivé parametry a jiné zobrazovací metody lépe diferencující patologický proces na noze. Řadíme mezi ně CT nohy, které dobře zachycuje anatomické poměry, MR (obr. 3), jež dobře diferencuje záně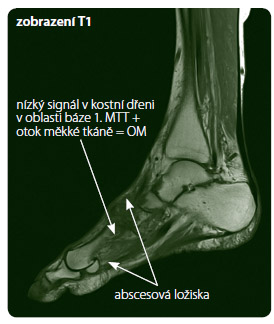 t v měkkých tkáních od patologického kostního procesu a určí rozsah postižení (MR užíváme zejména předoperačně) [26, 27], izotopové vyšetření (pomocí třífázové scintigrafie kostí s methylendifosfonátem a LeukoScan s Tc-protilátkami značenými leukocyty, jež může být falešně negativní při ATB terapii a pozitivní u pacientů s hyperemií), SPECT/CT (Single Photon Emission Computed Tomography) nebo PET/CT (Positron Emission Tomography), které zaznamenávají akumulaci v zánětlivém ložisku a zobrazí anatomické poměry v rámci patologického procesu [27].
t v měkkých tkáních od patologického kostního procesu a určí rozsah postižení (MR užíváme zejména předoperačně) [26, 27], izotopové vyšetření (pomocí třífázové scintigrafie kostí s methylendifosfonátem a LeukoScan s Tc-protilátkami značenými leukocyty, jež může být falešně negativní při ATB terapii a pozitivní u pacientů s hyperemií), SPECT/CT (Single Photon Emission Computed Tomography) nebo PET/CT (Positron Emission Tomography), které zaznamenávají akumulaci v zánětlivém ložisku a zobrazí anatomické poměry v rámci patologického procesu [27].
Zlatým standardem by mělo být provedení biopsie kostí [22, 28], v praxi se však často jeví jako příliš rizikové. Tato metoda by měla být indikována u nehojících se OM při dlouhotrvající ATB terapii s cílem stanovit kauzální agens z kostního vzorku.
Bezpečnější formou je stanovení OM zpracováním histologického vzorku z kostního resekátu při resekčních či amputačních výkonech. Lze provádět i mikrobiologické stanovení ze vzorků kostí, kdy se můžeme setkat s falešně negativními nálezy, pokud je pacient zajištěn léčbou ATB (vyšetření je vhodnější provést s odstupem dvou týdnů po ukončení ATB terapie), pokud došlo k chybnému odběru vzorku nebo pokud je kultivace některých patogenů problematická. Falešně pozitivních vzorků se můžeme dočkat při kontaminaci odběru. V naší studii byl nejčastějším patogenem izolovaným z kostních resekátů koaguláza-negativní stafylokok. Izoláty z kostí a ze stěrů byly shodné ve 28 % případů [29].
Infekce a ischemie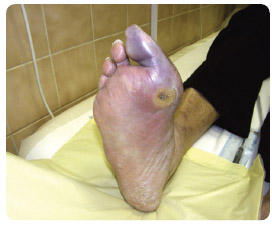
Jedním z faktorů, který nepochybně přispívá k rozvoji SDN, je ischemická choroba dolních končetin [2]. Ovšem i vlastní infekce a s ní související změny mohou dále potencovat ischemii částí nohy, a to:
- otokem (vzniká reaktivně);
- septickou mikrotrombotizací do periferie;
-
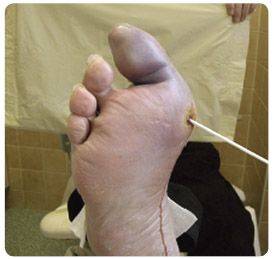 kompartment syndromem, kdy např. absces, nekrotizující fasciitida a masivní infekce jiných měkkých tkání spojená např. s lymfangoitidou může způsobit při zvýšeném tlaku v jednotlivých kompartmentech útlak tkání, edém a následně ischemizaci příslušné části nohy a její periferie (obr. 4 a 5).
kompartment syndromem, kdy např. absces, nekrotizující fasciitida a masivní infekce jiných měkkých tkání spojená např. s lymfangoitidou může způsobit při zvýšeném tlaku v jednotlivých kompartmentech útlak tkání, edém a následně ischemizaci příslušné části nohy a její periferie (obr. 4 a 5).
Terapie infekce u pacientů se SDN
Infekce v rámci SDN by měla být vždy léčena komplexně. Faktory predikující úspěch této léčby zahrnují:
- intaktní kost;
- hmatné pulzace;
- vyšší palcový tlak (> 45 mm Hg);
- uspokojivé hodnoty dopplerovského vyšetření dolních končetin (> 80 mm Hg);
- hodnoty transkutánní tenze kyslíku vyšší než 40 mm Hg.
Léčba infekce by měla zahrnovat především včasnou a účinnou ATB terapii vedenou zkušeným podiatrem ve spolupráci s ATB střediskem. Dále kromě kompenzace diabetu (cave circulus vitiosus: hyperglykemie zhoršuje průběh infekce a hojení ran a opačně – infekce a imobilizace zhoršuje kompenzaci diabetu [30]) a kromě řešení problematiky malnutrice by její součástí měla být také lokální terapie s adekvátní aplikací lokálních terapeutik a včasná a řádná chirurgická intervence. Terapie by rozhodně měla zahrnovat i správně indikované odlehčení dolní končetiny a řešení cévních abnormalit. Zde je nutno podotknout, že po revaskularizacích ve smyslu PTA (perkutánní transluminální angioplastika) nebo bypassů často dochází k progresi infekčních komplikací zlepšením cévního zásobení, na což je třeba po revaskularizacích myslet a pacienta s infekcí již před výkonem zajistit ATB.
Lokální léčba
Účinnost aplikace lokálních přípravků v boji proti infekci není řádně podložena důkazy, jelikož neexistují dvojitě zaslepené placebem kontrolované studie. Valná většina prací porovnává pouze účinnost dvou přípravků určených k lokální aplikaci. Např. studie Martíneze a kol. porovnávala vliv aplikace superoxidovaného roztoku a roztoku povidon jodidu u infikovaných ran. Podání superoxidovaného roztoku vedlo ke zmenšení zápachu, flegmony a zvýšení granulací [26]. Piagessi a kol. prokázali, že u ran po chirurgických intervencích superoxidovaný roztok redukuje počet dnů vyžadujících ATB terapii [31].
Efektivní by mohlo být používání G-CSF (Granulocyte Colony-Stimulating Factor) u pacientů s infekcí, kteří jsou po chirurgických intervencích a dostávají léčbu ATB. Gough prokázal po aplikaci G-CSF rychlejší hojení infekce a kratší dobu hospitalizace [32], Yönem to ovšem ve své studii nepotvrdil [33]. Protiinfekční účinek by měla mít i larvální terapie, která dle metaanalýzy Tiana a kol. zkracuje dobu ATB terapie, ale zdá se, že aplikace neovlivňuje výskyt infekčních komplikací po podání ATB [34].
Chirurgická intervence
Nedílnou součástí léčby infekce je i chirurgická intervence, která by dle klinického nálezu měla být vždy promptní a dostatečná. U závažnějších forem infekce není vhodné chirurgický výkon odkládat, dokonce je doporučováno, aby byl zákrok proveden u pacienta zajištěného parenterálními ATB nejpozději do 24 hodin od přijetí do nemocnice.
Mezi tyto emergentní výkony, kdy je noha ohrožena infekcí (absces s kompartment syndromem nebo nekrózou, sepse, infekce s bulami, ekchymózou, extrémní bolestivost, nekrotizující fasciitida [6]), patří drenáže, incize, discize plosky s nekrektomiemi, v některých případech resekční, amputační nebo exartikulační výkony s otevřeným hojením. Důvodem chirurgických intervencí, např. ostrého debridementu nebo odstranění nekróz, je snížení bakteriální nálože a ochrana před další ischemizací nožních struktur jejich uvolněním. Studie Tana a Faglia prokázaly, že ATB terapie v kombinaci s časnou chirurgickou intervencí u pacientů s infekcí hlubokých nožních struktur vede jednoznačně ke snížení rizika vysokých amputací (až o 14 %) [35, 36].
V rámci plánovaných výkonů využíváme chirurgické výkony při řešení deformit, chronických ulcerací, ale i při léčbě OM. Avšak dle recentních dat se zdá, že konzervativní terapie OM by mohla být v mnoha případech, nebo dokonce ve většině případů nevyžadujících emergentní chirurgický zákrok účinná a dostatečná [28].
ATB léčba
ATB terapie by se měla řídit symptomy a klinickým stavem pacienta [6]. Dle tíže infekce je doporučeno léčit mírnější formy peroráln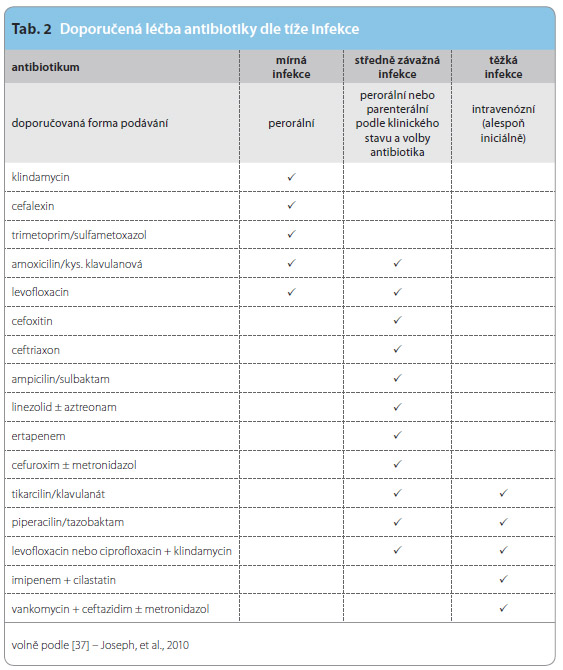 ími ATB. Některé pacienty se středně závažnou infekcí a všechny nemocné s těžkou infekcí je nutné léčit parenterální aplikací ATB (tab. 2) a vždy je nutné u nich posoudit, zdali nález nevyžaduje emergentní chirurgický výkon.
ími ATB. Některé pacienty se středně závažnou infekcí a všechny nemocné s těžkou infekcí je nutné léčit parenterální aplikací ATB (tab. 2) a vždy je nutné u nich posoudit, zdali nález nevyžaduje emergentní chirurgický výkon.
Diskutabilní zůstává problematika středně závažných infekcí, kdy u daného pacienta hrozí hospitalizace, ale pokoušíme se daný stav zvrátit a zvládnout jej z různých důvodů ambulantně. V těchto případech můžeme využít tzv. ambulantní podávání parenterálních ATB (OPAT – outpatient parenteral antibiotic therapy), které potenciálně může zlepšit kvalitu života nemocných (odnětí stresu z hospitalizace, pobyt v domácím prostředí s pomocí ze strany rodiny), může snížit riziko šíření nozokomiálních infekcí [38], ale také finanční náklady spojené s hospitalizacemi těchto nemocných. Např. studie Goodayho a kol., v níž se podařilo oddálit jednu šestinu hospitalizací v průběhu téměř dvou let nebo jim zabránit, prokázala, že došlo k výrazné redukci nákladů (snížení o 26 hospitalizací vedlo k poklesu nákladů o 76 tisíc liber [39]).
Efektivita OPAT systému je sporná dle studie Mackintoshe a kol. u nemocných s MRSA pozitivitou nebo s rezistentními koaguláza-negativními stafylokoky a u pacientů s vyšším stupněm obezity a/nebo s neuspokojivou kompenzací diabetu [40]. K minimalizaci nežádoucích účinků včetně progrese renální insuficience [40] je třeba pacienty bedlivěji monitorovat a pravidelně provádět laboratorní kontroly. V OPAT centrech v zahraničí, kde mají delší zkušenosti s ambulantním podáváním parenterálních ATB, umožňují pacientům dokonce i samostatnou domácí aplikaci ATB; tato aplikace je dle našeho názoru vhodná pouze u pacientů náležitě proškolených a edukovaných, s dobrou compliance, s určitou dávkou zručnosti a zejména s možností provádět ji za sterilních podmínek, jichž však u nemocných se SDN, kteří jsou často i kolonizovaní různými bakteriálními kmeny, nelze prakticky dosáhnout.
Při léčbě ATB by měla platit následující pravidla:
- Léčíme pouze infikované rány z důvodu možného výskytu nežádoucích účinků, s ohledem na finanční náklady a rizika indukce mikrobiální rezistence.
- Léčba ATB je zpočátku většinou empirická a řídí se klinickou závažností infekce.
- Později by léčba infekčních komplikací měla být cílená (u lehčích forem perorálními, u těžších parenterálními ATB).
- Při středně závažné a závažné infekci by ATB terapie měla být vždy včasná a dostatečně agresivní.
- U vybraných ATB (betalaktamových ATB, aminoglykosidů a vankomycinu) je žádoucí monitorovat jejich plazmatické hladiny a následně na základě výsledků individuálně upravovat jejich dávkovací schémata.
Výběr ATB
Empirická terapie
Ve valné většině případů, kdy nemáme dostupné recentní výsledky kultivací a jasná kauzální agens, zahajujeme terapii infekce empiricky. Při empirické volbě ATB se řídíme závažností infekce, předchozí ATB terapií, předchozími kultivačními nálezy, informacemi o přítomnosti OM a anamnestickými údaji o pacientových renálních a hepatálních funkcích, alergiích atd. [38]. Nejprve volíme ATB cílená na grampozitivní mikroorganismy. Pokud byl pacient již ATB léčen nebo je přítomna závažná infekce, je lépe léčbu zaměřit na gramnegativní bakterie nebo enterokoky. U gangrén a zapáchajících ran potencujeme terapii ATB metronidazolem (tab. 2). U nemocných s OM volíme většinou ATB cílená na grampozitivní patogeny, především na S. aureus. Nejlepší prostupnost do kostí je popisována u chinolonů, rifampicinu, klindamycinu a kotrimoxazolu.
Cílená deeskalační terapie
Pokud je známo kauzá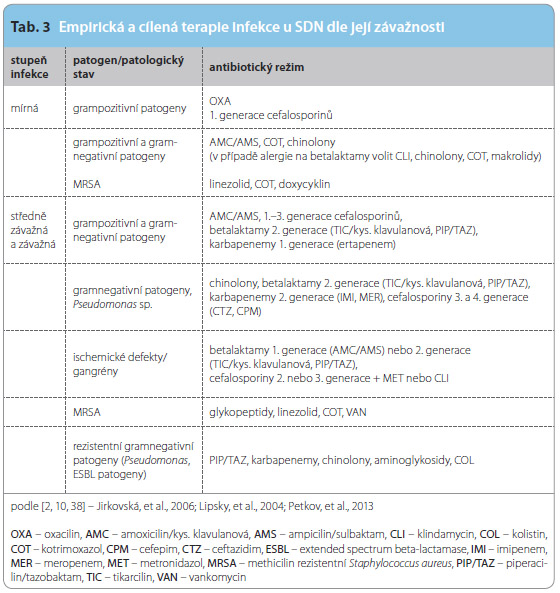 lní agens, vždy se snažíme provádět léčbu infekčních komplikací SDN cíleně podle klinické závažnosti infekce. Volbu jednotlivých léčiv dle závažnosti stavu shrnuje tab. 3. Výběr parenterálních ATB je poměrně široký, ale doposud neexistuje velká randomizovaná studie zkoumající efekt jednotlivých terapeutických režimů u SDN. Při volbě ATB se prozatím spoléháme na menší studie prováděné v jednotlivých podiatrických centrech s menšími soubory nemocných. Tyto studie porovnávají spíše účinek dvou různých ATB nebo efekt převodu pacienta z parenterálních na perorální formy. Slabým článkem těchto prací je délka léčby, která není vždy uniformní a pohybuje se v rozmezí 1–4 týdnů.
lní agens, vždy se snažíme provádět léčbu infekčních komplikací SDN cíleně podle klinické závažnosti infekce. Volbu jednotlivých léčiv dle závažnosti stavu shrnuje tab. 3. Výběr parenterálních ATB je poměrně široký, ale doposud neexistuje velká randomizovaná studie zkoumající efekt jednotlivých terapeutických režimů u SDN. Při volbě ATB se prozatím spoléháme na menší studie prováděné v jednotlivých podiatrických centrech s menšími soubory nemocných. Tyto studie porovnávají spíše účinek dvou různých ATB nebo efekt převodu pacienta z parenterálních na perorální formy. Slabým článkem těchto prací je délka léčby, která není vždy uniformní a pohybuje se v rozmezí 1–4 týdnů.
Vyšší výpovědní hodnotu mají multicentrické studie zahrnující větší soubory pacientů. Multicentrickými studiemi nebylo jednoznačně prokázáno příznivější působení různých terapeutických režimů na hojení infekcí, délku hospitalizace nebo na počet amputací dolních končetin. Velká multicentrická dvojitě zaslepená studie zahrnující 828 pacientů s infekcí kůže a hlubokých struktur (257 pacientů tvořilo podskupinu diabetiků) srovnávala 7–14denní léčbu ceftobiprolem (nový parenterální cefalosporin) s kombinací vankomycinu a ceftazidimu. Nedošlo k signifikantnímu rozdílu klinicky zaléčených infekcí (86 % vs. 81 %) [41].
Další multicentrická randomizovaná studie, která zahrnovala 804 nemocných s infekcí kůže a hlubokých struktur a podskupinu diabetiků čítající 134 nemocných, srovnávala účinek intravenózního a perorálního podání moxifloxacinu a intravenózního a perorálního podání amoxicillinu s klavulanátem. Po 14 dnech nebyl zjištěn signifikantní rozdíl v počtu zaléčených infekcí nebo ve zmírnění známek infekce (51 % vs. 67 %) [42].
Lokální aplikace ATB
Lokální aplikace ATB je sporná, protože nevíme, jakých koncentrací může dané ATB v místě podání dosáhnout, zdali dochází i k jeho absorpci do systémového řečiště, a co je nejpodstatnější, zda může pomáhat indukovat vznik mikrobiální rezistence. Studie podávání lokálních ATB u infekcí SDN jsou sporé a jejich výsledky neprokazují jednoznačně vyšší přínos oproti např. perorálním ATB [43]. Pozitivní v tomto případě je vyřazení trávicího traktu z ATB léčby, což by mohlo snížit riziko vzniku pseudomembranózní kolitidy. Využití lokálních ATB spatřujeme spíše v jejich vázané formě, kdy je možné tyto přípravky aplikovat navázané na různé struktury, např. na bovinní kolagen nebo na biocementy. Následně je možné jimi vyplňovat chybějící prostory např. po parciálních kostních amputacích nebo resekcích kloubů. ATB se postupně uvolňuje z nosiče, což zprostředkovává jeho dlouhodobý účinek [44], který vede např. ke zkrácení doby hojení SDN po chirurgických výkonech [45]. Ve valné většině případů se takto aplikuje gentamicin, proto podmínkou aplikace těchto náhrad je citlivost patogenu k danému ATB.
Délka ATB terapie
Délka ATB terapie by měla být individualizovaná dle lokálního nálezu a výsledků mikrobiálních stěrů. Léčba mírné formy infekce by měla dle standardních doporučení [10] trvat minimálně 1–2 týdny, u středně závažné formy 2–4 týdny. K ukončení ATB terapie by mělo dojít až po ústupu příznaků infekce. ATB terapie by měla být rozhodně delší u imunokompromitovaných pacientů, u nemocných s ischemickými lézemi, kde lze předpokládat nižší dostupnost ATB, v případě hlubokých nekrotických ran a zejména při OM. U nemocných s OM je nutné dbát na dostatečně dlouhou a účinnou ATB terapii, která by měla trvat i 3–6 měsíců, jinak by při konzervativním postupu mohl hrozit její relaps. Tímto způsobem je možno dosáhnout zhojení až u dvou třetin pacientů. K remisi častěji dochází u těch nemocných, kde terapie byla cíleně volena podle výsledků kultivací z kostních biopsií [46].
Při léčbě infekčních komplikací zejména u imunokompromitovaných osob se obáváme rozvoje mikrobiální rezistence a výskytu MRSA a multirezistentních kmenů Pseudomonas aeruginosa [15, 30]. Bakteriální rezistence se nejčastěji rozvíjí při nepatřičné, neopodstatněné nebo příliš dlouhé ATB terapii [37].
Závěr
Vždy je nutné časně a správně diagnostikovat infekci, léčit ji na specializovaných podiatrických pracovištích (seznam uveden na www.diab.cz), vybrat adekvátně empiricky a následně cíleně ATB, u středně závažných a závažných infekcí aplikovat parenterální ATB ambulantně nebo za hospitalizace, co nejrychleji a ve vyšších koncentracích, určit správné načasování chirurgické intervence a řádně pečovat o ránu a adekvátně odlehčit dolní končetinu. Nezbytnou součástí léčby infekčních komplikací je i kontrola cévního zásobení končetiny a ovlivnění i ostatních faktorů působících na hojení ran – např. kompenzace diabetu a stavu nutrice.
Podpořeno MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“).
Seznam použité literatury
- [1] Peters EJ, Lipsky BA. Diagnosis and management of infection in the diabetic foot. Med Clin North Am 2013; 97: 911–946.
- [2] Jirkovská A. Syndrom diabetické nohy. 1. vydání, Maxdorf Jessenius, 2006.
- [3] Shah BR, Hux JE. Quantifying the risk of infectious diseases for people with diabetes. Diabetes Care 2003; 26: 510–513.
- [4] Wukich DK, Hobizal KB, Brooks MM. Severity of diabetic foot infection and rate of limb salvage. Foot Ankle Int 2013; 34: 351–358.
- [5] Gemechu FW, Seemant F, Curley CA. Diabetic foot infections. Am Fam Physician 2013; 88: 177–184.
- [6] Ricco JB, Thanh Phong L, Schneider F, et al. The diabetic foot: a review. J Cardiovasc Surg (Torino) 2013; 54: 755–762.
- [7] Prompers L, Huijberts M, Schaper N, et al. Resource utilisation and costs associated with the treatment of diabetic foot ulcers. Prospective data from the Eurodiale Study. Diabetologia 2008; 51: 1826–1834.
- [8] Fejfarová V, Jirkovská A, Köveslygetyová D, et al. Aktuality v hrazení podiatrické péče z pohledu klinika. Kazuistiky v diabetologii 2013; Suppl. 2; 11: S11–S12.
- [9] International consensus on the diabetic foot and practical guidelines on the management and prevention of the diabetic foot by The international working group on the diabetic foot International working group on the diabetic foot/consultative section of IDF.
- [10] Lipsky BA, Berendt AR, Cornia PB, et al., Infectious Diseases Society of America. 2012 Infectious Diseases Society of America clinical practice guideline for the diagnosis and treatment of diabetic foot infections. Clin Infect Dis 2012; 54: e132–173.
- [11] Lipsky BA, Berendt AR, Deery HG, et al. Infectious Diseases Society of America. Diagnosis and treatment of diabetic foot infections. Clin Infect Dis 2004; 39: 885–910.
- [12] Citron DM, Goldstein EJ, Merriam CV, et al. Bacteriology of moderate-to-severe diabetic foot infections and in vitro activity of antimicrobial agents. J Clin Microbiol 2007; 45: 2819–2828.
- [13] Lipsky BA. Osteomyelitis of the foot in diabetic patients. Clin Infect Dis 1997; 25: 1318–1326.
- [14] Fejfarová V. Bakteriální a mykotické infekce u pacientů se syndromem diabetické nohy. Florence, Galén, Praha, 2006: 45–49.
- [15] Fejfarová V, Jirkovská A, Petkov V, et al. Comparison of microbial findings and resistance to antibiotics between transplant patients, patients on hemodialysis, and other patients with the diabetic foot. J Diabetes Complications 2004; 18: 108–112.
- [16] Schaper NC. Diabetic foot ulcer classification system for research purposes: a progress report on criteria for including patients in research studies. Diabetes Metab Res Rev 2004; 20; Suppl 1: 590–595.
- [17] Mutluoglu M, Sivrioglu AK, Eroglu M, et al. The implications of the presence of osteomyelitis on outcomes of infected diabetic foot wounds. Scand J Infect Dis 2013; 45: 497–503.
- [18] Fejfarová V, Jirkovská A, Bém R, Skibová J. Risk and benefit of total contact cast Jirkovská, J. Skibová, V. Petkov: The association of resistant Staphylococcus aureus and the rate of lower limb amputations in patients with the diabetic foot. (abstrakt) Diabetologia 2006; Suppl. 1: 685–686.
- [19] Rao N, Ziran BH, Lipsky BA. Treating osteomyelitis: antibiotics and surgery. Plast Reconstr Surg 2011; 127; Suppl 1: 177S–187S.
- [20] Morales Lozano R, González Fernández ML, Martinez Hernández D, et al. Validating the probe-to-bone test and other tests for diagnosing chronic osteomyelitis in the diabetic foot. Diabetes Care 2010; 33: 2140–2145.
- [21] García Morales E, Lázaro-Martínez JL, Aragón-Sánchez FJ, et al. Inter-observer reproducibility of probing to bone in the diagnosis of diabetic foot osteomyelitis. Diabet Med 2011; 28: 1238–1240.
- [22] Weiner RD, Viselli SJ, Fulkert KA, Accetta P. Histology versus microbiology for accuracy in identification of osteomyelitis in the diabetic foot. J Foot Ankle Surg 2011; 50: 197–200.
- [23] Malone M, Gannass A, Descallar J, et al. Pedal osteomyelitis in patients with diabetes: a retrospective audit from Saudi Arabia. J Wound Care 2013; 22: 318–320.
- [24] Jin T, Zhu YL, Li J, et al. Staphylococcal protein A, Panton-Valentine leukocidin and coagulase aggravate the bone loss and bone destruction in osteomyelitis. Cell Physiol Biochem 2013; 32: 322–333.
- [25] Butalia S, Palda VA, Sargeant RJ, et al. Does this patient with diabetes have osteomyelitis of the lower extremity? JAMA 2008; 299: 806–813.
- [26] Martínez-De Jesús FR, Ramos-De la Medina A, Remes-Troche JM, et al. Efficacy and safety of neutral pH superoxidised solution in severe diabetic foot infections. Int Wound J 2007; 4: 353–362.
- [27] Donovan A, Schweitzer ME. Use of MR imaging in diagnosing diabetes-related pedal osteomyelitis. Radiographics 2010; 30: 723–736.
- [28] Game FL. Osteomyelitis in the diabetic foot: diagnosis and management. Med Clin North Am 2013; 97: 947–956.
- [29] Wosková V, Jirkovská A, Bém R, et al. Could be coagulase-negative Staphylococcus a causative pathogen of chronic osteomyelitis in patients with diabetic foot (abstract). Abstractbook X. Meeting of DFSG 9/2012; 85.
- [30] Boyanova L, Mitov I. Antibiotic resistance rates in causative agents of infections in diabetic patients: rising concerns. Expert Rev Anti Infect Ther 2013; 11: 411–420.
- [31] Piaggesi A, Goretti C, Mazzurco S, et al. A randomized controlled trial to examine the efficacy and safety of a new super-oxidized solution for the management of wide postsurgical lesions of the diabetic foot. Int J Low Extrem Wounds 2010; 9: 10–15.
- [32] Gough A, Clapperton M, Rolando N, et al. Randomised placebo-controlled trial of granulocyte-colony stimulating factor in diabetic foot infection. Lancet 1997; 20: 855–859.
- [33] Yönem A, Cakir B, Güler S, et al. Effects of granulocyte-colony stimulating factor in the treatment of diabetic foot infection. Diabetes Obes Metab 2001; 3: 332–337.
- [34] Tian X, Liang XM, Song GM, et al. Maggot debridement therapy for the treatment of diabetic foot ulcers: a meta-analysis. J Wound Care 2013; 22: 462–469.
- [35] Tan JS, Friedman NM, Hazelton-Miller C, et al. Can aggressive treatment of diabetic foot infections reduce the need for above-ankle amputation? Clin Infect Dis 1996; 23: 286–291.
- [36] Faglia E, Clerici G, Caminiti M, et al. The role of early surgical debridement and revascularization in patients with diabetes and deep foot space abscess: retrospective review of 106 patients with diabetes. J Foot Ankle Surg 2006; 45: 220–226.
- [37] Joseph WS, Lipsky BA. Medical therapy of diabetic foot infections. J Vasc Surg 2010; 52 (3 Suppl): 67S–71S.
- [38] Petkov V, Jirkovská A. Agresivní antibiotická terapie syndromu diabetické nohy, zejména osteomyelitidy. Možnosti ambulantní antibiotické léčby. Kazuistiky v diabetologii 2013; 11 (Supl. 2): S22–24.
- [39] Gooday C, Hallam C, Sieber C, et al. An antibiotic formulary for a tertiary care foot clinic: admission avoidance using intramuscular antibiotics for borderline foot infections in people with diabetes. Diabet Med 2013; 30: 581–589.
- [40] Mackintosh CL, White HA, Seaton RA. Outpatient parenteral antibiotic therapy (OPAT) for bone and joint infections: experience from a UK teaching hospital-based service. J Antimicrob Chemother 2011; 66: 408–415.
- [41] Noel GJ, Bush K, Bagchi P, et al. A randomized, double-blind trial comparing ceftobiprole medocaril with vancomycin plus ceftazidime for the treatment of patients with complicated skin and skin-structure infections. Clin Infect Dis 2008; 46: 647–655.
- [42] Vick-Fragoso R, Hernández-Oliva G, Cruz-Alcázar J, STIC Study Group, et al. Efficacy and safety of sequential intravenous/oral moxifloxacin vs intravenous/oral amoxicillin/clavulanate for complicated skin and skin structure infections. Infection 2009; 37: 407–417.
- [43] Lipsky BA, Holroyd KJ, Zasloff M. Topical versus systemic antimicrobial therapy for treating mildly infected diabetic foot ulcers: a randomized, controlled, double-blinded, multicenter trial of pexiganan cream. Clin Infect Dis 2008; 47: 1537–1545.
- [44] Barth RE, Vogely HC, Hoepelman AI, Peters EJ. ‘To bead or not to bead?’ Treatment of osteomyelitis and prosthetic joint-associated infections with gentamicin bead chains. Int J Antimicrob Agents 2011; 38: 371–375.
- [45] Sixta B, Herdegen P, Varga M, Řezaninová L. Je indikována lokální antibiotická léčba u syndromu diabetické nohy? (abstrakt). Hojení ran 2012; 1: 21–22.
- [46] Senneville E, Lombart A, Beltrand E, et al. Outcome of diabetic foot osteomyelitis treated nonsurgically: a retrospective cohort study. Diabetes Care 2008; 31: 637–642.