Dlouhodobý účinek léčby chronické virové hepatitidy B
Chronická virová hepatitida B patří i na počátku 21. století mezi závažné zdravotní problémy. V současné době již disponujeme velkým množstvím údajů, které hodnotí dlouhodobé účinky jednotlivých léčebných variant z mnoha různých pohledů. Mezi nejdůležitější patří vlastní virologická účinnost přípravků hodnocená počtem dosažených sérokonverzí v HBe či HBs systému, riziko vzniku virologické rezistence, regrese jaterní fibrózy, redukce incidence hepatocelulárního karcinomu apod. V přehledném článku se věnujeme hodnocení těchto parametrů u jednotlivých terapeutických postupů chronické hepatitidy B.
Úvod
![Graf 1 Asociace rizika rozvoje jaterní cirhózy se sérovou koncentrací HBV DNA; podle [3] – Iloeje, et al., 2006.](https://www.remedia.cz/photo-a-29475---.jpg)
Chronická infekce virem hepatitidy B (HBV) je celosvětovým problémem pro své závažné dlouhodobé důsledky, jako je rozvoj jaterní cirhózy se všemi komplikacemi a primární rakovina jater (hepatocelulární karcinom, HCC) [1]. Klinické studie jednoznačně prokázaly, že klíčovým momentem, který rozhoduje o průběhu onemocnění, je aktivita imunitního systému. Tato je podmíněna úrovní aktivní replikace HBV [1, 2]. Studie REVEAL jednoznačně ukázala na rozsáhlém počtu pacientů s chronickou HBV infekcí, že riziko rozvoje HCC a jaterní cirhózy významně narůstá od sérové koncentrace HBV DNA 2000 IU/ml (graf 1 a 2) [3, 4]. V grafech jsou použity ještě staré jednotky pro kvantifikaci sérové koncentrace HBV DNA. Pro převod na standardní IU/ml je potřeba hodnotu v kopiích (genomu)/ml dělit přibližně pěti. ![Graf 2 Asociace rizika rozvoje hepatocelulárního karcinomu se sérovou koncentrací HBV DNA; podle [4] – Chen, et al., 2006.](https://www.remedia.cz/photo-a-29476---.jpg)
Na základě těchto poznatků je za primární cíl protivirové léčby chronické virové hepatitidy B považováno dosažení dlouhodobého (ideálně trvalého) potlačení virové replikace. Potlačení virové replikace vede ke snížení aktivity jaterního onemocnění (v histologickém smyslu slova hepatitidy) a ke zpomalení či zastavení progrese jaterního onemocnění směrem k jaterní cirhóze. Snižuje se také riziko vzniku HCC. Dlouhodobým cílem léčby chronické HBV infekce je potom dosažení eliminace Australského antigenu (HBsAg, hepatitis B surface antigen), tj. dosažení sérokonverze v HBs systému. Pokud je tohoto cíle dosaženo, dochází v dlouhodobém pohledu k dalšímu prodloužení přežití, dále se také redukuje riziko rozvoje HCC. U pacientů s jaterní cirhózou významně klesá riziko dekompenzace onemocnění a pravděpodobnost nutnosti transplantace jater [5].
Možnosti léčby chronické virové hepatitidy B
V současné době můžeme varianty protivirové léčby chronické HBV infekce rozdělit na dvě velké skupiny:
- časově definovaná léčba – konvenční rekombinantní interferon α (IFN) a pegylovaný interferon α (PEG-IFN);
- časově nedefinovaná léčba (nukleosidová a nukleotidová analoga) – lamivudin (LAM), adefovir dipivoxil (ADV), entekavir (ETV), telbivudin (LdT, L-enantiomer deoxythymidinu – není v ČR dostupný), tenofovir (TDF, tenofovir-disoproxyl-fumarát).
U všech těchto jmenovaných léčiv bylo prokázáno, že jejich podání může vést k naplnění výše zmíněných cílů léčby chronické HBV infekce [6]. Zásadami a indikacemi podání jednotlivých variant léčby se nyní nebudeme podrobně zabývat. Zaměříme se na dlouhodobý efekt zmíněných terapeutických možností. I s ohledem na výše zmíněné patofyziologické principy infekce HBV se soustředíme na účinky jednotlivých léčebných možností v několika oblastech:
- virologický účinek – potlačení virové replikace (snížení sérové koncentrace HBV DNA), dosažení sérologických změn (vymizení HBeAg – hepatitis B extracellular antigen, HBsAg, sérokonverze v HBs a HBe systému);
- histologický účinek – potlačení, zastavení jaterní fibrogeneze;
- pokles incidence rozvoje HCC;
- vliv léčby na dlouhodobou prognózu pacienta.
Dělení je však schematické, jednotlivé oblasti spolu velmi úzce souvisejí a prolínají se. Pro snadnější pochopení dalšího textu uvedeme také na tomto místě charakteristiku dvou základních variant chronické virové hepatitidy B:
- HBeAg pozitivní varianta: virus se mohutně replikuje (vysoká sérová koncentrace HBV DNA v IU/ml) a secernuje HBeAg do séra.
- HBeAg negativní varianta: virus se replikuje většinou minimálně (nízká sérová koncentrace HBV DNA v IU/ml). Existují však případy s významnou a vysokou replikací (vysoká koncentrace HBV DNA v IU/ml), kdy v důsledku mutací virového genomu nedochází k sekreci HBeAg do séra.
Časově definovaná léčba, IFN a PEG-IFN
Studie s dlouhodobým sledováním HBeAg-pozitivních pacientů po terapii konvenčním IFN trvající čtyři nebo šest měsíců prokázaly redukci progrese jaterní fibrózy, a to především u pacientů s trvalou sérokonverzí v HBe systému. Čínská studie se 233 HBeAg-pozitivními pacienty léčenými IFN prokázala ve srovnání se skupinou neléčených osob redukci kumulativní incidence jaterní cirhózy (17,8 % vs. 33,7 %, p = 0,041) při dlouhodobém sledování (medián 6,8 roku při rozmezí 1,1–15,5 roku) [7]. V této studii bylo také prokázáno, že IFN vede ke snížení incidence HCC u HBeAg-pozitivních pacientů (2,7 % vs. 12,5 % u kontrol, p = 0,011). Dále bylo dokázáno, že trvalá eliminace HBeAg je asociována s významným prodloužením přežití a redukcí výskytu cirhotických komplikací a potřeby jaterní transplantace [8, 9].
Výše citovaná studie pochází z Asie, je proto v řadě parametrů obtížně srovnatelná s evropskými poměry. V Evropě se velká část pacientů indikovaných k zahájení protivirové léčby nachází ve fázi HBeAg negativity, léčba pomocí IFN není indikována tak často (v současné době je navíc upřednostňován PEG-IFN).
Jedna z největších evropských studií na téma dlouhodobého efektu IFN u HBeAg-negativní varianty onemocnění byla proto publikována už v roce 1998 [10]. V této studii léčba trvala 6–24 měsíců. U pacientů, kteří dosáhli trvalé zástavy virové replikace (SVR, sustained virologic response – nedetekovatelná sérová koncentrace HBV DNA), byla pozorována regrese Ishakova skóre jaterní fibrózy a snížení rizika rozvoje jaterní cirhózy. Dlouhodobé přežití bylo rovněž prodlouženo ve srovnání s kontrolami díky snížení incidence komplikací jaterní cirhózy včetně redukce incidence HCC (1,8 % vs. 10,5 %, p = 0,027, u relapsérů, pacientů s relapsem onemocnění – vysoká sérová koncentrace HBV DNA po skončení léčby, a 7,7 %, p = 0,048, u neléčených osob). Podobných výsledků bylo dosaženo i v dalších studiích. SVR mezi HBeAg-negativními osobami přitom byla relativně nízká, méně než 30 % [11, 12]. Sérokonverze v HBs systému, nebo vymizení HBsAg, je častěji dosahováno u pacientů léčených IFN s dosažením SVR než u neléčených. Eliminace HBsAg vede k dalšímu zvýšení pozitivního přínosu léčby, zejména ve smyslu poklesu incidence dlouhodobých komplikací, tj. především snížení rizika vzniku HCC [10].
Opakovaně byla popsána eliminace HBsAg s odstupem po skončení protivirové léčby s použitím PEG-IFN. Buster a kol. [13] prokázali eliminaci HBsAg u pacientů HBeAg-negativních léčených PEG-IFNα-2b a v šestém měsíci po léčbě ve 3 % a na konci třetího roku po léčbě v 9 % případů. HBeAg-pozitivní variantou onemocnění se z tohoto pohledu zabývali Marcellin a kol. [14]. Jejich skupina pacientů byla léčena PEG-IFNα-2b a v týdnu 78 po skončení léčby bylo zaznamenáno 7 % osob HBsAg-negativních. Na konci třetího roku to bylo již 11 % osob. ![Graf 3 Eliminace HBsAg po terapii IFN; podle [15] – Lampertico, et al., 2003.](https://www.remedia.cz/photo-a-29477---.jpg)
Ještě delším odstupem od skončení protivirové léčby IFN u HBeAg-negativních pacientů se zabýval Lampertico a kol. [15]. Jejich studie byla publikována v roce 2003 a patří mezi nejcitovanější v tomto ohledu vůbec. Výsledky ukazuje graf 3. Je patrné, že deset let po skončení léčby IFN bylo mezi pacienty se SVR (normální hodnoty alaninaminotransferázy, ALT, a negativní sérová koncentrace HBV DNA) až 60 % osob HBsAg-negativních. Pravdou je, že tato studie byla uspořádána ve snaze dokázat takto pozitivní efekt prodloužené léčby IFN, takže léčba zde použitá trv![Graf 4 Vliv elimiance HBsAg na prognózu pacientů s jaterní cirhózou; podle [10] – Fattovich, et al., 1998. Retrospektivní studie 309 cirhotiků s průměrnou dobou sledování 5,7 roku.](https://www.remedia.cz/photo-a-29478---.jpg) ala 24 měsíců, standardní doporučovaná délka léčby je ale pouze 12 měsíců. Všechna tato čísla nicméně neodpovídají spontánnímu průběhu infekce a pravděpodobnosti dosažení eliminace HBsAg spontánně bez terapie (cca 1 % ročně). Vliv eliminace HBsAg na prognózu pacientů s jaterní cirhózou dobře popsala již citovaná studie Fattovichové a kol. [10], viz graf 4.
ala 24 měsíců, standardní doporučovaná délka léčby je ale pouze 12 měsíců. Všechna tato čísla nicméně neodpovídají spontánnímu průběhu infekce a pravděpodobnosti dosažení eliminace HBsAg spontánně bez terapie (cca 1 % ročně). Vliv eliminace HBsAg na prognózu pacientů s jaterní cirhózou dobře popsala již citovaná studie Fattovichové a kol. [10], viz graf 4.
Redukce rizika vzniku HCC je možná jedním z nejdůležitějších pozdních účinků protivirové léčby. Metaanalýza 12 studií (1292 osob léčených IFN a 1450 neléčených osob) ukázala významný pokles rizika vzniku HCC (34% pokles, relativní riziko – RR: 0,66; konfidenční interval – 95% CI: 0,48–0,89; p = 0,006) po terapii IFN. Tento efekt byl nejvíce vyjádřen u osob s jaterní cirhózou (47% pokles, RR: 0,53; 95% CI: 0,36–0,78; p = 0,001) [16]. Významnou redukci incidence HCC po terapii IFN potvrdily i další dvě metaanalýzy [17, 18].
Časově nedefinovaná léčba, perorální virostatika
Lamivudin, adefovir dipivoxil
Dlouhodobá léčba (> 3 roky) LAM nebo ADV vedla k významné regresi fibrózy [19, 20]. Ve skupině 142 HBeAg-
-pozitivních osob bez jaterní cirhózy bylo při dlouhodobé terapii LAM (medián 89,9 měsíce, rozpětí 26,5–128,3 měsíce) dosaženo významně nižší incidence jaterní cirhózy a vývoje HCC (p = 0,005) ve srovnání se 124 HBeAg-pozitivními, ale neléčenými osobami [21]. Jedna z několika málo dvojitě slepých kontrolovaných randomizovaných studií s LAM podávaným dlouhodobě (medián 32,4 měsíce) skupině 436 pacientů s pokročilou fibrózou či cirhózou (Ishakovo skóre fibrózy ≥ 4) prokázala významné snížení celkové progrese onemocnění (17,7 % vs. 7,8 %, p = 0,001) ve srovnání s kontrolní skupinou osob (n = 215) [22].
LAM byl prvním virostatikem přímo inhibujícím replikační cyklus HBV, v současné době má v hepatologii pouze velmi limitované indikace. Dostupná jsou nyní již analoga vyšších generací, jejichž určitou nevýhodou je uplynutí kratší doby od jejich zavedení (ve srovnání s LAM), a proto i množství údajů o jejich dlouhodobém efektu je menší nežli v případě LAM. Jejich účinnost je ve všech ohledech ale vyšší nežli u LAM, je proto pravděpodobné, že i dlouhodobý efekt bude významně lepší. Jejich základním a dobře měřitelným účinkem je přímá inhibice virové reverzní transkriptázy, která vede k poměrně rychlému poklesu sérové koncentrace HBV DNA. Sérologické změny v HBe systému, či dokonce v HBs systému jsou významně méně časté nežli při použití IFN a PEG-IFN.
Hadziyannis a kol. publikovali v roce 2006 [23] výsledky 5leté léčby ADV. Pět let terapie vedlo ke zlepšení histologického nálezu u více než 60 % pacientů s přemosťující fibrózou či cirhózou. Medián změn při Ishakově hodnocení byl -1,0 bodu v obou skupinách. Často citovanou limitací podání ADV je jeho nefrotoxicita, která prakticky chybí u dalšího virostatika – ETV.
Entekavir
Dlouhodobé studie s ETV ukázaly, že po třech letech léčby dochází k významné regresi fibrózy (zlepšení o ≥ 1 bod při Ishakově hodnocení) u 57 % osob, po letech pak dokonce u 88 % osob [24, 25]. V roce 2012 byly zveřejněny výsledky studie VIRGIL s ETV [26]. Cirhotici, kteří dosáhli virologické odpovědi definované jako hladina sérové koncentrace HBV DNA ≤ 80 IU/ml, vykázali 71% pokles rizika rozvoje dekompenzace, HCC a úmrtí na jaterní cirhózu. Medián délky podávání ETV v této skupině byl 20 měsíců (rozpětí 11–32) [26].
Tenofovir
![Graf 5 Pokles počtu pacientů s pokročilou fibrózou a cirhózou v histologickém hodnocení při léčbě TDF; podle [27] – Marcellin, et al., 2013. * základní referenční úroveň](https://www.remedia.cz/photo-a-29479---.jpg) Regrese fibrózy je dosahováno i při terapii dalším virostatikem – TDF. Počátkem roku 2013 byla publikována studie hodnotící dlouhodobý histologický účinek podávání TDF [27]. Během pěti let podávání TDF došlo k významnému ústupu skóre fibrózy u naprosté většiny pacientů. Tento efekt je výraznější u pacientů s jaterní cirhózou (74 %) ve srovnání s 51 % pacientů bez jaterní cirhózy. Distribuci skóre fibrózy při Ishakově hodnocení během studie ukazuje graf 5. Možná nejpozoruhodnějším nálezem je skutečnost, že u významného počtu pacientů došlo i k regresi jaterní cirhózy. Za jaterní cirhózu histologicky verifikovanou v Ishakově hodnocení je považováno skóre 5 a 6. Pokud bychom srovnali počty pacientů s fibrózou 5/6 na počátku léčby a v pátém roce léčby, došli bychom rovněž k
Regrese fibrózy je dosahováno i při terapii dalším virostatikem – TDF. Počátkem roku 2013 byla publikována studie hodnotící dlouhodobý histologický účinek podávání TDF [27]. Během pěti let podávání TDF došlo k významnému ústupu skóre fibrózy u naprosté většiny pacientů. Tento efekt je výraznější u pacientů s jaterní cirhózou (74 %) ve srovnání s 51 % pacientů bez jaterní cirhózy. Distribuci skóre fibrózy při Ishakově hodnocení během studie ukazuje graf 5. Možná nejpozoruhodnějším nálezem je skutečnost, že u významného počtu pacientů došlo i k regresi jaterní cirhózy. Za jaterní cirhózu histologicky verifikovanou v Ishakově hodnocení je považováno skóre 5 a 6. Pokud bychom srovnali počty pacientů s fibrózou 5/6 na počátku léčby a v pátém roce léčby, došli bychom rovněž k![Graf 6 Individuální pokles skóre jaterní fibrózy v 5. roce léčby TDF; podle [27] – Marcellin, et al., 2013.](https://www.remedia.cz/photo-a-29480---.jpg) e statisticky významné regresi ze 28 % na 8 % pacientů. Ze 348 pacientů s dostupnými párovými biopsiemi mělo 74 % osob v pátém roce léčby skóre jaterní fibrózy nižší než 5, a dokonce u 73 % léčených došlo k poklesu o 2 a více bodů. Individuální pokles skóre fibrózy ukazuje graf 6. Ze znázornění je vidět, že 15 osob vykázalo pokles o 4 body, 41 o 3 body atd.; u 24 pacientů (25 %) nebyla zaznamenána žádná změna a pouze u jediného pacienta nastala progrese o jeden bod. Velmi podobných výsledků bylo dosaženo při podávání TDF pacientům s rezistencí na LAM. Z výchozího počtu 75 pacientů mělo 54 (72 %) dostupné párové jaterní biopsie (opět v čase zahájení a v 5. roce léčby), 18 z 54 (33 %) osob mělo ve vstupní biopsii zjištěnu jaterní cirhózu, v 5. roce léčby to už byly pouze 2 osoby z 54 (4 %) léčených [28].
e statisticky významné regresi ze 28 % na 8 % pacientů. Ze 348 pacientů s dostupnými párovými biopsiemi mělo 74 % osob v pátém roce léčby skóre jaterní fibrózy nižší než 5, a dokonce u 73 % léčených došlo k poklesu o 2 a více bodů. Individuální pokles skóre fibrózy ukazuje graf 6. Ze znázornění je vidět, že 15 osob vykázalo pokles o 4 body, 41 o 3 body atd.; u 24 pacientů (25 %) nebyla zaznamenána žádná změna a pouze u jediného pacienta nastala progrese o jeden bod. Velmi podobných výsledků bylo dosaženo při podávání TDF pacientům s rezistencí na LAM. Z výchozího počtu 75 pacientů mělo 54 (72 %) dostupné párové jaterní biopsie (opět v čase zahájení a v 5. roce léčby), 18 z 54 (33 %) osob mělo ve vstupní biopsii zjištěnu jaterní cirhózu, v 5. roce léčby to už byly pouze 2 osoby z 54 (4 %) léčených [28].
Vznik rezistence
Jedním ze závažných problémů spojených s dlouhodobým užíváním virostatik u chronické hepatitidy B je riziko rozvoje lékových rezistencí. Obecným podkladem pro rozvoj takové rezistence je vznik jedné nebo několika mutací virového genomu, které vedou ke změně prostorového uspořádání virové reverzní transkriptázy a ke snížení afinity tohoto enzymu k danému virostatiku. Pokud k tomuto dojde, dochází k postupné obnově virové replikace a sérová koncentrace HBV DNA po předchozím poklesu opět stoupá. Z pohledu mechanismů vedoucích k rezistenci a riziku rozvoje rezistence je proto možné virostatika dělit na skupinu s nízkou genetickou bariérou k rezistenci (LAM a LdT) a s vysokou genetickou bariérou (ETV a TDF). Nabízí se tedy otázka, zda vznik lékové rezistence, který vede k prolomení blokády virové replikace, má negativní efekt i z dlouhodobého pohledu. Literatura zabývající se tímto problémem je bohužel poměrně chudá na větší studie. Mezi nejrozsáhlejší patří již jednou citovaná randomizovaná studie Liawa a kol. s léčbou LAM. Uspořádání studie umožnilo posouzení efektu léčby u tří skupin pacientů:
- neléčení (placebo);
- léčení, ale s rozvojem rezistence (při podávání LAM označované podle lokusu, ve kterém mutace nejčastěji vznikaly, jako YMDD mutace);
- léčení bez vzniku lékové rezistence.
Srovnán![Graf 7 Progrese jaterního onemocnění ve vztahu ke vzniku lékové rezistence při terapii LAM; podle [22] – Liaw, et al., 2004.](https://www.remedia.cz/photo-a-29481---.jpg) í těchto tří podskupin ukazuje graf 7. Je dobře vidět, že progrese onemocnění je nejčastější u skupiny neléčené, naopak ve skupině bez vzniku rezistence progreduje pouze u minima osob. Pozitivní efekt léčby je však ztracen u osob s rozvojem lékové rezistence, nicméně k prokazatelné progresi onemocnění dochází o něco méně často nežli u neléčené populace. Ve stejné studii byla významně redukována také incidence HCC u pacientů s pokročilou fibrózou či s cirhózou při srovnání léčené a neléčené skupiny (3,9 % vs. 7,4 %, p = 0,047).
í těchto tří podskupin ukazuje graf 7. Je dobře vidět, že progrese onemocnění je nejčastější u skupiny neléčené, naopak ve skupině bez vzniku rezistence progreduje pouze u minima osob. Pozitivní efekt léčby je však ztracen u osob s rozvojem lékové rezistence, nicméně k prokazatelné progresi onemocnění dochází o něco méně často nežli u neléčené populace. Ve stejné studii byla významně redukována také incidence HCC u pacientů s pokročilou fibrózou či s cirhózou při srovnání léčené a neléčené skupiny (3,9 % vs. 7,4 %, p = 0,047).
Redukce jaterních komplikací
Nyní se soustředíme na problém, zda existují data, která by jednoznačně ukázala na to, že výše dokumentované histologické účinky léčby virostatiky (zejména vyšších generací) mají prokazatelný klinický dopad ve smyslu redukce výskytu jaterních komplikací včetně HCC u pacientů s chronickou HBV infekcí. Některá pozitivní zjištění již byla rovněž zmíněna u dosud rozebíraných studií. Pokles kumulativní incidence úmrtí, jaterní dekompenzace i incidence HCC byl dále prokázán ve studii Kima a kol. [29]. Do studie bylo zařazeno v letech 1999 až 2009 celkem 240 osob s jaterní cirhózou (60,4 % bylo HBeAg-pozitivních). V průběhu uvedeného časového období byli pacienti léčeni LAM jako lékem první volby, při vzniku rezistence poté virostatiky vyšší generace. Kontrolní skupina osob byla tvořena celkem 481 pacienty s jaterní cirhózou při HBV infekci, kteří nebyli až do roku 1999 léčeni protivirovou léčbou. U 78 % pacientů bylo dosaženo virologické odpovědi (HBV DNA < 105 cp/ml) při mediánu trvání léčby 46 měsíců. Pětiletá kumulativní incidence úmrtí byla v léčené skupině 19,4 %, v neléčené 43,9 % (p < 0,001), incidence HCC pak byla 13,8 % vs. 23,4 % (p < 0,074). Jako rizikový faktor úmrtí, dekompenzace i rozvoje HCC byla identifikována nedostatečná odpověď na protivirovou léčbu (HBV DNA >105 cp/ml). V tomto ohledu jde vlastně o potvrzení výsledků výše citované studie REVEAL.
Ve studii publikované v roce 2012 [30] byla incidence dekompenzace u pacientů s HBeAg-negativní variantou onemocnění při mediánu délky sledování a léčbě ETV 53 měsíců 0 % (100 % pacientů přežilo v daném období bez dekompenzace). Ve stejné skupině nemocných bylo vynikající nejen dlouhodobé přežití bez jaterních komplikací, ale i přežití celkové. Obojí je dáno mimo jiné také významným snížením incidence HCC. Významnou redukci incidence HCC ve skupině osob léčených virostatiky prokázal i v nedávno publikované studii Kumada a kol. [31]. Prioritou této studie je průkaz vztahu mezi HCC a mutací genomu HBV v oblasti tzv. basal core promoteru (BCP).
Dalším samostatným problémem je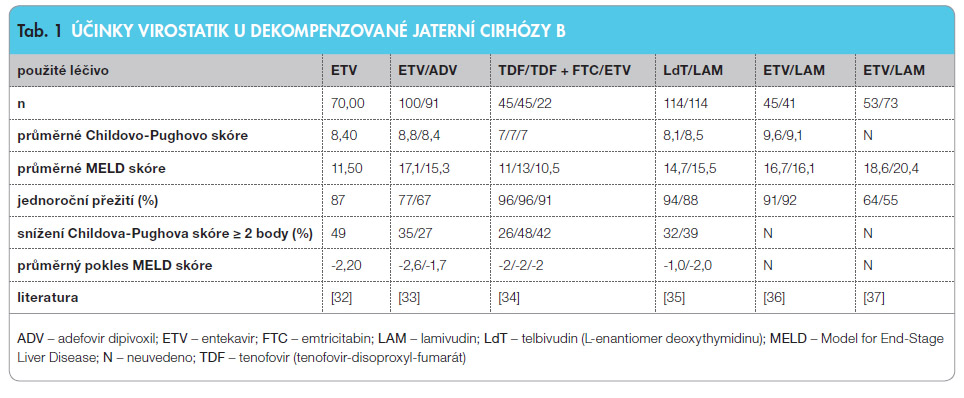 podání protivirové terapie pacientům s dekompenzovanou jaterní cirhózou. Výběr studií a několika základních hodnocených parametrů ukazuje tab. 1. Konvenční IFN i PEG-IFN jsou považovány za kontraindikované v této indikaci pro riziko fatálních komplikací. Studie vzhledem k rozdílnosti uspořádání a vstupních kritérií nelze srovnávat proti sobě, nicméně je zjevné, že všichni autoři dosáhli významného poklesu (tj. zlepšení) v Childově-Pughově klasifikaci i v MELD (Model for End-Stage Liver Disease) skóre, tedy ve dvou nejdůležitějších a prognosticky nejlépe validovaných systémech hodnocení jaterní dysfunkce.
podání protivirové terapie pacientům s dekompenzovanou jaterní cirhózou. Výběr studií a několika základních hodnocených parametrů ukazuje tab. 1. Konvenční IFN i PEG-IFN jsou považovány za kontraindikované v této indikaci pro riziko fatálních komplikací. Studie vzhledem k rozdílnosti uspořádání a vstupních kritérií nelze srovnávat proti sobě, nicméně je zjevné, že všichni autoři dosáhli významného poklesu (tj. zlepšení) v Childově-Pughově klasifikaci i v MELD (Model for End-Stage Liver Disease) skóre, tedy ve dvou nejdůležitějších a prognosticky nejlépe validovaných systémech hodnocení jaterní dysfunkce.
Závěr
Výše uvedená data poměrně jednoznačně ukazují, že veškeré dostupné varianty protivirové léčby vedou z dlouhodobého pohledu k velmi pozitivním výsledkům u pacientů s chronickou HBV infekcí, HBeAg-pozitivních i HBeAg-negativních, v různém stadiu jaterního postižení. Podařilo se opakovaně prokázat, že v případě trvalé zástavy replikace (a tím spíše při eliminaci viru, tj. dosažení negativity HBsAg) dochází k zastavení progrese onemocnění, či dokonce k histologické regresi. Významným zjištěním je, že jaterní cirhóza je reverzibilní. Dalším významným účinkem protivirové léčby je významný pokles incidence HCC, jehož léčebné možnosti nejsou stále příliš uspokojivé, a to i přes nepochybný pokrok, jenž byl v posledních letech v této oblasti učiněn.
Seznam použité literatury
- [1] Liaw YF, Chu CM. Hepatitis B virus infection. Lancet 2009; 373: 582–589.
- [2] Liaw YF. Impact of hepatitis B therapy on the long-term outcome of liver disease. Liver Int 2011; 31 (Suppl. 1): 117–121.
- [3] Iloeje UH, Yang HI, Su J, et al. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load. Gastroenterology 2006; 130: 678–686.
- [4] Chen CJ, Yang HI, Su J, et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA 2006; 295: 65–73.
- [5] Liaw YF, Kao JH, Piratvisuth T, et al. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2012 update. Hepatol Int 2012; 6: 531–561.
- [6] Marcellin P, Asselah T, Boyer N. Treatment of chronic hepatitis B. J Viral Hepat 2005; 12: 333–345.
- [7] Lin SM, Yu ML, Lee CM, et al. Interferon therapy in HBeAg positive chronic hepatitis reduces cirrhosis and hepatocellular carcinoma. J Hepatol 2007; 46: 45–52.
- [8] Lin SM, Sheen IS, Chien RN, et al. Long-term beneficial effect of interferon therapy in patients with chronic hepatitis B virus infection. Hepatology 1999; 29: 971–975.
- [9] Niederau C, Heintges T, Lange S, et al. Long-term follow up of HBeAg positive patients treated with interferon alfa for chronic hepatitis B. N Engl J Med 1996: 334: 1422–1427.
- [10] Fattovich G, Giustina G, Sanchez-Tapias J, et al. Delayed clearance of serum HBsAg in compensated cirrhosis B: relation to interferon alpha therapy and disease prognosis. Europen Concerted Action on Viral Hepatitis (EUROHEP). Am J Gatroenterol 1998; 93: 896–900.
- [11] Papatheodoridis GV, Petraki K, Cholongitas E, et al. Impact of interferon-alpha therapy on liver fibrosis progression in patients with HBeAg negative chronic hepatitis B. J Viral Hepat 2005; 12: 199–206.
- [12] Brunetto MR, Oliveri F, Coco B, et al. Outcome of anti-HBe positive chronic hepatitis B in alpha-interferon treated and untreated patients: a long term cohort study. J Hepatol 2002; 36: 263–270.
- [13] Buster EH, Flink HJ, Cakaloglu Y, et al. Sustained HBeAg and HBsAg loss after long-term follow-up of HBeAg-positive patients treated with peginterferon alpha-2b. Gastroenterology 2008; 135: 459–467.
- [14] Marcellin P, Bonino F, Lau GK, et al. Sustained response of hepatitis B e antigen-negative patients 3 years after treatment with peginterferon alpha-2a. Gastroenterology 2009; 136: 2169–2179.
- [15] Lampertico P, Del Ninno E, Vigano M, et al. Long-term suppression of hepatitis B e antigen-negative chronic hepatitis B by 24-month interferon therapy. Hepatology 2003; 37: 756–763.
- [16] Sung JJ, Tsoi KK, Wong VW, et al. Meta-analysis: treatment of hepatitis B infection reduces risk of hepatocellular carcinoma. Aliment Pharmacol Ther 2008; 28: 1067–1077.
- [17] Yang YF, Zhao W, Zhong YD, et al. Interferon therapy in chronic hepatitis B reduces progression to cirrhosis and hepatocellular carcinoma: a meta-analysis. J Viral Hepat 2009; 16: 265–271.
- [18] Miyake Y, Kobashi H, Yamamoto. Meta-analysis: the effect of interferon on development of hepatocellular carcinoma in patients with chronic hepatitis B virus infection. J Gastroenterol 2009; 44: 470–475.
- [19] Dienstag JL, Golidn RD, Heathcote EJ, et al. Histopatological outcome during long-term lamivudine therapy. Gastroenterology 2006; 131: 1743–1751.
- [20] Marcellin P, Chang TT, Lim SG, et al. Long-term efficacy and safety of adefovir dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis B. Hepatology 2008; 48: 750–758.
- [21] Yuen MF, Seto WK, Chow DHF, et al. Long-term lamivudine therapy reduces the risk of long-term complications of chronic hehaptitis B infection even in patients without advanced disease. Antiviral Therapy 2007; 12: 1295–1303.
- [22] Liaw XF, Sung JY, Chow WC, et al. On behalf of the CALM study group. Lamivudine for patients with chronic hepatitis B and advanced liver disease. N Engl J Med 2004; 351: 1521–1531.
- [23] Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, et al. Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B for up to 5 years. Gastroenterology 2006; 131: 1743–1751.
- [24] Yokosuka O, Takaguchi K, Fujioka S, et al. Long-term use of entecavir in nucleoside-naïve Japanese patients with chronic hepatitis B infection. J Hepatol 2010; 52: 791–799.
- [25] Chang TT, Liaw YF, Wu SS, et al. Long-term entecavir therapy results in the reversal of fibrosis/cirrhosis and continued histological improvement in patients with chronic hepatitis B. Hepatology 2010; 52: 886–893.
- [26] Zoutendijk R, Reijnders JG, Zoulim F, et al. Virological response to entecavir is associated with a better clinical outcome in chronic hepatitis B patients with cirrhosis. Gut 2013; 62: 760–765.
- [27] Marcellin P, Gane E, Buti M, et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: a 5-year open-label follow-up study. Lancet 2013; 381: 468–475.
- [28] Pan CQ, Hu KQ, Tsai N. Long-term therapy with nucleoside/nucleotide analogues for chronic hepatitis B in Asian patients. Antivir Ther 2012; doi: 10.3851/IMP2481. [Epub ahead of print].
- [29] Kim CH, Um SH, Seo YS, et al. Prognosis of hepatitis B-related liver cirrhosis in the era of oral nucleos(t)ide analog antiviral agents. Gastroenterol Hepatol 2012; 27: 1589–1595.
- [30] Aghemo A, Lampertico P, Colombo M. Assessing long-term treatment efficacy in chronic hepatitis B and C: between evidence and common sense. J Hepatol 2012; 57: 1326–1335. doi: 10.1016/j.jhep.2012.06.025. Epub 2012 Jun 28. Review.
- [31] Kumada T, Toyoda H, Tada T, et al. Effect of nucleos(t)ide analogue therapy on hepatocarcinogenesis in chronic hepatitis B patients: a propensity score analysis. J Hepatol 2013; 58: 427–433.
- [32] Shim JH, Lee HC, Kim KM, et al. Efficacy of entecavir in treatment-naïve patients with hepatitis B virus-related decompensated cirrhosis. J Hepatol 2010; 52: 176–182.
- [33] Liaw YF, Raptopoulou-Gigi M, Cheinquer H, et al. Efficacy and safety of entecavir versus adefovir in chronic hepatitis B patients with hepatic decompensation: a randomized, open-label study. Hepatology 2011; 54: 91–100.
- [34] Liaw YF, Sheen IS, Lee CM, et al. Tenofovir disoproxil fumarate (TDF), emtricitabine/TDF, and entecavir in patients with decompensated chronic hepatitis B liver disease. Hepatology 2011; 53: 62-72.
- [35] Chan HL, Chen YC, Gane EJ, et al. Randomized clinical trial: efficacy and safety of telbivudine and lamivudine in treatment-naïve patients with HBV-related decompensated cirrhosis. J Viral Hepat 2012; 19: 732–743.
- [36] Hyun JJ, Seo YS, Yoon E, et al. Comparison of the efficacies of lamivudine versus entecavir in patients with hepatitis B virus-related decompensated cirrhosis. Liver Int 2012; 32: 656–664.
- [37] Hsu YC, Mo LR, Chang CY, et al. Entecavir versus lamivudine in the treatment of chronic hepatitis B patients with hepatic decompensation. Antivir Ther 2012; 17: 605–612.