Dnavá artritida – současné možnosti farmakoterapie
Souhrn:
Dna v širším slova smyslu představuje heterogenní skupinu metabolických onemocnění, pro kterou je charakteristická tvorba a ukládání krystalů natrium
urátu v různých tkáních. Jako hyperurikemii označujeme patologické zvýšení sérové koncentrace kyseliny močové. Dna postihuje přibližně 1–2 % dospělé populace vyspělých zemí a její prevalence v posledních desetiletích narůstá. I přes znalost patogeneze a klinického obrazu onemocnění nebývá často dna diagnostikována správně a včas, léčba onemocnění není správně vedena, což může vyústit v poškození struktury kloubů vedoucí k poklesu fyzických schopností a ke zhoršení kvality života nemocných. Hlavním nezávislým rizikovým faktorem vývoje dny je hyperurikemie. Časnou manifestací dny může být akutní dnavý záchvat. Pokud dojde z důvodu depozice krystalů natrium urátu k destrukci struktur pohybového aparátu, označujeme tento stav jako chronickou tofózní dnu. Nezbytnou podmínkou pro úspěšnou léčbu dny je snížení sérové koncentrace kyseliny močové pod hodnotu 360 μmol/l a její dlouhodobé udržení, což umožní rozpuštění urátových usazenin v tkáních a zabrání jejich tvorbě. Článek se zabývá současnými možnostmi léčby jednotlivých stadií dny: léčbou asymptomatické hyperurikemie, akutního dnavého záchvatu, léčbou v interkritickém období a léčbou chronické tofózní dny. Nezbytnou součástí léčby symptomatické hyperurikemie je i profylaktická léčba dnavých záchvatů. Zmíněny jsou rovněž nové možnosti léčby hyperurikemie a akutního dnavého záchvatu pomocí pegylované urikázy a inibitoru IL-1β canakinumabu. Text vychází z aktuálních národních a mezinárodních doporučení k léčbě hyperurikemie a dny.
Key words: gout , hyperuricemia , uric acid, allopurinol, febuxostat, colchicine, pegloticase, canakinumab.
Summary:
Gout is a heterogeneous group of metabolic diseases which is characterized by the formation and deposition of sodium urate crystals in various tissues. Hyperuricemia is a pathological increase in serum uric acid concentration. Gout aff ects approximately 1–2% of adults in developed countries, and its prevalence is increasing in recent decades. Despite knowledge of the pathogenesis and clinical manifestation of the disease, gout is often not diagnosed correctly and early, treatment is not well managed, which can result in damage of the joint structure, leading to decline in physical abilities and deterioration in the quality of life of patients. Hyperuricemia is a major independent risk factor for development of gout. Acute gout attack may be an early manifestation of gout. Chronic tophaceous gout indicates the state when the structures of the musculoskeletal system are destructed by the deposition of sodium urate crystals. The reduction and long-term maintenance of serum uric acid concentrations below 360 μmol/l is a necessary prerequisite of successful treatment of gout which allows the dissolution of urate deposits in tissues and prevents their formation. The article deals with current treatment options at each stage of the gout, treatment of asymptomatic hyperuricemia, acute gout attack, intercritical period, and chronic tophaceous gout. Prophylactic treatment of gout fl ares is also an essential part of the treatment of symptomatic hyperuricemia. New treatment options of hyperuricemia and acute gout attack with pegylated uricase and IL-1β inhibitor canakinumab are also mentioned. The text is based on current national and international guidelines for the treatment of hyperuricemia and gout.
Úvod
Dna v širším slova smyslu představuje heterogenní skupinu metabolických onemocnění, pro kterou je charakteristická tvorba a ukládání krystalů natrium urátu v různých tkáních. Jako dnavá artritida je označován klinický revmatologický syndrom, který vzniká u jedinců s hyperurikemií a představuje zánětlivé postižení pohybového aparátu spojené s přítomností krystalů natrium urátu. Jako hyperurikemii pak označujeme patologické zvýšení sérové koncentrace kyseliny močové.
Dnou trpí až 5 milionů obyvatel Evropské unie a přibližně 8,3 milionu obyvatel Spojených států amerických. Dna postihuje přibližně 1–2 % dospělých ve vyspělých zemích a stává se tak nejčastější artritidou postihující zejména muže starší 40 let [1–4]. Muži bývají dnou postiženi 4–9krát častěji než ženy. Prevalence onemocnění narůstá s věkem, například ve Velké Británii trpí dnou přes 7 % mužů starších 65 let a téměř 3 % žen starších 85 let [2]. Některé studie naznačují, že incidence dny se zvýšila od sedmdesátých let minulého století více než dvojnásobně [5]. Například data získaná ze dvou národních průzkumů zdravotního stavu obyvatelstva USA (National Health and Nutrition Examination Survey – NHANES) prováděných v letech 1988–1994 a 2007–2008 prokázala, že prevalence dny v tomto období stoupla o 1,2 % a prevalence hyperurikemie dokonce o 3,2 % [6]. V letech 2007–2008 byla hyperurikemie prokázána u 21,1 % mužů a 4,7 % žen a dnou trpělo 5,9 % mužů a 2,0 % žen. K nejčastěji uváděným faktorům vedoucím k nárůstu prevalence dny patří vyšší průměrný věk, častější onemocnění ledvin, narůstající prevalence obezity, změna stravovacích návyků nebo extenzivní používání některých léčiv (diuretika).
I přes znalost patogeneze a klinického obrazu onemocnění nebývá často dna diagnostikována správně a včas, léčba onemocnění není správně vedena, což může vyústit v poškození struktury kloubů s následným poklesem fyzických schopností a zhoršením kvality života nemocných.
Hyperurikemie
Nejvýznamnějším ovlivnitelným rizikovým faktorem pro vývoj dny je hyperurikemie. Její prevalence v populaci je udávána v rozmezí 4–40 % [7]. Kyselina močová je u člověka konečným produktem metabolismu purinových nukleotidů.
Příčinou hyperurikemie může být zvýšený příjem purinů potravou závislý na množství a skladbě stravy a konzumaci alkoholu. K nadprodukci kyseliny močové v organismu přispívá i konzumace nápojů slazených fruktózovým sirupem. Údaje z USA v této souvislosti ukazují nejen na zvyšující se výskyt hyperurikemie, ale i na rostoucí prevalenci poruch metabolismu glukózy, obezity a metabolického syndromu (MetS) [8]. Další příčinou hyperurikemie může být nadprodukce kyseliny močové v důsledku vrozeného metabolického defektu (např. deficit hypoxantin‑guanin fosforibosyltransferázy známý jako Leschův‑Nyhanův syndrom), zvýšená aktivita fosforibosylpyrofosfát syntetázy) nebo v důsledku zvýšeného buněčného obratu (karcinomy, myeloproliferativní onemocnění, hemolytická anémie, psoriáza, chemoterapie, radioterapie). Často je však příčina nadprodukce kyseliny močové neznámá. Nejčastější příčinou hyperurikemie (90 %) je však snížená exkrece kyseliny močové ledvinami. Může být hereditární nebo je důsledkem poklesu renálních funkcí (chronické onemocnění ledvin, laktátová acidóza) nebo užívání některých léčiv (kličková diuretika, tacrolimus, ciclosporin, kyselina acetylsalicylová).
Dnavá artritida
Dnavá artritida je zánětlivé postižení pohybového aparátu, které se může vyvinout jako následek hromadění urátů ve strukturách pohybového aparátu. Riziko vývoje dny narůstá se zvyšující se sérovou koncentrací kyseliny močové. Prospektivní hodnocení, které sledovalo 2 046 zdravých dobrovolníků po dobu 14,9 roku, prokázalo významný nárůst incidence dny v závislosti na výši urikemie [9]. Roční incidence dny ve skupině osob s hodnotou urikemie nižší než 416 µmol/l byla 0,1 %, ale stoupla na 4,9 % ve skupině osob s urikemií převyšující 530 µmol/l. Incidence dny byla rovněž třikrát vyšší u pacientů s hypertenzí. K dalším prediktivním faktorům vývoje dny závislým na výši urikemie patřily věk, hodnota body mass indexu (BMI), sérová koncentrace cholesterolu a konzumace alkoholu.
 Definitivním potvrzením diagnózy dnavé artritidy je průkaz krystalů natrium urátu v synoviální tekutině získané punkcí kloubní dutiny nebo v aspirátu z dnavého tofu. K průkazu negativně dvojlomných krystalů kyseliny močové se nejčastěji používá polarizační, případně elektronový mikroskop nebo je možný chemický průkaz tzv. murexidovou reakcí. Není‑li výpotek nebo aspirát z dnavého tofu dostupný, je možné dnavou artritidu diagnostikovat pomocí klasifikačních kritérií American College of Rheumatology (ACR) tab. 1. Samotný průkaz hyperurikemie není dostačující pro diagnózu dnavé artritidy. Značná část akutních dnavých záchvatů může být provázena normální nebo jen lehce zvýšenou sérovou koncentrací kyseliny močové.
Definitivním potvrzením diagnózy dnavé artritidy je průkaz krystalů natrium urátu v synoviální tekutině získané punkcí kloubní dutiny nebo v aspirátu z dnavého tofu. K průkazu negativně dvojlomných krystalů kyseliny močové se nejčastěji používá polarizační, případně elektronový mikroskop nebo je možný chemický průkaz tzv. murexidovou reakcí. Není‑li výpotek nebo aspirát z dnavého tofu dostupný, je možné dnavou artritidu diagnostikovat pomocí klasifikačních kritérií American College of Rheumatology (ACR) tab. 1. Samotný průkaz hyperurikemie není dostačující pro diagnózu dnavé artritidy. Značná část akutních dnavých záchvatů může být provázena normální nebo jen lehce zvýšenou sérovou koncentrací kyseliny močové.
Ve vývoji dny klasicky rozlišujeme čtyři stadia:
- asymptomatická hyperurikemie,
- akutní dnavý záchvat,
- interkritické období,
- chronická tofózní dna.
K typickému klinickému obrazu akutní dny patří dnavý záchvat projevující se nejčastěji akutní monoartritidou, případně oligoartritidou, postihující zejména klouby na dolních končetinách (metatarzofalangeální klouby, nárt, hlezenní a kolenní klouby). Monoartritida představuje 85–90 % primárních záchvatů dny, nejčastěji (50–60 %) postihujících metatarzofalangeální kloub palce nohy (tzv. klasická podagra), obr. 1. Akutní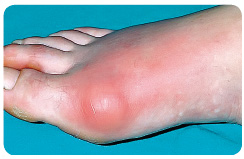 dnavý záchvat vzniká náhle, často v průběhu druhé poloviny noci, postižený kloub je výrazně bolestivý, oteklý, kůže v jeho okolí je zarudlá, napjatá a horká. Nejvyšší intenzity dosahuje artritida prvních 24 hodin a obvykle odeznívá během jednoho až dvou týdnů.
dnavý záchvat vzniká náhle, často v průběhu druhé poloviny noci, postižený kloub je výrazně bolestivý, oteklý, kůže v jeho okolí je zarudlá, napjatá a horká. Nejvyšší intenzity dosahuje artritida prvních 24 hodin a obvykle odeznívá během jednoho až dvou týdnů.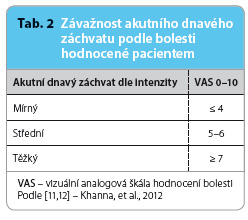
Ve svých doporučených postupech k léčbě dny navrhla ACR rozdělení závažnosti akutního dnavého záchvatu podle bolesti hodnocené pacientem na vizuální analogové škále (VAS) na mírný, středně těžký a těžkýtab. 2. Z hlediska časového průběhu doporučuje ACR rozdělit jednotlivé fáze dnavého záchvatu na časnou, etablovanou a pozdní fázi, tab. 3. Dále je možné akutní dnavý záchvat rozdělit podle počtu a velikosti postižených kloubů, tab. 4.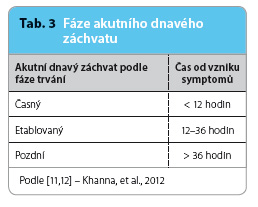
V posledních letech přibývá pacientů s tzv. atypickým průběhem dny. Postiženi bývají často jedinci starší 65 roků, u nichž bývá častěji přítomna polyartritida postihující zejména drobné klouby na rukouobr. 2. V anamnéze těchto pacientů nalézáme chronické onemocnění ledvin nebo časté používání diuretik, naopak méně často klasické rizikové faktory vývoje dny (obezitu, hypertenzi, dyslipidemii).
Asymptomatické období mezi jednotlivými záchvaty akutní dnavé artritidy se označuje jako i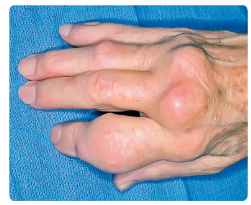 nterkr
nterkr itické období. Pokud dojde z důvodu depozice krystalů natrium urátu k destrukci tkání pohybového aparátu, označuje se tento stav jako chronická tofózní dna (5–10 % pacientů), obr. 3. Při ní nalézáme dnavé tofy ve strukturách pohybového aparátu (kost, chrupavka, kloubní pouzdro, šlachy, vazy), ale i mimo něj (ušní boltce, ulnární hrana předloktí, okolí kloubů palců nohou, kloubů rukou, na loktech). Současně dochází k rozvoji sekundární osteoartrózy postižených kloubů. Poškození struktur pohybového aparátu vede k významnému poklesu fyzických schopností a ke zhoršení kvality života nemocných s chronickou tofózní dnou
itické období. Pokud dojde z důvodu depozice krystalů natrium urátu k destrukci tkání pohybového aparátu, označuje se tento stav jako chronická tofózní dna (5–10 % pacientů), obr. 3. Při ní nalézáme dnavé tofy ve strukturách pohybového aparátu (kost, chrupavka, kloubní pouzdro, šlachy, vazy), ale i mimo něj (ušní boltce, ulnární hrana předloktí, okolí kloubů palců nohou, kloubů rukou, na loktech). Současně dochází k rozvoji sekundární osteoartrózy postižených kloubů. Poškození struktur pohybového aparátu vede k významnému poklesu fyzických schopností a ke zhoršení kvality života nemocných s chronickou tofózní dnou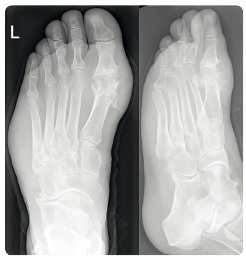 .
.
Komorbidity a mortalita pacientů s hyperurikemií a dnou
Hyperurikemie a dna jsou spojeny s vyšším výskytem přidružených onemocnění zahrnujících dyslipidemii, hypertenzi, diabetes mellitus, chronické onemocnění ledvin nebo MetS. Podle NHANES III je riziko vývoje MetS u pacientů s dnou zvýšeno téměř pětinásobně [14]. Řada prací prokázala, že celková a kardiovaskulární (KV) mortalita pacientů s dnou je zvýšená [15]. Rovněž samotná asymptomatická hyperurikemie představuje nezávislý rizikový faktor celkové i KV mortality [16].
Léčba hyperurikemie a dny
Léčbu dny lze rozdělit do několika kroků odpovídajících jednotlivým stadiím onemocnění:
- léčba asymptomatické hyperurikemie,
- léčba akutního dnavého záchvatu,
- léčba v interkritickém období,
- léčba chronické tofózní dny.
Důležitou součástí léčby je i terapie přidružených onemocnění, případně chirurgická léčba. V léčbě hyperurikemie a dny je nutno využít kombinaci nefarmakologických a farmakologických léčebných postupů.
Léčba asymptomatické hyperurikemie
Jak již bylo uvedeno, hyperurikemie představuje nejvýznamnější nezávislý rizikový faktor vývoje dny, ale může být rovněž rizikem pro vývoj některých přidružených onemocnění. Zdá se, že toto riziko narůstá s výší urikemie. Ve fázi asymptomatické hyperurikemie lze doporučit zejména režimová a dietní opatření. Obecně je doporučován zdravý životní styl [13,16,17]. Přímé důkazy pro to, že by intervence životního stylu významně zlepšovaly stav a prognózu pacientů s hyperurikemií a dnou, však většinou chybějí [18–20]. Z režimových opatření lze doporučit redukci hmotnosti u osob s nadváhou a obezitou, pravidelnou pohybovou aktivitu nebo cvičení, nekuřáctví, omezení konzumace alkoholu (zejména piva a destilátů) a pravidelný a dostatečný příjem tekutin, který zajistí přiměřenou hydrataci organismu. Z dietních opatření se doporučuje vyhnout se konzumaci vnitřností (játra, brzlík), omezit konzumaci potravin s vysokým obsahem purinů (maso, mořští korýši) a potravin a nápojů doslazovaných fruktózovým sirupem, dodatečné dosolování a přislazování pokrmů.
U pacientů s asymptomatickou hyperurikemií by měla být sledována přítomnost přidružených onemocnění (porucha metabolismu glukózy, dyslipidemie, hypertenze, chronické onemocnění ledvin) a tato onemocnění by měla být adekvátně léčena [17]. V neposlední řadě je nutné myslet na racionální farmakoterapii léčivy, která mohou zvyšovat urikemii (diuretika).
Podávání léčiv snižujících sérovou koncentraci kyseliny močové (ULT, urate‑lowering therapy) je v tomto stadiu vyhrazeno podle některých doporučení pouze pacientům s urikemií opakovaně vyšší než 540 µmol/l, u kterých je významně zvýšeno riziko vývoje orgánových komplikací [13]. Kyselina močová může navozením oxidačního stresu přispívat k vývoji endoteliální dysfunkce. Prokázán byl vztah k riziku vývoje MetS [14]. V současné době se diskutuje, zda lze ULT doporučit u osob s asymptomatickou hyperurikemií s vysokým KV rizikem. Avšak přesvědčivé důkazy o tom, že by ULT jednoznačně snižovala KV riziko, doposud nejsou k dispozici. V této fázi léčby lze využít i urikosurického působení některých antihypertenziv (losartan) nebo hypolipidemik (fenofibrát).
Léčba akutního dnavého záchvatu
Léčba akutního dnavého záchvatu by měla být komplexní, včasná a razantní. Důvodem je zejména vysoká intenzita zánětlivé odpovědi v prvních 24 hodinách záchvatu spojená s výraznými klinickými projevy. Při rozhodování o léčebné strategii by měly být zvažovány faktory, jako je závažnost a délka trvání akutního dnavého záchvatu, odpověď na léčbu, celkový zdravotní stav pacienta a rizikový profil používaných léků.
Z nefarmakologických opatření lze doporučit klidový režim a aplikace chladu (lokální kryoterapie) na postižený kloub. Protizánětlivá léčba by měla být zahájena co nejdříve, ideálně během 24 hodin od vzniku akutního dnavého záchvatu. K léčbě akutního dnavého záchvatu doporučuje ACR použít nesteroidní antiflogistika (NSA), kolchicin, lokálně nebo celkově podané glukokortikoidy (GK), adrenokortikotropní hormon (ACTH), případně po schválení biologická léčiva ze skupiny inhibitorů interleukinu 1 (IL‑1) [21–23].
Na základě analýzy odborné literatury, kterou provedli specialisté podílející se na vytváření evropských doporučení k léčbě dny, bylo identifikováno celkem 26 klinických studií prokazujících účinek výše jmenovaných lékových skupin v léčbě akutní dnavé artritidy (21 studií hodnotilo NSA, pět GK, dvě kolchicin a jedna canakinumab) [23–46]. V návodech ACR je doporučeno použití monoterapie u záchvatů mírné a střední intenzity a zvážení kombinované léčby u pacientů s těžkým dnavým záchvatem [11]. V případě selhání primární léčby (ACR definuje selhání jako < 20% zmírnění bolesti během 24 hodin nebo < 50% zmírnění bolesti za 24 a více hodin od zahájení léčby) ACR doporučuje změnu lékové skupiny, případně použití kombinace dvou lékových skupin doporučovaných k léčbě akutní dny. Po vyčerpání všech možností standardní léčby je možné použít inhibitory IL‑1. Při selhání léčby je rovněž nutné zvážit, zda se skutečně jedná o projevy akutní dny. Doposud chybějí důkazy, které by prokázaly superioritu použití některé z výše uvedených lékových skupin v léčbě akutní dny. Proto je doporučeno postupovat při výběru jednotlivých lékových skupin individuálně, zejména s ohledem na celkový zdravotní stav pacienta a rizikový profil jednotlivých přípravků.
U pacientů, u kterých perorální podání léčiv není možné, lze podle aktuálních doporučení použít v případě postižení 1–2 kloubů jako alternativní postup intraartikulární podání GK, v ostatních případech intravenózní nebo intramuskulární podání methylprednisolonu v iniciální dávce 0,5–2,0 mg/kg s opakováním podle potřeby nebo subkutánní podání ACTH v iniciální dávce 25–40 IU, rovněž s možností opakování léčby v případě nutnosti [11]. Použití syntetického analoga ACTH (tetracosactid) v léčbě akutního dnavého záchvatu není v České republice doporučováno. Pro podání inhibitorů IL‑1 v těchto situacích neexistuje dostatek důkazů.
Podle doporučení ACR není vhodné používat k léčbě akutního dnavého záchvatu alternativní doplňky stravy zahrnující například třešňový džus, extrakt z vrbové kůry, zázvor, lněné semínko, živočišné uhlí, jahody, černý rybíz, lopuch, zakysanou smetanu, olivový olej, přesličku, hrušky nebo celer. Pro účinnost takového postupu neexistuje žádný medicínský důkaz.
Nesteroidní antiflogistika
Nejužívanější lékovou skupinou v léčbě akutní dnavé artritidy jsou NSA. Jejich protizánětlivé působení je zprostředkováno inhibicí produkce prostaglandinů prostřednictvím blokády cyclooxygenázy (COX), klíčového enzymu syntézy prostaglandinů. Pokud je léčba NSA zahájena včas, vede k potlačení dnavého záchvatu během 5–8 dnů až u 90 % pacientů. Srovnávací studie, které byly provedeny, nevedly k doporučení konkrétního NSA v léčbě akutní dny [25–41]. Historicky nejpoužívanějším léčivem se stal indometacin. K léčbě akutního dnavého záchvatu lze ale doporučit jakékoli NSA v protizánětlivé dávce včetně léčiv specifických pro COX‑2. Výhodné je použití NSA s rychlým nástupem účinku. Při výběru konkrétního léčiva je nutné respektovat jeho rizikový profil (gastrointestinální, kardiovaskulární a renální riziko). U pacientů s vysokým rizikem NSA indukované gastropatie lze použít NSA specifická pro COX‑2 nebo jako alternativu kombinaci NSA s inhibitorem protonové pumpy [47–49]. Žádné klinické hodnocení doposud netestovalo použití paracetamolu v léčbě akutního dnavého záchvatu, přesto lze paracetamol použít pro jeho přídavný analgetický účinek.
Kolchicin
Léčebnou alternativou, zejména jsou‑li NSA kontraindikována nebo v případě diagnostických rozpaků, je použití kolchicinu. Kolchicin je přírodní alkaloid pocházející z ocúnu podzimního (Colchicum autumnale). Kolchicin působí jako mitotický jed a má silný protizánětlivý účinek. Vazbou na tubulinové struktury polymorfonukleárních leukocytů ovlivňuje některé jejich funkce, jako je schopnost fagocytózy, motilita, adhezivita nebo produkce prostaglandinů. Kolchicin se po perorálním podání dobře vstřebává, maximální koncentrace v plazmě dosahuje za 2 hodiny a jeho plazmatický poločas je 4 hodiny. Kolchicin je dostupný v tabletách o síle 0,5 mg nebo 0,6 mg. V České republice jsou registrovány pouze tablety s obsahem 0,5 mg kolchicinu. Působení kolchicinu je relativně specifické pro dnavou artritidu, a proto je jeho použití doporučeno i v případech diagnostických rozpaků.
Nejlepšího účinku dosahuje kolchicin, je‑li léčba zahájena během prvních 24 hodin (resp. 36 hodin) od vzniku akutního dnavého záchvatu. Podle současných doporučení je vhodnější podávat kolchicin v nízkých dávkách, to je dvě tablety kolchicinu v úvodu a následně jednu tabletu s odstupem jedné hodiny [11,13,17]. Dvě klinická hodnocení prokázala, že nízké dávky kolchicinu (1,8 mg denně) jsou účinnější než placebo, srovnatelně účinné jako vysoké dávky kolchicinu (4,8 mg denně), ale na rozdíl od vysokých dávek mají příznivější bezpečnostní profil [45,46]. Délka podávání kolchicinu je většinou 1–3 dny. Intravenózní forma kolchicinu není v České republice registrována a její použití není doporučováno z důvodu vyšší toxicity.
Glukokortikoidy
K léčbě akutní dnavé artritidy lze použít GK aplikované intraartikulárně nebo celkově perorálně, intravenózně nebo intramuskulárně.
Tři klinické studie prokázaly srovnatelnou účinnost a bezpečnostní profil systémově podaných GK v porovnání s NSA [42–44]. Systémové podání GK je možné zejména u polyartikulární nebo oligoartikulární formy dnavého záchvatu, a to v případě neúspěchu nebo kontraindikace léčby NSA a/nebo kolchicinem. Doporučovaná dávka prednisonu je 30 mg podávaných 1–3 dny s následnou redukcí dávky a ukončením léčby během 1–2 týdnů. Zlepšení je patrné obvykle za 12–48 hodin. Doporučení ACR uvádějí použití prednisonu nebo methylprednisolonu v úvodní dávce 0,5 mg/kg po dobu 5–10 dní, alternativně po dobu 2–5 dní s následnou redukcí dávky a ukončením léčby během 7–10 dnů [11]. Diskutovaným problémem je vyšší výskyt nových záchvatů dny, k němuž dochází v důsledku tzv. rebound fenoménu při příliš rychlé redukci dávky GK. Alternativou může být parenterální podání GK, ale proti perorálnímu podání neposkytuje žádné další výhody. Výjimkou je nemožnost perorálního příjmu.
Intraartikulární aplikace GK spojená s aspirací synoviální tekutiny je vhodná zejména u pacientů s postižením 1–2 kloubů vhodných k punkci. Vede většinou k odeznění záchvatu během 12–24 hodin. Kvalitní důkazy pro takový postup však nejsou k dispozici. Podle ACR je vhodné intraartikulární podání triamcinolon acetonidu v dávce 60 mg s následnou léčbou perorálním prednisonem [11]. Z důvodu bezpečnosti léčby GK je nutné před jejich aplikací do kloubu vyloučit, že se jedná o septickou artritidu.
Inhibice interleukinu 1
K použití biologických léčiv blokujících působení IL‑1 přispělo poznání role tohoto cytokinu v patogenezi dnavého záchvatu. Interleukin 1β je klíčový cytokin spouštějící zánětlivou reakci u akutního dnavého záchvatu. Je tvořen zejména v makrofázích, poté co urátové krystaly aktivují multimolekulový signální komplex označovaný jako inflamasom. Enzym kaspáza 1, který je součástí tohoto komplexu, přeměňuje pro‑IL‑1β na aktivní IL‑1β. Účinek tohoto cytokinu je zprostředkován vazbou na specifický receptor. Vyvinuta a klinicky testována byla tři biologická léčiva: anakinra, která se váže na podjednotku receptoru pro IL‑1 (IL‑1R1), rilonacept, který se váže na IL‑1α a je antagonistou receptoru pro IL‑1 (IL‑1Ra), a canakinumab, který se selektivně váže na IL‑1β. Regulační orgány European Medicines Agency (EMA) i Food and Drug Administration (FDA) povolily v indikaci akutní dnavé artritidy pouze použití canakinumabu.
Canakinumab je plně humánní monoklonální protilátka proti lidskému IL‑1β. Jeho klinická účinnost a bezpečnost byla u pacientů s recidivujícími dnavými záchvaty ověřena ve dvou randomizovaných, dvojitě zaslepených klinických studiích III. fáze [50,51]. Do těchto studií byli zařazováni pacienti s minimálně třemi dnavými záchvaty v uplynulém roce, kteří nedostatečně odpovídali na léčbu kolchicinem nebo NSA nebo u kterých léčba těmito přípravky vedla k výskytu nežádoucích účinků nebo byla kontraindikovaná. Pacienti byli randomizováni k podání canakinumabu v dávce 150 mg subkutánně (n = 225) nebo triamcinolon acetonidu v dávce 40 mg intramuskulárně (n = 229) do 5 dní od vzniku dnavého záchvatu. Primárními cílovými ukazateli studie byla intenzita bolesti hodnocená pacientem na VAS 72 hodin od podání studijního léku a doba do dalšího dnavého záchvatu. Společná analýza obou studií prokázala, že canakinumab vedl ke statisticky významnějšímu snížení bolesti již za 24 hodin od podání. Canakinumab ve srovnání s triamcinolon acetonidem rovněž statisticky významně prodloužil dobu do dalšího dnavého záchvatu. Hodnocení bezpečnosti prokázalo vyšší výskyt nežádoucích účinků při léčbě canakinumabem v porovnání s léčbou triamcinolon acetonidem (66 % vs. 53 %) a vyšší výskyt infekcí (20 % vs. 10 %) během 24týdenního sledování.
Canakinumab je indikován k léčbě pacientů s častými akutními dnavými záchvaty (3 a více během předchozích 12 měsíců), u kterých léčba NSA anebo kolchicinem nebyla dostatečně účinná nebo v případech, kdy tato léčba nebyla tolerována nebo byla kontraindikována, a dále u pacientů, u nichž není vhodné opakované podání GK. Při léčbě canakinumabem je nezbytné, aby byla adekvátně kontrolována sérová koncentrace kyseliny močové pomocí ULT. Canakinumab se aplikuje v jedné denní dávce 150 mg subkutánně v případě potřeby, tedy co nejdříve po vzniku dnavého záchvatu. Při dobré léčebné odpovědi lze podání opakovat nejdříve po uplynutí 12 týdnů. Použití canakinumabu je momentálně podmíněno schválením revizního lékaře zdravotní pojišťovny na základě splnění podmínek §16 zákona o veřejném zdravotním pojištění č. 48/1997 Sb. Širšímu použití canakinumabu bude zřejmě bránit jeho cena.
Léčba v interkritickém období a u pacientů s chronickou tofózní dnou
U pacientů v interkritickém období mezi jednotlivými dnavými záchvaty a u pacientů s chronickou tofózní dnou je kromě režimových opatření indikována ULT. Léčba by měla být komplexní a měla by směřovat k dosažení konkrétních cílů (treat to target). Cílem léčby by mělo být snížení frekvence a závažnosti dnavých záchvatů, zmenšení velikosti a počtu dnavých tofů a zpomalení nebo zastavení progrese strukturálního poškození pohybového aparátu u pacientů s chronickou tofózní dnou. Doposud nemáme k dispozici spolehlivé prognostické faktory k posouzení závažnosti průběhu onemocnění. Proto základním snadno měřitelným ukazatelem závažnosti průběhu onemocnění je stanovení sérové koncentrace kyseliny močové. Hyperurikemie je nejvýznamnějším nezávislým rizikovým faktorem pro vznik dnavé artritidy. Zvýšení sérové koncentrace kyseliny močové nad úroveň nasycení její sodné soli v biologickém roztoku, tedy nad hranici přibližně 360–380 µmol/l, může být spojeno s tvorbou a ukládáním krystalů natrium urátu. Základním cílem ULT v této fázi onemocnění je snížení urikemie pod hodnotu 360 µmol/l. K dispozici máme dostatek důkazů o tom, že snížení urikemie pod tuto hranici je spojeno se snížením frekvence dnavých záchvatů, se zmenšením velikosti dnavých tofů a s vymizením depozit krystalů natrium urátu prokazatelných ultrasonograficky nebo krystalografickou analýzou [52–62]. Některé práce prokázaly, že další snížení urikemie pod hranici 300 µmol/l může být spojeno s rychlejší redukcí velikosti dnavých tofů nebo s prodloužením času do opakování dnavého záchvatu po ukončení dlouhodobé ULT [52,58]. K ULT jsou indikováni zejména pacienti s vyšší frekvencí výskytu dnavých záchvatů, s chronickou tofózní dnou a s rentgenově prokazatelným a progredujícím onemocněním. Dle doporučení ACR je vhodné zahájit ULT v následujících situacích:
- u pacientů s 1–2 dnavými záchvaty během jednoho roku;
- u pacientů s minimálně jedním dnavým záchvatem, kteří trpí chronickým onemocněním ledvin (chronic
kidney disease, CKD) hodnoceným jako stadium 2 a vyšší; - u pacientů s průkazem dnavých tofů při klinickém vyšetření nebo při vyšetření zobrazovací metodou;
- u pacientů s urátovou urolitiázou [12].
Léčba snižující sérovou koncentraci kyseliny močové by neměla být přerušována v průběhu dnavého záchvatu a neměla by být rovněž měněna dávka léčiv. Kdy zahájit ULT po proběhlém dnavém záchvatu, není zcela jasné. Nicméně, současná doporučení připouštějí její zahájení již v průběhu akutního dnavého záchvatu, ale vždy se současným zahájením profylaktické léčby [12]. Vždy je nutné zahajovat léčbu nízkými dávkami a následnou léčbu upravovat v postupných krocích (start slow, go slow) tak, aby bylo dosaženo léčebných cílů.
Účinnost a bezpečnost ULT musí být v jejím průběhu monitorována. Podle European League Against Rheumatism (EULAR) by měl minimální požadavek na monitoraci ULT zahrnovat opakované měření urikemie, sledování frekvence výskytu dnavých záchvatů a velikosti dnavých tofů [17]. Žádné další specifické postupy nejsou doporučovány. K detailnějšímu posouzení vývoje onemocnění však mohou být použity další nástroje zahrnující řadu biologických markerů, klinických ukazatelů, zobrazovacích metod nebo pacientských dotazníků (např. Health assessment questionnaire, Short form 36) [63–65].
Do skupiny ULT řadíme především inhibitory enzymu xantinoxidázy (XO) allopurinol a febuxostat, dále urikosurika probenecid a benzbromaron a z nových lékových skupin pegylovanou urikázu. Experti EULAR identifikovali více než 40 klinických studií prokazujících účinnost a bezpečnost těchto lékových skupin v léčbě symptomatické hyperurikemie. K dispozici jsou vysoce kvalitní data, která prokazují výraznější účinek allopurinolu, febuxostatu a peglotikázy ve srovnání s placebem na snížení sérové koncentrace kyseliny močové u pacientů s dnou [66–72]. Rozsáhlý klinický výzkum na více než 4 000 pacientech s dnou prokázal, že febuxostat v dávkách 80–240 mg je účinnější než allopurinol podávaný v dávkách 300 mg, respektive 100 mg, v dosažení cílové urikemie, v dosažení tohoto cíle u pacientů s CKD, ve snížení frekvence dnavých záchvatů a v redukci velikosti a počtu dnavých tofů [66–71]. Léčba s postupně se zvyšující dávkou allopurinolu (300–600 mg) a benzbromaronu (100–200 mg) byla prokazatelně účinnější než placebo ve snížení sérové koncentrace kyseliny močové [73]. Urikosurikum benzbromaron bylo účinné u pacientů s dnou, u kterých léčba allopurinolem nevedla k dosažení cílové urikemie [74]. Léčba pegylovanou urikázou je účinná, ale může být spojena s vyšší frekvencí dnavých záchvatů, s vyšší frekvencí infuzních reakcí a předčasného ukončení léčby ve srovnání s placebem [72].
Současná mezinárodní doporučení k léčbě dny doporučují použití inhibitoru XO jako léku první linie. Zatímco ACR doporučuje použití obou léčiv z této skupiny v první linii, EULAR a s ním v souladu česká národní doporučení upřednostňují použít v první linii allopurinol [12,13,17]. Druhá linie ULT by měla zahrnovat febuxostat nebo urikosurika (pokud jsou k dispozici), která mohou být použita v případě selhání účinnosti allopurinolu nebo v případech, kdy je léčba allopurinolem kontraindikována nebo by vedla k výskytu nežádoucích příhod. Jako alternativní léčivo první linie u pacientů, u kterých není tolerována nebo je kontraindikována léčba alespoň jedním inhibitorem XO [12], doporučuje ACR urikosurikum probenecid; neměl by však být použit u pacientů s urolitiázou a s poklesem ledvinných funkcí (clearance kreatininu < 50 ml/min) a u pacientů s nadprodukcí kyseliny močové. Podávání probenecidu by měl doprovázet dostatečný příjem tekutin a případná alkalizace kyselé moči zabraňující tvorbě močových konkrementů. V případě nedostatečné účinnosti monoterapie inhibitorem XO doporučuje ACR použití kombinace inhibitoru XO a urikosurika probenecidu nebo dalších přípravků s urikosurickým účinkem (losartan, fenofibrát) [12]. V případě selhání tohoto postupu, zejména u pacientů s vyšší frekvencí dnavých záchvatů a s nekontrolovanou chronickou tofózní dnou a u pacientů, kteří netolerují žádný z výše uvedených postupů, je doporučeno použití peglotikázy. Dávkování a strategie léčby jednotlivými léčivy je uvedena v dalším textu.
Inhibitory xantinoxidázy
Základním léčivem této skupiny je allopurinol [17], syntetický analog hypoxantinu, který je substrátem pro enzym XO. Je indikován k léčbě hyperurikemie u pacientů se symptomatickou primární a sekundární hyperurikemií (dnavá artritida, tofy, urolitiáza). K léčbě byl schválen americkým úřadem FDA již v roce 1965. Allopurinol a jeho hlavní aktivní metabolit oxipurinol je purinový inhibitor enzymu XO, který inhibuje redukovanou formu enzymu. Z gastrointestinálního traktu se vstřebává přibližně 70–90 % podané dávky, maximální plazmatické koncentrace je dosaženo během 0,5–2 hodin. Plazmatický poločas kolísá mezi 1 a 3 hodinami. Allopurinol je metabolizován převážně v játrech na oxipurinol, jehož eliminační poločas je 12–27 hodin v případě normální renální funkce, ale prodlužuje se u pacientů s ledvinnou nedostatečností. Allopurinol ani oxipurinol se neváže na plazmatické bílkoviny. Přibližně 80 % denní dávky je vyloučeno glomerulární filtrací (10 % allopurinol, 70 % oxipurinol), zbývajících 20 % je vyloučeno v nezměněné formě stolicí. U pacientů s ledvinnou nedostatečností se clearance allopurinolu i jeho aktivního metabolitu významně snižuje, což může vést k nárůstu jejich plazmatických koncentrací a ke zvýšení toxicity, a proto je u pacientů s poklesem ledvinných funkcí nutné adekvátní snížení dávky.
Doporučovaná úvodní dávka allopurinolu je 100 mg denně, u pacientů s CKD 4. a 5. stadia 50 mg denně. Dávka allopurinolu by následně měla být titrována každých 2–5 týdnů až do dávky 800 mg denně tak, aby bylo dosaženo cílového snížení urikemie [17]. Denní dávky vyšší než 300 mg by měly být rozděleny do 2–4 podání. Experti ACR konstatují, že v běžné praxi se často stává, že léčba allopurinolem je zahájena úvodní dávkou 300 mg denně a tato dávka je následně udržována bez toho, že by bylo sledováno dosažení léčebného cíle [12]. Tento postup je považován za chybný. U pacientů s lehkým nebo středně závažným poklesem ledvinných funkcí (clearance kreatininu ≥ 30 ml/min, CKD 2.–3. stadia) by se denní dávka allopurinolu měla pohybovat v rozmezí 100–300 mg. Zváženo může být i prodloužení dávkovacího intervalu (alternativní podávání). U pacientů s těžkou poruchou ledvinných funkcí (clearance kreatininu < 30 ml/min, CKD 4.–5. stadia) by denní dávka neměla přesahovat 100 mg. Doporučené postupy ACR uvádějí, že allopurinol může být použit u pacientů s poklesem ledvinných funkcí i v dávkách vyšších než 300 mg denně, pokud je léčba adekvátně monitorována [12]. Doporučováno je monitorování plazmatických koncentrací allopurinolu, které by neměly přesáhnout 100 µmol/l (15,2 mg/l). U osob vyššího věku není nutná úprava dávky, pokud tyto osoby nemají současně sníženou funkci ledvin.
Při léčbě allopurinolem je nutné počítat s jeho toxicitou u přibližně 5 % pacientů, zejména s projevy gastrointestinální intolerance (nauzea a zvracení), s poruchami jaterních funkcí, vyrážkou, bolestí hlavy nebo s hypersenzitivní reakcí. American College of Rheumatology doporučuje provádět u vybraných etnických skupin (Korejci, Číňané, Thajci) před zahájením léčby allopurinolem analýzu DNA na přítomnost alely HLA B*5801, která je spojena s několikasetnásobným zvýšením rizika hypersenzitivní reakce [12]. Na paměti je rovněž nutné mít lékové interakce allopurinolu například s perorálními antikoagulancii, theophyllinem a léčivy, která jsou metabolizována XO (azathioprin, mercaptopurin).
Podle evropských a českých národních doporučení může být v případě nedostatečného účinku allopurinolu nebo v případech, kdy je allopurinol kontraindikován nebo kdy léčba nebyla tolerována, použit alternativní inhibitor XO febuxostat [12,17]. V České republice byl přípravek s touto účinnou látkou registrován k léčbě symptomatické hyperurikemie v roce 2012.
Febuxostat je 2‑arylthiazolový derivát, který dosahuje svého léčebného účinku selektivní inhibicí enzymu XO [75]. Febuxostat je silný nepurinový selektivní inhibitor tohoto enzymu. Inhibuje jak oxidované, tak redukované formy XO [74]. Při terapeutických koncentracích febuxostat neinhibuje další enzymy účastnící se metabolismu purinů a pyrimidinů. Rychle a dobře se vstřebává z gastrointestinálního traktu, přičemž absorpce není významně ovlivněna současným užitím se stravou. Maximální plazmatické koncentrace dosahuje za 1–1,5 hodiny. Silně se váže na plazmatické bílkoviny, zejména na albumin. Jeho zdánlivý eliminační poločas je přibližně 5 až 8 hodin. Febuxostat se metabolizuje v játrech konjugací v enzymatickém systému uridin difosfát glukuronosyltransferázy (UDPGT) a oxidací v systému cytochromu P450, jehož aktivitu neovlivňuje. Eliminace z organismu se poté děje jak játry, tak ledvinami. Farmakokinetika febuxostatu není významně ovlivněna poklesem ledvinných nebo jaterních funkcí. U pacientů s mírným nebo středně závažným poklesem ledvinných a jaterních funkcí není nutná úprava dávky. Úprava dávky není rovněž nutná u osob vyššího věku.
V rozsáhlém klinickém výzkumu fáze II a III byl febuxostat v denních dávkách 80 mg a 120 mg významně účinnější ve srovnání s allopurinolem 300 mg, respektive 100 mg denně v dosažení cílové urikemie nižší než 360 µmol/l. Významně vyšší účinnost febuxostatu proti allopurinolu byla pozorována i u pacientů s velmi vysokou vstupní hodnotou urikemie (≥ 600 µmol/l) a u pacientů s poklesem ledvinných funkcí (sérová koncentrace kreatininu > 133 µmol/l až ≤ 177 µmol/l). Dlouhodobá léčba febuxostatem vedla k redukci počtu dnavých záchvatů a k redukci velikosti a počtu dnavých tofů [66–71].
Doporučená úvodní denní dávka febuxostatu je 80 mg. Pokud po 2–4 týdnech léčby přetrvává urikemie s hodnotami vyššími než 360 µmol/l, může být dávka zvýšena na 120 mg denně. V České republice jsou v současné době registrovány pouze tablety s obsahem 80 mg febuxostatu. Vzhledem k chybějícím zkušenostem s použitím u dětí a dospívajících není febuxostat u těchto skupin pacientů doporučen. Rovněž u pacientů po orgánové transplantaci není použití febuxostatu kvůli nedostatku zkušeností doporučeno. Léčbu febuxostatem není zatím doporučeno zahajovat u pacientů s ischemickou chorobou srdeční nebo s městnavým srdečním selháním. Důvodem je vyšší výskyt KV příhod zaznamenaných v klinických hodnoceních APEX a FACT. Výsledky těchto studií měla potvrdit nebo vyvrátit studie CONFIRMS, která zmíněné KV riziko nepotvrdila. Studie neprokázala statisticky významné rozdíly mezi febuxostatem a allopurinolem ani příčinnou souvislost mezi zvýšeným výskytem KV příhod a léčbou febuxostatem. Přesto bylo zmíněné doporučení zatím ponecháno v platnosti. V současné době probíhá prospektivní, randomizovaná, otevřená studie FAST srovnávající KV bezpečnost léčby febuxostatem a allopurinolem u pacientů se symptomatickou hyperurikemií. Její výsledky jsou očekávány v brzké době [77].
S toxicitou febuxostatu je nutno počítat přibližně u 3–5 % léčených pacientů. Nejčastěji se setkáváme s elevací hodnot jaterních testů. Alergické reakce se objevují poměrně vzácně. Pamatovat je rovněž nutné na lékové interakce, které jsou společné všem inhibitorům XO.
Urikosurika
Urikosurika mohou být použita jako léky druhé linie u pacientů, u kterých léčba allopurinolem nebyla dostatečně účinná nebo kde selhala z důvodu toxicity nebo byla kontraindikována. Jak již bylo uvedeno, ACR doporučuje použití urikosurika probenecidu jako alternativního léčiva první linie u pacientů, u kterých není tolerována nebo je kontraindikována léčba alespoň jedním inhibitorem XO [12]. V případě nedostatečné účinnosti monoterapie inhibitorem XO odborníci z ACR doporučují použití kombinace inhibitoru XO a urikosurika probenecidu nebo dalších léčiv s urikosurickým působením (losartan, fenofibrát) [12].
Vedle probenecidu, který se podává v denní dávce 1,5–2,0 mg, patří do této lékové skupiny také benzbromaron, podávaný v denní dávce 50–100 mg, a sulfinpyrazon. Urikosurika zvyšují eliminaci kyseliny močové ledvinami snížením její tubulární reabsorpce. Léčiva této skupiny však nejsou v současné době v České republice registrována. Urikosurika mohou být použita pouze u pacientů s normální funkcí ledvin (clearance kreatininu ≥ 50 ml/min). Výhodné je jejich použití zejména u pacientů se sníženou exkrecí kyseliny močové ledvinami. Urikosurika jsou dále kontraindikována u pacientů s výraznou nadprodukcí kyseliny močové (> 4,2 mmol/24 h) a u pacientů s urolitiázou. Zvýšená urikosurie spojená s použitím urikosurik může vést k vyššímu riziku depozice urátových krystalů v močových cestách. Proto musí podání urikosurik doprovázet dostatečný příjem tekutin (≥ 2 litry denně) a případná alkalizace kyselé moči zabraňující tvorbě močových konkrementů. U pacientů, kteří mají současně hypertenzi a/nebo dyslipidemii, je možné zvážit podání antagonisty receptoru pro angiotensin II losartanu nebo hypolipidemika fenofibrátu, jejichž urikosurický účinek je rovněž znám. Při léčbě urikosuriky je nutné počítat zejména s jejich hepatotoxicitou.
Pegylovaná urikáza
V případě selhání monoterapie nebo kombinované léčby léčivy ze skupiny inhibitorů XO a urikosurik nebo v případě kontraindikace těchto přípravků doporučují ACR i EULAR u pacientů s chronickou tofózní dnou s možným erozivním poškozením kloubů použití pegylované urikázy [12,17]. Urikáza je enzym, který se podílí na přeměně kyseliny močové na dobře rozpustný allantoin. Člověk a vyšší primáti, na rozdíl od většiny savců, tento enzym ve své výbavě nemají. V roce 2010 schválil americký úřad FDA pegylovanou urikázu k léčbě refrakterních forem symptomatické hyperurikemie. Proces pegylace zajistil tomuto přípravku nižší imunogenicitu a delší biologický poločas. V klinickém hodnocení byla pegylovaná urikáza, aplikovaná v dávkách 8 mg intravenózně každé 2 nebo 4 týdny, významně účinnější ve srovnání s placebem ve snížení urikemie u pacientů s dnou [72]. Léčba pegylovanou urikázou je sice účinná, ale její aplikace může být zejména v úvodu spojena s vyšší frekvencí dnavých záchvatů, proto je doporučeno současně zahájit profylaktickou léčbu dnavých záchvatů. Při léčbě je nutné rovněž počítat s vyšším rizikem infuzních reakcí a s rizikem předčasného ukončení léčby ve srovnání s placebem. Peglotikáza se podává jako intravenózní infuze v dávce 8 mg každé 2 týdny. Od roku 2012 je léčivý přípravek obsahující pegylovanou urikázu registrován v Evropské unii, a tedy i v České republice. Použití peglotikázy je podmíněno schválením revizního lékaře zdravotní pojišťovny na základě splněných podmínek § 16 zákona o veřejném zdravotním pojištění č. 48/1997 Sb.
Profylaxe akutních dnavých záchvatů během léčby snižující urikemii
V průběhu ULT, zejména na jejím začátku, může z důvodu mobilizace urátů z tkáňových depozit paradoxně docházet k častějším dnavým záchvatům. Při zahájení ULT je proto současně doporučeno zahájit profylaktickou léčbu akutních dnavých záchvatů. V profylaxi dnavých záchvatů je doporučeno použití nízkých dávek kolchicinu (0,5–1,0 mg denně) nebo nízkých dávek NSA současně s inhibitory protonové pumpy k eliminaci rizika gastrotoxicity [12,13,17]. Alternativou může být použití NSA specifických pro COX‑2. Důkazy o účinnosti profylaktické léčby máme pouze pro kolchicin. Ve dvou randomizovaných studiích kontrolovaných placebem vedlo použití kolchicinu v dávkách 0,6–1,5 mg po dobu 3–6 měsíců od zahájení ULT k redukci počtu a závažnosti dnavých záchvatů ve srovnání s placebem [78,79]. Pro NSA a GK však podobné údaje chybějí. V případě selhání tohoto postupu nebo při kontraindikaci kolchicinu a NSA doporučuje ACR zvážit dlouhodobou léčbu nízkou dávkou prednisonu (≤ 10 mg denně) [12]. Jak dlouho podávat v průběhu ULT profylaktickou léčbu, není zcela jasné. Při rozhodování o délce profylaktické léčby by měl být brán zřetel na faktory, jakými je trvání choroby, frekvence dnavých záchvatů nebo přítomnost a velikost dnavých tofů. Podle doporučených postupů ACR se má v profylaktické léčbě pokračovat tak dlouho, dokud trvají příznaky dny (dnavé záchvaty, tofy, perzistující synovitida) [12]. Dojde‑li k vymizení příznaků dnavé artritidy, může být profylaktická léčba ukončena do tří měsíců od dosažení cílové urikemie u pacientů bez tofózní dny nebo do šesti měsíců od dosažení cílové urikemie u pacientů s tofózní dnou před zahájením léčby, u nichž dnavé tofy vymizely. Pokud se v průběhu ULT a profylaktické léčby objeví akutní dnavý záchvat, měla by být zahájena jeho adekvátní léčba.
Seznam použité literatury
- [1] Zhang W, Doherty M, Pascual E, et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006; 65: 1301–1311.
- [2] Mikuls TR, Farrar JT, Bilker WB, et al. Gout epidemiology: results from the UK General Practice Research Database, 1990–1999. Ann Rheum Dis 2005; 64: 267–272.
- [3] Annemans L, Spaepen E, Gaskin M, et al. Gout in the UK and Germany: prevalence, comorbidities and management in general practice 2000–2005. Ann Rheum Dis 2008; 67: 960–966.
- [4] Alamanos Y, Drosos AA. Epidemiology of adult rheumatoid arthritis. Autoimmun Rev 2005; 4: 130–136.
- [5] Arromdee E, Michet CJ, Crowson CS, et al. Epidemiology of gout: is the incidence rising? J Rheumatol 2002; 29: 2403–2406.
- [6] Grassi D, Ferri L, Desideri G, et al. Chronic hyperuricemia, uric acid deposit and cardiovascular risk. Curr Pharm Des 2013; 19: 2432–2438.
- [7] Pavelka K. Dna (arthritis urica). In Pavelka K, Rovenský J, et al. Klinická revmatologie. Praha: Galén; 2003: 347–358.
- [8] Nakagawa T, Hu H, Zharikov S, et al. A causal role for uric acid in fructose induced metabolic syndrome. Am J Physiol Renal Physiol 2006; 290: F625–F631.
- [9] Campion EW, Glynn RJ, DeLabry LO. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study. Am J Med 1987; 82: 421–426.
- [10] Wallace SL, Robinson H, Masi AT, et al. Preliminary criteria for the classification of the acute arthritis of primary gout. Arthritis Rheum 1977; 20: 895–900.
- [11] Khanna D, Khanna PP, Fitzgerald JD, et al. 2012 American College of Rheumatology guidelines for management of gout. Part 2: therapy and antiinflammatory prophylaxis of acute gouty arthritis. Arthritis Care Res (Hoboken) 2012; 64: 1447–1461.
- [12] Khanna D, Fitzgerald JD, Khanna PP, et al. 2012 American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res (Hoboken) 2012; 64: 1431–1446.
- [13] Pavelka K. Doporučení České revmatologické společnosti pro léčbu dnavé artritidy. Čes Revmatol 2012; 20: 82–92.
- [14] Choi HK, Ford ES, Li C, Curhan G. Prevalence of the metabolic syndrome in patients with gout: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2007; 57: 109–115.
- [15] Choi HK, Curhan G. Independent impact of gout on mortality and risk for coronary heart disease. Circulation 2007; 116: 894–900.
- [16] Stack AG, Hanley A, Casserly LF, et al. Independent and conjoint associations of gout and hyperuricaemia with total and cardiovascular mortality. QJM 2013; 106: 647–658.
- [17] Sivera F, Andrés M, Carmona L, et al. Multinational evidence based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3e initiative. Ann Rheum Dis 2014; 73: 328–335.
- [18] Moi JHY, Sriranganathan MK, Edwards CJ, et al. Lifestyle interventions for chronic gout (Protocol). Cochrane Database Syst Rev 2013; 5: CD010039.
- [19] Andres M, Sivera F, Falzon L, et al. Dietary supplements for chronic gout (Protocol). Cochrane Database Syst Rev 2012; 11: CD010156.
- [20] Dalbeth N, Ames R, Gamble GD, et al. Effects of skim milk powder enriched with glycomacropeptide and G600 milk fat extract on frequency of gout flares: a proof of concept randomised controlled trial. Ann Rheum Dis 2012; 71: 929–934.
- [21] van Durme CMPG, Wechalekar MD, Buchbinder R, et al. Non steroidal anti inflammatory drugs for acute gout (Protocol). Cochrane Database Syst Rev 2012; 10: CD010120.
- [22] Wechalekar MD, Vinik O, Schlesinger N, et al. Intra articular glucocorticoids for acute gout. Cochrane Database Syst Rev 2013; 4: CD009920.
- [23] Sivera F, Wechalekar MD, Andrés M, et al. Interleukin 1 inhibitors for acute gout (Protocol). Cochrane Database Syst Rev 2012; 7: CD009993.
- [24] Garcia de la Torre I. A comparative, double blind, parallel study with tenoxicam vs placebo in acute gouty arthritis. Invest Med Int 1987; 14: 92–97.
- [25] Lederman R. A double blind comparison of etodolac (Lodine) and high doses of naproxen in the treatment of acute gout. Adv Ther 1990; 7: 344–354.
- [26] Weiner GI, White SR, Weitzner RI, et al. Double blind study of fenoprofen versus phenylbutazone in acute gouty arthritis. Arthritis Rheum 1979; 22: 425–426.
- [27] Valdes EF. Use of tenoxicam in patients with acute gouty arthritis. Eur J Rheumatol Inflamm 1987; 9: 133–136.
- [28] Tumrasvin T, Deesomchok U. Piroxicam in treatment of acute gout high dose versus low dose. J Med Assoc Thai 1985; 68: 111–116.
- [29] Sturge RA, Scott JT, Hamilton EB, et al. Multicentre trial of naproxen and phenylbutazone in acute gout. Ann Rheum Dis 1977; 36: 80–82.
- [30] Smyth CJ, Percy JS. Comparison of indomethacin and phenylbutazone in acute gout. Ann Rheum Dis 1973; 32: 351–353.
- [31] Shrestha M, Morgan DL, Moreden JM, et al. Randomized double blind comparison of the analgesic efficacy of intramuscular ketorolac and oral indomethacin in the treatment of acute gouty arthritis. Ann Emerg Med 1995; 26: 682–686.
- [32] Schumacher HR, Jr., Boice JA, Daikh DI, et al. Randomised double blind trial of etoricoxib and indometacin in treatment of acute gouty arthritis. BMJ 2002; 324: 1488–4892.
- [33] Maccagno A, Di Giorgio E, Romanowicz A. Effectiveness of etodolac (‘Lodine’) compared with naproxen in patients with acute gout. Curr Med Res Opin 1991; 12: 423–429.
- [34] Lomen PL, Turner LF, Lamborn KR, et al. Flurbiprofen in the treatment of acute gout. A comparison with indomethacin. Am J Med 1986; 80: 134–139.
- [35] Eberl R, Dunky A. Meclofenamate sodium in the treatment of acute gout. Results of a double blind study. Arzneimittelforschung 1983; 33: 641–643.
- [36] Douglas G, Thompson M. A comparison of phenylbutazone and flufenamic acid in the treatment of acute gout. Ann Phys Med 1970; 10: 275–280.
- [37] Cheng TT, Lai HM, Chiu CK, et al. A single blind, randomized, controlled trial to assess the efficacy and tolerability of rofecoxib, diclofenac sodium, and meloxicam in patients with acute gouty arthritis. Clin Ther 2004; 26: 399–406.
- [38] Butler RC, Goddard DH, Higgens CS, et al. Double blind trial of flurbiprofen and phenylbutazone in acute gouty arthritis. Br J Clin Pharmacol 1985; 20: 511–513.
- [39] Rubin BR, Burton R, Navarra S, et al. Efficacy and safety profile of treatment with etoricoxib 120 mg once daily compared with indomethacin 50 mg three times daily in acute gout. Arthritis Rheum 2004; 50: 598–606.
- [40] Willburger RE, Mysler E, Derbot J, et al. Lumiracoxib 400 mg once daily is comparable to indomethacin 50 mg three times daily for the treatment of acute flares of gout. Rheumatology 2007; 46: 1126–1132.
- [41] Altman RD, Honig S, Levin JM, et al. Ketoprofen versus indomethacin in patients with acute gouty arthritis: a multicenter, double blind comparative study. J Rheumatol 1988; 15: 1422–1426.
- [42] Axelrod D, Preston S. Comparison of parenteral adrenocorticotropic hormone with oral indomethacin in the treatment of acute gout. Arthritis Rheum 1988; 31: 803–805.
- [43] Janssens HJ, Janssen M, van de Lisdonk EH, et al. Use of oral prednisolone or naproxen for the treatment of gout arthritis: a double blind, randomised equivalence trial. Lancet 2008; 371: 1854–1860.
- [44] Man CY, Cheung ITF, Cameron PA, et al. Comparison of oral prednisolone/paracetamol and oral indomethacin/paracetamol combination therapy in the treatment of acute goutlike arthritis: a double blind, randomized, controlled trial. Ann Emerg Med 2007; 49: 670–677.
- [45] Ahern MJ, Reid C, Gordon TP, et al. Does colchicine work? The results of the first controlled study in acute gout. Aust NZ J Med 1987; 17: 301–304.
- [46] Terkeltaub RA, Furst DE, Bennett K, et al. High versus low dosing of oral colchicine for early acute gout flare: Twenty four hour outcome of the first multicenter, randomized, double blind, placebo controlled, parallel group, dose comparison colchicine study. Arthritis Rheum 2010; 62: 1060–1068.
- [47] Yeomans ND, Tulassay Z, Juhász L, et al. A comparison of omeprazole with ranitidine for ulcers associated with nonsteroidal antiinflammatory drugs. Acid Suppression Trial: Ranitidine versus Omeprazole for NSAID associated Ulcer Treatment (ASTRONAUT) Study Group. N Engl J Med 1998; 338: 719–726.
- [48] Silverstein FE, Graham DY, Senior JR, et al. Misoprostol reduces serious gastrointestinal complications in patients with rheumatoid arthritis receiving nonsteroidal anti inflammatory drugs. A randomized, double blind, placebo controlled trial. Ann Intern Med 1995; 123: 241–249.
- [49] Hawkey C, Laine L, Simon T, et al. Comparison of the effect of rofecoxib (a cyclooxygenase 2 inhibitor), ibuprofen, and placebo on the gastroduodenal mucosa of patients with osteoarthritis: a randomized, double blind, placebo controlled trial. The Rofecoxib Osteoarthritis Endoscopy Multinational Study Group. Arthritis Rheum 2000; 43: 370–377.
- [50] Schlesinger N, De Meulemeester M, Pikhlak A, et al. Canakinumab relieves symptoms of acute flares and improves health related quality of life in patients with difficult to treat Gouty Arthritis by suppressing inflammation: results of a randomized, dose ranging study. Arthritis Res Ther 2011; 13: R53.
- [51] So A, De Meulemeester M, Pikhlak A, et al. Canakinumab for the treatment of acute flares in difficult to treat gouty arthritis: Results of a multicenter, phase II, dose ranging study. Arthritis Rheum 2010; 62: 3064–3076.
- [52] Perez Ruiz F, Atxotegi J, Hernando I, et al. Using serum urate levels to determine the period free of gouty symptoms after withdrawal of long term urate lowering therapy: a prospective study. Arthritis Rheum 2006; 55: 786–790.
- [53] Sarawate AC, Patel PA, Schumacher HR, et al. Serum urate levels and gout flares: analysis from managed care data. J Clin Rheumatol 2006; 12: 61–65.
- [54] Halpern R, Fuldeore MJ, Mody RR, et al. The effect of serum urate on gout flares and their associated costs: an administrative claims analysis. J Clin Rheumatol 2009; 15: 3–7.
- [55] Shoji A, Yamanaka H, Kamatani N. A retrospective study of the relationship between serum urate level and attacks of gouty arthritis: evidence of recurrent gouty arthritis with antihyperuricemic therapy. Arthritis Rheum 2004; 51: 321–325.
- [56] Yamanaka H, Togashi R, Hakoda M, et al. Optimal range of serum urate concentrations to minimize risk of gouty attacks during anti hyperuricemic treatment. Adv Exp Med Biol 1998; 431: 13–18.
- [57] Wu EQ, Patel PA, Mody RR, et al. Frequency, risk, and cost of gout related episodes among the elderly: does serum uric acid level matter? J Rheumatol 2009; 36: 1032–1040.
- [58] Perez Ruiz F, Calabozo M, Pijoan JI, et al. Effect of urate lowering therapy on the velocity of size reduction of tophi in chronic gout. Arthritis Rheum 2002; 47: 356–360.
- [59] McCarthy G, Barthelemy CR, Veum JA, et al. Influence of antihyperuricemic therapy on the clinical and radiographic progression of gout. Arthritis Rheum 1991; 34: 1489–1494.
- [60] Thiele RG, Schlesinger N. Ultrasonography shows disappearance of monosodium urate crystal deposition on hyaline cartilage after sustained normouricemia is achieved. Rheumatol Int 2010; 30: 495–503.
- [61] Li Yu J, Clayburne G, Sieck M, et al. Treatment of chronic gout. Can we determine when urate stores are depleted enough to prevent attacks of gout? J Rheumatol 2001; 28: 577–580.
- [62] Pascual E, Sivera F. Time required for disappearance of urate crystals from synovial fluid after successful hypouricaemic treatment relates to the duration of gout. Ann Rheum Dis 2007; 66: 1056–1058.
- [63] Becker MA, Schumacher HR, Benjamin KL, et al. Quality of life and disability in patients with treatment failure gout. J Rheumatol 2009; 36: 1041–1048.
- [64] Khanna PP, Perez Ruiz F, Maranian P, et al. Long term therapy for chronic gout results in clinically important improvements in the health related quality of life: short form 36 is responsive to change in chronic gout. Rheumatology 2011; 50: 740–745.
- [65] Alvarez Hernandez E, Pelaez Ballestas I, Vazquez Mellado J, et al. Validation of the health assessment questionnaire disability index in patients with gout. Arthritis Care Res 2008; 59: 665–669.
- [66] Schumacher HR Jr, Becker MA, Wortmann RL, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28 week, phase III, randomized, double blind, parallel group trial. Arthritis Rheum 2008; 59: 1540–1548.
- [67] Becker MA, Schumacher HR Jr, Wortmann RL, et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med 2005; 353: 2450–2461.
- [68] Becker MA, Schumacher HR, MacDonald PA, et al. Clinical efficacy and safety of successful long term urate lowering with febuxostat or allopurinol in subjects with gout. J Rheumatol 2009; 36: 1273–1282.
- [69] Schumacher HR Jr, Becker MA, Lloyd E, et al. Febuxostat in the treatment of gout: 5 year findings of the FOCUS efficacy and safety study. Rheumatology 2009; 48: 188–194.
- [70] Becker MA, Schumacher HR Jr, Wortmann RL, et al. Febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase: a twenty eight day, multicenter, phase II, randomized, double blind, placebo controlled, doseresponse clinical trial examining safety and efficacy in patients with gout. Arthritis Rheum 2005; 52: 916–923.
- [71] Becker MA, Schumacher HR, Espinoza LR, et al. The urate lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial. Arthritis Res Ther 2010; 12: R63.
- [72] Sundy JS, Baraf HS, Yood RA, et al. Efficacy and tolerability of pegloticase for the treatment of chronic gout in patients refractory to conventional treatment: two randomized controlled trials. JAMA 2011; 306: 711–720.
- [73] Reinders MK, Haggsma C, Jansen TL, et al. A randomized controlled trial on the efficacy and tolerability with dose escalation of allopurinol 300–600 mg/day versus benzbromarone 100–200 mg/day in patients with gout. Ann Rheum Dis 2009; 68: 892–897.
- [74] Reinders MK, van Roon EN, Jansen TL, et al. Efficacy and tolerability of urate lowering drugs in gout: a randomised controlled trial of benzbromarone versus probenecid after failure of allopurinol. Ann Rheum Dis 2009; 68: 51–56.
- [75] Okamoto K, Eger BT, Nishino T, et al. An extremely potent inhibitor of xanthine oxidoreductase. Crystal structure of the enzyme inhibitor complex and mechanism of inhibition. J Biol Chem 2003; 278: 1848–1855.
- [76] Okamoto K, Nishino T. Crystal structures of mammalian xanthine oxidoreductase bound with various inhibitors: allopurinol, febuxostat, and FYX 051. J Nippon Med Sch 2008; 75: 2–3.
- [77] MacDonald TM, Ford I, Nuki G, et al. Protocol of the Febuxostat versus Allopurinol Streamlined Trial (FAST): a large prospective, randomised, open, blinded endpoint study comparing the cardiovascular safety of allopurinol and febuxostat in the management of symptomatic hyperuricaemia. BMJ Open 2014; 4: e005354.
- [78] Borstad CG, Bryant LR, Abel MP, et al. Colchicine for prophylaxis of acute flares when initiating allopurinol for chronic gout arthritis. J Rheumatol 2004; 31: 2429–2432.
- [79] Paulus HE, Schlosstein SH, Godfrey RG, et al. Prophylactic colchicine therapy of intercritical gout a placebo controlled study of probenecid treated patients. Arthritis