Doporučená očkování seniorů
Souhrn:
V celosvětové populaci, včetně české populace, přibývá osob v seniorském věku. Spolu s prodlužující se střední délkou života, se změnami imunitního systému podmíněnými věkem a s nedostatečnou proočkovaností seniorské populace jsou tyto faktory základním východiskem pro vytváření doporučení pro očkování seniorů. Očkování může u této zranitelné skupiny osob snižovat vnímavost a výskyt infekčních nemocí typických pro seniory, snižovat výskyt a závažnost zdravotních komplikací, počet hospitalizací a úmrtí seniorů. Mezi nejčastěji doporučovaná očkování seniorů patří očkování proti pneumokokovým onemocněním, proti chřipce a proti pásovému oparu. Svůj význam u seniorů má také očkování proti černému kašli nebo proti klíšťové encefalitidě. Bohužel v České republice stále zůstává nejčastějším očkováním seniorů pouhé přeočkování proti tetanu. Proočkovanost proti ostatním infekcím je stále nízká, což svědčí o tom, že o současných možnostech a výhodách očkování ve vyšším věku jsou nedostatečně informováni nejenom senioři, ale také jejich praktičtí lékaři, včetně lékařů spcialistů. Vývoj vakcín pro seniory má svá specifika, která spočívají také ve využívání adjuvantních systémů, vyšších dávek antigenů nebo efektivnějších aplikačních cest. Nové vakcíny a nová doporučení pro očkování seniorů by měly být více využívány v každodenní klinické praxi.
Summary:
The world population of the elderly increases, including the Czech population. Together with prolonged life expectancy, age‑related immune system changes, and inadequate vaccination of the elderly population, these factors are the basic starting point for making recommendations for the vaccination of seniors. Vaccination may reduce the susceptibility and the incidence of infectious diseases typical for the elderly, reduces the number of complications, hospitalizations and deaths in this vulnerable group of people. The most commonly recommended vaccinations for the elderly include vaccination against pneumococcal disease, influenza and shingles. Also, vaccination against whooping cough an tick‑borne encephalitis is important in the elderly. Unfortunately, the most frequent vaccination of the elderly is still just the vaccination against tetanus in the Czech Republic. The vaccination rate against other infections remains low, indicating a lack of awareness not only of the elderly but also of their practitioners and medical specialists about the current possibilities and benefits of older age vaccination. The novel vaccines for the elderly have their own specifics, including the use of adjuvant systems, higher doses of vaccine antigens or more effective administration methods. New vaccines and new recommendations for the elderly should be more widely used in day‑to‑day clinical practice.
Key words: vaccine, vaccination. elderly, imunosenescence, recommendations
Úvod
Střední délka života se v řadě zemí postupně a stále více prodlužuje. Přibývá lidí, kteří se dožívají vyššího věku, a počet seniorů tak narůstá. Za seniory jsou označovány osoby zpravidla na základě věku. Za hranici seniorského věku je nejčastěji považován věk 60–65 let. Obecně platí, že celosvětově populace stárne. Již v tuto dobu je 25 % evropské populace starší 60 let a odhaduje se, že v roce 2040 bude 30–50 % populace ve věku vyšším než 65 let. Počet novorozenců klesá. „Baby boom“ se tak postupně mění na „elderly boom“. Ještě dramatičtější nárůst je očekáván ve věkové kategorii osob starších 80 let, kde se odhaduje, že jejich celosvětový počet 125 milionů v roce 2015 vzroste do roku 2050 na 434 milionů [1].
Seniorská populace je obecně považována mezi dospělými za nejzranitelnější. Infekční onemocnění v seniorské populaci, s rizikem vzniku komplikací, hospitalizací, dlouhodobých následků včetně častějšího rizika úmrtí, indikují význam předcházení vzniku těchto infekcí v podobě očkování. Tím, jak narůstá počet zranitelných seniorů, nabývá na významu očkování v této věkové skupině osob. Pro seniory se objevuje stále více nových očkovacích látek a více nových doporučení k vakcinaci, jež umožňují vnímat očkování jako celoživotní proces.
V seniorském věku dochází k přirozeným změnám v imunitním systému, které vedou ke zvýšené vnímavosti k infekčním onemocněním a ke snížené postvakcinační imunitní odpovědi [2]. Problémem očkování seniorů je proto riziko nižší imunitní odpovědi na očkování v porovnání s mladší populací. Obecně platí, že věk ovlivňuje protilátkovou odpověď na vakcinaci. U osob starších 40 let bývá protilátková odpověď na některé typy očkování, například proti virové hepatitidě typu A a B, nižší než u mladších dospělých. U seniorů může rychleji než u mladší populace dojít také k oslabení (vyvanutí) získané imunity po očkování nebo po prodělané infekci, které může umožnit reaktivaci některých virů, jako je například virus varicella zoster (VZV) [3]. Oslabení ochrany z dětství se projevuje návratem některých nemocí do dospělé populace, včetně seniorské (pertuse, příušnice, spalničky). V porovnání s mladší dospělou populací je u seniorů zaznamenáván závažnější průběh infekčních nemocí, infekční nemoci u nich častěji vedou k dlouhodobým následkům v podobě negativního ovlivnění každodenních běžných aktivit, k celkovému oslabení zdravotního stavu a ke ztrátě soběstačnosti [4,5].
Proto očkování zůstává
nejvýznamnějším preventivním nástrojem, jak předcházet
infekcím u seniorské populace. Přitom proočkovanost seniorů
je na rozdíl od dětí nebo mladých dospělých
minimální. Mezi onemocnění, kterým lze předcházet očkováním
s nejvyšší účinností v seniorské populaci, patří
pneumokoková onemocnění, zejména pro vysokou mortalitu,
následovaná chřipkou. Ztracená léta života (poškození kvality
života, včetně úmrtí) v důsledku nemoci (DALYs –
Disability Adjusted Life Years) dosáhla v modelových situacích
v Nizozemsku v letech 2010–2013 nejvyšší hodnoty
37 223 DALYs/rok právě pro pneumokoková onemocnění, 7 941
DALYs/rok pro chřipku, 942 DALYs/rok pro pásový opar a nejnižší,
812 DALYs/rok, pro černý kašel [6]. Ve vyšším věku hrozí
vyšší výskyt komplikací, hospitalizací či úmrtí u vybraných
infekcí. Hraničním věkem v tomto případě bývá 50 let
(vyšší riziko výskytu a komplikací pásového oparu, chřipky,
klíšťové encefalitidy) nebo 65 let (riziko pneumokokových
onemocnění, chřipky).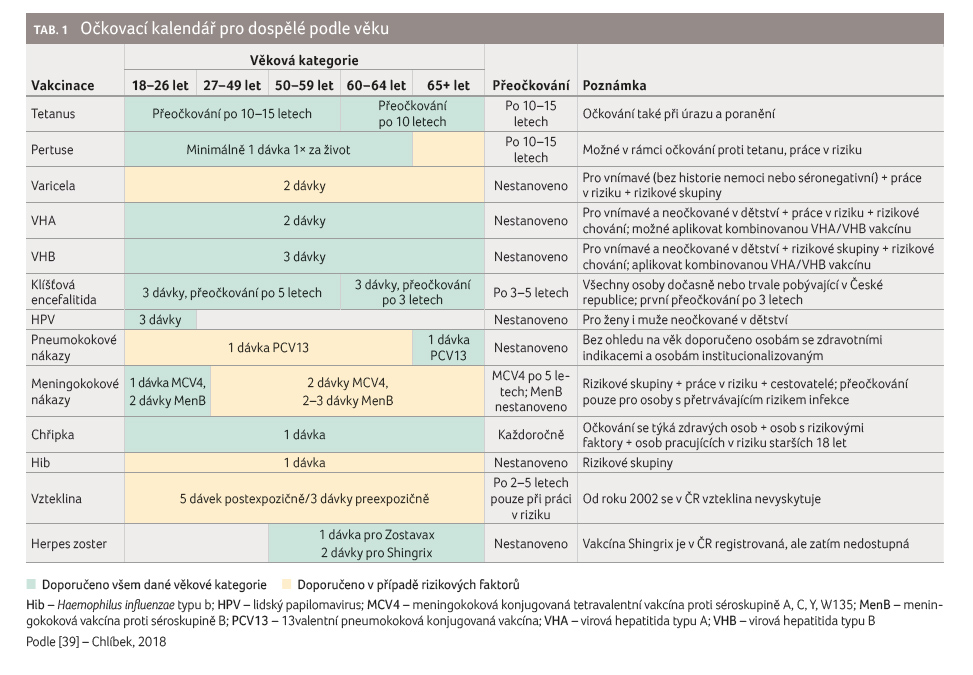
Proto je v řadě zemí věk očkovaného zohledňován v očkovacích kalendářích pro dospělé. V roce 2009 vznikl v České republice (ČR) očkovací kalendář pro dospělé, který byl v roce 2018 aktualizován a uvádí doporučení vhodného očkování podle věku (tab. 1). Některá očkování jsou v dané věkové kategorii doporučena všem bez dalších specifikací, jiná jsou doporučena jen v případě současného výskytu některého z rizikových faktorů.
Mezi nejčastější doporučovaná
očkování pro seniory v řadě evropských zemí patří
očkování proti chřipce, pneumokokovým
onemocněním, tetanu, pásovému oparu, černému kašli a záškrtu
(tab. 2). Vzhledem
k endemickému výskytu klíšťové encefalitidy s jedním
z nejvyšších výskytů v ČR a vzhledem k převaze
závažnějších forem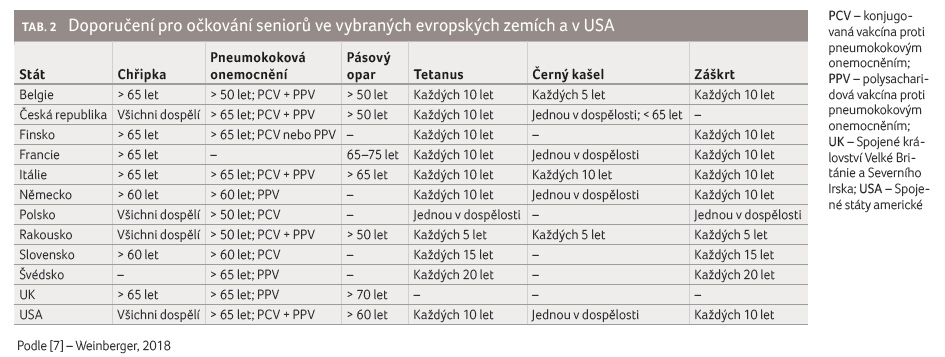 onemocnění ve vyšším věku se
specificky v ČR doporučuje také očkování proti klíšťové
encefalitidě. Přístup jednotlivých evropských zemí k očkování
seniorů se může lišit, například za kritický věk
v případě chřipky považují některé státy 60 let, jiné
65 let, některé státy doporučují očkování všem dospělým
bez ohledu na věk. Podobně kritickým pro očkování proti
pneumokokům je věk od 50 let (Polsko) přes 60 let (Německo,
Slovensko) až k 65 letům (většina zemí). Zatím pouze šest
evropských zemí včetně ČR doporučuje seniorům očkování
proti pásovému oparu, a to buď ve věku od 50 let,
nebo od 60–75 let. Podobně pouze 10 zemí doporučuje
seniorům očkování proti černému kašli, buď jednou za dospělý
život, nebo někde dokonce každých 5–10 let (Rakousko, Itálie,
Lucembursko, Lichtenštejnsko) [7]. Očkování proti klíšťové
encefalitidě doporučují seniorům pouze čtyři evropské státy
(Rakousko, ČR, Finsko a Slovinsko). Nejenom nízká
proočkovanost seniorů, ale také změny v imunitním systému
vyvolané věkem, které jsou označovány jako tzv. imunosenescence,
mohou být příčinou závažnějšího průběhu infekčních
onemocnění u seniorů.
onemocnění ve vyšším věku se
specificky v ČR doporučuje také očkování proti klíšťové
encefalitidě. Přístup jednotlivých evropských zemí k očkování
seniorů se může lišit, například za kritický věk
v případě chřipky považují některé státy 60 let, jiné
65 let, některé státy doporučují očkování všem dospělým
bez ohledu na věk. Podobně kritickým pro očkování proti
pneumokokům je věk od 50 let (Polsko) přes 60 let (Německo,
Slovensko) až k 65 letům (většina zemí). Zatím pouze šest
evropských zemí včetně ČR doporučuje seniorům očkování
proti pásovému oparu, a to buď ve věku od 50 let,
nebo od 60–75 let. Podobně pouze 10 zemí doporučuje
seniorům očkování proti černému kašli, buď jednou za dospělý
život, nebo někde dokonce každých 5–10 let (Rakousko, Itálie,
Lucembursko, Lichtenštejnsko) [7]. Očkování proti klíšťové
encefalitidě doporučují seniorům pouze čtyři evropské státy
(Rakousko, ČR, Finsko a Slovinsko). Nejenom nízká
proočkovanost seniorů, ale také změny v imunitním systému
vyvolané věkem, které jsou označovány jako tzv. imunosenescence,
mohou být příčinou závažnějšího průběhu infekčních
onemocnění u seniorů.
Fenomén imunosenescence –
vyvanutí imunity s věkem
Fenomén vyvanutí imunity (imunosenescence) představuje kvalitativní a kvantitativní pokles funkcí a výkonnosti imunitního systému, který je asociován s narůstajícím věkem. Projevuje se zejména zvýšenou vnímavostí k infekčním onemocněním, sklonem k patologickým stavům souvisejícím se zánětlivým procesem, jako jsou autoimunitní onemocnění, nebo zvýšenou incidencí nádorových onemocnění (věkem indukovaná sekundární imunodeficience) [8–11]. Imunitní systém a na něj kladené nároky se liší u novorozenců a u dětí v porovnání s osobami v seniorském věku. U seniorů dochází ke změnám v oblasti nespecifické imunity, která je dána jednak poklesem fagocytární schopnosti makrofágů a neutrofilů, dále sníženou schopností pohlcení a prezentace antigenu dendritickými – antigen prezentujícími – buňkami, současně se zhoršenou funkcí NK buněk a zhoršenou expresí toll like receptorů [12].
Kromě těchto změn s věkem dochází také ke změnám ve specifické imunitní odpovědi. Věkem podmíněné změny se týkají jak B lymfocytů, tak T buněk. S narůstajícím věkem postupně klesá počet tzv. naivních B lymfocytů, které jsou schopny reagovat s novými antigenními stimuly v podobě mikroorganismů nebo vakcinálních antigenů. S věkem dochází také k omezení počtu naivních a paměťových T lymfocytů a s tím spojené klesající schopnosti imunitního systému reagovat na různorodé antigeny [12–15]. Všechny tyto změny mohou vést ke zvýšenému výskytu vybraných infekcí u seniorů.
Očkování seniorů proti
pneumokokovým onemocněním
Streptococcus pneumoniae je jedním z nejčastějších původců komunitních pneumonií a respiračních infekcí, které jsou spojeny s hospitalizací u seniorů, a invazivních pneumokokových onemocnění (IPO) [16]. Příčinou hospitalizace nebo úmrtí může být samotné pneumokokové onemocnění nebo následné stavy a zdravotní poškození. Výsledky mnoha studií potvrzují 2–8× vyšší riziko vzniku akutního koronárního syndromu, srdečního selhání nebo výskytu srdečních arytmií v bezprostředním období po prodělaném pneumokokovém onemocnění. Některé studie dokonce prokazují, že zvýšené riziko onemocnění srdce přetrvává až po dobu 10 let od prodělané pneumokokové pneumonie. Pneumokoková pneumonie je některými autory považována za nový nezávislý rizikový faktor kardiovaskulárních (KV) onemocnění. Bohužel stále není dostatek studií a prací hodnotících účinek očkování proti pneumokokovým onemocněním na primární prevenci vzniku KV onemocnění u pacientů s rizikovými faktory KV chorob nebo na sekundární prevenci u pacientů s KV onemocněním. Doporučení k očkování proti pneumokokům u pacientů s KV onemocněním jsou založena na názorech odborníků a na retrospektivních sledováních.
Riziko onemocnění pneumokokovým onemocněním narůstá s věkem. U osob ve věku 50–65 let je toto riziko 2,0× vyšší, ve věku 65–80 let 2,5× vyšší a lidé starší 80 let mají 4,9× vyšší riziko onemocnění IPO než osoby mladšího věku [17]. Všem seniorům, bez ohledu na další komorbidity, tedy i seniorům bez chronických onemocnění, se z uvedených důvodů doporučuje očkování aplikací jedné dávky 13valentní konjugované vakcíny proti pneumokokovým onemocněním bez nutnosti dalšího přeočkování [18]. Dříve se doporučovala a používala polysacharidová vakcína, která ale na rozdíl od konjugované má své limitace. Vzhledem k tomu, že obsahuje na T buňkách nezávislý antigen, nedochází po její aplikaci k tvorbě paměťových buněk, které zajišťují dlouhodobost protekce. Proto je nezbytné u polysacharidové vakcíny přeočkování po 5 letech.
Konjugovaná 13valentní vakcína proti pneumokokům (Prevenar 13) byla v Evropě v roce 2009 nejprve schválena pro děti ve věku od 6 týdnů do 5 let, v roce 2011 pro dospělé starší 50 let, v roce 2012 pro věkovou kategorii dětí 6–17 let a v roce 2013 pro zbývající kategorii 18–49 let. Postupně tak došlo k rozšíření možnosti použití konjugované pneumokokové vakcíny od dětí přes dospělé až k seniorům. K rozšíření došlo také v indikacích použití. K původní indikaci prevence IPO u dospělých ≥ 18 let přibyla indikace pneumokokových pneumonií. Konjugovaná vakcína prokázala u seniorů (65+) účinnost v prevenci pneumokokové komunitní pneumonie způsobené vakcinálními typy pneumokoka (46% účinnost), nebakteriemické pneumonie (45% účinnost) a v prevenci IPO (75% účinnost) [19]. Proočkovanost seniorů je přitom stále v řadě států včetně ČR nízká. Například v USA je to pouhých 11,0 % osob ve věku 65–69 let [20]. V ČR se odhaduje 2,9% proočkovanost [21].
V případě očkování proti pneumokokovým onemocněním hraje důležitou roli také možnost existence nepřímého (tzv. herd – kolektivního) efektu očkování. Při zajištění dostatečně vysoké proočkovanosti dětské populace, která je nejčastějším zdrojem nákazy pro seniory, je v řadě zemí pozorován také pokles výskytu IPO u neočkované seniorské populace. Tento herd efekt očkování vedl v Anglii a Walesu při 94% proočkovanosti dětské populace konjugovanou vakcínou k 44–95% poklesu výskytu vybraných sérotypů pneumokoka (ST 1, 3, 6A, 7F, 19A) u seniorů ve věku 65 let a starších při porovnání sezon 2008–2010 a 2013–2014 [22]. Bohužel v ČR tento efekt dosud popsán nebyl. Jedním z důvodů může být nízká a v poslední době spíše klesající proočkovanost dětské populace (67,5 % v roce 2017).
Očkování seniorů proti chřipce
Chřipka způsobuje každoroční úmrtí a hospitalizace všech věkových kategorií, nejvíce však osob starších 65 let [23,24]. Proto je každoroční očkování proti chřipce doporučováno všem seniorům, nejen osobám s akutním nebo chronickým onemocněním, ale také všem zdravým seniorům. Mezi očkovanými pacienty byla prokázána signifikantní redukce mortality a rovněž nižší frekvence hospitalizací v porovnání s rokem, kdy očkováni nebyli. Přínos očkování proti chřipce je zvýrazněn u seniorů s chronickým KV onemocněním s aterosklerotickou etiologií. Očkování je významné pro seniory se srdečním selháváním nebo s fibrilací síní. U těchto pacientů je popisován pokles protilátkové imunity vlivem modulace β2 adrenergních receptorů vyvolaný dysregulací sympatiku. Proto také pacienti léčení betablokátory redukujícími tuto dysregulaci vykazují signifikantně lepší efekt na očkování proti chřipce.
Přínos a účinnost očkování proti chřipce se v jednotlivých letech může lišit dle převažujících cirkulujících variant chřipkových virů a zacílení připravené vakcíny. Účinnost očkování může být rovněž ovlivněna dobou zahájení vakcinace. Časnou vakcinací (září–říjen) se u pacientů signifikantně zvyšuje její účinnost v porovnání s pozdějším zahájením. U seniorů také přináší opakovaná sezonní vakcinace (pět sezon po sobě) vyšší účinnost než jednorázové očkování. Kontroverzní zůstává délka protekce. Výsledky některých studií potvrzují efekt protekce po dobu 12 měsíců, jiné studie omezují efekt pouze na chřipkovou sezonu. Řada studií prokázala nižší koncentraci protilátek po očkování u seniorů v porovnání s mladšími dospělými [25]. Podobně provedené metaanalýzy předpokládají nižší úroveň protekce u seniorů, nicméně stále s klinickým účinkem na prevenci nemoci, komplikací, hospitalizací a úmrtí na chřipku [26,27]. Snaha o zvýšení účinnosti vakcín proti chřipce u seniorů vedla k vývoji a registraci adjuvantních vakcín obsahujících látku MF59, emulzi olej ve vodě nebo vakcín s vyšším obsahem antigenů s 60 µg proteinů místo běžně používaných 15 µg. Další možností, jak zvýšit imunogenitu vakcín proti chřipce u seniorů, je intradermální aplikace vakcíny místo klasické intramuskulární [28].
K očkování se doporučují dostupné inaktivované vakcíny proti chřipce s preferencí tetravalentních vakcín před trivalentními. Tetravalentní vakcíny zajišťují širší pokrytí cirkulujících chřipkových virů v dané sezoně. Riziko chřipky přetrvává pro seniory po celou dobu výskytu chřipky již od počátku chřipkové sezony, nikoliv pouze v období epidemie. Očkování se doporučuje aplikací jedné dávky vakcíny co nejdříve, kdy je vakcína na trhu dostupná. Vzhledem k měnícím se cirkulujícím virům chřipky je nezbytné očkování opakovat každý rok [29].
Kardioprotektivní efekt očkování
proti chřipce a pneumokokům
V poslední době přibývá výzkumných prací zaměřených na očkování proti chřipce, ale i proti pneumokokovým onemocněním z hlediska možného kardioprotektivního efektu na srdce a KV systém. Zvažovány jsou dva mechanismy pozitivního vlivu vakcinace. Nespecifický účinek vakcinace vychází z novodobých znalostí etiopatogeneze aterosklerózy, která je dnes již považována nikoliv za degenerativní, ale za zánětlivý proces. Zánětlivé změny hrají hlavní úlohu v procesech od vzniku aterosklerózy až po její progresi a rupturu aterosklerotických plátů. Jde o zánět cévní stěny podporovaný infiltrací LDL cholesterolu do cévní intimy a aktivací makrofágů. Tento chronický proces se vyznačuje střídáním fáze stabilizace s akutní destabilizací a formováním aterosklerotických plátů vedoucích ke vzniku koronárního syndromu. Prozánětlivé cytokiny uvolněné během zánětlivého aterosklerotického procesu mají pak různé negativní účinky na srdce a cévy. Účinkem očkování dochází u pacientů s KV onemocněním k redukci vzniku nejčastějších infekčních onemocnění, která mohou svým zánětlivým působením destabilizovat chronický aterosklerotický zánětlivý proces a urychlit agregaci krevních destiček, vést k trombóze a ke vzniku akutního koronárního syndromu. Očkování může tyto procesy inhibovat.
Specifický účinek vakcinace vychází z imunogenních vlastností chřipkového viru a pneumokoka, respektive z imunogenních vlastností antigenů připravených z těchto původců. Řada studií prokázala, že protektivní účinek vakcinace proti chřipce nebyl omezen pouze na chřipkovou sezonu, ale byl také potvrzen v mimosezonní době, kdy v populaci chřipkový virus necirkuloval. Přesto byl mimo sezonu zaznamenán nižší výskyt srdečních příhod u očkovaných pacientů. Možné vysvětlení je založeno na existenci antigenních mimiker mezi vakcinálním antigenem a antigeny aterosklerotických plátů. Zkřížená reaktivita postvakcinačních IgM protilátek proti chřipkovému hemaglutininu A s oxidovaným LDL cholesterolem může vést u očkovaných k redukci pohlcování LDL cholesterolu makrofágy a tím k oddálení jejich přeměny na tzv. pěnové buňky. Vznik pěnových buněk je první fází aterosklerotického procesu. Postvakcinační protilátky tak inhibují progresi aterosklerotických procesů a snižují riziko srdeční příhody. Zároveň protilátky zvyšují aktivitu bradykininových receptorů s následným vazodilatačním účinkem snižujícím riziko cévního uzávěru. Podobně mohou vakcinální antigeny pneumokoka interagovat s imunozánětlivým mechanismem aterosklerotického procesu. Pokusy na zvířecích modelech ukázaly 40% redukci výskytu aterosklerotických plátů po očkování proti pneumokokovým onemocněním. Prokázaná redukce výskytu akutního koronárního syndromu u pacientů očkovaných proti pneumokokům v klinické studii případů a kontrol je autory vysvětlována existencí antigenních mimiker (podobnosti) mezi oxidovaným LDL cholesterolem a Streptococcus pneumoniae. Postvakcinační IgM protilátky po očkování redukují pohlcování LDL cholesterolu makrofágy a zpomalují tvorbu aterosklerotických plaků a progresi KV onemocnění [30].
Očkování seniorů proti pásovému
oparu
Pásový opar je onemocnění objevující se sporadicky na celém světě. Na rozdíl od planých neštovic, způsobených VZV, pásový opar nevykazuje sezonní závislost a nevznikají epidemie. K jeho vzniku může dojít v různém časovém odstupu od primoinfekce VZV. Více než 90 % dospělých vykazuje sérologické známky předchozí VZV infekce. Toto potvrzují i data ze sérologického přehledu, který byl v ČR proveden roku 1996. Výsledky uvádějí zvyšující se promořenost VZV s věkem, která již u 5–10letých dětí dosahuje 70–80 % a ve vyšších věkových skupinách až 90–98 % [31]. Stejně jako v jiných zemích nebyly nalezeny rozdíly v promořenosti mužů a žen. Všechny osoby, které se v minulosti setkaly s VZV a prodělaly třeba i inaparentní infekci, jsou během života ohroženy rizikem vzniku herpes zoster (HZ). U 10–30 % séropozitivních osob dojde v průběhu života k reaktivaci latentní nákazy a k rozvoji onemocnění pásovým oparem. Výskyt pásového oparu není vázán pouze na jednu specifickou věkovou kategorii. Může postihnout jedince každého věku. Nicméně u dětí se vyskytuje vzácně. S věkem pak dochází k postupnému nárůstu incidence, který začíná po 50. roce života, s vrcholem v nejvyšších věkových kategoriích u osob starších 60–70 let. Více než polovina postižených tak bývá starší 60 let.
V počtu případů HZ v České republice dochází za posledních třicet let k mírnému nárůstu. Daleko více stoupá počet komplikací, zejména neurologických, jako jsou postherpetické neuralgie. Podle informačního systému EPIDAT u nás v průměru ročně onemocní více než 6 000 osob (data za období 1978–2013). Roční incidence se v letech 1978–2013 pohybovala od 4 494 případů (43,9 případu/100 000 obyvatel) v roce 1978 do 6 894 případů (67,6/100 000) v roce 2002. Incidence u žen je dlouhodobě 1,4krát vyšší než u mužů. V letech 1982–2013 byla průměrná roční incidence u žen 68,5/100 000, u mužů pouze 51,4/100 000. I data z ČR potvrzují výrazně vyšší riziko vzniku pásového oparu u starších osob. Nejpostiženější věkovou kategorií jsou osoby starší 80 let, následovány kategorií 70–80 let a třetí nejohroženější skupinou jsou lidé ve věku 60–70 let. V roce 2011 byl u nás vrchol incidence popsán u osob starších 75 let (175,3/100 000), přičemž průměrná incidence bez ohledu na věk byla 60,5 případu/100 000 osob. Zlomový věk pro nárůst incidence onemocnění představuje již věková kategorie 45–49 let. Ve věkové kategorii nad 50 let je již incidence větší než průměrná roční incidence bez ohledu na věk. Prodělaný HZ vede k opětovnému posílení buněčné imunity, proto je u imunokompetentních osob opakování nemoci spíše vzácné. Přesto se může vyskytnout až u 6 % osob do osmi let po první epizodě, mezi imunosuprimovanými až u 12 % osob [32].
První vakcína proti pásovému oparu byla zaregistrována v roce 2006. Jednalo se o živou atenuovanou vakcínu Zostavax, která obsahuje oslabený VZV (Oka/Merck) pomnožený v lidských diploidních (MRC 5) buňkách. V Shingles Prevention Study, která hodnotila účinnost Zostavaxu, byla účinnost protekce proti vzniku HZ 51 % u osob ve věku 60 let a starších a 38 % u osob ve věku 70 let a starších. Vakcína rovněž snižuje incidenci nejčastější komplikace HZ, kterou představuje postherpetická neuralgie, o 67 % u osob ve věku 60 let a starších. Úroveň účinnosti a přetrvávání protekce jsou po pěti letech po aplikaci této vakcíny nejisté. Vakcína je v České republice registrována od roku 2006 a na trh v ČR je dodávána od roku 2014. Vakcinace proti pásovému oparu je doporučena zejména osobám ve zvýšeném riziku vzniku a závažnějšího průběhu pásového oparu. Do této kategorie patří senioři. Bohužel tato živá vakcína má u seniorů omezenou účinnost a u starších 80 let je prakticky neúčinná.
Proto byla vyvinuta nová vakcína proti pásovému oparu nazvaná Shingrix, která byla nově v říjnu 2017 zaregistrována v USA a Kanadě k prevenci HZ u osob ve věku 50 let a starších. V roce 2018 byla zaregistrována také v Evropě. Jde o subjednotkovou rekombinantní vakcínu na bázi glykoproteinu E a adjuvantního systému AS01B. Klinická studie ZOE 50 hodnotící účinnost vakcíny při srovnání s placebem u osob ve věku 50 let a starších při době sledování průměrně 3,2 roku prokázala vysokou účinnost 97,2 % proti HZ. Paralelně probíhající studie ZOE 70, která hodnotila účinnost vakcíny při srovnání s placebem u osob ve věku 70 let a starších, potvrdila i u této věkové kategorie vysokou účinnost 89,9 % proti HZ při době sledování průměrně 3,7 roku. Srovnatelných hodnot účinnosti vakcíny bylo dosaženo v obou sledovaných věkových skupinách 70–79 let a 80 let a starších (90,0 % a 89,1 %). Souhrnná analýza dat z obou studií u osob ve věku 70 let a starších potvrdila vysokou účinnost proti HZ (91,3 %) a vysokou účinnost proti postherpetické neuralgii (88,8 %). Z pohledu bezpečnosti byla vakcína více reaktogenní než placebo. Studie však u vakcíny neprokázaly žádný bezpečnostní problém [33–35]. Vzhledem k prokázané vysoké účinnosti a skutečnosti, že nejde o živou vakcínu, má vakcína vysoký potenciál být využívána právě ve skupinách osob nejrizikovějších pro rozvoj pásového oparu.
Zostavax je indikován k prevenci HZ a postherpetické neuralgie související s HZ. Je určen k imunizaci osob ve věku 50 let a starších. Očkovací schéma živé oslabené vakcíny Zostavax je tvořeno jednou dávkou vakcíny. Potřeba aplikace další dávky není stanovena. Vakcína není určena k prevenci primární infekce VZV (plané neštovice) a není indikována pro děti a dospívající. Rovněž není indikována pro léčbu pásového oparu ani postherpetické neuralgie. Lze ji aplikovat bez ohledu na údaj o předchozím prodělání HZ v anamnéze.
Vakcína Shingrix je určena k prevenci HZ u osob ve věku 50 let a starších. Základní vakcinační schéma je tvořeno dvěma dávkami. Druhá dávka se podává v intervalu 2–6 měsíců po aplikaci první dávky. Potřeba aplikace další booster dávky není stanovena. Osobám v minulosti očkovaným živou vakcínou Zostavax se doporučuje přeočkování vakcínou Shingrix. Americký poradní sbor pro očkování (Advisory Committee of Immunization Practices, ACIP) upřednostňuje vakcínu Shingrix před vakcínou Zostavax. Zostavax se aplikuje subkutánně, nejlépe do oblasti deltového svalu. Vakcína se dodává ve formě prášku a roztoku pro přípravu injekčního roztoku. Aplikuje se po rekonstituci. Shingrix se aplikuje intramuskulárně, nejlépe do oblasti deltového svalu. Vakcína se dodává ve formě prášku a roztoku pro přípravu injekčního roztoku. Aplikuje se po rekonstituci. Nová, moderní vakcína Shingrix bohužel zatím není v ČR dostupná.
Očkování seniorů proti černému
kašli
Černý kašel patří mezi onemocnění, jež se i přes dostupné očkování vrací zpět do populace a postupně se přesouvá z dětské populace mezi dospělé, včetně seniorů. Narůstající incidence pertuse, zvláště u dospělých, je zaznamenávána v řadě evropských zemí [36–38] a také v ČR, kde je zjišťován nárůst od roku 1993 s maximem v roce 2014. V roce 2017 bylo v ČR evidováno 667 případů pertuse a nemocnost tak dosáhla 6,3/100 000 obyvatel [39]. Většina (64 %) případů onemocnění je hlášena u dospělých osob. Současná incidence pertuse odpovídá incidenci v 60. letech minulého století, tedy v době, kdy se proti černému kašli neočkovalo. Reálná incidence může být v důsledku podhlášenosti ve skutečnosti až 200× vyšší (699/100 000 obyvatel) [40]. V seniorské populaci se pertuse v roce 2017 vyskytovala nejvíce ve věkové kategorii 70–74 let [39]. Proto je vhodné zvážit přeočkování ještě před dosažením věku 65 let, pokud již neproběhlo kdykoliv dříve v dospělosti. Senioři jsou považováni za jeden z možných zdrojů nákazy pro děti, zejména pro novorozence a kojence, kteří z důvodu věku nemají ještě zajištěnou dostatečnou postvakcinační protekci proti pertusi. Právě senioři bývají často v těsném rodinném kontaktu s těmito dětmi, svými vnoučaty a pravnoučaty. Proto by přeočkování v seniorském věku mělo být doporučeno všem [41]. Zemí s tímto doporučením postupně přibývá, přesto je stále množství zemí bez existence doporučení. Vzhledem k nedostupnosti monovakcíny pouze proti pertusi je možné pro přeočkování využít jednu dávku kombinované vakcíny proti záškrtu, tetanu a pertusi s nižším obsahem antigenů (tzv. dtap vakcínu). Vakcíny jsou v tomto věku bezpečné, dobře tolerovány a dostatečně imunogenní [42]. Očkování zajistí protekci i navzdory tomu, že postvakcinační koncentrace protilátek 4 týdny po přeočkování je u seniorů nižší než u mladých dospělých osob [43].
Úhrada očkování seniorů
Seniorům starším 65 let (ve věku 66 a více let) je ze zdravotního pojištění plně hrazena vlastní očkovací látka, včetně aplikace vakcíny proti chřipce a proti pneumokokovým onemocněním. Z pravidelných očkování je seniorům plně hrazeno každých 10 let přeočkování proti tetanu a kdykoliv při poranění a úrazu s rizikem nákazy. Úhrada očkování proti chřipce a pneumokokovým onemocněním je stanovena zákonem č. 48/1997 Sb., o veřejném zdravotním pojištění (§ 30, odst. 2 zákona).
Očkování proti chřipce je také hrazeno osobám mladším 65 let, pokud se zároveň jedná o pacienty s KV onemocněním nebo v případě, kdy mají porušenou/zaniklou funkci sleziny, trpí závažným imunodeficitem vyžadujícím dispenzarizaci na specializovaném pracovišti či jsou po transplantaci kmenových buněk. Dále jsou li umístěni v léčebnách pro dlouhodobě nemocné, v domovech pro seniory, v domovech pro osoby zdravotně postižené nebo v domovech se zvláštním režimem. Očkování proti pneumokokům je také hrazeno bez ohledu na věk u osob umístěných v léčebnách pro dlouhodobě nemocné a v domovech pro seniory a také u osob s porušenou/zaniklou funkcí sleziny trpících závažným imunodeficitem či po transplantaci kmenových buněk. U porušené/zaniklé funkce sleziny, závažného imunodeficitu a po transplantaci kmenových buněk je navíc hrazeno očkování proti meningokokovým a HiB onemocněním.Na další očkování seniorů lze využít příspěvky zdravotních pojišťoven, které často poskytují svým pojištěncům vakcinaci v rámci preventivních balíčků.
Závěr
Narůstající počet seniorů v populaci a stále se prodlužující střední délka života vede k rostoucímu významu možnosti prevence infekčních onemocnění očkováním také ve vysokém věku. Současné možnosti a doporučení toto používání očkovacích látek u seniorů dovolují. Očkování seniorů předchází nejenom výskytu infekcí, vzniku komplikací, hospitalizací a úmrtí, ale také u nich vede ke zvýšení kvality života. Doporučení očkování seniorů se v Evropě liší stát od státu a jen těžko můžeme očekávat v blízké době nějakou harmonizaci a sjednocení těchto doporučení.
Daleko větší význam má implementace jednotlivých národních doporučení do každodenní klinické praxe a zvýšení zájmu seniorů o očkování spojené se zvýšenou proočkovaností této věkové skupiny obyvatel. Proočkovanost seniorů je doposud v řadě zemí velmi nízká. Získat přesná data o proočkovanosti seniorů je přitom velmi obtížné z důvodu neexistence centrálních databází očkovaných seniorů. Nicméně cíle Světové zdravotnické organizace proočkovat 75 % seniorů starších 65 let například proti chřipce do roku 2015 nebylo v řadě zemí zdaleka dosaženo. Nejvyšší proočkovanosti – kolem 70 % – dosahují v Nizozemsku a ve Velké Británii. V ČR se odhaduje pouhá 20% proočkovanost seniorů proti chřipce. Základní vakcinační strategií seniorů stále zůstává očkování proti pneumokokovým onemocněním, proti chřipce a proti pásovému oparu, v ČR navíc proti klíšťové encefalitidě. Očkování seniorů se bude rozvíjet také v blízké budoucnosti s příchodem nových vakcín proti nemocem vyvolaným respiračním syncytiálním virem (RSV vakcíny) nebo vakcín proti nozokomiálním infekcím, jako jsou vakcíny namířené proti Clostridium difficile, Staphylococcus aureus, Klebsiella pneumoniae, Escherichia coli, nebo proti mykotickým onemocněním způsobeným Candida spp.
Seznam použité literatury
- [1] United Nations. World population prospects. 2017. http://esa.un.org/unpd/wpp. Accessed 20 November 2018.
- [2] Aw D, Silva AB, Palmer DB. Immunosenescence: emerging challenges for anageing population. Immunology 2007; 120: 435–446.
- [3] Thomas SL, Hall AJ. What does epidemiology tell us about risk factors for herpes zoster? Lancet Infect Dis 2004; 4: 26–33.
- [4] Janssens JP. Pneumonia in the elderly (geriatric) population. Curr Opin Pulm Med 2005; 11: 226–230.
- [5] Attal N, Deback C, Gavazzi G, et al. Functional decline and herpes zoster in older people: an interplay of multiple factors. Aging Clin Exp Res 2015; 27: 757–765.
- [6] Kristensen M, Lier AV, Eilers R, et al. Burden of four vaccine preventable diseases in older adults. Vaccine 2016; 34: 942–949.
- [7] Weinberger B. Vaccines for the elderly: current use and future challenges. Immun Ageing 2018; 15: 3, DOI 10.1186/s12979‑017‑0107‑2.
- [8] Aw D, Silva AB, Palmer DB. Immunosenescence: emerging challenges for an ageing population. Immunology 2007; 120: 435–446.
- [9] Fujihashi K, McGhee JR. Mucosal immunity and tolerance in the elderly. Mech Ageing Dev 2004; 125: 889–898.
- [10] High KP. Infection as a cause of age‑related morbidity and mortality. Aging Res Rev 2004; 3: 1–14.
- [11] Gavazzi G, Krause KH. Ageing and infection. Lancet Infect Dis 2002; 2: 659–666.
- [12] Weinberger B, Herndler‑Brandstetter D, Schwanninger A, et al. Biology of immune responses to vaccines in elderly persons. Clin Infect Dis 2008; 46: 1078–1084.
- [13] Simell B, Vuorela A, Ekström NT, et al. Aging reduces the functionality of anti‑pneumococcal antibodies and the killing of Streptococcus pneumoniae by neutrophil phagocytosis. Vaccine 2011; 29: 1929–1934.
- [14] Siegrist CA, Aspinall R. B‑cell responses to vaccination at the extremes of age. Nat Rev Immunol 2009; 9: 185–194.
- [15] Chen WH, Kozlovsky BF, Effros RB, et al. Vaccination in the elderly: an immunological perspective. Trends Immunol 2009; 30: 351–359.
- [16] Centers for Disease Control and Prevention. Prevention of pneumococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 1997; 46: 1–24.
- [17] Baxter R, Yee A, Aukes L, et al. Risk of underlying chronic medical conditions for invasive pneumococcal disease in adults. Vaccine 2016; 34: 4293–3297.
- [18] Ludwig E, Unal S, Bogdan M, et al. Opportunity for healthy ageing: lessening the burden of adult pneumococcal disease in Central and Eastern Europe, and Israel. Review and analysis of the problem. Cent Eur J Public Health 2012; 20: 121–125.
- [19] Bonten MJ, Huijts SM, Bolkenbaas M, et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med 2015; 372: 1114–1125.
- [20] Black CLWW, Warnock R, Pilishvili T, et al. Pneumococcal vaccination among medicare beneficiaries occurring after the Advisory Committee on Immunization Practices recommendation for routine use of 13‑valent pneumococcal conjugate vaccine and 23‑valent pneumococcal polysaccharide vaccine for adults aged ≥ 65 years. Morb Mortal Wkly Rep 2017; 66: 728–733.
- [21] Dušek L. Hradecké vakcinologické dny 4.‒6. 10. 2018. Dostupné na: https://www.vakcinace.eu/data//files/hradeckevakcinologickedny2018 [accessed February 12th 2019].
- [22] Waight PA, Andrews NJ, Ladhani SN, et al. Effect of the 13‑valent pneumococcal conjugate vaccine on invasive pneumococcal disease in England and Wales 4 years after its introduction: an observational cohort study. Lancet Infect Dis 2015; 15: 535–543.
- [23] Thompson WW, Shay DK, Weintraub E, et al. Mortality associated with influenza and respiratory syncytial virus in the United States. JAMA 2003; 289: 179–86.
- [24] Thompson WW, Shay DK, Weintraub E, et al. Influenza‑associated hospitalizations in the United States. JAMA 2004; 292: 1333–1340.
- [25] Goodwin K, Viboud C, Simonsen L. Antibody response to influenza vaccination in the elderly: a quantitative review. Vaccine 2006; 24: 1159–1169.
- [26] Osterholm MT, Kelley NS, Sommer A, Belongia EA. Efficacy and effectiveness of influenza vaccines: a systematic review and meta‑analysis. Lancet Infect Dis 2012; 12: 36–44.
- [27] Beyer WE, McElhaney J, Smith DJ, et al. Cochrane re‑arranged: support for policies to vaccinate elderly people against influenza. Vaccine 2013; 31: 6030–6033.
- [28] Holland D, Booy R, de Looze F, et al. Intradermal influenza vaccine administered using a new microinjection system produces superior immunogenicity in elderly adults: a randomized controlled trial. J Infect Dis 2008; 198: 650–658.
- [29] Smetana J, Chlibek R, Shaw J, et al. Influenza vaccination in the elderly. Hum Vaccin Immunother 2018; 14: 540–549.
- [30] Ciszewski A. Cardioprotective effect of influenza and pneumococcal vaccination in patients with cardiovascular diseases. Vaccine 2018; 36: 202–206.
- [31] Roubalová K, Seman J. Sérologický přehled protilátek proti herpetickým virům CMV, BV, VZV. Zprávy CEM 1998; 7, příloha 1: 29–31.
- [32] Yawn BP, Wollan PC, Kurland MJ, et al. Herpes zoster recurrences more frequent than previously reported. Mayo Clin Proc 2011; 86: 88–93.
- [33] Chlibek R, Bayas JM, Collins H, et al. Immunogenicity of an AS01‑adjuvanted Varicella‑zoster Virus Subunit Candidate Vaccine Against Herpes Zoster in Adults ≥ 50 Years of Age. J Infect Dis 2013; 208: 1953–1961.
- [34] Lal H, Cunningham AL, Godeaux O, et al. Efficacy of an Adjuvanted Herpes Zoster Subunit Vaccine in Older Adults. N Engl J Med 2015; 372: 2087–2096.
- [35] Cunningham AL, Lal H, Kovac M, et al. Efficacy of the herpes zoster subunit vaccine in adults 70 years of age or older. N Engl J Med 2016; 375: 1019–1032.
- [36] Rendi‑Wagner P, Tobias J, Moerman L, et al. The seroepidemiology of Bordetella pertussis in Israel-estimate of incidence of infection. Vaccine 2010; 28: 3285–3290.
- [37] Ridda I, Yin JK, King C, et al. The importance of pertussis in older adults: a growing case for reviewing vaccination strategy in the elderly. Vaccine 2012; 30: 6745–6752.
- [38] Gil A, Oyaguez I, Carrasco P, Gonzalez A. Hospital admissions for pertussis in Spain, 1995–1998. Vaccine 2001; 19: 4791–4794.
- [39] Fabiánová K, Zavadilová J, Šebestová H, et al. Syndrom dávivého kašle. Pertuse a parapertuse v České republice v roce 2017 – epidemiologická situace a přehled očkování proti pertusi. Zprávy CEM (SZÚ Praha) 2018; 27: 75–83.
- [40] Chlibek R, Smetana J, Sosovickova R, et al. Seroepidemiology of whooping cough in the Czech Republic: estimates of incidence of infection in adults. Public Health 2017; 150: 77–83.
- [41] Chlíbek R. Očkování dospělých. Praha: Mladá fronta, 2018.
- [42] Halperin SA, Scheifele D, de Serres G, et al. Immune responses in adults to revaccination with a tetanus toxoid, reduced diphtheria toxoid, and acellular pertussis vaccine 10 years after a previous dose. Vaccine 2012; 30: 974–982.
- [43] Kaml M, Weiskirchner I, Keller M, et al. Booster vaccination in the elderly: their success depends on the vaccine type applied earlier in life as well as on pre‑vaccination antibody titers. Vaccine 2006; 24: 6808–6811.