Elotuzumab v léčbě mnohočetného myelomu
Souhrn:
Špička I. Elotuzumab v léčbě mnohočetného myelomu. Remedia 2020; 30: 287–291.
Terapie mnohočetného myelomu (MM) se v posledních dvou dekádách zcela změnila s možností použití cílených léků, jako jsou inhibitory proteazomu, imunomodulační léky a monoklonální protilátky. Tyto přípravky první, druhé a třetí generace v různých kombinacích nyní představují páteřní léčbu MM. Doba přežití pacientů se za poslední dekády zdvojnásobila, nicméně stále platí, že ve většině případů dochází k relapsům a postupně se rozvíjí rezistence na terapii. Elotuzumab (Elo) je u MM první monoklonální protilátkou schválenou pro klinickou praxi; v roce 2015 ji americký Úřad pro kontrolu potravin a léčiv schválil jako tzv. breakthrough therapy. Jejím cílovým antigenem je povrchový receptor SLAMF7 (též CS1) ze skupiny CD2 a rodiny SLAMF (signaling lymphocytic activation molecule). V současnosti je Elo schválen v kombinaci s dexametazonem a buď s lenalidomidem, nebo s pomalidomidem pro relabující myelomové pacienty. Výhodou Elo proti jiným testovaným protilátkám je bezpečnost a dobrá tolerance. Alergické reakce, které uvádějí v malém procentu klinické studie, jsou nezávažné a snadno zvládnutelné.
Summary:
Spicka I. Elotuzumab in the treatment of multiple myeloma. Remedia 2020; 30: 287–291.
In the last two decades, the therapy of multiple myeloma (MM) has changed radically with the possibility to use targeted drugs, such as proteasome inhibitors, immunomodulatory substances and monoclonal antibodies. These products of first, second and third generation in different combinations now comprise the backbone of MM treatment. Overall survival has increased two‑fold in the last decades. However, in most cases, relapses occur and a resistance to therapy gradually develops. Elotuzumab (Elo) is the first monoclonal antibody in MM approved for clinical practice; in 2015, American Food and Drug Administration has approved it as so called breakthrough therapy. The target antigen is a surface receptor SLAMF7 (also CS1) from CD2 group and SLAMF family (signaling lymphocytic activation molecule). At the moment, Elo is approved in combination with dexamethasone and either lenalidomide or pomalidomide for relapsing myeloma patients. The advantage of Elo compared with other evaluated antibodies is safety and good tolerance. Allergic reactions recorded in low numbers by clinical trials are not serious and easily managed.
Key words: multiple myeloma, monoclonal antibodies, elotuzumab ,lenalidomide, pomalidomide
Úvod
Mnohočetný myelom (MM), charakterizovaný klonální proliferací plazmocytů kostní dřeně, představuje podle analýz asi 2 % všech nově diagnostikovaných malignit a více než 15 % hematologických nádorů [1]. Pokroky v léčbě MM patří k jednomu z největších úspěchů onkologie posledních dvou desetiletí, doba přežití pacientů se za oněch dvacet let zdvojnásobila. Podle nedávné analýzy vzrostla u pacientů s autologní transplantací kmenových buněk (autologous stem cell transplantation, ASCT) pravděpodobnost pětiletého období bez progrese (progression free survival, PFS) z 29 % z doby před rokem 1997 na 68 % po roce 2014 [2]. Vděčíme za to vývoji biologických či cílených přípravků, nejdříve jejich první generace − proteazomového inhibitoru (PI) bortezomibu a imunomodulačních léků (IMiDů) − talidomidu a lenalidomidu. V další fázi to byly jejich účinnější a lépe tolerované varianty a zejména monoklonální protilátky (monoclonal antibodies, mAb).
Elotuzumab (Elo) je humanizovaná mAb, jejímž cílovým antigenem je povrchový receptor SLAMF7 (cell surface signaling lymphocytic activation molecule family member 7) ze skupiny CD2 a rodiny SLAMF (též CS1 – cell surface glykoprotein CD2, podskupiny 1), glykoprotein s vysokou expresí na plazmatických buňkách a NK buňkách (přirození zabíječi, natural killers). Více než 95 % plazmocytů kostní dřeně exprimuje SLAMF7 a tato exprese je přítomna u všech podtypů myelomových populací nezávisle na cytogenetických změnách nebo na počtu předchozích linií terapie [3]. Při nulovém nebo velmi nízkém výskytu SLAMF7 na ostatních buňkách Elo selektivně ničí plazmocyty s minimálními vedlejšími efekty.
Mechanismy účinku elotuzumabu
zahrnují NK buňkami mediovanou na protilátkách závislou
buněčnou cytotoxicitu (antibody dependent cell cytotoxicity, ADCC)
i přímou aktivaci NK buněk (obr. 1) [4,5]. Na rozdíl od protilátek anti CD38
však Elo neindukuje přímo apoptózu ani imunitně zprostředkovanou
přímou cytolýzu plazmatických buněk. Mechanismy rezistence
na Elo nejsou známy, vysvětlením by mohla být přítomnost
solubilních SLAMF7 molekul v séru, které in
vitro interferují s ADCC NK buněk [6].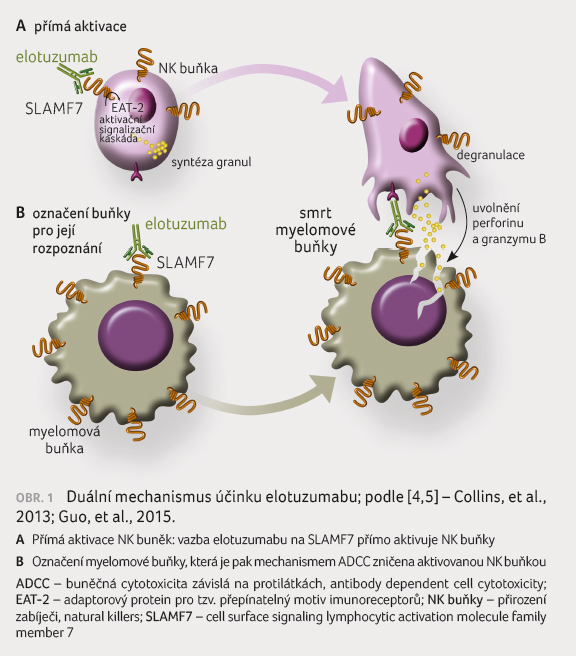
Klinické výsledky
Elotuzumab je jediným z přípravků používaných v současnosti k terapii MM, který nemá efekt v monoterapii. Ve studii fáze I s Elo v dávkách 0,5−20 mg/kg u 35 pacientů s relabujícím/refrakterním myelomem (RR MM) nebyla pozorována prakticky žádná aktivita – pouze 26 % léčených dosáhlo stabilizace nemoci jako nejlepšího stupně odpovědi. V této fázi se alespoň ukázala minimální toxicita léčby [7].
Zcela jiné
výsledky však přinesly studie, kde byl Elo používán
v kombinacích s jinými přípravky. Účinek kombinace
elotuzumabu s lenalidomidem přibližuje obrázek 2 [8]. Již studie fáze
I s lenalidomidem a dexametazonem (Ld) prokázala
celkovou terapeutickou odpověď (overall response rate, ORR, tj.
dosažení alespoň parciální remise) u 82 % léčených,
většinou tzv. lenalidomid naivních pacientů, téměř u jedné
třetiny typu velmi dobré parciální remise (very good partial
remission, VGPR) či lepší, s dobou trvání remise (PFS)
32,9 měsíce [9].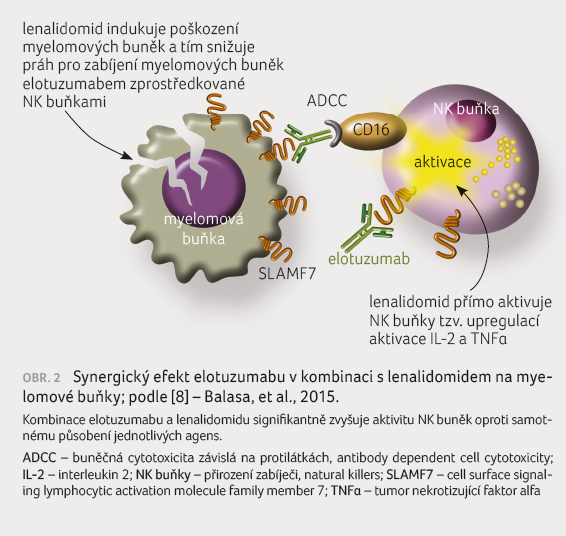
V následném hodnocení fáze II byl studován efekt dvou různých dávek Elo (10 a 20 mg/kg) v téže kombinaci (ELd). U 73 pacientů s RR MM neléčených dříve lenalidomidem byla odpověď podobná jako v předchozí studii – ORR 84 % při 14 % stringentních kompletních remisí a 42 % VGPR. Tato studie určila dávkování pro další klinický vývoj, neboť dávka 10 mg/kg vedla k delšímu trvání PFS než dávka dvojnásobná (32 měsíců vs. 25 měsíců). Také se potvrdila nízká toxicita protilátky, která se nelišila od očekávané toxicity dvojkombinace Ld [10].
Registrační studie fáze III dostala název ELOQUENT 2, zařazeno do ní bylo 646 pacientů s RR MM (1−4 předchozí linie léčby, medián 2), včetně nemocných z České republiky. Trojkombinace ELd byla srovnávána se standardní kombinací Ld. Průběžné výsledky této studie byly v posledních letech opakovaně publikovány. V první souhrnné analýze byla při mediánu doby sledování 24,5 měsíce ORR 79 % ve skupině s ELd proti 66 % v kontrolní skupině (p < 0,001), medián PFS 19,4 měsíce proti 14,9 měsíce (p < 0,001) a dvouleté přežití dosahovalo 41 % proti 27 % [11]. Přínos Elo byl pozorován i ve skupině pacientů s nepříznivou cytogenetikou, s renální insuficiencí nebo s předchozí léčbou lenalidomidem (kterých však bylo zařazeno méně než 10 %) [12]. Další analýza po tříletém sledování ukázala, že ELd snižuje riziko progrese onemocnění a/nebo smrti o 27 % (poměr rizik [HR] 0,73; p = 0,0014) a prokazuje trend prodloužení celkové doby přežití (overall survival, OS) (p = 0,0257). Po roce, dvou a třech letech léčby bylo ve skupinách ELd vs. Ld 91 % vs. 83 %, 73 % vs. 69 % a 60 % vs. 53 % žijících pacientů. Efekt byl zvlášť patrný u nemocných s delší dobou od diagnózy, hlavně však pouze s jednou předchozí linií terapie – u těch kombinace ELd znamenala 53% snížení rizika progrese/smrti (HR 0,47). Signifikantně delší bylo podle finální analýzy i OS – 48,3 měsíce proti 39,6 měsíce (odesláno k publikaci). Elo představuje mAb, jejíž efekt byl u MM opakovaně prezentován po jednoznačně nejdelší době sledování; studie ELOQUENT-2 vedla k tomu, že americký Úřad pro kontrolu potravin a léčiv (FDA) schválil kombinaci ELd pro léčbu nemocných po 1−3 předchozích liniích léčby.
Druhou a zatím poslední schválenou indikací Elo je kombinace s pomalidomidem (P) a dexametazonem. Do studie ELOQUENT 3 (fáze II) bylo zařazeno 117 nemocných s RR MM, ale proti předchozí studii byla mezi vstupní kritéria zařazena rezistence na předchozí léčbu lenalidomidem (a PI) [13]. Zde je nutno uvést, že terapie pacientů refrakterních na lenalidomid, kterých při širokém použití jednoho z nejúčinnějších myelomových léků pochopitelně přibývá, patří mezi hlavní současné problémy léčby MM. Na řešení tohoto problému se zaměřují prakticky všechny klinické studie s novou generací přípravků (bifázické protilátky, selinexor, melflufen atd.). Kombinace Elo Pd vedla k vyššímu podílu ORR proti kontrolní skupině Pd (53 % vs. 26 %). Signifikantně delší byla PFS − 10,3 měsíce u Elo Pd vs. 4,7 měsíce u Pd (HR 0,54; 95% interval spolehlivosti [CI] 0,34–0,86). Data pro hodnocení OS jsou zatím nezralá, ale trend favorizující trojkombinaci je již zřejmý (HR 0,62; 95% CI 0,30–1,28). Také tato studie znamenala schválení kombinace FDA pro pacienty s RR MM, kteří byli dříve léčeni PI a lenalidomidem.
Pro celkový přehled ještě zmiňme, že kombinace Elo s kortikoidy a první látkou ze skupiny IMiDů talidomidem má oproti předchozím terapeutickým režimům signifikantně nižší efekt a vysoké riziko výskytu periferních neuropatií (20 % grade 1 a 2, resp. 3 % grade 3 a 4) [14]. Také klinické hodnocení kombinace s bortezomibem nesplnilo základní cíl – signifikantní prodloužení PFS po přidání Elo (medián 9,7 měsíce vs. 6,9 měsíce; HR 0,72, 95% CI 0,49–1,06; p = 0,09) [15].
Nežádoucí účinky
Bezpečnost léčby je výhodou Elo proti jiným schváleným a testovaným protilátkám. Alergické reakce spojené s infuzním podáním (infusion related reaction, IRR), které uvádějí v malém procentu klinické studie, jsou lehkého charakteru a snadno zvládnutelné. Ve studii ELOQUENT 2 byly hlášeny u 10 % pacientů v rameni s Elo, pouze ve čtyřech případech z nich závažnosti stupně 3 (a žádného stupně 4 nebo 5). U dvou pacientů byla léčba Elo z tohoto důvodu ukončena. Stejně jako v případě protilátek proti receptoru CD38 byly reakce pozorovány pouze při prvním podání (zde v 70 %) [11]. Velmi podobné výsledky ukázala studie ELOQUENT 3 [13]. Kromě IRR nebyly v obou studiích pozorovány žádné nežádoucí účinky, které by byly častější ve skupině s protilátkou ve srovnání se skupinou kontrolní. Na rozdíl od mAb anti CD38 neinterferuje Elo s testy skupinové kompatibility, protože erytrocyty receptor SLAMF7 neexprimují.
Trochu paradoxní nevýhodou terapie Elo, daratumumabem a ev. dalšími mAb je obtížné hodnocení odpovědi, resp. interference protilátek s metodami klasické detekce monoklonální komponenty pomocí elektroforézy a imunoelektroforézy. V případě vymizení monoklonální komponenty zůstává patrný gradient, takže není možné potvrdit dosažení kompletní remise. Důsledkem je nikoliv klinický, ale psychologický problém pro nemocného i pro ošetřujícího lékaře. Statisticky, při srovnávání s jinými postupy, dochází k chybné interpretaci výsledků klinických studií (podhodnocení počtu kompletních a stringentních kompletních remisí). Při delší zkušenosti může klinik se značnou pravděpodobností povahu popisované monoklonální bílkoviny odhadnout, zatím si však se situací neporadily standardizační postupy (např. obecně užívané hodnocení odpovědi dle International Myeloma Working Group, IMWG) [16]. Pro potřeby studií byly vyvinuty speciální detekční metody, které oba gradienty odliší, ty se však zatím neuplatňují v klinické praxi.
Pozice elotuzumabu v současné
léčbě MM
Oblast terapie pacientů s MM po 1−3 liniích léčby se v posledních několika letech dramaticky proměnila. Pokud je základním cílem kurativní efekt, podle všeobecného konsenzu podáváme triplety účinných látek na bázi PI nebo IMiDů. V České republice tak máme k dispozici schválené trojkombinace s novými PI karfilzomibem (KRd − karfilzomib, revlimid, dexametazon), ixazomibem (IRd – ixazomib, revlimid, dexametazon); monoklonálními protilátkami anti CD38 (DRd – daratumumab, revlimid, dexametazon; DVd – daratumumab, bortezomib, dexametazon); elotuzumabem (ERd – Elo, revlimid, dexametazon) a panobinostatem (PanoVd – panobinostat, bortezomib, dexametazon).
Všechny tyto triplety prokázaly účinek vyšší než dosud standardní dvojkombinace nebo trojkombinace s cytostatiky, ale srovnání jejich účinnosti mezi sebou je pouze nepřímé. Při takovém srovnání vykazuje nejvyšší efekt na trvání doby remise kombinace DRd – PFS 40 měsíců proti 19,4 měsíce u ELd [17]. Prvotní volba režimu záleží samozřejmě také na charakteristice nemoci, vzhledem k různým nežádoucím účinkům na komorbiditách pacienta, někdy také na jeho volbě. Subanalýza studie ELOQUENT 2 ukázala přínos léčby Elo u pacientů s nepříznivou cytogenetikou – delecí 17p (HR 0,65; 95% CI, 0,45–0,94), ziskem 1q21 (HR 0,75; 95% CI, 0,56–0,99) a translokací t(4,14) (HR 0,53; 95% CI, 0,29–0,95), stejně jako u populace nemocných starších 65 let (HR 0,65; 95% CI, 0,50–0,85) [12].
Dalšími indikovanými k léčbě kombinací ERd mohou být pacienti léčení anti CD38 protilátkami (daratumumab, isatuximab). Při jejich pravděpodobném širokém užívání bude přibývat nemocných, kteří budou na tuto léčbu rezistentní. Elotuzumab je zacílen na jiný antigen a má zcela odlišný mechanismus účinku. V úvahu musíme vzít také faktor polyklonální povahy myelomu, kdy v průběhu léčby dochází k útlumu, nebo naopak k proliferaci biologicky odlišných typů nádorových populací. Klinické studie, stejně jako širší „real world“ zkušenosti efektu v této situaci zatím chybějí. Nedávná zpětná analýza spíše ukázala, že Elo podaný v pozdější linii než daratumumab může mít omezený efekt. Zatímco odpověď na první protilátku byla podobná (daratumumab první 56,5 % vs. Elo první 64,3 %, p = 0,641), odpověď při druhém podání v případě daratumumabu (daratumumab po Elo) byla vyšší proti Elo (Elo po daratumumabu) – 64,3 % vs. 34,8 %, p = 0,081. To se v malé skupině 37 pacientů odrazilo na delším trvání PFS, pokud byl první protilátkou Elo, oproti obrácenému pořadí (22,67 měsíce vs. 10,5 měsíce, p = 0,001) [18].
V současnosti probíhá řada dalších klinických studií, pro příklad uvádíme např. kombinace Elo/VRd (NCT02375555), Elo/KRd (NCT02969837) nebo Elo/pomalidomid/bortezomib/dexametazon (NCT02718833) [19]. I z důvodu velmi nízké toxicity Elo probíhá rovněž klinické hodnocení u pacientů s rizikovým „doutnajícím myelomem“ [20] nebo studie zkoumající jeho efekt v udržovací léčbě. Výsledky účinnosti ELd u nově diagnostikovaných pacientů se očekávají v blízké době.
Seznam použité literatury
- [1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin 2018; 68: 7–30.
- [2] Nishimura KK, Barlogie B, van Rhee F, et al. Long‑term outcomes after autologous stem cell transplantation for multiple myeloma. Blood Adv 2020; 4: 422–431.
- [3] Hsi ED, Steinle R, Balasa B, et al. CS1, a potential new therapeutic antibody target for the treatment of multiple myeloma. Clin Cancer Res 2008; 14: 2775–2784.
- [4] Collins SM, Bakan CE, Swartzel GD, et al. Elotuzumab directly enhances NK cell cytotoxicity against myeloma via CS1 ligation: evidence for augmented NK cell function complementing ADCC. Cancer Immunol Immunother 2013; 62: 1841–1849.
- [5] Guo H, Cruz‑Monoz ME, Wu N, et al. Immune Cell Inhibition by SLAMF7 Is Mediated by a Mechanism Requiring Src Kinases, CD45, and SHIP‑1 That Is Defective in Multiple Myeloma Cells. Mol Cell Biol 2015; 35: 41–51.
- [6] Ishibashi M, Soeda S, Sasaki M, et al. Clinical impact of serum soluble SLAMF7 in multiple myeloma. Oncotarget 2018; 9: 34784–34793.
- [7] Zonder JA, Mohrbacher AF, Singhal S, et al. A phase 1, multicenter, open‑label, dose escalation study of elotuzumab in patients with advanced multiple myeloma. Blood 2012; 120: 552–559.
- [8] Balasa B, Yun R, Belmar NA, et al. Elotuzumab enhances natural killer cell activation and myeloma cell killing through interleukin‑2 and TNF‑α pathways. Cancer Immunol Immunother 2015; 64: 61–73.
- [9] Lonial S, Vij R, Harousseau JL, et al. Elotuzumab in combination with lenalidomide and low‑dose dexamethasone in relapsed or refractory multiple myeloma. J Clin Oncol 2012; 30: 1953–1959.
- [10] Richardson PG, Jagannath S, Moreau P, et al. Elotuzumab in combination with lenalidomide and dexamethasone in patients with relapsed multiple myeloma: final phase 2 results from the randomised, open‑label, phase 1b‑2 dose‑escalation study. Lancet Haematol 2015; 2: e516–e527.
- [11] Lonial S, Dimopoulos M, Palumbo A, et al.; ELOQUENT‑2 Investigators. Elotuzumab Therapy for Relapsed or Refractory Multiple Myeloma. N Engl J Med 2015; 373: 621–631.
- [12] Dimopoulos MA, Lonial S, White D, et al. Elotuzumab plus lenalidomide/dexamethasone for relapsed or refractory multiple myeloma: ELOQUENT‑2 follow‑up and post‑hoc analyses on progression‑free survival and tumour growth. Br J Haematol 2017; 178: 896–905.
- [13] Dimopoulos MA, Dytfeld D, Grosicki S, et al. Elotuzumab plus pomalidomide and dexamethasone for multiple myeloma. N Engl J Med 2018; 379: 1811–1822.
- [14] Mateos MV, Granell M, Oriol A, et al. Elotuzumab in combination with thalidomide and low‑dose dexamethasone: a phase 2 single‑arm safety study in patients with relapsed/refractory multiple myeloma. Br J Haematol 2016; 175: 448–456.
- [15] Jakubowiak A, Offidani M, Pégourie B, et al. Randomized phase 2 study: elotuzumab plus bortezomib/dexamethasone vs bortezomib/dexamethasone for relapsed/refractory MM. Blood 2016; 127: 2833–2840.
- [16] Kumar S, Paiva B, Anderson KC, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol 2016; 17: e328–e346.
- [17] Bahlis N, Dimopoulos M, White D. Benboubker, L. Three‑Year Follow up of the Phase 3 Pollux Study of Daratumumab Plus Lenalidomide and Dexamethasone (D‑Rd) versus Lenalidomide and Dexamethasone (Rd) Alone in Relapsed or Refractory Multiple Myeloma (RRMM). Blood 2019; 132(Suppl 1): 1996.
- [18] Hoylman E, Brown A, Perissinotti AJ, et al. Optimal sequence of daratumumab and elotuzumab in relapsed and refractory multiple myeloma. Leuk Lymphoma 2020; 61: 691–698.
- [19] Bonello F, Mina R, Boccadoro M, Gay F. Therapeutic Monoclonal Antibodies and Antibody Products: Current Practices and Development in Multiple Myeloma. Cancers (Basel) 2019; 12: 15.
- [20] Ghobrial IM, Badros AZ, Vredenburgh JJ, et al. Phase II Trial of Combination of Elotuzumab, Lenalidomide, and Dexamethasone in High‑Risk Smoldering Multiple Myeloma. Blood 2016; 128: Abstract #976 [ASH 2016 58th Meeting].