EMPA REG OUTCOME: malý krok pro empagliflozin, obrovský skok pro diabetologii?
Souhrn:
Článek stručně shrnuje výsledky nových klinických studií hodnotících kardiovaskulární bezpečnost léčby antidiabetiky. Podrobně jsou diskutovány výsledky studie EMPA REG OUTCOME s empagliflozinem, který u pacientů s diabetem 2. typu trpících manifestním kardiovaskulárním onemocněním významně snížil výskyt kardiovaskulárních příhod, úmrtnost na kardiovaskulární příhody i celkovou mortalitu. Jsou rozvedeny hlavní příčiny vedoucí ke snížení kardiovasku-lární úmrtnosti a vyvráceny v poslední době prezentované chybné interpretace výsledků této studie včetně hypotézy o negativním vlivu derivátů sulfonylurey a metforminu na mortalitu v této studii.
Key words: empagliflozin – cardiovascular events – mortality – heart failure.
Summary:
This article deals briefly with the results of new clinical trials evaluating the cardiovascular safety of antidiabetic treatment. The results of the EMPA REG OUTCOME trial with empagliflozin are discussed in more details; in patients with type 2 diabetes and manifest cardiovascular disease, this drug has significantly lowered the rate of cardiovascular events, cardiovascular mortality, and overall mortality. The major causes leading to cardiovascular mortality lowering are analyzed and recent erroneous interpretations of the results of the above study are discarded, including the hypothesis about negative effect of sulfonylureas and metformin on mortality in this trial.
Úvod
Při příležitosti konání nedávného XXII. kongresu České internistické společnosti mě v časopise Acta Medicinae 8/2015, věnovaném problematice vnitřního lékařství, zaujal článek profesora Milana Kvapila s názvem Zvyšují sulfonylurea a inzulin mortalitu diabetiků 2. typu v porovnání s empagliflozinem? [1].
Řada hypotéz a interpretací v tomto článku nebyla podrobně zdůvodněna, a může tedy vést k chybnému pohledu lékařů na nová léčiva. Rád bych proto detailněji vysvětlil poznatky získané studií EMPA‑REG OUTCOME a uvedl je do kontextu s poznatky z ostatních kardiovaskulárních studií nových antidiabetik.
Proč vznikají a k jakému účelu slouží kardiovaskulární studie s antidiabetiky?
V některých studiích s antidiabetiky uskutečněných v první dekádě tohoto století bylo zaznamenáno zvýšení počtu kardiovaskulárních (KV) příhod a mortality. Byly to zejména významný nárůst výskytu infarktu myokardu v metaanalýze studií s rosiglitazonem, který byl provázen hraničním nárůstem KV mortality [2], a výsledky studie ACCORD, v níž rovněž došlo ke zvýšení mortality v intenzivně léčené větvi, aniž byl pozitivně ovlivněn výskyt KV příhod [3].
Evropské i americké regulační úřady (European Medicines Agency, EMA, a Food and Drug Administration, FDA) proto začaly vyžadovat průkaz KV bezpečnosti pro každé antidiabetikum, které je nově registrováno. K tomuto účelu je nutné pro každý přípravek provést prospektivní, randomizovanou a dvojitě zaslepenou studii trvající minimálně 18 měsíců u populace pacientů s diabetem 2. typu a s vysokým KV rizikem. Studovaná látka nebo placebo se přidává ke standardní léčbě obsahující také antihypertenzní, hypolipidemickou, antiagregační i antidiabetickou medikaci dle současných doporučení.
Cílem KV studií s antidiabetiky není zhodnotit účinnost aktivní látky na kompenzaci diabetu, naopak, kompenzace diabetu je v obou větvích studie udržována v co nejvíce obdobné míře, k čemuž slouží možnost upravovat antidiabetickou léčbu jak v placebové, tak i v aktivní větvi studie. Pacienti jsou léčeni individuálně s cílem dosažení kontroly diabetu a hodnoty glykovaného hemoglobinu dle lokálně platných doporučení.
Délka studie je ovlivněna hlavně požadavkem na dostatečný počet KV příhod, který je vypočítán statistickými metodami (tzv. power analýza) tak, aby studie měla dostatečnou statistickou sílu a její výsledky byly validní. Studie končí po dosažení předem definovaného počtu KV příhod a teprve poté mohou být výsledky statisticky zpracovány. Tyto požadavky platí pro všechny studie v diabetologii, které mají za cíl prokázat KV bezpečnost antidiabetik.
Jaké jsou výsledky dosavadních dokončených kardiovaskulárních studií v diabetologii?
Na základě požadavků regulačních úřadů vzniklo v poslední dekádě nejméně 18 velkých KV studií s novými antidiabetiky, z nichž již bylo pět dokončeno.
Nejprve zmíním výsledky tří studií s gliptiny (inhibitory dipeptidylpeptidázy 4, DPP‑4). Studie SAVOR‑TIMI 53 hodnotila KV bezpečnost saxagliptinu. Ten prokázal oproti placebu non‑inferioritu v ovlivnění výskytu KV příhod, ale při léčbě saxagliptinem bylo pozorováno významně zvýšené (o 27 %) riziko hospitalizace pro srdeční selhání [4]. Alogliptin ve studii EXAMINE byl ve srovnání s placebem non‑inferiorní v ovlivnění výskytu KV příhod, také počet hospitalizací pro srdeční selhání po léčbě alogliptinem byl zvýšen pouze nevýznamně [5]. Studie TECOS posuzovala KV bezpečnost sitagliptinu, který byl ve srovnání s placebem non‑inferiorní v ovlivnění KV příhod a rozdíl v počtu hospitalizací pro srdeční selhání nebyl zjištěn [6].
Podobně jako u glitazonů i ve studiích s gliptiny vidíme, že při posuzování KV bezpečnosti nelze spoléhat na tzv. class effect a předpokládat, že všechna farmaka ze stejné třídy mají obdobnou účinnost a bezpečnost: svědčí pro to významně zvýšený výskyt srdečního selhání u saxagliptinu, který v případě alogliptinu a sitagliptinu pozorován nebyl.
Studie ELIXA hodnotila lixisenatid (agonistu glukagonu podobného peptidu 1, glucagon‑like peptide 1, GLP‑1), který byl ve srovnání s placebem non‑inferiorní v ovlivnění výskytu KV příhod. Rovněž počet hospitalizací pro srdeční selhání nebyl při léčbě lixisenatidem zvýšen [7]. Poslední dokončenou a publikovanou byla studie EMPA‑REG OUTCOME, které je věnována podrobnější pozornost v následujících odstavcích.
EMPA‑REG OUTCOME: metody a hlavní výsledky
První KV studie s empagliflozinem, inhi![Graf 1 Výskyt primárního cílového ukazatele ve studii EMPA-REG OUTCOME (výskyt úmrtí z kardiovaskulárních příčin, nefatálního infarktu myokardu a nefatální cévní mozkové příhody); podle [8] – Zinman, et al., 2015.](https://www.remedia.cz/photo-a-30451---.jpg) bitorem společného transportéru pro sodík a glukózu (sodium‑glucose co‑transporter 2, SGLT2), nesla název EMPA‑REG OUTCOME a zahrnula celkem 7 028 pacientů, kteří byli randomizováni do tří větví: s podáváním placeba (n = 2 333), s léčbou empagliflozinem v dávce 10 mg denně
bitorem společného transportéru pro sodík a glukózu (sodium‑glucose co‑transporter 2, SGLT2), nesla název EMPA‑REG OUTCOME a zahrnula celkem 7 028 pacientů, kteří byli randomizováni do tří větví: s podáváním placeba (n = 2 333), s léčbou empagliflozinem v dávce 10 mg denně ![Graf 2 Úmrtí z kardiovaskulárních příčin ve studii EMPA-REG OUTCOME; podle [8] – Zinman, et al., 2015.](https://www.remedia.cz/photo-a-30452---.jpg) (n = 2 345) a v dávce 25 mg denně (n = 2 342) [8]. Primární složený cílový ukazatel zahrnující úmrtí z KV příčin, nefatální infarkt myokardu a nefatální cévní mozkovou příhodu (tzv. 3P‑MACE endpoint) byl empagliflozinem významně snížen – o 14 % (10,5 % ve skupině s empagliflozinem vs. 12,1 % ve skupině s placebem; poměr rizik, hazard ratio, HR = 0,86; relativní snížení rizika, relative risk reduction, 14 %; 95% interval spolehlivosti, confidence interval, CI: 0,74–0,99; p = 0,04 pro superioritu, graf 1) [8].
(n = 2 345) a v dávce 25 mg denně (n = 2 342) [8]. Primární složený cílový ukazatel zahrnující úmrtí z KV příčin, nefatální infarkt myokardu a nefatální cévní mozkovou příhodu (tzv. 3P‑MACE endpoint) byl empagliflozinem významně snížen – o 14 % (10,5 % ve skupině s empagliflozinem vs. 12,1 % ve skupině s placebem; poměr rizik, hazard ratio, HR = 0,86; relativní snížení rizika, relative risk reduction, 14 %; 95% interval spolehlivosti, confidence interval, CI: 0,74–0,99; p = 0,04 pro superioritu, graf 1) [8].
![Graf 3 Úmrtí z jakýchkoliv příčin ve studii EMPA-REG OUTCOME; podle [8] – Zinman, et al., 2015. CI – confi dence interval,interval spolehlivosti; HR – hazard ratio, poměr rizik](https://www.remedia.cz/photo-a-30453---.jpg) Empagliflozin ve srovnání s placebem také signifikantně snížil riziko úmrtí z KV příčin o 38 % (HR = 0,62; 95% CI: 0,49–0,77; p < 0,001, graf 2), počet úmrtí
Empagliflozin ve srovnání s placebem také signifikantně snížil riziko úmrtí z KV příčin o 38 % (HR = 0,62; 95% CI: 0,49–0,77; p < 0,001, graf 2), počet úmrtí ![Graf 4 Hospitalizace pro srdeční selhání ve studii EMPA-REG OUTCOME; podle [8] – Zinman, et al., 2015. CI – confi dence interval,interval spolehlivosti; HR – hazard ratio, poměr rizik](https://www.remedia.cz/photo-a-30454---.jpg) z jakékoliv příčiny o 32 % (HR = 0,68; 95% CI: 0,57–0,82, p < 0,001, graf 3) a riziko hospitalizace pro srdeční selhání o 35 % (HR = 0,65; 95% CI: 0,50–0,85; p = 0,002, graf 4). Analýzy byly provedeny souhrnně pro obě dávky empagliflozinu, avšak ani u jedné z analyzovaných příhod nebyl pozorován rozdíl mezi oběma dávkami [8].
z jakékoliv příčiny o 32 % (HR = 0,68; 95% CI: 0,57–0,82, p < 0,001, graf 3) a riziko hospitalizace pro srdeční selhání o 35 % (HR = 0,65; 95% CI: 0,50–0,85; p = 0,002, graf 4). Analýzy byly provedeny souhrnně pro obě dávky empagliflozinu, avšak ani u jedné z analyzovaných příhod nebyl pozorován rozdíl mezi oběma dávkami [8].
Proč se liší ovlivnění fatálních a nefatálních kardiovaskulárních příhod ve studii EMPA‑REG OUTCOME?
Na signifikantním snížení rizika kombinovaného cílového ukazatele 3P‑MACE mělo největší podíl snížení rizika úmrtí z KV příčin (o 38 %). V ostatních dvou komponentách složeného cílového ukazatele, tj. snížení rizika nefatálního infarktu myokardu a nefatální mozkové mrtvice, nebyl zjištěn signifikantní rozdíl mezi aktivní léčbou a placebem. Výskyt nefatálního infarktu myokardu byl nevýznamně snížen o 13 % (HR = 0,87; 95% CI: 0,70–1,09; p = 0,22), výskyt nefatálních cévních mozkových příhod byl nevýznamně zvýšen o 24 % (HR = 1,24; 95% CI: 0,92–1,67; p = 0,16) [8].
Nejpravděpodobnější interpretací tohoto zjištění je, že pacient, který prodělal během podávání studijní medikace (empagliflozinu) infarkt myokardu nebo cévní mozkovou příhodu, je přežil s větší pravděpodobností než pacient užívající placebo [9]. Řada příhod (cévních mozkových příhod a infarktů) ve studijní větvi s aktivní léčbou tedy zřejmě proběhla nefatálně místo fatálně (a přesunula se tudíž „ze škatulky“ fatální do nefatální), což by vysvětlilo výše uvedené nálezy [9].
Empagliflozin ve studii EMPA‑REG OUTCOME vedl oproti placebu k výraznějšímu poklesu systolického krevního tlaku asi o 4 mm Hg, rozdíl zůstával obdobný po celou dobu studie (graf 5). Diastolický krevní tlak poklesl po podávání empagliflozinu oproti hodnotě na počátku studie ![Graf 5 Změny systolického krevního tlaku ve studii EMPA-REG OUTCOME; podle [8] – Zinman, et al., 2015. STK – systolický tlak krve](https://www.remedia.cz/photo-a-30455---.jpg) pouze o 1,5 mm Hg a v dalším průběhu studie se rozdíl snižoval, takže na konci studie se zjištěné hodnoty diastolického krevního tlaku mezi větvemi s empagliflozinem a placebem prakticky nelišily (graf 6). Je to poměrně zajímavý, ale žádoucí výsledek pozorování, neboť pulsní tlak (rozdíl mezi systolickým a diastolickým tlakem) je velmi silným prediktorem vzniku KV příhod, zejména koronárních [10–12], a jeho snížení vede u diabetiků s hypertenzí ke snížení výskytu KV příhod [13].
pouze o 1,5 mm Hg a v dalším průběhu studie se rozdíl snižoval, takže na konci studie se zjištěné hodnoty diastolického krevního tlaku mezi větvemi s empagliflozinem a placebem prakticky nelišily (graf 6). Je to poměrně zajímavý, ale žádoucí výsledek pozorování, neboť pulsní tlak (rozdíl mezi systolickým a diastolickým tlakem) je velmi silným prediktorem vzniku KV příhod, zejména koronárních [10–12], a jeho snížení vede u diabetiků s hypertenzí ke snížení výskytu KV příhod [13].
Donedávna jsme se domnívali, že snížení krevního tlaku vlivem empagliflozinu by ![Graf 6 Ovlivnění diastolického krevního tlaku ve studii EMPA-REG OUTCOME; podle [8] – Zinman, et al., 2015. DTK – diastolický tlak krve](https://www.remedia.cz/photo-a-30456---.jpg) správně mělo riziko vzniku cévní mozkové příhody snížit. V nedávno publikované rozsáhlé studii SPRINT, která analyzovala účinky antihypertenziv na snižování krevního tlaku, však tyto předpoklady potvrzeny nebyly: intenzivnější snižování krevního tlaku na průměrné hodnoty 121,4 mm Hg oproti 136,2 mm Hg ve standardně léčené větvi, díky kterému došlo k významnému poklesu počtu KV příhod i celkové mortality, vedlo k pouze nevýznamnému 11% snížení výskytu cévní mozkové příhody (p = 0,50) [14].
správně mělo riziko vzniku cévní mozkové příhody snížit. V nedávno publikované rozsáhlé studii SPRINT, která analyzovala účinky antihypertenziv na snižování krevního tlaku, však tyto předpoklady potvrzeny nebyly: intenzivnější snižování krevního tlaku na průměrné hodnoty 121,4 mm Hg oproti 136,2 mm Hg ve standardně léčené větvi, díky kterému došlo k významnému poklesu počtu KV příhod i celkové mortality, vedlo k pouze nevýznamnému 11% snížení výskytu cévní mozkové příhody (p = 0,50) [14].
Při prespecifikované analýze senzitivity studie EMPA‑REG OUTCOME bylo zjištěno, že k výskytu většiny cévních mozkových příhod došlo až během následného sledování více než 30 dní po ukončení léčby empagliflozinem (průměrně s odstupem 1,5 roku), nikoliv v průběhu léčby. Pokud u pacientů, kteří užívali studijní medikaci více než 30 dní, byl hodnocen výskyt nefatálních cévních mozkových příhod v průběhu studie a do 30 dní po ukončení léčby, bylo relativní riziko výskytu cévních mozkových příhod při léčbě empagliflozinem pouze nevýznamně vyšší – o 10 % (HR = 1,10; 95% CI: 0,81–1,50; p = 0,54) – a kombinovaný cílový ukazatel fatálních a nefatálních cévních mozkových příhod byl vyšší pouze o 4 % (HR = 1,04; 95% CI: 0,78–1,40; p = 0,78) [8].
Je také možné, a zatím není prozkoumáno, že po ukončení léčby empagliflozinem dochází k určitému „rebound fenoménu“, který může vést k vyšší retenci tektutin, k volumexpanzi, případně i ke vzestupu krevního tlaku, což může zapříčinit zvýšení výskytu cévních mozkových příhod.
Mohou rozdíly v mortalitě vysvětlit deriváty sulfonylurey a inzulin?
V průběhu prvních 12 týdnů klinické studie EMPA‑REG OUTCOME po zahájení studijní medikace nesměli lékaři dle pr![Graf 7 Průměrné hodnoty glykovaného hemoglobinu ve studii EMPA-REG OUTCOME; podle [8] – Zinman, et al., 2015.](https://www.remedia.cz/photo-a-30457---.jpg) otokolu měnit antidiabetickou léčbu. V empagliflozinové větvi poklesl po 12 týdnech glykovaný hemoglobin průměrně na hodnoty kolem 7,4 % (57 mmol/mol), zatímco v placebové větvi zůstávala jeho hodnota nezměněna – kolem 8,0 % (64 mmol/mol), graf 7. Následný pozvolný vzestup hodnot glykovaného hemoglobinu v empagliflozinové větvi lze vysvětlit přirozeným průběhem diabetu
otokolu měnit antidiabetickou léčbu. V empagliflozinové větvi poklesl po 12 týdnech glykovaný hemoglobin průměrně na hodnoty kolem 7,4 % (57 mmol/mol), zatímco v placebové větvi zůstávala jeho hodnota nezměněna – kolem 8,0 % (64 mmol/mol), graf 7. Následný pozvolný vzestup hodnot glykovaného hemoglobinu v empagliflozinové větvi lze vysvětlit přirozeným průběhem diabetu ![Graf 8 Průměrné hodnoty glykovaného hemoglobinu ve studii EXAMINE; podle [5] – White, et al., 2013. SD – směrodatná odchylka](https://www.remedia.cz/photo-a-30458---.jpg) s postupně se snižující sekrecí inzulinu. Kompenzace však byla v této větvi lepší a splňovala cíle léčby diabetu u pacientů s manifestním KV onemocněním, proto lékaři nebyli nuceni navyšovat antidiabetickou léčbu v průběhu studie tak často jako v placebové větvi (která má proto plošší tvar s menším vzestupem v průběhu studie). Obdobný obraz jsme měli možnost pozorovat i v ostatních recentních studiích, např. ve studii EXAMINE (graf 8).
s postupně se snižující sekrecí inzulinu. Kompenzace však byla v této větvi lepší a splňovala cíle léčby diabetu u pacientů s manifestním KV onemocněním, proto lékaři nebyli nuceni navyšovat antidiabetickou léčbu v průběhu studie tak často jako v placebové větvi (která má proto plošší tvar s menším vzestupem v průběhu studie). Obdobný obraz jsme měli možnost pozorovat i v ostatních recentních studiích, např. ve studii EXAMINE (graf 8).
Rozdíl v hodnotách glykovaného hemoglobinu mezi větví s empagliflozinem 25 mg a větví s placebem byl na konci studie 0,36 % – tedy zcela identický jako mezi alogliptinem a placebem na konci studie EXAMINE. Rozdíl v hodnotách mezi větví s empagliflozinem 10 mg a placebem byl na konci studie 0,24 % – srovnatelný se studií SAVOR (0,2 %).
V placebové větvi studie EMPA‑REG OUTCOME byla inzulinoterapie zahájena o 5,7 % častěji, léčba deriváty sulfonylurey o 2,7 % častěji než v aktivní větvi (viz tab. 1). Výskyt potvrzených závažných hypoglykemií se mezi větví s empagliflozinem (1,3 %) a placebem (1,5 %) významně nelišil [8].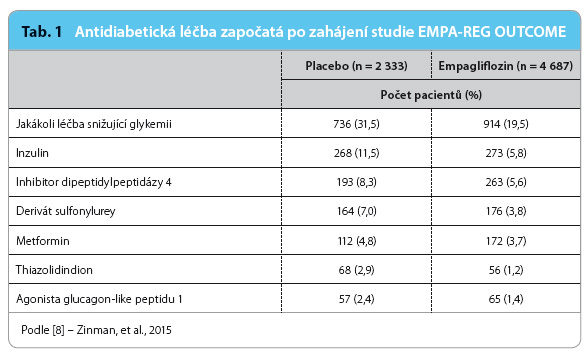
Zásadní je uvědomit si skutečnost, že i v ostatních diabetologických KV studiích poslední dekády byla přídatná léčba antidiabetiky v kontrolní větvi podávána častěji. Ve studii TECOS byla léčba jinými antidiabetiky zahájena u pacientů, kterým byl podáván sitagliptin, ve 21,7 % a u placebové skupiny v 27,9 % (tedy 28% rozdíl, p < 0,001), přitom nebyl pozorován žádný rozdíl v ovlivnění výskytu KV úmrtí (výskyt náhlých úmrtí nebyl v této studii hlášen) [6]. Na konci studie SAVOR‑TIMI 53 užívalo inzulin významně více pacientů v placebové větvi než ve větvi aktivně léčené saxagliptinem (46,4 % vs. 43,8 %, p = 0,0008), přitom se výskyt KV úmrtí (3,2 % u saxagliptinu vs. 2,9 % u placeba) ani náhlých úmrtí (1,6 % u saxagliptinu vs. 1,3 % u placeba) významně nelišil [4].
Tvrzení o častějším výskytu nepotvrzených či asymptomatických hypoglykemií v placebové větvi vedoucích k častějšímu výskytu maligních arytmií a úmrtí v placebové větvi studie EMPA‑REG OUTCOME je proto v kontextu ostatních výše uvedených studií a dat nutno odmítnout jako nepravděpodobnou a ničím nepodloženou spekulaci.
Co vedlo ke snížení kardiovaskulární úmrtnosti při léčbě empagliflozinem?
Ve studii EMPA‑REG OUTCOME se na snížení KV mortality nejvíce podílelo snížení rizika úmrtí v důsledku zhoršení srdečního selhání (0,2 % u empagliflozinu vs. 0,8 % u placeba, viz tab. 2). Z grafu 4 zřetelně vyplývá, že se rozdíl mezi Kaplanovými–Meierovými křivkami vytváří velmi časně, již v prvním měsíci léčby (nikoliv po třech měsících a později, jak uvádí prof. Kvapil). Lze jej nejpravděpodobněji vysvětlit diuretickým účinkem empagliflozinu, který nastupuje ihned po zahájení léčby.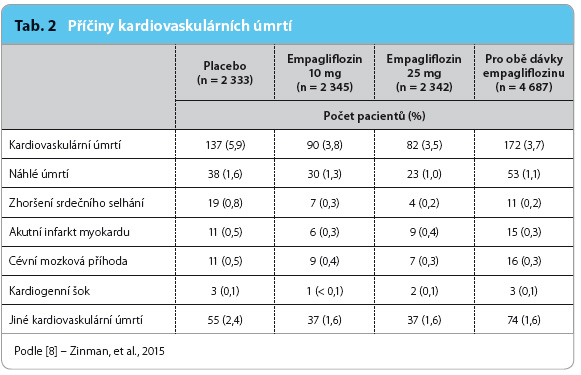
Na nedávné konferenci Americké kardiologické společnosti (American Heart Association, AHA) v Orlandu v USA byla prezentována subanalýza studie EMPA‑REG OUTCOME týkající se srdečního selhání. Při zařazení do studie mělo 10 % pacientů v anamnéze prodělané srdeční selhání. U těchto nemocných došlo v průběhu studie k hospitalizaci pro srdeční selhání nebo k úmrtí na KV příčiny v 20,1 % ve skupině s placebem a v 16,2 % ve skupině s empagliflozinem (relativní snížení rizika 28 %). U pacientů bez anamnézy srdečního selhání byl výskyt tohoto kombinovaného cílového ukazatele 7,1 % při podávání placeba a 4,5 % při léčbě empagliflozinem (relativní snížení rizika 37 %) [15].
Je zřejmé, že empagliflozin bude velmi vhodným antidiabetikem pro pacienty se srdečním selháním, v budoucnu možná bude také testován i u pacientů se srdečním selháním bez diabetu.
Druhou hlavní příčinou snížení KV mortality bylo snížení výskytu náhlých úmrtí (1,1 % při podávání empagliflozinu vs. 1,6 % při podávání placeba). Je pravda, jak konstatuje prof. Kvapil, že nejčastější příčinou náhlého úmrtí bývá maligní arytmie. Nižší výskyt náhlých úmrtí je zde přisuzován nižšímu výskytu hypoglykemií v empagliflozinové větvi, protože v placebové větvi byla častěji podávána antidiabetika vedoucí k hypoglykemii (zejména inzuliny a deriváty sulfonylurey) [1]. Jak jsem však ukázal v předchozí stati, tato antidiabetika byla podávána častěji i v placebové větvi ostatních recentních diabetologických KV studií, ve kterých nebyl zaznamenán žádný rozdíl v mortalitě, a tuto hypotézu lze tudíž odmítnout.
Jako pravděpodobnější vysvětlení nižšího počtu náhlých úmrtí ve větvi léčené empagliflozinem se mi jako kardiologovi jeví nižší četnost nasazování diuretik v aktivní větvi po zahájení studie, zřejmě díky diuretickému účinku empagliflozinu (16,2 % vs. 22,7 %). Z kardiologických studií, např. studie SOLVD, víme, že podávání ne‑kalium šetřících diuretik vede ke zvýšenému riziku arytmických úmrtí [16]. Přestože se průměrné hodnoty kalemie (4,3 mmol/l) mezi skupinami nelišily na počátku ani na konci studie, podrobnější analýza hodnot kalemie u pacientů, kteří zemřeli náhlým úmrtím, nebyla dosud publikována.
Jak správně interpretovat Kaplanovy–Meierovy křivky?
Ve svém článku prof. Milan Kvapil prezentuje svůj názor na Kaplanovy–Meierovy křivky (graf 1) – že „nedošlo k typickému poklesu ve větvi s aktivní terapií“, že křivka empagliflozinu „je přesně lineární“ a „není zřejmý žádný skokový pokles“ v aktivně léčené větvi, naopak „ve větvi s placebem došlo ke zvýšení incidence, a to zejména během prvních 6 měsíců sledování“. Jde o zcela chybnou interpretaci.
Kaplanovy–Meierovy křivky se využívají v klinických studiích k názornému zobrazení kumulativního výskytu určitého cílového ukazatele v čase a ke statistickému srovnání účinnosti různých terapeutických strategií. Umějí zohlednit různý čas začátku studie i různou délku sledování různých pacientů a také skutečnost, že někteří pacienti se ztratí ze sledování nebo u nich v průběhu sledování nedojde ke vzniku sledované příhody. V pravidelných časových bodech (zpravidla tehdy, když dojde k manifestaci cílového ukazatele u nějakého pacienta/pacientů), je kalkulován podíl pacientů, u kterých se manifestoval daný cílový ukazatel (např. úmrtí nebo KV příhoda), ke všem pacientům, kteří v danou dobu byli ve sledování a příhodu ještě neprodělali (tzv. pacienti v riziku, „at risk“). Tento podíl se násobí frakcí (zjednodušeně procentem) pacientů, kteří zůstávali bez manifestace sledované příhody v předcházejícím období, a tím se získá výsledná frakce (procento) pacientů, kteří v tomto čase neprodělali sledovanou příhodu (např. přežívají).
Ke skokovému poklesu v Kaplanově–Meierově křivce může dojít tehdy, pokud dojde k náhlé kumulaci výskytu sledovaných příhod – v krátkém období – tedy např. k jejich častějšímu výskytu, než tomu bylo v předchozím průběhu studie. To však zpravidla v klinických studiích nevídáme, výskyt příhod bývá po celou dobu studie rovnoměrný, což se projeví právě lineární, rovnoměrnou křivkou.
Ke statistickému srovnání účinnosti obou léčebných metod ve studii je užíván takzvaný log‑rank test, ve kterém se provede souhrnné porovnání výskytu daného cíle v obou větvích v jednotlivých časových bodech. Pokud je výsledná hodnota pravděpodobnosti (p) při to![Graf 9 Kaplanovy–Meierovy křivky ze studie MADIT-CRT; podle [17] – Moss, et al., 2009. CRT – cardiac resynchronization therapy, srdeční resynchronizační léčba; ICD – implantabilní kardioverter-defi brilátor](https://www.remedia.cz/photo-a-30461---.jpg) mto testu < 0,05, pak tento test potvrzuje, že jedna léčebná metoda je účinnější než druhá. Větší účinnost jedné terapeutické metody (vedoucí k nižší mortalitě nebo k nižšímu výskytu jiného cílového ukazatele) se projeví výraznější separací křivek – čím je jedna terapeutická strategie účinnější než druhá, tím více se křivky rozevírají. Jako příklad mohu uvést křivky ze studie MADIT‑CRT, ve které přidání srdeční resynchronizační léčby k implantabilnímu kardioverteru‑defibrilátoru vedlo ke statisticky významnému zlepšení přežívání pacientů bez srdečního selhání ve srovnání s pouhým vpravením implantabilního kardioverteru‑defibrilátoru (p < 0,001) [17]. I zde je patrný typický lineární průběh křivek, graf 9.
mto testu < 0,05, pak tento test potvrzuje, že jedna léčebná metoda je účinnější než druhá. Větší účinnost jedné terapeutické metody (vedoucí k nižší mortalitě nebo k nižšímu výskytu jiného cílového ukazatele) se projeví výraznější separací křivek – čím je jedna terapeutická strategie účinnější než druhá, tím více se křivky rozevírají. Jako příklad mohu uvést křivky ze studie MADIT‑CRT, ve které přidání srdeční resynchronizační léčby k implantabilnímu kardioverteru‑defibrilátoru vedlo ke statisticky významnému zlepšení přežívání pacientů bez srdečního selhání ve srovnání s pouhým vpravením implantabilního kardioverteru‑defibrilátoru (p < 0,001) [17]. I zde je patrný typický lineární průběh křivek, graf 9.
Interpretace uvedená v článku [1], že „empagliflozin nesnižuje úmrtí a jednotlivé KV příhody, ale placebo je zvyšuje“ (viz grafy 1–4), vyznívá v tomto světle jako naprosto mylná. Empagliflozin při statistickém srovnání obou léčebných metod je naprosto jednoznačně účinnější než placebo v ovlivnění všech výše uvedených primárních i sekundárních cílových parametrů. O placebovém efektu bude dále podrobněji pojednáno v následující stati.
Může se na zvýšení mortality podílet placebový efekt?
Placebo je neúčinná látka nebo jakýkoliv jiný neúčinný terapeutický postup či intervence, která je podávána či prováděna se záměrem pozitivního působení (terapeutického přínosu) [18]. Pokud má placebo negativní účinky, nazývá se nocebo.
Podávání placeba obvykle vykazuje určitý pozitivní dopad na pacientův zdravotní stav, u většiny intervencí a terapeutických postupů se placebo podílí asi na 30–40 % účinku dané intervence [18]. Placebový efekt je rozdílný u jednotlivých nemocí a různých typů intervencí. Například bolest nebo deprese reagují na placebo poměrně silně, rakovina je obvykle ovlivněna jen minimálně. Obecně bývají placebem výrazněji ovlivněny subjektivní obtíže pacientů než objektivní nálezy a ukazatele [18].
Ve většině klinických studií jsou pečlivě sledovány a porovnávány také nežádoucí účinky v placebové a v aktivně léčené větvi. Jejich výskyt je zpravidla srovnatelný, což svědčí pro skutečnost, že tyto nežádoucí účinky nejsou způsobeny studovanou látkou, ale vznikají nezávisle na podávání studijní medikace.
Podávání placeba u KV onemocnění zpravidla vedlo k poměrně výrazným přínosům. V placebových větvích hypertenzních studií docházelo ke statisticky významnému poklesu krevního tlaku v ordinaci – průměrně o 5,92/5,40 mm Hg, ve studiích rezistentní hypertenze k poklesu ještě výraznějšímu – o 8,76/3,70 mm Hg [19]. Velmi pozitivní účinky byly při podávání placeba zaznamenány v léčbě neurokardiogenní synkopy (výrazný pozitivní efekt mělo i voperování nefunkčních kardiostimulátorů), placebo také zmírňovalo symptomy anginy pectoris a zvyšovalo toleranci zátěže u pacientů s anginou pectoris [18,20]. V neurologii u pacientů s těžkou cévní mozkovou příhodou nemělo placebo žádný efekt, ale u pacientů s mírnějšími neurologickými deficity vedlo ke zhruba 50% zlepšení symptomatiky. Naproti tomu v diabetologických studiích nevedlo placebo k žádnému ovlivnění lačné ani postprandiální glykemie a nemělo žádný účinek na glykovaný hemoglobin [20].
Různé KV studie s antidiabetiky užívaly různá zařazovací kritéria, a zahrnuly proto různě rizikové populace. Chceme‑li porovnat rizikovost těchto populací mezi sebou, můžeme se podívat na mortalitu či výskyt jiného cílového ukazatele v placebové větvi. Například roční výskyt úmrtí z KV příčin byl při podávání placeba ve studii TECOS 4,0 %, ve studii EXAMINE 4,9 %, ve studii SAVOR‑TIMI 53 2,9 % a ve studii EMPA‑REG OUTCOME 5,9 %. Že by placebo nejméně „zvyšovalo mortalitu“ ve studii SAVOR‑TIMI 53? Nikoliv, tento výsledek pouze odráží méně rizikovou populaci zařazenou v této studii, z níž pouze 78 % pacientů prodělalo před vstupem do studie KV příhodu (zatímco v ostatních studiích byla anamnéza prodělané KV příhody zařazujícím kritériem u všech pacientů, a řada pacientů dokonce prodělala před zařazením do studie KV příhod více).
Výše zmíněné KV studie v diabetologii byly velmi podobně koncipovány a prováděny na podobných populacích. Případný placebový či nocebový efekt by se tedy na základě dosavadních znalostí o placebo efektu projevil ve všech těchto studiích obdobně a je velmi nepravděpodobné, že by právě v jedné studii (EMPA‑REG OUTCOME) došlo na základě škodlivého účinku placeba k 32% nárůstu mortality, zatímco v ostatních studiích nebyla podáváním placeba mortalita vůbec ovlivněna.
Může se jednat o „class effect“ gliflozinů?
Empagliflozin je zatím jediným perorálním antidiabetikem, u něhož bylo prokázáno snížení KV rizika a úmrtnosti. Zatím není možné říci, zda se jedná o „class effect“ celé třídy gliflozinů, či nikoliv, neboť není znám přesný mechanismus, který vedl ke KV prospěchu [15].
Jelikož u glitazonů a nově i u gliptinů byly pozorovány rozdílné (a někdy zcela opačné) účinky různých molekul na jednotlivá KV rizika, měli bychom být při zobecňování výsledků jednoho konkrétního antidiabetika na celou třídu velmi opatrní.
V současné době probíhají velké KV studie s dalšími dvěma inhibitory SGLT‑2, canagliflozinem a dapagliflozinem, jejichž výsledky by měly být k dispozici přibližně za 2–3 roky. Do té doby není možné o tzv. efektu třídy hovořit a vztahovat tyto výsledky na další léky ze skupiny gliflozinů.
Malý krok pro empagliflozin, obrovský skok pro diabetologii?
Podívejme se nyní na empagliflozin a jím navozené významné snížení výskytu KV příhod v kontextu „nejtvrdších čísel“ obdobných přelomových KV studií. K zabránění jednomu úmrtí bylo ve studii 4S se simvastatinem nutno léčit 30 pacientů po dobu 5,4 roku (number needed to treat, NNT, počet pacientů, které je nutno léčit, aby se zabránilo jednomu úmrtí) [21]. Ve studii HOPE bylo k zabránění jednomu úmrtí nutno léčit ramiprilem 56 pacientů po dobu pěti let [22]. Ve studii EMPA‑REG OUTCOME dostačovalo k zabránění jednomu úmrtí léčit empagliflozinem 39 pacientů po dobu tří let [8].
Nemohu v žádném případě souhlasit s konstatováním prof. Kvapila, že „empagliflozin má neutrální vliv na KV riziko, stejně jako všechna nová antidiabetika“ [1]. Ve skutečnosti empagliflozin u diabetiků 2. typu s manifestním KV onemocněním prokazatelně a významně snižuje výskyt KV příhod, úmrtnost na KV příhody i celkovou mortalitu [8].
V nedávné době jsme byli svědky dlouhé řady tzv. neutrálních studií, kdy nové léčebné postupy už při komplexní léčbě kardiaků (obsahující statin, antiagregační a antihypertenzní léčbu) nevedly k dalšímu poklesu výskytu KV příhod a ke snížení mortality pacientů. Jako kardiolog jsem velmi rád, že se nyní konečně objevil nový lék, který toto dokáže.
Studie EMPA‑REG OUTCOME představuje nový milník v diabetologických KV studiích. Od nynějška totiž nebude u nových antidiabetik žádoucí KV neutralita (absence negativního ovlivnění KV příhod) jako doposud, ale žádoucí bude průkaz pozitivního ovlivnění KV příhod a mortality [9]. Tato studie představuje spíše než malý krok velký počin pro empagliflozin, a také obrovský skok pro diabetologii [9].
Seznam použité literatury
- [1] Kvapil M. Zvyšují sulfonylurea a inzulin mortalitu diabetiků 2. typu v porovnání s empagliflozinem? Acta Med 2015; 8: 65–68.
- [2] Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007; 356: 2457–2471.
- [3] Gerstein HC, Miller ME, Byington RP, et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358: 2545–2559.
- [4] Scirica BM, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013; 369: 1317–1326.
- [5] White WB, Cannon CP, Heller SR, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med 2013; 369: 1327–1335.
- [6] Green JB, Bethel MA, Armstrong PW, et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2015; 373: 232–242.
- [7] Pfeffer. ELIXA. In: American Diabetes Association Congress 75th Scientific Sessions, 5 9 June 2015, Boston, USA.
- [8] Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015: 373: 2117–2128.
- [9] Kalra S. One Small Step for Empagliflozin, One Giant Leap for Diabetology. Diabetes Ther 2015. oi:10.1007/s13300 015 0144 9.
- [10] Benetos A, Safar M, Rudnichi A, et al. Pulse pressure: a predictor of long term cardiovascular mortality in a French male population. Hypertension 1997; 30: 1410–1415.
- [11] Franklin SS, Gustin W, Wong ND, et al. Hemodynamic patterns of age related changes in blood pressure. The Framingham Heart Study. Circulation 1997; 96: 308–315.
- [12] Cockcroft JR, Wilkinson IB, Evans M, et al. Pulse pressure predicts cardiovascular risk in patients with type 2 diabetes mellitus. Am J Hypertens 2005; 18: 1463–1467; discussion 1468–1469.
- [13] Tropeano AI, Katsahian S, Molle D, et al. Lowering of brachial pulse pressure in 9379 hypertensives with type 2 diabetes and reduction of cardiovascular events. Blood Press 2008; 17: 26–33.
- [14] The SPRINT Research Group. A Randomized Trial of Intensive versus Standard Blood Pressure Control. N Engl J Med 2015; 373: 2103–2116.
- [15] Jancin B. AHA: Empagliflozin for T2D reduces heart failure endpoints. 2015. dostupné na http://www.clinicalendocrinologynews.com/specialty focus/diabetes/single article page/aha empagliflozin for t2d reduces heart failure endpoints/351fd7b66147e81d6f215e3788b1ce32.html. Accessed December 1, 2015.
- [16] Cooper HA, Dries DL, Davis CE, et al. Diuretics and risk of arrhythmic death in patients with left ventricular dysfunction. Circulation 1999; 100: 1311–1315.
- [17] Moss AJ, Hall WJ, Cannom DS, et al. Cardiac resynchronization therapy for the prevention of heart failure events. N Engl J Med 2009; 361: 1329–1338.
- [18] Olshansky B. Placebo and nocebo in cardiovascular health: implications for healthcare, research, and the doctor patient relationship. J Am Coll Cardiol 2007; 49: 415–421.
- [19] Patel HC, Hayward C, Ozdemir BA, et al. Magnitude of blood pressure reduction in the placebo arms of modern hypertension trials: implications for trials of renal dener-vation. Hypertension 2015; 65: 401–406.
- [20] Weihrauch TR, Gauler TC. Placebo efficacy and adverse effects in controlled clinical trials. Arzneimittelforschung 1999; 49: 385–393.
- [21] 4S Investigators. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet (Lon-don, England) 1994; 344: 1383–1389.
- [22] Yusuf S, Sleight P, Pogue J, et al. Effects of an angiotensin converting enzyme inhibitor, ramipril, on cardiovascular events in high risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000; 342: 145–153.