Endokanabinoidní systém – nový léčebný cíl u multirizikových nemocných
Obezita se rychle stává novodobou celosvětovou pandemií. Především viscerální obezita je přitom spojena s výskytem celého clusteru přidružených metabolických rizikových faktorů a s vysokým kardiovaskulárním rizikem. Nadměrný příjem potravy stejně jako kouření vede k dlouhodobé a nadměrné stimulaci endokanabinoidního systému, který se podílí na kontrole energetické rovnováhy a tělesné hmotnosti. Nedávno objevený první selektivní blokátor receptorů CB1 endokanabinoidního systému rimonabant vede ke snížení tělesné hmotnosti a zlepšuje i s obezitou sdružené metabolické abnormality, jako je dyslipidémie a porucha glukózové tolerance. Rimonabant je v probíhajícím rozsáhlém klinickém programu RIO (Rimonabant In Obesity) zkoušen v léčbě nadváhy/obezity a v programu STRATUS (STudies with Rimonabant And Tobacco USe) v léčbě nikotinové závislosti. Dosavadní výsledky jsou velmi slibné.
Úvod
Dnes již asi nikdo nepochybuje, že etiopatogeneze aterosklerózy a onemocnění, která způsobuje, je multifaktoriální. Máme pro to k dispozici nespočet přesvědčivých důkazů. Nedávno publikovaná studie Interheart [1] ukázala, že 9 známých a intervenovatelných rizikových faktorů je schopno celosvětově vysvětlit více než 90 % případů prvních infarktů myokardu. Intervence a modifikace rizikových faktorů aterosklerózy jsou základním preventivním opatřením vedoucím ke snížení kardiovaskulárního rizika. Ke kontrole hypertenze a hyperlipidémií dnes existuje dosti široká paleta farmakologických prostředků a v dlouhé řadě klinických studií bylo velmi přesvědčivě prokázáno, že snížení krevního tlaku a celkového nebo LDL cholesterolu vede k významnému snížení kardiovaskulární mortality i morbidity. Daleko horší je situace s farmakologickými možnostmi kontroly dalších hlavních rizikových faktorů aterosklerózy, především obezity a kouření. Přitom kouření je spoluzodpovědné za choroby, kardiovaskulární i nekardiovaskulární, které jsou v rozvinutých zemích nejčastějšími příčinami úmrtí [2]. Vztah kouření a kardiovaskulárního rizika je prokázán již dlouho a odhaduje se, že jenom v USA se kouření podílí na více než 442 000 úmrtích ročně, což představuje 19 % všech úmrtí [2].
V roce 2004 v USA poprvé přesáhl počet úmrtí na choroby, za které je spoluzodpovědná obezita, počet úmrtí na choroby, za které je spoluzodpovědné kouření. Z nadváhy a obezity se velmi rychle stává celosvětová pandemie. Obezita, zejména obezita viscerální, je přitom klíčovým faktorem při vzniku inzulinové rezistence a celého clusteru s ní spojených metabolických abnormalit, který je označován termínem metabolický syndrom [3]. Světová zdravotnická organizace (WHO) odhaduje, že celosvětově má více než 1 miliarda lidí nadváhu (BMI > 25 kg/m2) a přibližně 300 milionů z nich je klinicky obézních (BMI > 30 kg/m2) [4]. Obezita je často spojena s aterogenní dyslipidémií a zvýšením zánětlivých a protrombotických markerů [5]. Kromě svého nezávislého příspěvku ke kardiovaskulárnímu riziku je obezita, zejména abdominálního (viscerálního) typu, také často sdružena s inzulinovou rezistencí, rozvojem poruch glukózového metabolismu až vznikem diabetes mellitus 2. typu a rozvojem metabolického syndromu [6].
Tyto dva rizikové faktory – obezita a kouření – patří mezi hlavní příčiny úmrtí, kterým se dá zabránit. Bylo jasně prokázáno, že abstinence kouření a redukce tělesné hmotnosti mohou výrazně snížit kardiovaskulární riziko. Zhubnutí o ≥ 2,25 kg snižuje v průběhu následujících 16 let riziko vzniku kardiovaskulárního onemocnění u mužů o 48 % a u žen o 40 % [7]. Za jediný rok od zanechání kouření klesá riziko ischemické choroby srdeční o plných 50 % [2]. Současná léčba závislosti na tabáku a léčba obezity však má velmi omezené možnosti a přinesla jen minimální úspěchy. U kuřáků jsou navíc častou překážkou pokusů zanechat kouření obavy z nárůstu tělesné hmotnosti. Když se vše výše řečené sečte dohromady, je jasné, že potřebujeme nové léčebné postupy k účinnější kontrole takových rizikových faktorů, jako je obezita a kouření.
Endokanabinoidní systém – klíčový modulátor energetické rovnováhy
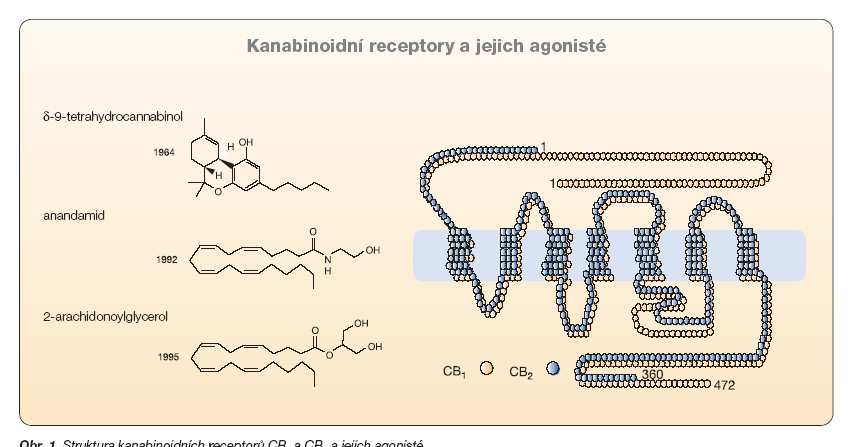
Endokanabinoidní systém získal svůj název od konopí (Cannabis sativa). Již od starověku se usušené listy a kvetoucí konce stonků této rostliny zneužívají pro jejich analgetické a euforické účinky jako návyková látka pod názvem marihuana. Marihuana se ale využívala a využívá také léčebně, např. k potlačení nejrůznějších druhů bolesti včetně bolestí při maligních nádorech, k léčbě svalové spasticity při Parkinsonově chorobě nebo roztroušené skleróze, ale také ke zvýšení chuti k jídlu a léčbě hubnutí při závažných onemocněních, v poslední době např. u nemocných s AIDS [8]. Účinnými psychoaktivními látkami obsaženými v konopí jsou lipofilní alkaloidy, nazývané kanabinoidy. Konopí jich obsahuje více než 60. Nejúčinnějším a nejvýznamnějším z nich je d-9-tetrahydrocannabinol (THC). Začátkem devadesátých let byly při výzkumu molekulárního mechanismu účinku d-9-tetrahydrocannabinolu objeveny receptory, na které se tato látka váže s vysokou afinitou. Byly nazvány kanabinoidní (CB z angl. cannabinoid) receptory a zprostředkovávají všechny psychoaktivní účinky drogy. Tetrahydrocannabinol je mohutným agonistou těchto receptorů [9].
Dosud byly identifikovány dva podtypy receptorů CB (obr. 1).
V roce 1990 byl identifikován receptor CB1 v mozku potkana a v roce 1991 pak i lidský receptor CB1. Je tvořen proteinovým řetězcem o 473 aminokyselinách a jeho primární struktura je takřka shodná s receptorem myším i krysím, má s nimi 98% shodu v sekvenci aminokyselin. Krátce poté, v roce 1993, byl u člověka identifikován další receptor – CB2. Ten je tvořen řetězcem 360 aminokyselin a sekvencí aminokyselin se od receptoru CB1 dosti liší, je jen 44% shoda [10]. Receptory CB patří do velké rodiny receptorů spřažených s proteinem G. Ovlivňují aktivitu nitrobuněčné adenylcyklázy a proteinkinázy aktivované mitogenem. Z obou receptorových podtypů, které dosud byly naklonovány, je u savců nejrozšířenější podtyp CB1. S nejvyšší hustotou se nachází v určitých oblastech mozku (hypothalamu, limbickém systému, bazálních gangliích, mozečkové kůře a jinde), ale je také přítomen v mnoha periferních orgánech a tkáních, jako např. v gastrointestinálním systému, játrech, tukové tkáni, dýchacích cestách, reprodukčních orgánech a kardiovaskulárním systému. Stimulace receptorů CB1 agonisty vede k inhibici uvolňování neurotransmiterů v centrálních a periferních (autonomních i senzorických) neuronech. V ostatních buňkách a tkáních má stimulace receptorů CB1 několik účinků včetně regulace proliferace, diferenciace, motility a apoptózy, pravděpodobně modulací exprese různých růstových faktorů. Význam receptorů podtypu CB2 je daleko méně jasný. Je přítomen na buňkách imunitního a hematopoetického systému a v některých periferních tkáních (hladké svalovině cévní stěny, varlatech, slezině) [11, 12].
Velmi záhy po objevu receptorů CB byly také objeveny jejich přirození endogenní agonisté (obr. 1).
Nazývají se endokanabinoidy (ECB), přestože s chemickou strukturou rostlinných alkaloidů z marihuany nemají kanabinoidy nic společného. Endokanabinoidy jsou endogenní lipidy odvozené od kyseliny arachidonové, chemicky patří mezi eikosanoidy. Váží se na kanabinoidní receptory CB1 a CB2 a aktivují je. Nejlépe prostudovanými ECB jsou anandamid (arachidonoyletanolamid) izolovaný v roce 1992, 2-arachidonoylglycerol izolovaný v roce 1993 a noladin (2-arachidonoylglyceryl éter) izolovaný v roce 2000 [13, 14]. Endokanabinoidy jsou tvořeny přímo neuronovými buňkami po remodelaci jejich membránových fosfolipidů, která je dependentní na Ca2+. Specifické prekurzory, vzniklé z remodelovaných membránových fosfolipidů, jsou pak enzymaticky hydrolyzovány na vlastní aktivní látky. Endokanabinoidy jsou biosyntetizovány po příslušném podnětu de novo a okamžitě uvolňovány do okolí buňky [10, 15]. Nejsou tedy skladovány v neuronech do zásoby. Jinými slovy, bazální koncentrace ECB nejsou detekovatelné, protože ECB jsou tvořeny a ihned uvolňovány jen tehdy, když jsou potřeba, a jen tam, kde jsou potřeba. Poté jsou velmi rychle inaktivovány hydrolytickými enzymy [16]. Proto za normálních okolností ECB aktivují receptory CB jen na velmi krátkou dobu.
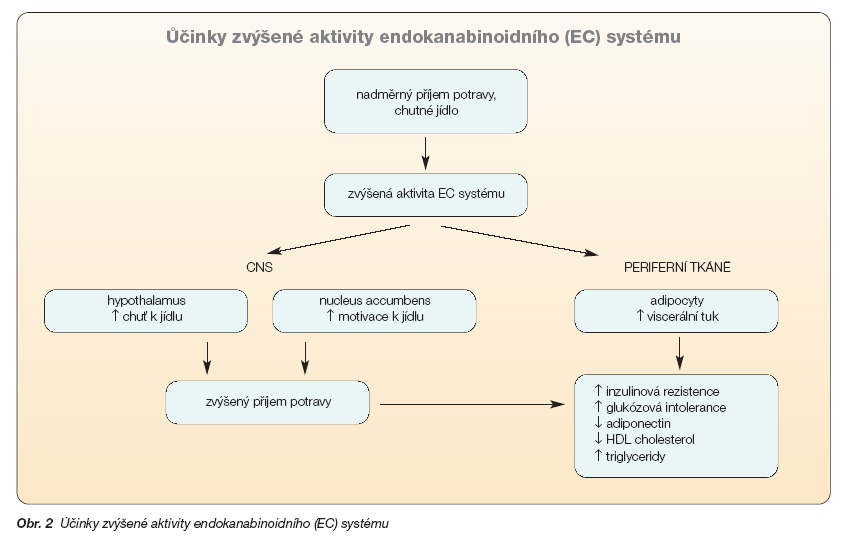
Jaká je biologická funkce endokanabinoidního systému? Zatím není ani zdaleka dopodrobna prozkoumána. Na základě výsledků experimentálních prací provedených v posledních 10 letech se zdá, že ECB jsou produkovány a receptory CB1 stimulovány jako odpověď na stresující podněty ve snaze obnovit homeostázu ostatních neurotransmiterů, mediátorů, hormonů a cytokinů. Stimulace receptorů CB1 je jen krátkodobá, omezená jenom na ty buňky a tkáně, které byly vystaveny stresu nebo poškozeny, a normálně končí v okamžiku, kdy se organismus z přechodného nerovnovážného stavu zotaví. Některé chronické patologické stavy však vedou k dlouhotrvající a nadměrné stimulaci biosyntézy ECB (nebo k jejich zpomalené biodegradaci), což má za následek trvalou a nadměrnou aktivaci receptorů CB1. Takovýmito patologickými stavy může být např. dlouhotrvající nadměrný příjem potravy nebo abúzus nikotinu. Fyziologická odpověď endokanabinoidního systému se může změnit na patologickou např. vlivem opakovaného požívání tučných jídel nebo opakované a dlouhodobé expozice nikotinu, kdy může dojít k trvalé stimulaci receptorů CB1, což má za následek další konzumaci jídla, akumulaci tuku a užívání některých návykových látek, jako je např. kouření tabáku nebo marihuany (obr. 2) [17].
Endokanabinoidní systém je přítomen ve všech mozkových i periferních oblastech, které se účastní kontroly energetické rovnováhy a tělesné hmotnosti. Dále je přítomen v hypothalamu v mezolimbickém systému, který se podílí na vzniku a udržování pocitu uspokojení a převádí motivaci ke vzniku pocitu uspokojení do akce. Je experimentálně prokázáno, že stimulace receptorů CB1 je nezbytná pro zahájení příjmu potravy po krátkodobém hladovění, k ukládání tuku do adipocytů a pro konzumaci stravitelné potravy. Jejich stimulace moduluje uvolnění a/nebo expresi některých hypothalamických anorexigenních a orexigenních mediátorů a dopaminu v nucelus accumbens. Biosyntéza a uvolňování ECB v hypothalamu jsou inhibovány leptinem [17].
Rimonabant – první selektivní blokátor receptorů CB1
Preklinické studie demonstrovaly úlohu endokanabinoidního systému v centrální a periferní regulaci energetické rovnováhy a kontrole závislosti na nikotinu. Inhibice receptorů CB1, např. leptinem, vede ke snížení tělesné hmotnosti a redukci obsahu tuku v tukové tkáni, především viscerální. Geneticky modifikované myši s „knockoutovaným" genem pro receptor CB1 mají nižší příjem potravy, jsou hubenější a mají menší obsah tukové tkáně [18]. To vše vedlo ke snaze vyvinout specifický blokátor receptorů CB1. Toto úsilí vyvrcholilo syntézou prvního selektivního blokátoru receptorů CB1 – rimonabantu [19]. Klinické studie s rimonabantem fáze II prokázaly účinnost této látky v léčbě obezity a závislosti na nikotinu [18, 20]. Proto byl zahájen velkorysý výzkumný klinický program účinnosti a bezpečnosti rimonabantu v léčbě obezity a závislosti na nikotinu (tab. 1).
Tohoto programu se má zúčastnit více než 13 000 nemocných v 500 centrech po celém světě. Program má dvě části. První z nich je označena akronymem RIO (Rimonabant In Obesity Trial Programme). Zkoumá bezpečnost a účinnost rimonabantu na snížení tělesné hmotnosti a její udržení a na ovlivnění k obezitě přidružených metabolických rizikových faktorů, jako je dyslipidémie, inzulinová rezistence a poruchy metabolismu glycidů. Tento program je tvořen 4 klinickými studiemi fáze III, do kterých je zahrnuto celkem více než 6 600 pacientů s nadváhou nebo obezitou, ať již s dalšími komorbiditami (hypertenze, dyslipidémie, diabetes mellitus 2. typu) nebo bez nich. Všechny 4 studie mají velmi podobné uspořádání. Tři z těchto 4 studií již byly ukončeny (RIO-Lipids, RIO-Europe a RIO-North America) a jejich výsledky prezentovány na nedávných kardiologických kongresech v USA a v Evropě [21–24]. Čtvrtá – RIO-Diabetes – zatím probíhá. Druhá část klinického výzkumného programu je označena akronymem STRATUS (STudies with Rimonabant And Tobacco USe). Zahrnuje tři studie, opět s velmi podobným uspořádáním, s více než 6 500 participujícími osobami, u kterých zkoumá účinnost a bezpečnost rimonabantu jako pomoci při odvykání od kouření, při udržení abstinence a také vliv na přírůstek tělesné hmotnosti po přerušení kuřáckého návyku. Z těchto studií byla zatím ukončena jediná – STRATUS-US – a její výsledky byly referovány v roce 2004 na kongresech American College of Cardiology a European Society of Cardiology [25, 26]. V české odborné literatuře se prozatím o endokanabinoidním systému, jeho prvním selektivním blokátoru rimonabantu a výsledcích s ním provedených klinických studií objevily pouze ojedinělé informace [27, 28].
Rimonabant v léčbě obezity
Obezita se rychle stává jedním z hlavních celosvětových zdravotních problémů. Je spojena se zvýšeným rizikem kardiovaskulárních onemocnění, a tak patří ke stavům, které jsou celosvětově nejčastějšími příčinami předčasných úmrtí. Obezita se tradičně měří indexem tělesné hmotnosti (body mass index – BMI). Nedávné výzkumy však ukázaly, že lepším prediktorem kardiovaskulárních příhod než tělesná hmotnost nebo BMI je množství abdominálního (viscerálního) tuku, jehož jednoduchým měřítkem je obvod pasu [1, 3]. Viscerální tuk je příčinně sdružen s dalšími metabolickými rizikovými faktory, jako je dyslipidémie nebo inzulinová rezistence, které mohou vést ke vzniku diabetes mellitus, infarktu myokardu, cévní mozkové příhody a jiných kardiovaskulárních onemocnění. Snížení množství viscerálního tuku se stává jedním z hlavních cílů kardiovaskulární prevence [3]. Současné léčebné možnosti a jejich účinnost jsou však velmi omezené. Výsledky tří dosud ukončených studií z programu RIO ukazují, že první selektivní blokátor receptorů CB1 rimonabant představuje novou a velmi slibnou cestu v léčbě nadváhy/obezity a s ní sdružených metabolických rizikových faktorů [21–24].
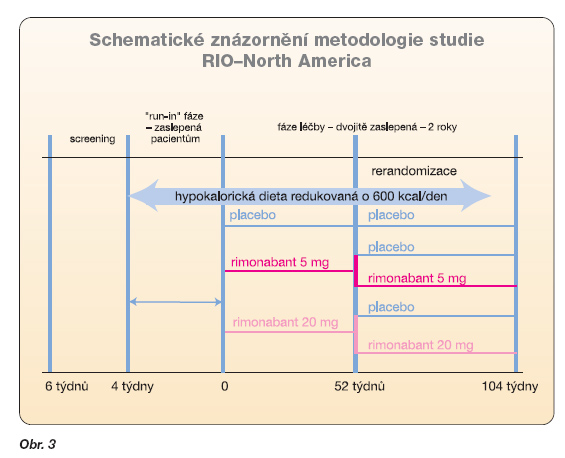
Studie RIO-North America je největší z dosud ukončených klinických studií s rimonabantem [24]. Je to mezinárodní, multicentrická, randomizovaná, dvojitě zaslepená a placebem kontrolovaná studie, která porovnává dvě fixní denní dávky rimonabantu (5 mg a 20 mg) s placebem. Zúčastnilo se jí 3 043 nemocných s nadváhou (BMI > 27 kg/m2) nebo obezitou (BMI > 30 kg/m2) v 72 centrech v USA a Kanadě. Primárním cílem studie v prvním roce trvání bylo zhodnotit účinek rimonabantu na snížení tělesné hmotnosti a ve druhém roce schopnost rimonabantu získané snížení tělesné hmotnosti udržet. Druhotným cílem bylo zlepšení rizikových faktorů sdružených s abdominální obezitou, jako je dyslipidémie, poruchy metabolismu glukózy a metabolický syndrom. Všem nemocným byla předepsána mírná hypokalorická dieta navržená tak, aby denní kalorický příjem byl o 600 kcal nižší než pacientova odhadnutá energetická potřeba, a poté nemocní vstoupili do čtyřtýdenního jednoduše zaslepeného vstupního období, kdy všichni užívali placebo. Poté byli randomizováni v poměru 1 : 2 : 2 do tří dvojitě zaslepených léčebných podskupin: placebo a rimonabant 5 mg nebo 20 mg denně po dobu 52 týdnů. Po prvním roce léčby byli nemocní, kteří užívali rimonabant 5 mg nebo 20 mg, rerandomizováni v poměru 1 : 1 na další rok buď k léčbě stejnou dávkou rimonabantu, nebo k užívání placeba. Ti, kteří byli první rok na placebu, na něm zůstali i druhý rok (obr. 3).
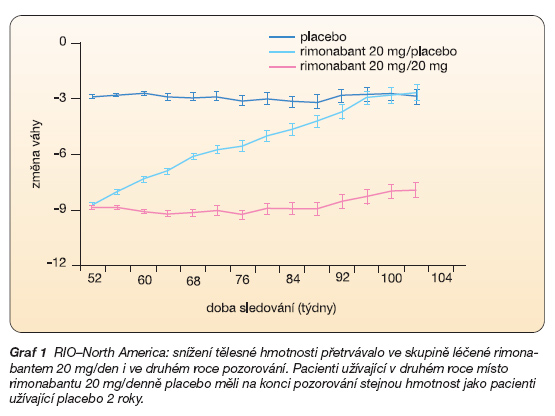
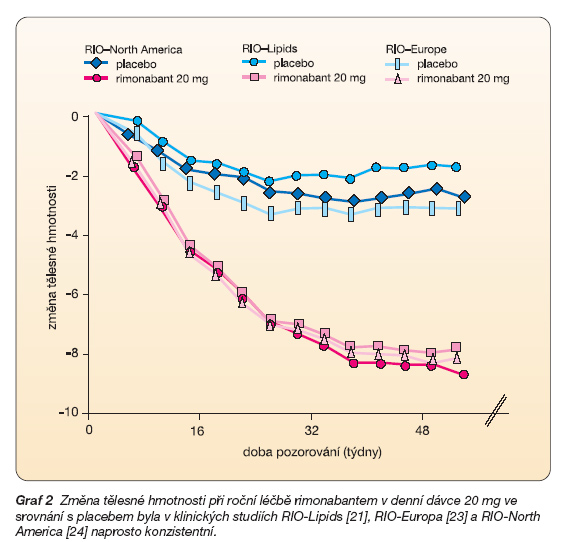
Výsledky po prvním roce léčby ukázaly, že účinky léčby rimonabantem 5 mg denně byly buď srovnatelné s účinky placeba, nebo ležely mezi účinky placeba a rimonabantu 20 mg denně. U nemocných léčených 20 mg rimonabantu denně významně poklesla tělesná hmotnost v průměru o 8,7 kg proti 2,8 kg při léčbě placebem (p < 0,001) a obvod pasu se snížil v průměru o 8,2 cm proti 3,9 cm při léčbě placebem (p < 0,001). Ve srovnání s placebem došlo při léčbě 20 mg rimonabantu denně také k významnému vzestupu průměrných plazmatických koncentrací HDL cholesterolu (o 16,1 % vs 7,2 %; p < 0,001) a snížení průměrných plazmatických koncentrací triglyceridů (o 11,5 % vs vzestup o 4,7 %; p < 0,001). Mnohočetná regresní analýza ukázala, že podstatná část zlepšení lipidových parametrů (cca 50 %) nebyla závislá na poklesu tělesné hmotnosti. To dokládá přímý účinek rimonabantu na lipidový metabolismus, který je nezávislý na tělesné hmotnosti. Léčba 20 mg rimonabantu také vedla ke zlepšení inzulinové odpovědi, měřené OGTT (p = 0,016) a významnému poklesu procenta nemocných, kteří splňovali kritéria pro diagnózu metabolického syndromu, z bazálních 34,8 % na 21,1 % po jednom roce léčby (p < 0,001) ve srovnání s nevýznamným poklesem z 31,7 % na 29,2 % u nemocných, kteří byli na placebu. Všechny tyto účinky rimonabantu zůstaly plně zachovány i po 2 letech léčby (graf 1).
Dvouletá léčba rimonabantem v dávce 20 mg vedla k poklesu tělesné hmotnosti ≥o 5 % u 62,5 % nemocných ve srovnání s 33,2 % nemocných léčených placebem (p < 0,001) a poklesu tělesné hmotnosti o 10 % u 32,8 % nemocných proti 16,4 % nemocných na placebu (p < 0,001). Výsledky studie RIO-North America jsou naprosto konzistentní s výsledky předcházejících dvou studií z programu RIO (graf 2) – RIO-Lipids [21] a RIO-Europe [22, 23].
Rimonabant v léčbě nikotinismu
Kouření cigaret a nadváha/obezita se často vyskytují společně. Zatím jsme neměli k dispozici žádný lék, kterým by bylo možno ovlivnit tyto dva rizikové faktory současně. Naopak, přírůstek tělesné hmotnosti, který se často objevuje po zanechání kouření, může být u kuřáků s nadváhou/obezitou, kteří mají vysoké kardiovaskulární riziko, mimořádně problematický. První selektivní blokátor receptorů CB1 rimonabant v pilotních studiích prokázal schopnost zvýšit abstinenci kouření a omezit přírůstek tělesné hmotnosti po zanechání kouření [25]. Mechanismus tohoto účinku je zprostředkován ovlivněním endokanabinoidního systému, který moduluje energetickou rovnováhu a omezuje pocit uspokojení z nikotinu.
Studie STRATUS-US (Studies with Rimonabant And Tobacco Use) je dvojitě zaslepená, randomizovaná a placebem kontrolovaná studie u 787 kuřáků motivovaných přestat kouřit, kteří kouřili minimálně 10 cigaret, v průměru 23 cigaret denně [26]. Tito lidé byli randomizováni k užívání rimonabantu v dávce 5 mg nebo 20 mg jednou denně, nebo placeba po dobu 10 týdnů. Hlášená abstinence od kouření byla objektivně kontrolována měřením CO ve vydechovaném vzduchu a plazmatické koncentrace hlavního metabolitu nikotinu kotininu. Primárním sledovaným ukazatelem byla prolongovaná abstinence od kouření během posledních 4 týdnů léčby. Jako sekundární ukazatele byly sledovány změny tělesné hmotnosti a hodnocena bezpečnost a snášenlivost léku. Léčba rimonabantem v dávce 20 mg denně vedla ve srovnání s placebem k významně větší 4týdenní biochemicky ověřené abstinenci od kouření (27,6 % vs 16,1 %; p < 0,05). Bez ohledu na kuřácký stav byly pozorovány významné rozdíly ve změně tělesné hmotnosti při rimonabantu v dávce 20 mg denně (v průměru -0,3 kg) ve srovnání s placebem (v průměru +1,1 kg; p < 0,01). Tento rozdíl ve změně tělesné hmotnosti byl ještě větší u neobézních jedinců s prolongovanou abstinencí (+0,7 kg vs +3,0 kg, p < 0,001). Pravděpodobnost, že přestanou kouřit přinejmenším poslední 4 týdny, byla u osob léčených 20 mg rimonabantu denně zhruba dvojnásobná než u osob na placebu. Navíc vedla aktivní léčba k redukci přírůstku tělesné hmotnosti po zanechání kouření u neobézních osob o 77 %. Obézní osoby (BMI > _ ≥35 kg/m2) dokonce při rimonabantu 20 mg denně tělesnou hmotnost ztrácely. Tento duální účinek dělá z rimonabantu velmi slibnou látku k léčbě závislosti na nikotinu. Osoby ve studii STRATUS-US budou po 10týdenní léčbě sledovány po dobu jednoho roku. Účinnost a bezpečnost rimonabantu v léčbě nikotinové závislosti je dále zkoumána ve dvou probíhajících studiích (tab. 1).
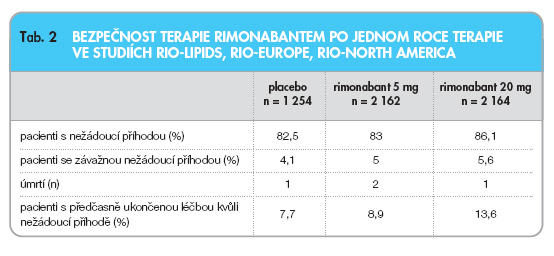
Ve všech dosud provedených klinických studiích se také potvrdil dobrý bezpečnostní profil rimonabantu. K přerušení léčby kvůli nežádoucím příhodám došlo jen u malého počtu osob, nejčastěji z psychiatrických příčin (tab. 2).
Lék neovlivňoval srdeční frekvenci ani krevní tlak. Nežádoucí účinky byly většinou mírné a přechodné. Nejčastějším byla nauzea (ve 4,3 % při placebu, ve 4,8 % při 5 mg a ve 12 % při 20 mg rimonabantu), průjem (ve 2,3 % při placebu, v 5,8 % při 5 mg a v 7 % při 20 mg rimonabantu) a závratě (ve 4,6 % při placebu, v 5,8 % při 5 mg a v 8,3 % při 20 mg rimonabantu).
Závěr
Obezita, zejména viscerálního typu, je velmi často sdružena s celou řadou metabolických poruch, jako je dyslipidémie, inzulinová rezistence, porucha tolerance glycidů nebo diabetes mellitus 2. typu a hypertenze. Souhrnně tento cluster metabolických abnormalit tvoří metabolický syndrom. Spolu s kouřením představuje metabolický syndrom jako celek i jeho jednotlivé složky hlavní rizikové faktory aterosklerózy. Farmakologicky umíme účinně ovlivňovat jenom některé jednotlivé rizikové faktory, jako je hypertenze, dyslipidémie a diabetes mellitus. Možnosti farmakologické léčby obezity a kouření jsou velmi omezené a jejich úspěšnost minimální. Přitom se zdá, že právě viscerální obezita hraje v rozvoji metabolického syndromu klíčovou roli. Poznání funkce endokanabinoidního systému v regulaci energetické rovnováhy, příjmu potravy a tělesné hmotnosti, ale také vzniku závislosti na některých návykových látkách, jako je nikotin a marihuana, je nepochybně velkým krokem vpřed. Blokáda tohoto systému nově vyvinutým selektivním blokátorem receptorů CB1 rimonabantem umožňuje příznivě ovlivnit hned několik hlavních rizikových faktorů aterosklerózy najednou. Výsledky ukončených klinických studií programu RIO jasně ukazují, že léčba rimonabantem vede k významnému snížení tělesné hmotnosti, zmenšení obvodu pasu a zlepšení přidružených poruch lipidového a glycidového metabolismu. Jak naznačují výsledky programu klinických studií STRATUS, současně tato léčba dvojnásobně zvyšuje pravděpodobnost, že člověk přestane kouřit a bude dlouhodobě od kouření abstinovat, aniž by přitom přibýval na váze. To vše je velmi lákavé a nadějné. Zdá se, že konečně dostaneme do rukou účinnou zbraň do boje proti rychle narůstající pandemii obezity a metabolického syndromu. Musíme si ale uvědomit, že tato zbraň bude pouze odstraňovat následky nezdravého, toxického způsobu života moderního člověka. Pokud bychom dokázali efektivně změnit náš nezdravý životní styl, to znamená přestali se chronicky přejídat a byli fyzicky aktivnější, pak bychom takovýto lék vůbec nepotřebovali. V tom případě bychom ale také nepotřebovali perorální antidiabetika, nebo bychom perorálních antidiabetik, hypolipidemik a atihypertenziv potřebovali daleko méně. To je ale asi těžko splnitelné přání. Rimonabant tedy jistě potřebovat budeme a pravděpodobně ho budeme masově také používat. Budeme jím ovlivňovat mechanismy, které zatím nejsou do detailů probádány a objasněny. Již dnes víme, že endokanabinoidní systém nezasahuje pouze do regulace energetické rovnováhy a tělesné hmotnosti, ale že ovlivňuje také procesy spánku a bdění, motivaci a pocit uspokojení nejenom při příjmu potravy, ale možná i další důležité aktivity. Zatím vůbec nevíme, jaká je funkce receptorů CB2 na membránách imunokompetentních a hematopoetických buněk. Nedávno bylo zjištěno, že kanabinoidy způsobují in vitro apoptózu buněk maligního gliomu [29] a inhibičně působí na proliferaci lidského karcinomu prsu [30]. Některé ze zatím nedostatečně prozkoumaných účinků blokády endokanabinoidního systému se mohou ukázat jako prospěšné a léčebně využitelné v jiných oblastech medicíny. Jiné ale mohou být potenciálně nebo i reálně škodlivé. To nabádá k veliké opatrnosti. Přestože nežádoucí účinky rimonabantu v dosud ukončených klinických studiích byly mírné, nezávažné, často jen přechodné a lék byl dobře tolerován, je třeba dalších studií a dlouhodobého sledování, abychom měli jistotu.
Seznam použité literatury
- [1] Yusuf S, Hawken S, Ounpuu S, on behalf of the INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): casecontrol study. Lancet 2004; 364: 937–952.
- [2] Center for Disease Control and Prevention. MMWR. 2002; 51: 1300–1303.
- [3] Haffner S, Taegmeyer H. Epidemic obesity and metabolic syndrome. Circulation 2003; 108: 1541–1545.
- [4] World Health Organization. Global strategy on diet, physical activity and health, 2003. http: //www.who.int/hpr/NPH/docs/gs_obesity.pdf.
- [5] Sharma AM. Adipose tissue: a mediator of cardiovascular risk. Int J Obes 2003; 26 (Suppl.24): S5–S7.
- [6] Reilly MP, Rader DJ. The metabolic syndrome: more than the sum of its parts? Circulation 2003; 108: 1546–1551.
- [7] Cannon CP. The importance of treating obesity and achieving smoking cessation in managing cardiovascular risk. Symposium: The endocannabinoid system. A new target for multirisk management, New Orleans, 9 March 2004.
- [8] Wingerchuk D. Cannabis for medical purposes: cultivating science, weeding out the fiction. Lancet 2004; 364: 315–316.
- [9] Palmer T. Evidence in cannabis research. Br J Psychiatry 2004; 184: 542–543.
- [10] Pertwee RG. Pharmacology of cannabinoid CB1 and CB2 receptors. Pharmacol Ther 1997; 74: 129–180.
- [11] Fride E, Shohami E. The endocannabinoid system: function in survival of the embryo, the newborn and the neuron. Neuroreport 2002; 13: 1833–1841.
- [12] Onaivi ES, Leonard CM, Ishiguro H, et al. Endocannabinoids in the central nervous system. Med Sci (Paris) 2004; 20: 45–53.
- [13] Sim-Selley LJ. Regulation of cannabinoid CB1 receptors in the central nervous system by chronic cannabinoids. Crit Rev Neurobiol 2003; 15: 91–119.
- [14] Palmer SL, Khanolkar AD, Makriyannis A. Natural and synthetic endocannabinoids and their structure-activity relationships. Curr Pharm Des 2000; 6: 1381–1397.
- [15] Grotenhermen F. Pharmacology of cannabinoids. Neuro Endocrinol Lett 2004; 25: 14–23.
- [16] Maccarrone M, van der Stelt M, Rossi A, et al. Anandamide hydrolysis by human cells in culture and brain. J Biol Chem 1998; 273: 332–339.
- [17] Piomelli D, Beltramo M, Giuffrida A, Stella N. Endogenous cannabinoid signaling. Neurobiol Dis 1998; 5: 462–473.
- [18] Horvath TL. Endocannabinoids and the regulation of body fat: the smoke is clearing. J Clin Invest 2003; 112: 323–326.
- [19] Fernandez JR, Allison DB. Rimonabant. Curr Opin Investig Drugs 2004; 5: 430–435.
- [20] Pagotto U. The endocannabinoid system: a new player in reinforcement and energy control functions. Poster presented at the Metabolic Syndrome, Type 2 Diabetes and Atherosclerosis Conference, Marrakech, 19–23 May 2004.
- [21] Després JP. Selective cannabinoid receptor antagonism and its role in the management of obesity/metabolic syndrome. Symposium The Endocannabinoid System. A New Target for Multi-Risk Management, New Orleans, 9 March 2004.
- [22] van Gaal L. The RIO-Europe Study: Use of selective CB1-receptor blocker (rimonabant) in the management of obesity and related metabolic risk factors. 26th Congress of the European Society of Cardiology (ESC), Munich, 28 August – 1 September 2004.
- [23] van Gaal L. The RIO-Europe Study: 2-year data. Metabolic effects of rimonabant in overweight/obese patients. 54th Annual Scientific Session of the American College of Cardiology (ACC), Orlando, March 6–9 2005.
- [24] Pi-Sunyer X. The RIO-North America: 2-year results. The American Heart Association (AHA) Scientific Session, New Orleans, November 7–10 2004.
- [25] Anthenelli RM. Using a cannabinoid receptor antagonism as an aid to smoking cessation. Symposium The Endocannabinoid System. A New Target for Multi-Risk Management, New Orleans, 9 March 2004.
- [26] Tonstad S. Managing cardiovascular risk: Metabolic syndrome, obesity and smoking cessation. 26th Congress of the European Society of Cardiology (ESC), Munich, 28 August – 1 September 2004.
- [27] Kvasnička T. Endokanabinoidy – nová možnost v léčbě metabolického syndromu a odvykání kouření. Čas Lék Čes 2005; 144: 81–84.
- [28] Šamánek M. Je na obzoru lék proti obezitě a kouření? Kap Kardiol 2005; 7 (1): 25–26.
- [29] Karlsson M, Pahlsson C, Fowler CJ. Reversible, temperature-dependent, and AM404-inhibitable adsorption of anandamide to cell culture wells as a confounding factor in release experiments. Eur J Pharm Sci 2004; 22: 181–189.
- [30] Bisogno T, Katayama K, Melck D, et al. Biosyn-thesis and degradation of bioactive fatty acids amides in human breast cancer and rat pheochromocytoma cells – implications for cell proliferation and differentitation. Eur J Biochem 1998; 254: 634–642.