Erektilní dysfunkce ve světle nových poznatků
Erektilní dysfunkce je definována jako neschopnost dosáhnout a udržet dostatečné ztopoření k realizaci uspokojivého sexuálního styku. Postihuje 54 % českých mužů ve věku 35–65 let. Erektilní dysfunkce je u mužů ve věku 30–60 let a u diabetiků prediktorem závažného kardiovaskulárního onemocnění v časovém horizontu 2–5 let. Moderní léčba erektilní dysfunkce spočívá v podávání inhibitorů fosfodiesterázy 5, je bezpečná a dobře tolerovaná. Nový způsob představuje léčba pomocí rázové vlny nízké intenzity vedoucí k neovaskularizaci. U onkologicky nemocných, stejně jako u pacientů s kardiovaskulárním onemocněním, je v prevenci ireverzibilního poškození indikována rehabilitace penisu pomocí perorální či intrakavernózní léčby.
Úvod
Erektilní dysfunkce (ED) znamená trvalou či opakovanou neschopnost dosáhnout a udržet ztopoření dostačující k realizaci uspokojivého sexuálního styku. Muž s ED selhává ve více než 25 % pokusů o sexuální styk. Příležitostné selhání je běžné. Zažije ho většina mužů po abúzu alkoholu, při nechuti k sexu nebo během nepříznivých zevních podmínek. ED je nejčastější sexuální poruchou. Trpí jí 150 milionů mužů na celém světě. Podle výzkumů sexuálního chování českých mužů má ED 54 % českých mužů ve věku od 35 do 65 let [1].
Erektilní dysfunkce a komorbidity
Rizikové faktory pro rozvoj ED představují hypertenze, hypercholesterolemie, endoteliální dysfunkce jako první stupeň aterosklerózy, s tím související ischemická choroba srdeční (ICHS), diabetes mellitus, obezita, kouření, fyzická inaktivita, poškození nervů při pánevních operacích (radikální prostatektomie, kolorektální chirurgie), poranění míchy, poranění pánve, syndrom LUTS (Lower Urinary Tract Symptoms, dysfunkce dolních močových cest) a užívání některých léčiv. V posledních letech je zkoumán syndrom spánkové apnoe. Spánková apnoe vede k řadě abnormalit v neurogenní, hormonální a cévní regulaci s vývojem ED. Santos a kol. popsali u 64,4 % pacientů se syndromem spánkové apnoe ED. Rizikovými faktory u těchto nemocných byly věk a diabetes mellitus [2].
Farmakoterapie ve vztahu k erektilní dysfunkci
Antihypertenziva jsou nejčastěji diskutována v souvislosti s negativním působením na erektilní funkci. Nejrizikovější jsou betablokátory (např. atenolol, bisoprolol, metoprolol, metipranolol), diuretika (např. thiazidová – hydrochlorothiazid, chlorthalidon; kalium šetřící – amilorid, spironolakton) a centrální agonisté α2-receptorů (např. methyldopa, klonidin). Blokátory periferních α1-receptorů (doxazosin, terazosin) naopak ED zmírňují, vedou však k retrográdní ejakulaci. Vhodnější a bezpečnější jsou z hlediska zachování erektilní funkce inhibitory angiotenzinkonvertázy ACE (např. cilazapril, fosinopril, ramipril, enalapril, kaptopril), blokátory kalcio-
vých kanálů (např. amlodipin, felodipin, nifedipin, verapamil) a sartany (např. losartan, valsartan, telmisartan).
Monoterapie hypertenze bývá úspěšná nanejvýš u 30 % nemocných. Ostatní pacienti vyžadují kombinovanou terapii, při níž se podává kombinace dvou nebo i více antihypertenziv. Nemocným, kteří jsou léčeni antihypertenzivy všech běžně používaných lékových skupin, mohou být bezpečně podávány inhibitory fosfodiesterázy 5 (PDE5). Léčba inhibitory PDE5 v kombinaci s jedním, dvěma a/nebo více antihypertenzivy nezvyšuje riziko vedlejších účinků ve srovnání s podáním samotného sildenafilu.
K dalším léčivům spojovaným se zvýšeným výskytem ED patří látky s anticholinergním působením (tricyklická antidepresiva, antiparkinsonika, antihistaminika či fenothiazinová antipsychotika, která kromě anticholinergního působení indukují hyperprolaktinemii), kardiotonika (digoxin), antiulcerózní léky (t. č. v ČR neregistrovaný cimetidin – antiandrogenní efekt), v gastroenterologii používaný metoklopramid, nesteroidní antiflogistika (indometacin – inhibice uvolňování prostaglandinů), benzodiazepiny (diazepam, oxazepam, alprazolam), antidepresiva (bicyklická antidepresiva i blokátory zpětného vychytávání serotoninu, SSRI) a lithium. Bezpečnou variantu antidepresivní léčby z hlediska zachování erektilní funkce představuje trazodon, bupropion, agomelatin, moklobemid. Antiandrogeny, cyproteron acetát, flutamid, bikalutamid, LHRH (hormon uvolňující luteinizační hormon) agonisté, a estrogeny zhoršují sexuální funkce [3–5].
Erektilní dysfunkce, endoteliální dysfunkce, kardiovaskulární rizikoED je prediktorem vzniku kardiovaskulárního onemocnění (KVO) – ICHS, srdečního infarktu, srdečního selhání – a ukazatelem rostoucího rizika mortality. ED se objevuje 2–5 let před srdečně-cévní příhodou a je markerem klinicky němé cévní, zvláště koronární nemoci; 70 % mužů se známým KVO a ED má zvýšené riziko srdečně-cévní příhody ve srovnání s muži, kteří nemají ED. Nejvyšší je toto riziko u mužů ve věku mezi 30–60 lety a u diabetiků [6].
Pro normální erektilní funkci je nezbytný zdravý endotel. Porucha funkce endotelu, endoteliální dysfunkce, je definována jako patologický defekt vazodilatace závislé na NO (oxid dusnatý); později dochází ke vzniku strukturálních vaskulárních abnormalit tvořících základ pro vznik KVO a ED. Klíčová pro vznik endoteliální dysfunkce a ED je snížená odpověď na působení vazodilatačních faktorů nebo zvýšená senzitivita na vazokonstrikční faktory, což ovlivňuje regulační schopnost endotelu kavernózních arterií i penilního žilního systému. Společným jmenovatelem je oxidativní stres, který poškozuje aktivitu eNOS/eNO (endoteliální syntáza oxidu dusnatého/endoteliální oxid dusnatý), která vede ke snížení na endotelu závislé relaxace hladké svaloviny topořivých těles a relaxace cév [7–9].
Diabetes mellitus, hypertenze, hypercholesterolemie, metabolický syndrom a stárnutí tvoří klíčový vztah mezi ED a ICHS se společným jmenovatelem endoteliální dysfunkcí. Porucha funkce endotelu je první fází řady KVO, zejména aterosklerózy. Penilní endoteliální dysfunkce vede k ED, která je indikátorem systémové endoteliální dysfunkce s následnou možností rozvoje koronární příhody [10]. Muži trpící ED se tak stávají nositeli systémového vaskulárního onemocnění.
Endoteliální 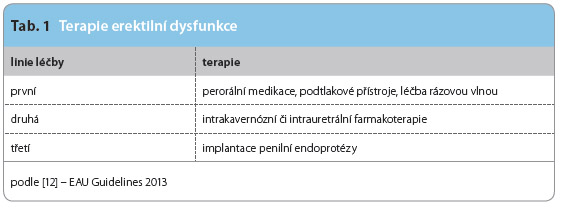 dysfunkce a ED jdou ruku v ruce a představují tak predikci systémového KVO. Z těchto důvodů je ED spojena s rostoucí mortalitou, jejíž příčinou je kardiovaskulární mortalita [11]. Diagnostika ED je proto důležitá u nemocných, kteří nemají žádné symptomy KVO. Terapii ED shrnuje tab. 1.
dysfunkce a ED jdou ruku v ruce a představují tak predikci systémového KVO. Z těchto důvodů je ED spojena s rostoucí mortalitou, jejíž příčinou je kardiovaskulární mortalita [11]. Diagnostika ED je proto důležitá u nemocných, kteří nemají žádné symptomy KVO. Terapii ED shrnuje tab. 1.
Perorální léčba inhibitory fosfodiesterázy 5
V první linii léčby se uplatňují inhibitory PDE5. Jsou selektivními, silnými inhibitory enzymu fosfodiesterázy 5, která je přítomna v topořivých tělesech. Její inhibicí v topořivých tělesech přetrvává ve zvýšené nabídce cGMP (cyklický guanosinmonofosfát), který je klíčový pro navození relaxace hladké svaloviny topořivých těles. Mechanismus působení inhibitorů PDE5 stručně ilustruje obr. 1.
Absolutní kontraindikaci podání představuje užívání nitrátů nebo látek uvolňujících oxid dusnatý (amylnitrit, dusitan amylnatý, užívaný v léčbě symptomů ICHS i jako rekreační inhalační droga, tzv. “poppers”) pro riziko vzniku maligní hypotenze. Retinitis pigmentosa či nearteritická přední ischemická neuropatie optického nervu (NAION) představují další kontraindikac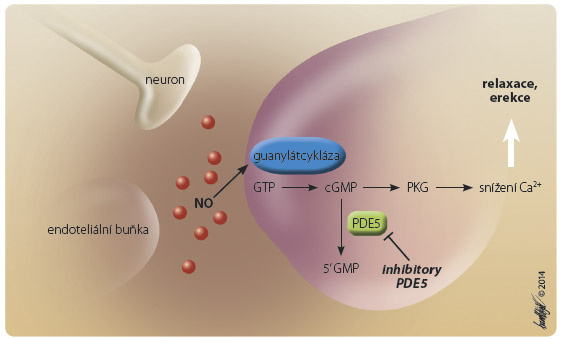 e podání inhibitorů PDE5. Z užívání těchto léčiv by měli být vyloučeni nemocní, jejichž krevní tlak je nižší než 90/50 mm Hg.
e podání inhibitorů PDE5. Z užívání těchto léčiv by měli být vyloučeni nemocní, jejichž krevní tlak je nižší než 90/50 mm Hg.
Tato léčiva vykazují interakce s alfablokátory, které jsou užívány k léčbě hypertenze a při syndromu dolních močových cest, kdy jsou pacienti ohroženi relativním rizikem vzniku ortostatické hypotenze. Sildenafil by neměl být podán během prvních čtyř hodin po užití alfablokátoru. Užití vardenafilu a alfablokátorů (kromě tamsulosinu) se nedoporučuje; tadalafil také není doporučován.
K dalším lékovým interakcím dochází při současném podání inhibitorů PDE5 s inhibitory cytochromu CYP3A4, které zvyšují hladinu systémové expozice sildenafilu. Jsou jimi ketokonazol, itrakonazol, erythromycin, klarithromycin a inhibitory HIV proteáz. Předpis těchto přípravků vyžaduje snížení dávek inhibitorů PDE5. Nedoporučuje se současné užívání sildenafilu a inhibitoru HIV proteázy ritonaviru. Grapefruitový džus, slabý inhibitor CYP3A4, způsobuje mírné zvýšení plazmatické hladiny sildenafilu. Naopak vyšší dávky inhibitorů PDE5 vyžaduje užívání rifampicinu, fenobarbitalu, fenytoinu a karbamazepinu; tyto látky jsou induktory CYP3A4.
U nemocných se sníženou funkcí ledvin a jater je nutné snížit dávku inhibitorů PDE5 [13]. Androgenní suplementace zvyšuje terapeutickou odpověď na podávané inhibitory PDE5 u mužů trpících hypogonadismem [4, 5]. U sildenafilu v dávce 50 mg, stejně jako u dalších inhibitorů PDE5, nevedlo současné podání alkoholu zdravým dobrovolníkům k potenciaci hypotenzních účinků alkoholu, pokud průměr maximální hladiny alkoholu v krvi nepřesahoval hodnotu 80 mg/dl [13]. Obecně platí, že podání alkoholu může mít nepříznivý vliv na dosažení erekce v důsledku zvýšení prahu sexuální dráždivosti a kvůli přechodnému poklesu krevního tlaku.
Léčba inhibitory PDE5 je bezpečná. Tato léčiva nezvyšují riziko vzniku srdečního infarktu. K běžným nežádoucím účinkům léčby patří bolest hlavy, návaly, dyspepsie, zarudnutí v obličeji, závrať, překrvení nosu s pocitem jeho ucpání a porucha barevného vidění. Sildenafil a vardenafil mohou vést k abnormalitám vizu u méně než 2 % pacientů. Po užití tadalafilu se mohou objevit bolesti svalů, kloubů a zad v 6 % [4, 5, 13]. Předpis inhibitorů PDE5 je bez omezení odbornosti lékaře.
Sildenafil
Sildenafil byl uveden na trh v roce 1998 jako první z inhibitorů PDE5 a způsobil revoluci v léčbě ED. Užívá se 30 minut až 60 minut před sexuální aktivitou. Požití opulentní stravy prodlužuje dobu nástupu účinku, který představuje 84 % ve srovnání s 25% účinkem placeba. Sildenafil je dostupný v dávkách 25 mg, 50 mg a 100 mg. Úvodní dávka by měla být 50 mg s možným zvýšením na 100 mg. U pacientů s poškozením jater či ledvin je vhodné začít podáním 25 mg sildenafilu s navýšením dle tolerance až na dávku 100 mg. U starších nemocných není nutné snižovat dávku.
Sildenafil, stejně jako ostatní inhibitory PDE5, není určen k podání ženám a jedincům mladším 18 let. Biologický poločas sildenafilu je 3–5 hodin. Za 12 hodin je vyloučeno celé množství účinné látky [13]. Od června roku 2011, kdy vypršela patentová ochrana originálnímu sildenafilu, zaznamenáváme nástup plejády generických léků. Zaregistrováno jich je 24, fakticky dostupných na trhu je 12 generických léků. Od roku 2014 je k dispozici disperzní forma originálního sildenafilu s jemnou citronovou chutí. Zvyšuje komfort nemocného při podání. Disperzní formu má i sildenafil produkovaný od roku 2013 dvěma společnostmi specializujícími se na výrobu generik.
Tadalafil
Tadalafil je na trhu od roku 2003. Jeho účinek nastupuje 30 minut po aplikaci, jeho koncentrace v plazmě dosahuje vrcholu za dvě hodiny. Účinek trvá 36 hodin; nemocný jej užívá maximálně jednou za 48 hodin při dávce 10 mg nebo 20 mg. Nízkodávkovaný tadalafil užívá nemocný denně v dávce 2,5 mg nebo 5 mg, nemusí tak sexuální styk plánovat. K interakci s jídlem nedochází. Terapeutický účinek dosahuje 81 %.
Vardenafil
Léčba vardenafilem byla zahájena v roce 2003. Vardenafil je účinný 30 minut po podání, obsah tuku v potravě (více než 57 %) redukuje rychlost nástupu účinku. Podáváme jej v dávce 5 mg, 10 mg a 20 mg s 80% účinkem, zatímco účinek placeba dosahuje 30 %.
Avanafil
Čtvrtým z inhibitorů PDE5 je avanafil, jehož podávání je indikováno při lehké až těžké ED. Má rychlý nástup účinku (do 15 minut), nejvyšší koncentrace v plazmě je dosaženo za 35 minut po podání. Klinický léčebný účinek přetrvává až 6 hodin po užití léku. Podává se v dávce 50 mg, 100 mg nebo 200 mg. Není nutná restrikce jídla nebo alkoholu. Nežádoucími účinky jsou návaly horka, cefalea, svalové křeče či kongesce nosní sliznice. V klinických studiích (Goldstein a kol.) byl avanafil statisticky významně účinnější než placebo [14]. Agentura FDA (Food and Drug Administration) schválila použití avanafilu v dubnu 2012, EMA (European Medicines Agency) v červnu 2013. Registrace avanafilu v ČR byla úspěšně ukončena a jeho uvedení na trh se očekává v květnu letošního roku.
Úskalí léčby inhibitory fosfodiesterázy 5
Problém v léčbě inhibitory PDE5 představují tzv. falešní non-respondéři, kteří léčbu předčasně opouštějí. Patří k nim nemocní, u nichž:
- nebyla titrována dávka do maximální terapeutické dávky (sildenafil 100 mg, tadalafil 20 mg, vardenafil 20 mg);
- nebyl doporučen a realizován dostatečný počet podání – nejméně šest až osm;
- nebyla provedena sexuální stimulace po podání léku;
- podání inhibitorů PDE5 bylo špatně načasované;
- při nízkém terapeutickém účinku nebyla provedena záměna jednoho inhibitoru PDE5 za jiný [5].
Přínos léčby inhibitory fosfodiesterázy 5
Užívání inhibitorů PDE5 má u nemocných s KVO protektivní účinek na zlepšení funkce cévního endotelu, pozitivní vliv na průtok krve koronárními tepnami a zlepšuje koronární rezervu. Sildenafil vedl ke zlepšení erektilní funkce a markerů endoteliální funkce u mužů s diabetem mellitem [15].Bylo prokázáno zlepšení funkce cévního endotelu u nemocných chronicky užívajících tadalafil. Chronické užívání tadalafilu vedlo k signifikantní redukci hs-CRP (vysoce senzitivní C-reaktivní protein) a ET-1 (endotelin 1). Tadalafil zlepšoval jak erektilní funkci, tak funkci cévního endotelu penilních arterií měřenou FMD (flow mediated dilation), zvyšoval dostupnost cEPCs (endoteliální progenitorové buňky) [16]. Přínos představuje kombinovaná terapie inhibitory PDE5 s deriváty testosteronu u hypogonadálních mužů – vede ke zlepšení terapeutické odpovědi na inhibitory PDE5. Muži trpící hypogonadismem jsou často diabetici, obézní, trpící syndromem spánkové apnoe, muži se syndromem LUTS. Snížená hladina testosteronu vede ke snížení aktivity NOS, a tím k ED [17, 18].
Nově se zavádí termín rehabilitace penisu u nemocných s ED vznikající v příčinné souvislosti s radikální prostatektomií pro karcinom prostaty, s operací kolorektálního karcinomu, se srdečním infarktem, s ICHS, u dialyzovaných, u pacientů po úrazech pánve i míchy. Rehabilitace penisu znamená včasné obnovení sexuální aktivity po zhojení, rehabilitaci a rekonvalescenci. Cílem je navodit pravidelné tumescence penisu a tak předejít deoxygenaci topořivých těles a tím apoptóze buněk s důsledkem jejich fibrotické přeměny. K rehabilitaci penisu se používají inhibitory PDE5 (tadalafil v dávce 2,5–5 mg, sildenafil v dávce 50–100 mg v denním podání), samostatně nebo v kombinaci s injekcemi prostaglandinu E1 [19].
Další indikace podání inhibitorů fosfodiesterázy 5
Registrovanou indikací silfenafilu je léčba arteriální plicní hypertenze. Tadalafil byl v roce 2012 zaregistrován v ČR pro léčbu LUTS, který představuje závažný problém mužů nad 50 let. LUTS je nezávislý rizikový faktor ED. Monoterapie tadalafilem v kontrolovaných klinických studiích (Oelke a kol., 2012) vedla ke zlepšení jak erektilní funkce, tak ke zmírnění LUTS [20].
Podtlakové přístroje a lineární aplikace rázové vlny nízké intenzity
K první linii léčby patří i používání podtlakových přístrojů neboli pump (VCD, Vacuum Constriction Device), které navozují erekci vlivem podtlaku. U nemocných užívajících warfarin, případně nízkomolekulární heparinové preparáty, může léčba vést ke krvácivým projevům [5]. K první linii léčby dle EAU (Evropská urologická asociace) patří i nový způsob využívající lineární aplikace rázové vlny nízké intenzity (LSWT, low-intensity extracorporeal Linear Shock Wave Therapy). Otcem této metody je profesor Yoram Vardi. Mechanismus účinku spočívá ve stimulaci eNOS a uvolnění VEGF (vaskulární endoteliální růstový faktor), čímž dochází k neovaskularizaci. Metoda je určena pro nemocné s vaskulární ED lehkého a středního stupně. Popisovaný terapeutický účinek dosahuje 60–75 % s délkou trvání po dobu dvou let. Nemocný podstoupí kúru během čtyř sezení probíhajících s týdenním odstupem, během nichž je pokaždé aplikováno 5000 rázů (900 rázů na levé i pravé corpus cavernosum, 1600 na crura penis) s frekvencí 300 rázů/min o energii 0,09 mJ/mm2/ráz. Rázová vlna působí na délku 70 mm, po celé délce penisu a zasahuje do hloubky 40 mm. Sezení trvají 15 minut. Aplikace je nebolestivá, pacient pociťuje pouhé šimrání. Zatím je k dispozici malý počet klinických studií a metoda vyžaduje další ověření v kontrolovaných klinických studiích [21].
Intrakavernózní a intrauretrální farmakoterapie
Druhá linie léčby zahrnuje intrakavernózní aplikaci vazoaktivní látky. Prostaglandin E1 byl vyvinut pro léčbu ED v podobě intrauretrálního gelu. Tento přípravek byl v České republice zaregistrován, ale není k dispozici. Jeho podávání je spojeno s nižším terapeutickým účinkem, ale také s pálením v močové trubici a celkovým dyskomfortem nemocného.Nejčastější a nejbezpečnější je použití prostaglandinu E1 (PGE1, alprostadil) v intrakavernózní aplikaci v dávce 5 μg až 20 μg. První zprávy o terapeutickém užití PGE1 v léčbě ED byly uvedeny na druhém světovém urologickém mítinku v Praze v roce 1986. Ve srovnání s dříve užívaným papaverinem a fentolaminem je léčba PGE1 spojena s lepší účinností a s minimálním rizikem vzniku priapismu.
PGE1 je přirozenou součástí savčí tkáně, u mužů se ho nachází nejvíce v semenných váčcích. V organismu vzniká syntézou pomocí enzymu prostaglandin syntetázy. PGE1 patří k neurotransmiterům, které se účastní fyziologického procesu vzniku erekce. Alprostadil, syntetický PGE1, je bílý prášek bez vůně a zápachu, jeho chemická stabilita a rozpustnost ve vodě je malá. Intrakavernózně aplikovaný aktivuje enzym adenylcyklázu štěpící adenosintrifosfát na cyklický adenosinmonofosfát (cAMP). Cyklický AMP vede ke snížení intracelulární koncentrace kalciových iontů, způsobuje hyperpolarizaci s následnou relaxací buněk hladké svaloviny topořivých těles. Výsledkem je zvýšení přítoku krve do topořivých těles, omezení venózního odtoku, vzestup intrakavernózního tlaku a vznik erekce [22, 23].
Naředěný roztok alprostadilu má omezenou dobu exspirace, nemocný ho může používat čtyři týdny. Alprostadil musí být uchováván při teplotě 2–5 °C. Pokud není dosaženo efektu vzniku dostatečně rigidní erekce při monoterapii alprostadilem, lze jej kombinovat s papaverinem či fentolaminem. Papaverin a fentolamin nejsou v naší republice k dispozici. V zahraničí jsou používány k intrakavernózní léčbě v kombinaci s PGE1, avšak s možným vyšším rizikem vedlejších účinků. U nás můžeme nemocnému doporučit kombinaci PGE1 s inhibitory PDE5 v případě, že dosažená rigidita i po aplikaci maximální dávky PGE1 není dostatečná.
Intrakavernózní léčba i její kombinace s inhibitory PDE5 patří do rukou zkušeného androloga. Tuto léčbu zahajujeme po podepsání informovaného souhlasu u motivovaného, dobře edukovaného nemocného s přirozenou inteligencí, dobrým zrakem a zachovanou jemnou motorikou ke zvládnutí přípravy injekce a autoaplikace do topořivých těles. Nemocný podstoupí sérii testovacích ambulantních sezení s cílem nalezení účinné dávky PGE1, kterou používá v domácích podmínkách ve formě autoinjekcí před každým plánovaným sexuálním stykem [5]. Účinek léčby PGE1 dosahuje 87–93,5 %. Doporučuje se, aby pacient podstoupil jednou za tři měsíce sonografickou kontrolu s cílem vyloučit fibrotické změny penisu. U aplikace PGE1 se tyto změny vyskytují v četnosti 0,5–2 % a po přerušení léčby mizejí.
Podepsaný informovaný souhlas by měl obsahovat i poučení nemocného, že při 4hodinovém trvání erekce se musí obrátit na konkrétně uvedené urologické pracoviště s nepřetržitým provozem. Komplikací aplikace PGE1 je vznik prolongované erekce (5 %) v délce trvání 4–6 hodin a priapismus (1 %), pokud erekce trvá déle než 6 hodin. Až 20 % pacientů pociťuje bolest po aplikaci, častěji to jsou diabetici [5, 22–25]. Léčbu prolongované erekce i priapismu zajišťuje urologické pracoviště.
Kontraindikací intrakavernózní léčby je aplikace u mužů, kteří mají sklon ke vzniku priapismu (srpkovitá anémie, mnohočetný myelom, leukemie), u nemocných, kteří dostávají antikoagulační léčbu, u mužů trpících induratio penis plastica, dále u mužů s dekompenzovaným diabetem, hypertenzí a srdečním selháním, u pacientů s dobou kratší než tři měsíce po prodělání srdečního infarktu či cévní mozkové příhody; intrakavernózní léčba je dále kontraindikována u nemocných v celkově těžkém stavu, se závažnou psychiatrickou morbiditou, s výrazně sníženým intelektem, se sexuálně přenosnými chorobami [13].
V současné době jsou cílovou skupinou intrakavernózní léčby nejčastěji muži po radikální prostatektomii pro adenokarcinom prostaty. Tito pacienti trpí těžkou ED kombinované etiologie (neurogenní a vaskulární), s poškozením nejen arteriálního přítoku, ale i venookluzivního mechanismu. Většinou dosahují erekce při podávání vyšších dávek PGE1 (15 μg až 20 μg). Jsou dobře spolupracujícími pacienty s velkým zájmem o léčbu. Na druhém místě jsou cílovou skupinou injekční léčby diabetici. Účinná dávka se rovněž blíží 20 μg. Etiologie ED u diabetiků je kombinovaná (neurogenní a vaskulární) [5, 24].
Perorální léčba inhibitory PDE5 dosahuje u mužů s těžkou ED po radikální prostatektomii a u diabetiků přibližně 50–60% účinku. Je zásadním pochybením lékaře, pokud non-respondérům perorální léčby nenabídne injekční léčbu PGE1 [5]. Rozhodnutí podstoupit semikonzervativní léčbu ED pomocí intrakavernózních injekcí by mělo být na pacientovi. Ze svých zkušeností mohu potvrdit, že jeden až dva nemocní z deseti indikovaných pacientů injekční léčbu z různých důvodů podstoupit nechtějí.
Implantace penilní endoprotézy
Třetí linii představuje operační léčba ED: implantace penilní endoprotézy. Pacientům jsou k dispozici semirigidní implantáty a inflatabilní, hydraulické protézy. V roce 1973 popsal dr. Brantley Scott implantaci hydraulické protézy. Tato protéza sestává ze tří částí, jež tvoří: rezervoár tekutiny umístěný v dutině břišní, pumpička implantovaná do skrota a protézy, které se vkládají do peroperačně dilatovaných topořivých těles. Principem funkce hydraulické protézy je uzavřený koloběh tekutiny: při kompresi pumpičky vycestuje tekutina do protézek, čímž dojde ke ztvrdnutí penisu. Glans penis a spongiózní tělesa zůstávají flacidní. Stejným způsobem se postupuje při ukončení takto navozené erekce. Komplikace této metody dosahují v průměru 8 %, infekce se objevuje ve 2–4 %, selhání mechaniky v 5–10 % [23].
Nově může být v jedné době s implantací penilní endoprotézy implantován umělý svěrač močové trubice nemocnému s těžkou ED a zároveň s těžkým stupněm jiným způsobem neléčitelné inkontinence po radikální prostatektomii pro karcinom prostaty. Je zřejmé, že narůstá počet nemocných s diagnostikovaným karcinomem prostaty a radikální prostatektomie je zlatým standardem léčby onemocnění lokalizovaného na orgánu, s předpokládanou dobou přežití 10 let. Až 90 % pacientů po radikální prostatektomii však trpí těžkým stupněm ED a různým stupněm inkontinence [5]. Pouze u posttraumatické arteriální ED u mladých nemocných po poranění pánve je doporučeno provedení penilní revaskularizace s úspěchem 60–70 %. U nemocného indikovaného k penilní revaskularizaci musí být vyloučena kardiovaskulární morbidita i heredita [5, 23].
Prognóza a komplexní přístup k terapii ED
ED zasahuje nejen biologickou podstatu muže, ale i jeho sociální a psychologickou stránku. S prodlužující se délkou života a úspěšnou léčbou KVO a onkologických nemocí bude výskyt poruch erekce narůstat. Do roku 2025 dojde k nárůstu ED ve světovém měřítku o 111 %, v Evropě o 39 %. U mužů ve věku 30–60 let a u diabetiků představuje ED významný rizikový faktor výskytu závažné kardiovaskulární příhody v následujících 2–5 letech. Tito muži by měli být pečlivě vyšetřeni s ohledem na kardiovaskulární morbiditu, která může být často klinicky němá, přesto s sebou nese riziko ohrožení života postiženého.
Léčba ED by dle guidelines měla být zahájena podáváním inhibitorů PDE5. Postavení dříve užívaných léků v léčbě ED (yohimbin, dopaminergní léčiva) je okrajové. Léčba ED inhibitory PDE5 je účinná a bezpečná. Podávání inhibitorů PDE5 je ověřeno patnácti lety jejich používání a množstvím kontrolovaných klinických studií. K dosud užívaným inhibitorům PDE5 – sildenafilu, tadalafilu a vardenafilu – přibyl avanafil, který se vyznačuje rychlejším nástupem účinku. Pro terapii inhibitory PDE5 platí důležitost titrace dávky, správné načasování podání léku, sexuální stimulace a opakované podání pro verifikaci účinku léku. Tím vyloučíme falešné non-respondéry perorální léčby inhibitory PDE5. Přínosem je perorální léčba inhibitory PDE5 u mužů s LUTS, u nemocných s endoteliální dysfunkcí i při rehabilitaci penilní erekce.
Kombinace inhibitorů PDE5 s androgeny zlepšuje účinek inhibitorů PDE5 u mužů s hypogonadismem, zejména u diabetiků. Intrakavernózní léčba PGE1 hraje nezastupitelnou roli u nemocných s těžkou vaskulární a neurogenní etiologií ED, zvláště u diabetiků a mužů po radikální prostatektomii; umožňuje jim návrat erektilní funkce a spokojený partnerský sexuální život. Rozhodně by neměla být opomíjena v nabídce non-respondérům perorální léčby.
Nová metoda léčby rázovou vlnou nízké intenzity, která má potenciálně rehabilitační charakter, vyžaduje další ověření v klinických studiích; první výsledky jsou slibné. Představuje rozšíření léčebných možností pro nemocné s vaskulární etiologií ED, zvláště pro diabetiky. Znalosti o rehabilitaci penisu by se měly dostat do povědomí lékařů, kteří jsou v prvním kontaktu s nemocnými, kandidáty rozvoje ED. Těmi jsou pacienti s kolorektálním karcinomem a karcinomem prostaty, muži po srdečním infarktu či po úrazech míchy a pánve.
Závěr
Ve světle moderních poznatků jsou zřejmá následující fakta.
- S prodlužující se délkou života a vzrůstajícím počtem KVO a onkologických onemocnění dojde do roku 2025 k nárůstu výskytu případů ED v Evropě o 39 %; dosud v ČR trpí ED každý druhý muž ve věku od 35 do 65 let.
- Klíčovou roli v patogenezi ED hraje penilní endoteliální dysfunkce vedoucí k rozvoji ED, která je indikátorem systémové endoteliální dysfunkce a následné koronární příhody.
- ED může být u mužů ve věku 30–60 let a u diabetiků prediktorem závažného, někdy i fatálního KVO, které se rozvíjí v časovém horizontu 2–5 let.
- V první linii léčby ED se již patnáct let nezastupitelně uplatňují inhibitory PDE5. Inhibicí enzymu PDE5 přetrvává v topořivých tělesech ve zvýšené nabídce cGMP, který je klíčový pro navození relaxace hladké svaloviny topořivých těles.
- Bylo prokázáno zlepšení funkce cévního endotelu u nemocných chronicky užívajících inhibitory PDE5.
- Tadalafil byl v roce 2012 zaregistrován v České republice pro léčbu LUTS, v monoterapii zmírňuje LUTS i ED.
- FDA potvrdila avanafil (čtvrtý z inhibitorů PDE5, charakterizovaný rychlejším nástupem účinku) v dubnu 2012, EMA v červnu 2013. Registrační řízení v ČR bylo úspěšně ukončeno.
- K první linii nefarmakologické léčby ED dle EAU patří od roku 2013 nový způsob terapie, který využívá lineární aplikaci rázové vlny nízké intenzity vedoucí k neovaskularizaci.
- V současné době jsou nejčastější cílovou skupinou druhé linie léčby (intrakavernózní aplikace prostaglandinu E1) muži s těžkou ED po radikální prostatektomii a diabetici. Pacientů obou skupin výrazně přibývá.
- Penilní rehabilitace u pacientů s předpokládaným vznikem ED, zejména po pánevních operacích z důvodu onkologické diagnózy, představuje ochranu erekce, prevenci ireverzibilního poškození hladké svaloviny corporum cavernosorum s jejich fibrotickou přestavbou.
Je nutné stále zvyšovat povědomí o ED mezi laickou i odbornou veřejností, a to zejména ve vztahu ED ke kardiovaskulární morbiditě a mortalitě. Na zřeteli je třeba mít kvalitu života mužů trpících ED a kardiovaskulárními či onkologickými chorobami nebo diabetem a účinnou léčbou jim pomoci ED řešit s ohledem na kvalitu života a partnerskou satisfakci.
Seznam použité literatury
- [1] Weiss P, Zvěřina J. Sexuální chování v ČR – situace a trendy. 1. vydání, Portál, Praha 2001; 159.
- [2] Santos T, Drummond M, Botelho F. Erectile dysfunction in obstructive sleep apnea syndrome – prevalence and determinants. Rev Port Pneumol 2012; 18: 64–71.
- [3] Žourková A. Sexuální dysfunkce. In.: Souček M. editor: Vnitřní lékařství II. díl. 1. vydání, Grada-Publishing, Praha 2011; 1571–1577.
- [4] Pohanka M, Stárka L. Erektilní dysfunkce a jejich léčba. 1. vydání, Praha, Maxdorf 2011; 140 s.
- [5] Šrámková T. Poruchy sexuality u somatických onemocnění a jejich léčba. Grada-Publishing, Praha 2013; 216 s.
- [6] Jackson G. Prediction of coronary artery disease by erectile function status: evidence-based data. Sex Med Rev 2013; 1: 104–107.
- [7] Costa C, Virag R. The Endotelial-Erectile Dysfunction Connection: An Essential Update. J Sex Med 2009; 6: 2390–2404.
- [8] Meluzín J, Vašků A, Kincl V, et al. Association of coronary artery disease, erectile dysfunction and endothelial nitric oxide synthase polymorphism. Heart Vessels 2009; 24: 157–163.
- [9] Tamler R, Bar-Chama N. Assessment of endothelial function in the patients with erectile dysfunction: an opportunity for the urologist. J Impot Res 2008; 20: 370–377.
- [10] Kirby M, Jackson G, Betteridge J, et al. Is erectile function marker of cardivascular disease? Int J Clin Pract 2001; 55: 614–618.
- [11] Jackson G, Boon N, Eardley I, et al. Erectile dysfunction and coronary artery disease prediction: evidence-based guidance and consensus. Int J Clin Pract 2010; 64: 848–857.
- [12] Wespes E, Eardley I, Giuliano F, et al. Male sexual dysfunction: Erectile dysfunction ands premature ejaculation. Guidelines EAU 2013. http://www.uroweb.org/gls/pdf/14_Male%20Sexual%20Dysfunction_LR.pdf
- [13] Souhrn informací o přípravku, SmPC www.sukl.cz/modules/medication/
- [14] Goldstein I, McCullough AR, Jones A, et al. A randomized-double-blind, placebo-controlled evaluation of the safety and efficacy of avanafil in subjects with erectile dysfunction. J Sex Med 2012; 9: 1122–1133.
- [15] Aversa A, Vitalec C, Volterrani M, et al. Chronic administration of sildenafil improves markers of endothelial function in men with type 2 diabetes. Diabet Med 2008; 25: 37–44.
- [16] Foresta C, Ferlin A, De Toni L, et al. Circulating endothelial progenitor cells and endothelial function after chronic tadalafil treatment in subjects with erectile dysfunction. Int J Impot Res 2006; 18: 484–488.
- [17] Stárka L. Hormony se vztahem k sexuálním funkcím. In Weiss P., et al. Sexuologie. Grada-Publishing, Havlíčkův Brod, 2010; 69–92.
- [18] Zvěřina J. Některé aktuality v terapii sexuálních dysfunkcí. Psychiatrie pro praxi 2012; 13: 13–14.
- [19] Alba F, Wang R. Current status of penile rehabilitation after radical prostatectomy. Urolog Listy 2011; 9: 24–29.
- [20] Oelke M, Giuliano F, Mirone V, et al. Monotherapy with tadalafil or tamsulosin similarly improved lower urinary tract symptoms suggestive of benign prostatic hyperplasia in an international randomised, parallel, placebo-controlled clinical trials. Euro Urol 2012; 61: 917–925.
- [21] Gruenwald I, Kitrey ND, Appel B, Vardi Y. Low-intensity extracorporeal shock wave therapy in vascular disease and erectile dysfunction: theory and outcomes. Sex Med Rev 2013; 1: 83–90.
- [22] Linet OI. Efficacy and safety of intracavernosal alprostadil in men with erectile dysfunction. N Engl J Med 1996; 334: 873–877.
- [23] Breza J. Erektilné poruchy. 1. vydání, Osveta Martin 1994; 270 s.
- [24] Šrámková T, Mechl M. Prostaglandin E1 Caverject v terapii erektilní dysfunkce. Prakt Lék 1997; 77: 296–301.
- [25] Schramek P. Prostaglandin E1 in Erectile Dysfunction. Efficiency and Incidence of Priapism. Br J Urol 1990; 65: 68–71.