Farmakokinetické parametry – clearance
Souhrn:
Clearance léčiva je parametr, díky němuž můžeme nastavit racionální dávkovací režim při dlouhodobé aplikaci léčiva. Informuje nás o efektivnosti eliminace léčiva, a to jak celkové, tak o eliminaci jednotlivými orgány. Různými mechanismy může docházet ke zvýšení či snížení clearance léčiva.
Key words: clearance, excretion, elimination, drug, renal clearance, hepatic clearance, extraction ratio.
Summary:
Clearance of a drug is a parameter which allows us to set rational dosing regimen for long‑term drug treatment. It informs us about the effectiveness of overall drug elimination and elimination by individual organs. Different mechanisms may lead to an increase or decrease of drug clearance.
Úvod
Farmakokinetické metody se snaží matematickými vztahy vystihnout časovou závislost délky pobytu léčiva v organismu. Vycházejí z analýzy koncentrací léčiva a jeho metabolitů v dostupných tělních tekutinách (nejčastěji krev, moč a sliny). Mezi ně řadíme informace o biologické dostupnosti, o distribuci léčiva v organismu a o rychlosti jeho eliminace [1]. Využíváme je k predikci koncentrace léčiva a k individualizaci dávkování. Takzvaný koncentrační profil léčiva je popsán pomocí základních farmakokinetických parametrů. Ty závisejí na řadě fyziologických i patofyziologických procesů v organismu a na faktorech na straně léčiva.
Parametry rozdělujeme na primární a sekundární. Mezi primární řadíme distribuční objem (Vd) a clearance (CL), jejichž změny lze přímo vysvětlit změnami fyziologických proměnných (jako např. průtokem krve, vazbou na bílkoviny, glomerulární filtrací). Sekundární parametry, jako je biologická dostupnost (F), biologický poločas eliminace (t1/2), plocha pod křivkou plazmatické koncentrace (AUC), závisejí na parametrech primárních [1].
Clearance
Jedná se o parametr udávající objem biologické tekutiny, která se za jednotku času zcela očistí od sledovaného farmaka [1,2]. Charakterizuje vztah mezi eliminací dávky léčiva a jeho koncentrací v biologické tekutině (CL = rychlost eliminace/c). Rychlost eliminace definuje množství léčiva eliminované za jednotku času (mol/s, mg/h). Jednotkou clearance je objem vztažený na jednotku času (l/hod, ml/s, ml/min), někdy se v odborné literatuře můžeme setkat s vyjádřením clearance ve vztahu k tělesné hmotnosti, tedy jaký objem tekutiny se očistí za jednotku času od daného léčiva vztaženého na jednotku hmotnosti, případně na jedince o průměrné hmotnosti 70 kg (l/h.kg–1), nebo vztaženého na jednotku povrchu těla (l/h.m–2) [1,2].
Clearance je nejvýznamnějším parametrem; jestliže chceme zajistit racionální dávkovací režim při dlouhodobé aplikaci léčiva, informuje nás o efektivnosti eliminace. U většiny léčiv usilujeme o udržení ustálené koncentrace léčiva na takové úrovni, která zajišťuje terapeutický efekt [2]. Existují však i výjimky jako např. pulzní podávání aminoglykosidů, kdy je výhodné dosáhnout dostatečně razantní účinné koncentrace (tzv. peak) s následným poklesem (tzv. údolní koncentrace) k nulovým hodnotám před podáním další dávky.
Clearance můžeme použít k odhadu rychlosti eliminace léčiva či rychlosti podání infuze léčiva a k výpočtu udržovací dávky [3].
Celková clearance
Celková clearance (též systémová clearance, CL) odráží celkovou rychlost eliminace léčiva z krve (plazmy) a má aditivní charakter, tj. zahrnuje eliminaci všemi orgány (střevo, játra, ledviny, plíce, aj.) [1,2]. Rozlišujeme pojem renální a nerenální clearance; ta je rozdílem mezi celkovou a renální clearance.
Hodnotu clearance mohou ovlivňovat následující faktory:
- potenciál enzymatické výbavy orgánů zajišťujících biotransformaci léčiva;
- aktivita transportních přenašečů zajišťujících transport léčiva např. do moče, žluči, potu apod.;
- průtok krve (plazmy) eliminačním orgánem [3].
Celková clearance není údajem o tom, kolik léčiva je biotransformováno, ale udává, kolik je ho vyloučeno z organismu, a to jak ve formě aktivní, tak ve formě neaktivních metabolitů [2]. Numerická hodnota CL a jejích dvou nejdůležitějších komponent, renální (CLR) a jaterní (CLJ), umožňuje porovnat úlohu dvou nejdůležitějších orgánů a případný vliv poškození ledvin a jater na rychlost eliminace léčiva, a tím i na jeho dávkování [2].
Renální clearance
Renální clearance je množství
léčiva vyloučené za jednotku času ledvinami, které je
vztaženo na koncentraci látky v krvi [1]. Můžeme ji
také chápat i jako objem krve (plazmy), který se v ledvinách
úplně očistí od léčiva za jednotku času [1,2].
Renální clearance je důležitá pro predikci dávkování
a toxicity léčiv, která jsou vylučována v aktivní,
převážně nezměněné formě (např. atenolol, digoxin,
furosemid, metotrexát), viz tabulku 1, či léčiv,
která mají úzké terapeutické okno (aminoglykosidy) [2]. Některá
léčiva mohou splňovat obě podmínky (např. aminoglykosidová
antibiotika či lithium).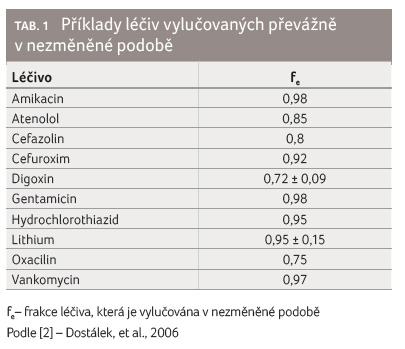
Renální exkrece zahrnuje procesy glomerulární filtrace (GF), aktivní tubulární sekrece a aktivní či pasivní tubulární reabsorpce. Glomerulární filtrace a tubulární sekrece CLR zvyšují, zatímco tubulární reabsorpce CLR snižuje.
Glomerulární filtrace
Fyziologické rozmezí pro rychlost GF je 80–120 ml/min, GF se v praxi měří pomocí clearance endogenní látky – kreatininu. Další možností je vyšetření sérového cystatinu C, senzitivního endogenního markeru GF. Výhodou je stanovení z jediného vzorku séra, vysoká senzitivita (vzestup koncentrace cystatinu C již při hodnotách kreatininové clearance 80 ml/min). V běžné ambulantní praxi tyto způsoby stanovení GF plně nahradily vyšetření clearance kreatininu pomocí sběru moči za 24 hodin [4]. Proces GF je vymezen velikostí pórů, které dovolují prostup pouze molekulám, jež jsou menší, než je průměr póru (Mr < 65 000 Da) [2]. Prostupovat tedy mohou pouze léčiva volná, nevázaná na plazmatické proteiny (Mr albuminu je 68 000 Da). Neprofiltrovaný podíl léčiva se dostává do peritubulárních kapilár proximálního tubulu, odkud může být transportován do moče aktivním transportem – tubulární sekrecí [2].
Tubulární sekrece
Tubulární sekrece je aktivní
transport látek z krve skrz epiteliální membrány do lumen
tubulů. Tubulární sekrece napomáhá rychlejšímu vyloučení
látek, které se glomerulární filtrací nepřefiltrují úplně.
Někdy však může být jediným způsobem vyloučení látky z těla
(viz tab. 2). Aktivní
transport je realizován dvěma nezávislými systémy přenašečů:
pro organické kyseliny (anionty) a pro organické báze
(kationty). Na této úrovni transportu mohou látky
o transportní přenašečový systém navzájem soutěžit.
Tento proces může probíhat obousměrně (z lumina tubulů
do krve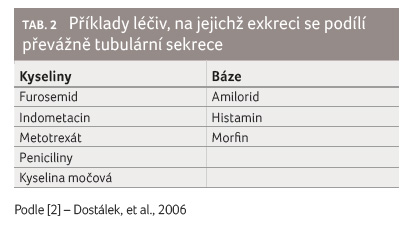 a naopak − aktivní tubulární
reabsorpce a sekrece), je saturabilní a nebývá přísně
specifický (stejným přenašečovým systémem mohou být přenášeny
různé látky). Příkladem může být užití thiazidového
diuretika u nemocného trpícího dnou, kde je plazmatická
koncentrace kyseliny močové zvýšená a přenašečový
systém do značné míry saturován, zvýšením plazmatické
koncentrace kyseliny močové tak může být vyvolán dnavý
záchvat. Pokud dojde ke vzájemnému soutěžení léčiv
o přenašečové molekuly, výsledkem může být snížení
exkrece obou léčiv. Nesteroidní antiflogistika tak kompeticí
zvyšují toxické projevy metotrexátu, které se mohou manifestovat
jako leukopenie, trombocytopenie, anémie, nefrotoxicita [2,5].
Zvýšenou toxicitu metotrexátu lze očekávat u pacientů
léčených vyššími nebo vysokými dávkami v onkologických
indikacích (obvykle při aplikaci dávek > 150 mg
denně) a v případě pacientů s poruchou funkce
ledvin i při podávání dávek nižších.
a naopak − aktivní tubulární
reabsorpce a sekrece), je saturabilní a nebývá přísně
specifický (stejným přenašečovým systémem mohou být přenášeny
různé látky). Příkladem může být užití thiazidového
diuretika u nemocného trpícího dnou, kde je plazmatická
koncentrace kyseliny močové zvýšená a přenašečový
systém do značné míry saturován, zvýšením plazmatické
koncentrace kyseliny močové tak může být vyvolán dnavý
záchvat. Pokud dojde ke vzájemnému soutěžení léčiv
o přenašečové molekuly, výsledkem může být snížení
exkrece obou léčiv. Nesteroidní antiflogistika tak kompeticí
zvyšují toxické projevy metotrexátu, které se mohou manifestovat
jako leukopenie, trombocytopenie, anémie, nefrotoxicita [2,5].
Zvýšenou toxicitu metotrexátu lze očekávat u pacientů
léčených vyššími nebo vysokými dávkami v onkologických
indikacích (obvykle při aplikaci dávek > 150 mg
denně) a v případě pacientů s poruchou funkce
ledvin i při podávání dávek nižších.
Velikost renální clearance umožňuje úvahy o mechanismu vylučování léčiv, např. renální clearance ampicilinu (283 ml/min) vysoko převyšuje velikost GF, můžeme proto uvažovat o významném příspěvku tubulární sekrece k eliminaci léčiva ledvinami [1].
Tubulární resorpce
Tubulární resorpce (nebo reabsorpce) se děje buď pasivním, nebo aktivním transportem. Její primární význam spočívá v udržení volumu tekutin v organismu za jakýchkoliv podmínek. Pasivní tubulární resorpce je děj, při kterém dochází ke zpětnému vstřebávání značného množství vody. Přibližně 99 % vody, která je glomerulem filtrována, je pasivně reabsorbováno zpět do krve, což znamená, že definitivní moč tvoří přibližně 1 % množství primární moči [2].
V důsledku reabsorpce vody z tubulu dojde ke zvýšení koncentrace vylučovaného léčiva, které může na základě takto vzniklého koncentračního gradientu prostupovat zpět do krve [2]. Pasivní reabsorpce je důležitá zejména pro léčiva, která jsou charakterizována jako slabé kyseliny a slabé báze, což je většina léčiv podávaných do organismu. V závislosti na pH prostředí se mohou vyskytovat v ionizované či neionizované formě. Úpravou pH moči lze zvýšit jejich exkreci; acidifikace moči (vyvolaná např. vysokými dávkami vitaminu C) může zvýšit exkreci zásaditých léčiv (např. amitriptylin), která se budou nacházet v ionizované formě, a současně zvýšit reabsorpci látek kyselé povahy. Obdobně alkalizace moči může zvýšit exkreci kyselých léčiv a zvýšit reabsorpci látek zásadité povahy (amfetamin) [6]. Lze podat například bikarbonát sodný, který alkalizuje moč, a urychlit tak vylučování kyseliny acetylsalicylové při jejím předávkování [7].
Kumulace léčiv u pacientů s onemocněním ledvin
Léčivo, které je z velké části vylučováno nemetabolizované do moči a má vysokou hodnotu CLR (≥ 0,1 ml/min), se v organismu nemocných se sníženou funkcí ledvin kumuluje. K významné kumulaci u takto nemocných může dojít i u léčiv, která jsou eliminována v nezměněné formě ledvinami z více než 30 %. Musí být proto prodloužen dávkovací interval, ev. i snížena jednotlivá dávka, případně kombinace obou metod [1]. Navíc je potřeba sledovat i renálně eliminované aktivní metabolity; příkladem je morfin, pethidin nebo spironolakton. Morfin 6 glukuronid, metabolit morfinu, může vést k útlumu dechového centra; aktivní metabolit pethidinu normeperidin může v důsledku kumulace způsobit křeče; kanreonát, metabolit spironolaktonu, je vylučován renálně a při snížené funkci ledvin působí hyperkalemii [8].
U nemocných s chronickým
selháváním ledvin (chronic kidney disease, CKD) dochází k mnoha
změnám v organismu, například v kardiovaskulárním
systému, pacienti jsou pak léčeni kombinací mnoha léčiv (tab. 3) a jsou ve zvýšené míře ohroženi
nežádoucími účinky a lékovými interakcemi [9].
Většina antibiotik podávaných v běžné praxi (betalaktamy, makrolidy, tetracykliny, chinolony, linkosamidy) patří mezi relativně málo nefrotoxická a jejich dávkování není obvykle nutné zásadněji upravovat [4]. Naopak redukce dávek často vede k riziku poddávkování a selhání terapie, což může nemocného poškodit více než případné zhoršení renální funkce. Ovšem je třeba zároveň upozornit na to, že dávkování doporučená v souhrnu údajů o přípravku (SPC) často vycházejí z citlivosti patogenů i před dvaceti lety a neodrážejí současný stav, kdy dochází k nárůstu rezistence mikrobů a k nutnosti podávání vyšších dávek antibiotik [4]. Mezi antibiotika, jejichž dávkování je nutné upravit, patří zejména aminoglykosidy (gentamicin, amikacin) a vankomycin [4]. Účinným nástrojem, jak snížit riziko nefrotoxicity aminoglykosidů, je tzv. pulzní podávání [10]. Vyšší dávka podávaná v prodlouženém intervalu, obvykle jedenkrát denně, zajistí dostatečný vzestup koncentrací pro baktericidní účinek, koncentrace před následující dávkou naopak klesají k nulovým hodnotám [10].
Mezi nejčastěji užívaná analgetika patří nesteroidní antiflogistika (NSAID), která představují významné nefrotoxiny, jejichž mechanismus nefrotoxicity je kombinovaný – především dochází ke snížení produkce prostaglandinů, jež garantují renální perfuzi, zároveň však vykazují i tubulotoxický a glomerulotoxický efekt [4]. Je li podávání NSAID nevyhnutelné, je nutné pravidelně kontrolovat renální funkce. V současnosti hojně užívanou kombinaci paracetamol/tramadol je možno hodnotit při krátkodobém podávání jako bezpečnou [4]. Inhibitory cyklooxygenázy 2 (COX 2) nejsou při renálním onemocnění bezpečnější volbou [4]. Většina opiátů je při krátkodobém podávání bezpečná (např. fentanyl), ale například u morfinu dochází po opakovaném podávání ke kumulaci aktivních metabolitů a k riziku vzniku křečí [4].
Podávání metforminu bylo pro riziko vzniku laktátové acidózy dlouho považováno za kontraindikované při poklesu GF pod 60 ml/min, aktuálně se terapie metforminem považuje za přípustnou až do stadia CKD G3a, někteří autoři připouštějí podávání až do GF ≈ 30 ml/min za předpokladu dobré spolupráce pacienta a přerušení podávání metforminu v případě situací zvyšujících riziko vzniku laktátové acidózy (horečnaté stavy, nadměrná fyzická zátěž) [4]. Deriváty sulfonylurey (gliklazid, glimepirid, glibenklamid) jsou transformovány na renálně eliminované metabolity, jejich kumulace při renálním selhání může vést k těžkým protrahovaným hypoglykemiím [4]. Ze skupiny inhibitorů dipeptidyl peptidázy 4 (DPP 4) je nejvýhodnější linagliptin, který je eliminován z největší části hepatálně, může tak být podáván při onemocnění ledvin bez redukce dávky [4]. Inzulin, který se normálně odbourává v ledvinách, má u pokročilé renální insuficience prodloužený poločas rozpadu [9].
Warfarin je možno podávat ve všech stadiích renálního onemocnění, ovšem v poslední době se upozorňuje na riziko jeho nefrotoxicity (warfarin induced nephropathy) a na riziko vzniku vzácné, ale potenciálně fatální komplikace v podobě kalcifikující uremické arteriolopatie [4]. Použití nových antikoagulancií je omezeno, podávání dabigatranu je nutno zcela ukončit při zhoršení renální funkce do stadia CKD G4 (při GF < 30 ml/min), inhibitory faktoru Xa (rivaroxaban a apixaban) je možné podávat v redukovaných dávkách i ve stadiu CKD G4, ve stadiu G5 (při GF < 15 ml/min) zatím není jejich užívání doporučeno [4].
Důležitá jsou obecně preventivní opatření, např. hydratace (při podávání kontrastní látky), předcházení hypokalemii, hypokalcemii nebo hypomagnezemii (při podávání aminoglykosidů) či zvyšování pH moči (při podávání metotrexátu ve vyšším dávkování) [5]. Cílená změna pH moči se může využít při otravách, aby se urychlilo vylučování jedovaté látky – například okyselení moči při otravě metamfetaminem, alkalizace při otravě fenobarbitalem [11].
Snížení clearance se promítne do velikosti eliminační konstanty, biologický poločas eliminace bude prodloužen.
Jaterní clearance
Játra jsou bohatě prokrvena, protéká jimi až 25 % srdečního výdeje, což je asi 1,5 litru krve za minutu [2]. Játry jsou vylučovány zejména konjugáty s kyselinou glukuronovou, velmi zřídka jsou vylučována nekonjugovaná léčiva [2]. Mechanismem, kterým se játra na exkreci léčiv podílejí, je aktivní transport, méně často se uplatňuje prostá difuze na základě ustaveného koncentračního gradientu mezi membránami hepatocytu [2]. Vylučovaná látka prostupuje dvěma membránami hepatocytu, pólem krevním a pólem žlučovým [2]. Většina konjugátů je při fyziologickém pH ionizována, což ulehčuje jejich aktivní transport do žluče. Žluč pak obsahuje desetkrát vyšší koncentraci xenobiotik a především jejich konjugátů než krev [2]. Je však třeba si uvědomit, že v tenkém střevě může docházet ke štěpení konjugátů xenobiotik a k jejich reabsorpci zpět do krve, zejména v distální části ilea [2]. Jedná se o enterohepatální cirkulaci, která je popisována například u digoxinu, což přispívá k delšímu setrvávání terapeutických plazmatických koncentrací [2].
Jaterní clearance je množství léčiva extrahované z krve játry za jednotku času vztažené na koncentraci látky v portální krvi:
CLJ = Q. (Cin – Cout) / Cin
Cin – koncentrace léčiva v krvi při vstupu do orgánu (ve v. portae); Cout – koncentrace v krvi z orgánu vytékající (ve v. hepatica); (Cin – Cout)/Cin– extrakční poměr (E); Q – objemová rychlost průtoku krve játry (1,5 l/min, 90 l/h)
U látek s vysokou jaterní extrakcí se Cout blíží nule a extrakční poměr (E) se blíží hodnotě 1, u látek s nízkou extrakcí se Cout blíží Cin a E je velmi nízký (blíží se nule). Některá léčiva jsou extrahována játry velmi efektivně již při prvním průchodu, po perorálním podání se do systémového oběhu dostane jen malá část dávky (< 40 %, ale u mnoha léčiv i méně než 10 %). Hovoříme o významném efektu prvního průchodu játry (first pass effect), např. u betablokátorů (metoprolol, karvedilol), felodipinu, nitrendipinu, midazolamu, simvastatinu, morfinu, esomeprazolu, rabeprazolu a dalších léčiv. Dávkování musí být při zhoršené funkci jater sníženo na polovinu až třetinu, protože biologická dostupnost po perorálním podání stoupá a CLJ klesá, což se projeví vyššími sérovými koncentracemi [1].
Eliminace léčiv játry je ovlivněna
několika faktory: množstvím a funkcí hepatocytů
a rychlostí, kterou je léčivo do orgánu přiváděno
(průtokem krve jaterní tkání) [1,2]. Tyto faktory mohou být
ovlivněny v důsledku různých jaterních onemocnění
rozdílným způsobem (tab. 4).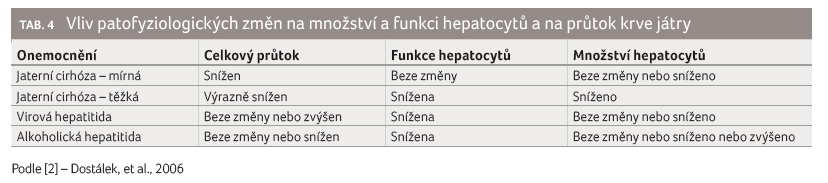
Podle hodnoty E lze rozhodnout, je li pro eliminaci léčiva rozhodující průtok krve játry (E > 0,7), nebo funkce parenchymu (E < 0,3) – viz tabulky 5, 6.
Chronická jaterní onemocnění
redukují celkový počet hepatocytů, které fungují normálně
a jsou normálně perfundovány [2]. Existují léčiva, u nichž
dochází k významnému ovlivnění metabolismu při chronickém
onemocnění jater, uveďme např. cefoperazon, diazepam,
metronidazol, metoprolol, teofylin či verapamil [2].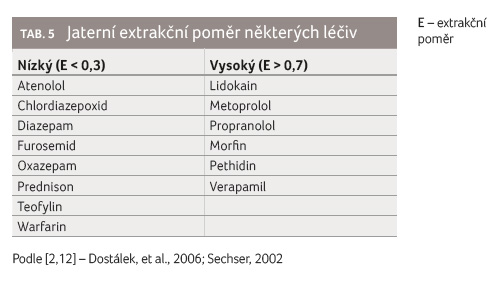
Pro značnou složitost, někdy
i protichůdných změn farmakokinetiky, může být predikce
účinku farmaka obtížná a farmakodynamika značně
variabilní [12]. V klinické praxi nemáme jednoduché nástroje
k optimalizaci dávkování farmak u onemocnění jater.
Predikce závažnosti jaterní insuficience na základě
aktivity jaterních enzymů není vhodná. Určení rozsahu
metabolické poruchy určitého léčiva se komplikuje značnou
funkční rezervou a dobrou regenerační schopností jater
[12]. Hypoalbuminemie se objevuje u pokročilého onemocnění
jater a může dojít k poklesu vazby farmak na plazmatické
bílkoviny a tím k riziku zvýšení toxicity farmaka pro
zvětšení množství volné frakce (např. u fenytoinu nebo
prednisolonu). Hemokoagulační porucha u jaterních onemocnění
vzniká v důsledku poklesu syntézy koagulačních faktorů,
s rizikem zvýšené citlivosti těchto nemocných na perorální
antikoagulancia. Jaterní encefalopatie při těžké formě
jaterního onemocnění může být důsledkem zhoršení mozkové
funkce v návaznosti na podání některých farmak:
sedativ, opioidních analgetik, léků vedoucích k obstipaci,
diuretik vyvolávajících hypokalemii (furosemid) [12]. Otoky
a ascites mohou být vyvolány retencí tekutin v důsledku
podávání nesteroidních antiflogistik a kortikoidů.
Hepatotoxicita může vznikat v důsledku poškození závislém
na dávce, ale i idiosynkraticky. Doporučeným postupem je
tato farmaka, u nichž je v SPC uvedena hepatotoxicita či
kontraindikace podání, prostě nepodávat [12]. Jde o skupinu
farmak poměrně široce používaných, jako jsou např.
antidepresiva typu fluoxetin, paracetamol, metotrexát, soli zlata
a další [12].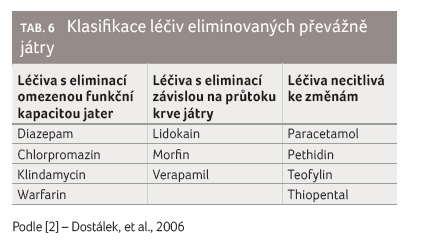
Faktory ovlivňující clearance
- tělesná hmotnost;
- povrch těla;
- onemocnění eliminačních orgánů: ledvin, jater;
- onemocnění orgánů, které léčivo přímo neeliminují, ale ovlivňují další parametry: při akutním nebo chronickém selhávání myokardu může být snížen průtok krve eliminačními orgány, hypoxemie pro nedostatečnou funkci plic může vést k poruše biotransformačních enzymů;
- genetický polymorfismus: ovlivňuje nejen aktivitu enzymových systémů biotransformujících nebo transportujících léčiva a odpověď organismu na podávané léky, ale i clearance léčiv;
- lékové interakce: clearance léčiv se může změnit blokádou exkrečních enzymů v ledvinách (např. kombinace salicylátů s metotrexátem vede k poklesu jeho clearance), změnami pH moči, enzymovou inhibicí nebo indukcí v játrech;
- vazba léčiv na bílkovinné struktury: vytěsnění léčiva z transportní vazby a zvýšení volné frakce, která se snadněji vylučuje. To může vést u látek vylučujících se glomerulární filtrací nebo u látek, které se biotransformují v játrech a mají nízkou extrakční frakci E, ke zvýšení clearance. Clearance látek vylučujících se tubulární sekrecí není většinou změnou vazebnosti ovlivněna, stejně jako clearance látek s vysokou hepatální frakční extrakcí;
clearance může být zvýšena u léčiv s enterohepatálním oběhem, pokud se léčivo v gastrointestinálním traktu váže na jiné léčivo a zablokuje se tak jeho enterohepatální oběh. Proto je přímo kontraindikováno podávat např. vysoké dávky carbo medicinalis (asi 10 g a více) u lidí léčených jakýmkoliv lékem podávaným perorálně.
Závěr
Clearance je nejdůležitější faktor určující koncentrace léků a patří mezi primární farmakokinetické parametry. Nemoci mohou modifikovat tyto parametry a schopnost predikce účinku chorobných stavů na farmakokinetické parametry je důležitá pro příslušnou úpravu dávkování. Abnormální clearance lze předpokládat, pokud má pacient poškozené funkce ledvin, jater nebo srdce. V případě léčiv vylučovaných primárně ledvinami existuje korelace mezi clearance léčiva a funkčním stavem ledvin, této znalosti lze využít při individualizaci dávkování. Clearance kreatininu může být vhodným kvantitativním indikátorem renální funkce, a naopak, clearance léku může být indikátorem funkčních důsledků selhání srdce, ledvin nebo jater. Avšak jaterní onemocnění nemusí vždy ovlivňovat jaterní vnitřní clearance. V současnosti není k dispozici žádný spolehlivý ukazatel schopnosti jater metabolizovat léky, který by se mohl použít k predikci změn jaterní clearance podobným způsobem, jakým se používá clearance kreatininu jako marker renální clearance léku. Celková clearance rozhoduje o koncentraci léčiva v krvi v ustáleném stavu při opakovaném perorálním podání nebo při kontinuální infuzi léčiva, může být použita pro výpočet udržovací dávky nebo rychlosti infuze, které jsou potřebné pro udržování cílové koncentrace léčiva v krvi v ustáleném stavu.
Seznam použité literatury
- [1] Wikiskripta, Matematický popis farmakokinetických procesů. Dostupné na: http://www.wikiskripta.eu/index.php/Matematick%C3%BD_popis_farmakokinetick%C3%BDch_proces%C5%AF
- [2] Dostálek M a kol. Farmakokinetika. Praha: Grada Publishing, 2006; 142–157, 189–207.
- [3] Vlček J, Fialová D, a kol. Klinická farmacie I. Praha: Grada Publishing, 2010; 60−63.
- [4] Hrnčiříková A, Vachek J. Nebezpečné léky u nemocných s renálním poškozením – kdy a jak redukovat dávky. Med praxi 2016; 13: 176–179.
- [5] Doseděl M. Nežádoucí účinky a lékové interakce nesteroidních antiflogistik a jejich management pohledem farmaceuta. Praktické lékárenství 2014; 10: 92−94.
- [6] Dušek K, Večeřová‑Procházková A. Diagnostika a terapie duševních poruch: 2., přepracované vydání, Praha: Grada Publishing, 2015; 523.
- [7] Trejtnar F. Základní mechanismy transportu léčiv v organismu: Remedia 2016; 26: 460−463.
- [8] Zakiyanov O, Vachek J, Tesař V. Farmakoterapie při chronickém onemocnění ledvin, Kardiologická revue. Interní Med 2014; 16: 53−56.
- [9] Vachek J, Tesař V. Farmakoterapie u pacienta se sníženou funkcí ledvin. Interní Med 2010; 12: 18–21.
- [10] Stará D. Specifika podávání léčiv pacientům s chronickým onemocněním ledvin. Praktické lékárenství 2015; 11: 170–173.
- [11] Lüllmann H, a kol. Barevný atlas farmakologie, 4. přepracované vydání. Praha: Grada Publishing, 2012; 42.
- [12] Sechser T. Farmakoterapie u pacientů s onemocněním jater. Buletin HPB 2002; 10. Dostupné na: http://www.hpb.cz/index.php? pId=02‑2‑3‑04