Farmakoterapie Alzheimerovy choroby
Alzheimerova choroba (ACH) je závažné neurodegenerativní onemocnění manifestující se klinicky syndromem demence a končící letálně. V současné době ještě neznáme plně etiologii ACH, proto můžeme léčit tím způsobem, že ovlivňujeme jednotlivé známé patogenetické články nemoci. Taková terapie chorobu nevyléčí, ale zpomalí průběh demence a zkvalitní život postižených. Založeny na důkazech jsou dva postupy: léčba inhibitory mozkových cholinesteráz a léčba inhibitorem glutamátergních receptorů typu NMDA memantinem. V článku jsou zmíněny i další postupy, jejichž použití však není dostatečně založeno na důkazech, i přístupy, které jsou v současné době ověřovány a z nichž některé se jeví jako perspektivní.
Alzheimerova choroba je závažné neurodegenerativní onemocnění, které se klinicky manifestuje syndromem demence. Jedná se o nejčastější příčinu demence vůbec. Tato nemoc končí letálně, patří mezi jednu z nejčetnějších primárních příčin smrti. V ČR trpí Alzheimerovou chorobou přibližně 70 000 lidí (přesné statistiky neexistují, pravděpodobné číslo je ještě vyšší).
Alzheimerovu chorobu neumíme v současnosti léčit kauzálně, není známa primární příčina nemoci. Je však známo více patogenetických článků, mezi nimiž jsou hledány souvislosti a vzájemná podmíněnost. Velmi významným patogenetickým faktorem, který je pokládán za stěžejní, je produkce a ukládání patologického proteinu beta-amyloidu (Aβ). Tato látka je tvořena z transmembránově uloženého amyloidového prekurzorového proteinu (APP). Za normálních okolností je APP štěpen převážně enzymem α-sekretázou na krátké solubilní fragmenty 1–39 aminokyselin (AMK); pouze malá část je štěpena následně enzymy β- a gamma-sekretázami, které odštěpují delší fragmenty – 40–42 AMK. Odštěpené fragmenty z APP (β-peptidy) jsou solubilní a mají své fyziologické role, dosud nedostatečně objasněné, mj. při tvorbě nových dendritických trnů, a tudíž nových synapsí. V případě Alzheimerovy choroby však štěpí většinu APP β- a gamma-sekretázy, vzniká nadbytek delších fragmentů, které nejprve oligomerují. Tyto oligomery jsou výrazně neurotoxické, toxičtější než vlastní Aβ. Až později tyto oligomery koagulují v mezibuněčných prostorách mozkové kůry, polymerují, a tím je vytvořen vlastní beta-amyloid. Drúzy Aβ se stávají centry neurodegenerativních útvarů nazývaných alzheimerovské plaky. V oblasti plaků dochází k projevům zánětu, jsou uvolňovány reaktanty akutní fáze zánětu (interleukiny aj.), volné kyslíkové radikály, dochází k aktivaci zánětlivých enzymů cyklooxygenáz. V okolí plaků se nachází detritus odumřelých neuronů a jejich výběžků. Platí přímá úměra mezi počtem plaků a funkčním postižením, tedy tíží demence.
Dalším významným patogenetickým faktorem je degradace intraneuronálního proteinu tau. Tento s mikrotubuly spojený protein je hyperfosforylován, postižená neuronová vlákna polymerují, tvoří párově heliakální filamenta, která jsou podkladem tzv. neurofibrilárních tangles (uzlíčků, košíčků). Postižené neurony podléhají apoptóze. Hyperfosforylaci proteinu tau spouští aktivovaný enzym GSK-3β(glykogen syntáza kináza 3β) za účasti enzymu CDK 5 (cyklin dependentní kináza 5). Tento děj je pravděpodobně spouštěn toxickými oligomery beta-peptidu. Acetylcholinergní systém je prvním neurotransmiterovým systémem, který je u Alzheimerovy choroby postižen. Bývá přítomen deficit enzymu cholinacetyltrans- ferázy, který syntetizuje acetylcholin z cholinu a z acetylkoenzymu A. Omezeno je také zpětné vychytávání cholinu ze synaptické štěrbiny. Dalším mechanismem, který přispívá k acetylcholinergnímu deficitu, je zvýšená tvorba butyrylcholinesterázy, rovněž odbourávající acetylcholin, na jejíž tvorbě se podílejí aktivované gliové elementy v oblasti plaků. Acetylcholinergní systém je nezbytný pro paměťové mechanismy, zejména pro krátkodobou paměť a konsolidaci (vštípivost nových informací).
Dalším postiženým neurotransmiterovým systémem je systém glutamátergní. Dochází k nadměrnému uvolnění glutamátu a dalších excitačních aminokyselin a v nejpostiženějších korových oblastech (hipokampy aj.) dochází ke sníženému zpětnému vychytávání glutamátu. Glutamát se tak nadměrně váže na receptory, mj. na ionotropní receptor typu NMDA (N-methyl-D-aspartátový receptor). Dochází pak k nadměrnému otevření kalciových kanálů, ke zvýšenému vstupu kalcia do neuronů, k aktivaci proteinkináz a fosfatáz a k následné kaskádě dějů, mezi něž patří zvýšení exprese některých nežádoucích genů, a v konečném důsledku k neuronální apoptóze. Navíc NMDA-receptory realizují jeden ze základních dějů učení – dlouhodobou potenciaci; tento mechanismus je hyperexcitací NMDA-receptorů rušen.
U Alzheimerovy choroby je zjišťován nedostatek některých antiapoptotických faktorů a nadbytek faktorů působících proapoptoticky. Bývá např. prokázána nižší produkce faktoru CREB (cAMP response element binding protein – protein vázající se v genomu na element zodpovědný za odezvu na cAMP), a v důsledku toho nižší tvorba nervového růstového faktoru BDNF (brain-derived neurotrophic factor). Obdobně dochází ke snížené tvorbě dalších nervových růstových faktorů. Vyskytuje se však také úbytek receptorů pro nervové růstové faktory (TrK-receptory – receptory aktivující tyrozinkinázu), což dále vede ke snížení neuronální plasticity – ke snížené tvorbě dendritických trnů, nových synapsí, nových neuronových okruhů. Pravděpodobně také dochází ke snížení neurogeneze. Zvyšuje se hladina toxicky působícího intermediátu metabolismu methioninu – homocysteinu.
Další změny bývají zjišťovány v mitochondriích, na úrovni enzymů dýchacích řetězců, což má za následek sníženou tvorbu makroergních vazeb, menší energetickou suplementaci mozku. Vlivem uvolněných volných radikálů dochází jednak k poškození mitochondriálních funkcí, jednak k poškození neuronálních membrán. Je sledována řada genetických faktorů. V případě výskytu familiární ACH (řádově několik procent pacientů s Alzheimerovou nemocí) bývají zjišťovány mutace na dlouhém raménku chromozomu 21 (gen pro APP) a na chromozomech 14 nebo 1 (gen pro transmembránový protein presenilin 1, resp. presenilin 2 – součásti enzymů gamma-sekretáz). Přítomnost izoformy 4 apolipoproteinu e je považována za rizikový, avšak nikoli nezbytný faktor. Genetických polymorfismů jako rizikových faktorů choroby je však sledováno více. V poslední době je sledována souvislost metabolického syndromu nebo jeho některých komponent a Alzheimerovy choroby. Bývá zjišťována zvýšená inzulinová rezistence, což má následně vliv na produkci Aβ. Patogenetických faktorů (nebo potenciálních patogenetických faktorů) je u ACH více. Je sledována jejich vzájemná provázanost a podmíněnost. Teprve poznání těchto vzájemných vztahů nám umožní správnou diagnostiku a efektivní terapii.
Současné možnosti farmakoterapie Alzheimerovy choroby
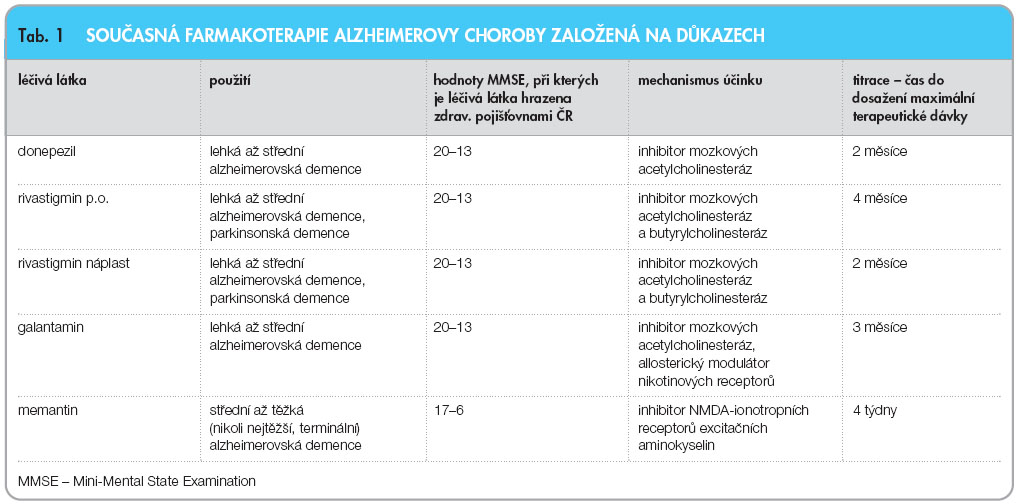 V současné době jsou v klinickém užívání pouze dvě skupiny látek, jejichž použití je založeno na důkazech (evidence-based). Od podání farmak z těchto dvou skupin očekáváme zpomalení progrese demence, oddálení těžkých stadií demence, oddálení doby, kdy jsou postižení pacienti umisťováni do léčebných zařízení nebo do zařízení sociální péče. Přehled současné farmakoterapie je uveden v tab. 1.
V současné době jsou v klinickém užívání pouze dvě skupiny látek, jejichž použití je založeno na důkazech (evidence-based). Od podání farmak z těchto dvou skupin očekáváme zpomalení progrese demence, oddálení těžkých stadií demence, oddálení doby, kdy jsou postižení pacienti umisťováni do léčebných zařízení nebo do zařízení sociální péče. Přehled současné farmakoterapie je uveden v tab. 1.
Postupy založené na důkazech ve farmakoterapii Alzheimerovy choroby
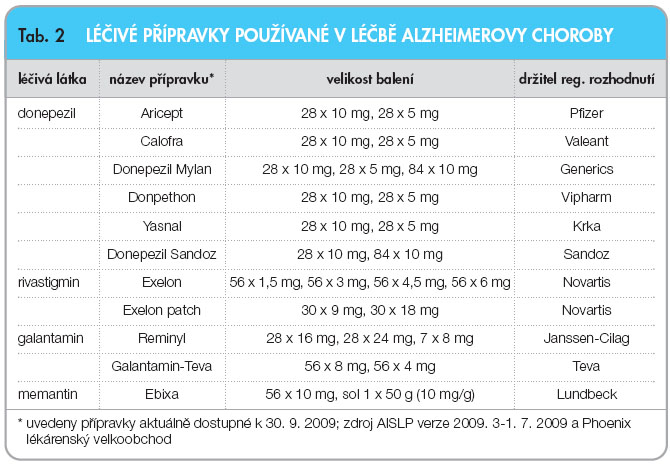 První skupinu reprezentují tzv. kognitiva – inhibitory mozkových acetyl- i butyrylcholin-esteráz. Tyto látky zlepšují acetylcholinergní transmisi tím, že blokují enzymy, které acetylcholin odbourávají. Tyto látky jsou určeny pro lehké až střední demence na podkladě AD (Alzheimerova demence), ale studie prokázaly účinky i u těžších alzheimerovských demencí. Zdravotní pojišťovny ČR hradí z větší části tato farmaka, pokud se hodnota testu MMSE (Mini-Mental State Examination, celosvětově nejužívanější orientační test kognitivních funkcí) pohybuje mezi 20–13 body. V mnoha zemích jsou tyto látky hrazeny již při hodnotě testu 24 bodů, což je výhodné pro pacienty – čím dříve se začne léčit, tím lépe.
První skupinu reprezentují tzv. kognitiva – inhibitory mozkových acetyl- i butyrylcholin-esteráz. Tyto látky zlepšují acetylcholinergní transmisi tím, že blokují enzymy, které acetylcholin odbourávají. Tyto látky jsou určeny pro lehké až střední demence na podkladě AD (Alzheimerova demence), ale studie prokázaly účinky i u těžších alzheimerovských demencí. Zdravotní pojišťovny ČR hradí z větší části tato farmaka, pokud se hodnota testu MMSE (Mini-Mental State Examination, celosvětově nejužívanější orientační test kognitivních funkcí) pohybuje mezi 20–13 body. V mnoha zemích jsou tyto látky hrazeny již při hodnotě testu 24 bodů, což je výhodné pro pacienty – čím dříve se začne léčit, tím lépe.
-
Donepezil je poměrně velmi čistý inhibitor acetylcholinesteráz bez podstatného ovlivnění butyrylcholinesteráz. Je obecně velmi dobře tolerován, má dlouhý poločas odbourávání (více než 70 hod.), což umožňuje podání 1krát denně. Obvyklé dávkovací schéma je první měsíc 1krát denně 5 mg perorálně, při dobré toleranci od druhého měsíce 1krát 10 mg/den. Řada klinických studií zjistila účinnost donepezilu také u některých non-alzheimerovských demencí (vaskulární, parkinsonské demence), kde však není hrazen zdravotními pojišťovnami ČR.
-
Rivastigmin je inhibitor jak acetyl-, tak i butyrylcholinesteráz. Při perorálním podání je nutné dávkování 2krát denně. Dávka se titruje tak, že první měsíc se podává 2krát denně 1,5 mg, druhý měsíc 2krát denně 3,0 mg, třetí měsíc 2krát 4,5 mg a dále 2krát 6,0 mg/den. V letošním roce proběhlo kategorizační řízení s lékovou formou náplasti (patch). Výhodou této lékové formy je jednorázové denní podání a rychlá titrace dávky, která probíhá tak, že první měsíc odpovídá denní dávka získaná z náplasti přibližně 5 mg, druhý měsíc přibližně 10 mg. Tím, že je obcházen gastrointestinální trakt, jsou minimalizovány gastrointestinální nežádoucí účinky. Navíc je hladina léčiva v krvi udržována plynuleji, bez větších výkyvů. Rivastigmin je kromě Alzheimerovy choroby (včetně varianty s Lewyho tělísky, kde dobře ovlivňuje psychotické příznaky) určen také k terapii demence u Parkinsonovy choroby.Galantamin je inhibitor acetylcholinesteráz i allosterický
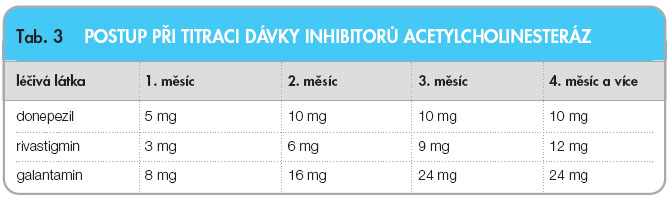 modulátor nikotinových receptorů. Podává se 1krát nebo 2krát denně, titrace probíhá tak, že první měsíc je podáváno per os 8 mg (2krát denně 4 mg), druhý měsíc 16 mg (2krát denně 8 mg) a od třetího měsíce 24 mg (2krát denně 12 mg). Tolerance galantaminu je obecně dobrá. Souhrnný postup při titraci dávky inhibitorů acetylcholinesteráz je uveden v tab. 3.
modulátor nikotinových receptorů. Podává se 1krát nebo 2krát denně, titrace probíhá tak, že první měsíc je podáváno per os 8 mg (2krát denně 4 mg), druhý měsíc 16 mg (2krát denně 8 mg) a od třetího měsíce 24 mg (2krát denně 12 mg). Tolerance galantaminu je obecně dobrá. Souhrnný postup při titraci dávky inhibitorů acetylcholinesteráz je uveden v tab. 3.
V případech, kdy pacient netoleruje jeden z inhibitorů cholinesteráz nebo je léčba málo účinná, je možné převedení na jiný typ inhibitoru, ale účinnost by měla být hodnocena nejdříve po 3 měsících podávání. Ke kontraindikacím užívání inhibitorů acetylcholinesteráz patří aktivní vředová choroba gastroduodenální a těžší převodní poruchy srdce, opatrnosti je zapotřebí i u sinusové bradykardie. Hlavní nežádoucí účinky jsou gastrointestinální – nechutenství, dyspepsie, nauzea, výjimečně zvracení, obvykle na počátku podávání a v průběhu titrace [2–4, 10, 11, 14]. Druhou skupinu představují slabí antagonisté NMDA-glutamátergních receptorů. Klinicky je používána zatím jediná látka – memantin. Podává se perorálně v denní dávce 20 mg (jednorázově nebo rozděleně do dvou denních dávek), titruje se tak, že se podává první týden 5 mg a každý další týden se 5 mg přidává. Memantin je obecně dobře tolerovanou látkou. Výjimečně může obvykle na počátku podávání působit poruchy vnímání – halucinace, iluze [3, 10, 11, 14, 15, 18].
Memantin je hrazen zdravotními pojišťovnami ČR při hodnotě testu MMSE 17–6 bodů, je tedy určen pro střední až těžké, ale nikoli nejtěžší demence.
Léčba inhibitory mozkových cholinesteráz a memantinem se může s výhodou kombinovat, ale tato léčba je finančně nákladná.
Dále jsou podávána farmaka, jejichž účinnost je podepřena nižší silou důkazů než u předešlých dvou skupin, nebo důkazy chybí zcela.
-
Extractum gingko biloba představuje směs řady účinných látek působících různými mechanismy (antioxidační působení, antiagregační efekt, zlepšení neuronálního metabolismu aj.). Některé klinické studie přinesly data o zlepšení výkonu v některých testech u pacientů s AD. Extractum ginkgo biloba se hodí jako přídatný lék k inhibitorům mozkových cholinesteráz a k memantinu.
-
Nicergolin zlepšuje mozkovou mikrocirkulaci a má slabší efekty na zesílení acetylcholinergního přenosu.
-
Antioxidanty (vitamin E, β-karoten, kyselina lipoová a další) i navzdory teoretickým předpokladům úspěšnosti nevykazují dostatečné klinické účinky. Je však předpokládán určitý preventivní efekt, jinak tyto látky slouží jako přídatná farmaka k inhibitorům cholinesteráz a memantinu, většinou formou volně prodejných přípravků.
-
Nootropní farmaka (např. piracetam, pyritinol) nevykazují v léčbě Alzheimerovy choroby dostatečnou účinnost, jejich podávání je neracionální.
-
Cerebrolysin, hydrolyzát vepřových mozků obsahující aminokyseliny a velmi krátké peptidy, slouží jako prekurzor pro tvorbu nervových růstových faktorů. Nutné je parenterální podání, používají se infuzní kúry. Klinické studie však nepřinesly dostatečné důkazy o účinnosti.
-
Inhibitory monoaminooxidázy typu B (především selegilin) by měly snižovat tvorbu volných kyslíkových radikálů a zlepšovat volněmotivační stránku učení, ale přesvědčivé důkazy efektivity nebyly podány.
-
Estrogeny u postklimakterických žen: estrogeny zlepšují jednak prokrvení mozku přímým vlivem na hladkou svalovinu mozkových cév, jednak mají příznivé trofické efekty na mozkovou tkáň, které jsou zprostředkovány přímou stimulací estrogenních receptorů v mozku. Terapeutické efekty u postklimakterických žen však prokázány nebyly a preventivní účinnost je sporná.
-
Další látky, např. w-3 nenasycené mastné kyseliny, koenzym Q10 aj., potřebují klinické studie k ověření účinku. Nesteroidní antirevmatika zatím neprokázala dostatečný terapeutický efekt, ale některá z nich působí spíše jako inhibitory gamma-sekretázové aktivity [19].
Farmaka, která jsou u Alzheimerovy choroby zkoušena a mají naději na klinické uplatnění V prvé řadě je ověřována účinnost látek blokujících tvorbu a ukládání Aβ, ale i látek, které blokují oligomeraci Aβ, likvidují již uložená depozita Aβ, inhibují degradaci tau-proteinu, zlepšují mitochondriální funkce a další.
-
Inhibitory enzymů β-sekretáz: zkoušeno je více látek, které se jeví bezpečné, ale v klinickém testování jsou málo účinné [9, 13].
-
Inhibitory enzymů gamma-sekretáz: látky se jeví účinné, ale jsou toxické (ovlivnění informačního systému NOTCH s poruchami imunity, krvetvorby aj.) [5, 9].
-
Modulátory gamma-sekretáz: tyto látky ovlivňují pouze tu část gamma-sekretázy, která je odpovědná za štěpení APP. Zkoušeno je několik nadějných látek s nízkou toxicitou, např. tarenflurbil (R-flurbiprofen, flurizan) [1, 9].
-
Aktivátory a-sekretáz: zatím nebyla nalezena výrazněji účinná látka, zkoušeny jsou např. statiny [9].
-
Blokátory oligomerace solubilního beta-amyloidu: nadějný je např. tramiprosat, zkoušen je colostrinin a jiné látky [9, 17].
-
Imunoterapie zaměřená vůči Aβ: velmi perspektivní přístup. Imunizace Aβ 42 působila asi v 6 % případů postvakcinační encefalitidy. Nyní jsou zkoušeny především monoklonální protilátky proti Aβ, např. bapineuzumab. Imunoterapie vede k odstraňování již uložených depozit Aβ. Zkoušejí se také imunoglobuliny [7, 9 ,12, 20].
-
Blokátory enzymu GSK-3β: tyto látky brání hyperfosforylaci a následné polymeraci intraneuronálního tau-proteinu. Zkoušeno je více látek, mezi jinými lithium. Požadovaný efekt má mj. memantin [8, 22].
-
Látky ovlivňující mozkový metabolismus nebo působící více různými mechanismy: dimebolin byl původně používán jako neselektivní antihistaminikum. Nyní tato látka prochází 3. stadiem klinického zkoušení v léčbě demencí. Ukázalo se, že pozitivně ovlivňuje neuronální funkce více způsoby, např. zlepšením mitochondriálního metabolismu, modulací ionotropních glutamátergních receptorů, inhibicí některých subtypů kalciových kanálů a dalšími mechanismy. Dosavadní výsledky ukazují příznivé ovlivnění kognitivních funkcí u lehkých až středních typů demence [6]. Aktivátor PPAR-gamma (peroxisome proliferator activated receptor – jádrový transkripční faktor) působí příznivě u demencí především tím, že zvyšuje citlivost mozkové tkáně k inzulinu. Zlepšuje se neuronální metabolismus, snižuje se zánětlivá reakce a tvorba beta-amyloidu. Jako aktivátory těchto receptorů jsou zkoušena některá antidiabetika ze skupiny thiazolidindionů, např. rosiglitazon.
Výčet farmak zkoušených v současné době u ACH zdaleka není úplný, je např. ověřován efekt látky obsažené v koření curry (curcumin) a další látky [16, 21].
Seznam použité literatury
- [1] Aisen PS. Tarenflurbil: a shot on goal. Lancet Neurol 2008; 7: 468–469.
- [2] Black SE, Doody R, Li H, et al. Donepezil preserves cognition and global function in patients with severe Alzheimer disease. Neurology 2007; 69: 459–469.
- [3] Caltagirone C, Bianchetti A, Di Luca M, et al. Guidelines for the treatment of Alzheimer’s disease from the Italian Association of Psychogeriatrics. Drugs Aging 2005; 22 (Suppl. 1): 1–26.
- [4] Cummings J, Winblad B. A rivastigmine patch for the treatment of Alzheimer’s disease and Parkinson’s disease dementia. Expert Rev Neurother 2007; 7: 1457–1463.
- [5] Czirr E, Leuchtenberger S, Dorner-Ciossek C, et al. Intensivity to Abeta42-lowering nonsteroidal anti-inflammatory drugs and gamma-secretase inhibitors in common among aggressive presenilin-1 mutations. J Biol Chem 2007; 282: 24504–24513.
- [6] Doody RS, Gavrilova SI, Sano M, et al. Effect of dimebon on cognition, activities of daily living, behaviour, and global function in patients with mild-to-moderate Alzheimer’s disease: a randomised, double-blind, placebo-controlled study. Lancet 2008; 372: 207–215.
- [7] Holmes C, Boche D, Wilkinson D, et al. Long-term effects of Abeta42 immunisation in Alzheimer’s disease: follow-up of a randomised, placebo-controlled phase I trial. Lancet 2008; 372: 216–223.
- [8] Hooper C, Killick R, Lovestone S. The GSK3 hypothesis of Alzheimer’s disease. J Neurochem 2008; 104: 1433–1439.
- [9] Christensen DD. Changing the course of Alzheimer’s disease: anti-amyloid disease-modifying treatments on the horizon. Prim Care Companion J Clin Psychiatry 2007; 9: 32–41.
- [10] Jirák R, Koukolík F. Demence. Neurobiologie, klinický obraz, terapie. Praha, Galén 2004.
- [11] Jirák R, Borzová C, Konrád J, et al. Demence. In: Psychiatrie. Doporučené postupy psychiatrické péče II, ed. Raboch J, Anders M, Praško J, Hellerová P. Praha, Infopharm Praha 2006: 22–37.
- [12] Kim J, Onstead L, Randle S, et al. Abeta40 inhibits amyloid deposition in vivo. J Neurosci 2007; 27: 627–633.
- [13] McConlogue L, Buttini M, Anderson JP, et al. Partial reduction of BACE1 has dramatic effects on Alzheimer plaque and synaptic pathology in APP Transgenic Mice. J Biol Chem 2007; 282: 26326–26334.
- [14] NICE guideline: CG42 Dementia; http: //guidance.nice.org.uk/cg42/niceguidance/pdf/English (22. 4. 2009).
- [15] Peskind ER, Potkin SG, Pomara N, et al. Memantine treatment in mild to moderate Alzheimer disease: a 24-week randomized, controlled trial. Am J Geriatr Psychiatry 2006; 14: 704–715.
- [16] Ringman JM, Frautschy SA, Cole GM, et al. A potential role of the curry spice curcumin in Alzheimer’s disease. Curr Alzheimer Res 2005; 2: 131–136.
- [17] Santa-Maria I, Hernandez F, Del Rio J, et al. Tramiprosate, a drug of potential interest for the treatment of Alzheimer’s disease, promotes an abnormal aggregation of tau. Mol Neurodegener 2007; 2: 17.
- [18] Tariot PN, Farlow MR, Grossberg GT, et al. Memantine treatment in patients with moderate to severe Alzheimer disease already receiving donepezil: a randomized controlled trial. JAMA 2004; 291: 317–324.
- [19] Townsend KP, Pratico D. Novel therapeutic opportunities for Alzheimer’s disease: focus on nonsteroidal anti-inflammatory drugs. FASEB J 2005; 19: 1592–1601.
- [20] Vasilevko V, Xu F, Previti ML, et al. Experimental investigation of antibody-mediated clearance mechanisms of amyloid-beta in CNS of Tg-SwDI transgenic mice. J Neurosci 2007; 27: 13376–13383.
- [21] Walker LC, Rosen RF. Alzheimer therapeutics – what after the cholinesterase inhibitors? Age Ageing 2006; 35: 332–335.
- [22] Wang J, Grundke-Iqbal I, Iqbal K. Kinases and phosphatases and tau sites involved in Alzheimer neurofibrillary degeneration. Eur J Neurosci 2007; 25: 59–68.