Farmakoterapie chronické obstrukční plicní nemoci v roce 2008
CHOPN je onemocnění charakterizované omezením průtoku vzduchu v průduškách, tedy bronchiální obstrukcí, která progreduje a je spojena s abnormální zánětlivou odpovědí plic na škodlivé částice a plyny. Prevalence CHOPN trvale stoupá a zvyšují se její ekonomické důsledky. Na rozvoji onemocnění se podílejí jak vlivy exogenní, především kouření včetně pasivního kouření, dále opakované respirační infekty, pracovní a životní prostředí znečištěné rizikovými škodlivinami, tak vlivy endogenní (věk, pohlaví, individuální odchylky bronchiálního prostředí, rodinná zátěž). Ve farmakoterapii této nemoci se v posledních letech uplatňuje několik nových preparátů (fixní kombinace inhalačních steroidů a dlouhodobě působících b2-agonistů a dlouhodobě účinná anticholinergika), které významně zlepšují kvalitu života nemocných, snižují počty exacerbací a dle některých studií i úmrtnost, což jsou hlavní cíle léčby CHOPN. Studie dokazují význam nefarmakologických postupů především dlouhodobé domácí oxygenoterapie a různých forem rehabilitace.
Definice
Chronická obstrukční plicní nemoc (CHOPN) je léčitelné onemocnění, kterému lze předcházet. CHOPN má významné mimoplicní účinky, které mohou přispívat k celkové závažnosti onemocnění u jednotlivých pacientů. Její plicní složka je charakterizována omezeným průtokem vzduchu v průduškách (dále bude používán vžitý název bronchiální obstrukce), který není úplně reverzibilní. Bronchiální obstrukce obvykle progreduje a je spojena s abnormální zánětlivou odpovědí plic na škodlivé částice a plyny [1].
Patogeneze
Bronchiální obstrukce typická pro CHOPN vzniká společným postižením drobných dýchacích cest (obstrukční bronchiolitidou) a destrukcí plicního parenchymu (emfyzémem). Poměr stupně postižení těmito dvěma složkami je individuální [1]. Zánět postihuje velké a malé bronchy i plicní parenchym. Zánětlivé změny zahrnují metaplazii pohárkových buněk, zmnožení a hypertrofii hlenových žláz, hypervaskularizaci a hypertrofii hladké svaloviny a změny v extracelulární matrix, společně s hromaděním zánětlivých buněk. Tyto změny ve velkých dýchacích cestách přispívají k projevům CHOPN, jako je kašel a hypersekrece hlenu, ne však ke vzniku obstrukční ventilační poruchy.
Malé bronchy jsou hlavní příčinou zvýšení odporu v dýchacích cestách. Tyto bronchy jsou infiltrovány zánětlivými buňkami, stěna je edematózní. Epitel bývá metaplastický a mohou se hromadit hlenové zátky. Bronchiální stěny jsou fibrotické. Dochází k hromadění myofibroblastů a kolagenu. Podobně jako u všech fibrotických tkání dochází ke kontrakci.
 Destrukce plicního parenchymu, která je vyvolána zánětlivými procesy, vede ke ztrátě vazby alveolů na drobné dýchací cesty, a tím ke snížení zpětného elastického napětí plic. Tyto změny tedy snižují schopnost dýchacích cest zůstat otevřené v průběhu výdechu. Vzniklé zúžení je pravděpodobně hlavní příčinou fixované bronchiální obstrukce.
Destrukce plicního parenchymu, která je vyvolána zánětlivými procesy, vede ke ztrátě vazby alveolů na drobné dýchací cesty, a tím ke snížení zpětného elastického napětí plic. Tyto změny tedy snižují schopnost dýchacích cest zůstat otevřené v průběhu výdechu. Vzniklé zúžení je pravděpodobně hlavní příčinou fixované bronchiální obstrukce.
Emfyzém je anatomicky definován jako trvalé zvětšení dechových cest distálně od terminálního bronchiolu spojené s destrukcí jejich stěn bez zřetelné fibrózy [2]. Při emfyzému může vinutost a zúžení bronchů vzniknout následkem ztráty alveolárního upevnění nebo snížením elastického tahu.
Přehled zánětlivých změn a jejich lokalizace je uvedena v tab. 1.
Vznik CHOPN se snaží vysvětlit dvě teorie: teorie oxidačního stresu a teorie nerovnováhy mezi proteázami a antiproteázami.
Oxidační stres je důležitým zesilujícím mechanismem u CHOPN [3]. Biomarkery oxidačního stresu (např. peroxid vodíku, 8-isoprostan) jsou zvýšené v kondenzátu vydechovaného vzduchu, ve sputu a v systémové cirkulaci nemocných s CHOPN. Oxidační stres se zvyšuje při exacerbacích. Oxidancia jsou vytvářena cigaretovým kouřem a dalšími inhalovanými částicemi. Tyto produkty se uvolňují z aktivovaných zánětlivých buněk, jako jsou makrofágy a neutrofily [4]. U nemocných s CHOPN může být rovněž snížené množství endogenních antioxidačních látek. Oxidační stres má různé nežádoucí následky pro plíce, způsobuje např. aktivaci prozánětlivých genů, inaktivaci antiproteáz, stimulaci tvorby hlenu a stimulaci zvýšené exsudace plazmy. Oxidační stres může též zodpovídat za snížení aktivity histon deacetylázy v plicní tkáni nemocných s CHOPN, což může vést ke zvýšené expresi zánětlivých genů a také ke snížení protizánětlivého účinku kortikosteroidů [5].
U CHOPN existují přesvědčivé důkazy nerovnováhy mezi proteázami, které štěpí složky pojivové tkáně, a antiproteázami, které tomuto štěpení brání. Hladiny různých proteáz pocházejících ze zánětlivých a epiteliálních buněk jsou u pacientů s CHOPN zvýšené. Proteázami způsobená destrukce elastinu, hlavní složky pojivové tkáně plicního parenchymu, je důležitým příznakem emfyzému a je pravděpodobně reverzibilní.
Patofyziologie
Zánět v plicní tkáni způsobuje strukturální změny, které mají za následek vznik obstrukční ventilační poruchy lokalizované převážně v periferních bronších. U zdravých jedinců představují největší odpor velké dýchací cesty, což bylo prokázáno postupným měřením rezistence pomocí katétru retrográdně od laryngu [6]. Nízká rezistence v malých dýchacích cestách je způsobena jejich velkým celkovým průřezem (průřez jednotlivým bronchiolem je sice malý, ale velké množství malých bronchiolů vytváří dohromady větší průřez než u velkých bronchů). Navíc nízká rychlost proudění v periferních dýchacích cestách vede k laminárnímu proudění, zatímco ve velkých dýchacích cestách a laryngu se vyskytuje spíše turbulentní proudění.
Hlavním rizikovým faktorem pro vznik CHOPN je kouření cigaret. Nedávno byl ověřen i vliv pasivního kouření. Expozice doma a v práci po dobu více než 40 hodin týdně v trvání pěti let zvyšuje riziko vzniku CHOPN o 48 % [7].
Diagnostika
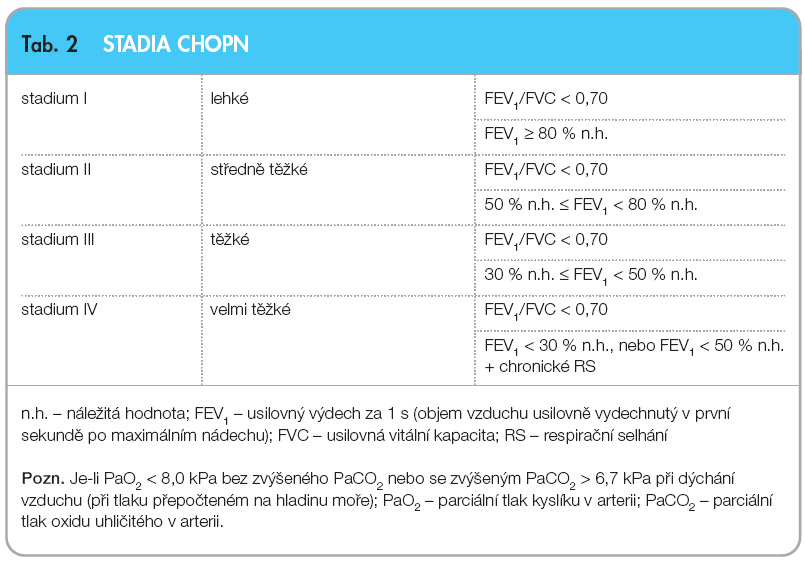 Základem pro stanovení diagnózy CHOPN je průkaz trvalé bronchiální obstrukce. Obstrukční ventilační poruchu stanovíme z poměru vitální kapacity (VC) nebo usilovně vydechnuté vitální kapacity (FVC) a usilovně vydechnutého objemu vzduchu za první sekundu (FEV1). Bronchiální obstrukci považujeme za prokázanou, klesne-li poměr FEV1/VC nebo FEV1/FVC pod 70 %. Podle závažnosti obstrukce dělíme CHOPN do jednotlivých stadií CHOPN I–IV, viz tab. 2.
Základem pro stanovení diagnózy CHOPN je průkaz trvalé bronchiální obstrukce. Obstrukční ventilační poruchu stanovíme z poměru vitální kapacity (VC) nebo usilovně vydechnuté vitální kapacity (FVC) a usilovně vydechnutého objemu vzduchu za první sekundu (FEV1). Bronchiální obstrukci považujeme za prokázanou, klesne-li poměr FEV1/VC nebo FEV1/FVC pod 70 %. Podle závažnosti obstrukce dělíme CHOPN do jednotlivých stadií CHOPN I–IV, viz tab. 2.
Systémové symptomy CHOPN, zvláště u nemocných s těžkým onemocněním, zahrnují kachexii, úbytek kosterní svaloviny, zvýšené riziko kardiovaskulárních onemocnění, anémie, osteoporózy a deprese. CHOPN je rizikovým faktorem pro vývoj bronchogenního karcinomu.
Prevence
Nejúčinnějším opatřením k zamezení vzniku CHOPN je nikdy nezačít kouřit. K tomu účelu slouží postupné zákazy reklamy tabákových výrobků v novinách, televizi a na billboardech, a konečně i zákaz reklamy při mezinárodních sportovních událostech. V nejvíce rozvinutých zemích jsou účinným opatřením k omezení spotřeby cigaret daně. Řada studií prokázala přímou korelaci mezi zvyšující se cenou cigaret a poklesem jejich spotřeby [8]. Podobně jako zvýšení daní působí účinný zákaz kouření ve veřejných prostorách, který platí v mnoha zemích (New York 2003; Irsko, Nový Zéland, Norsko 2004; Kuba, Bangladéš a Malta 2005; Skotsko, Uruguay, Bermudy 2006; Wales, Severní Irsko a Anglie v roce 2007). Tento zákaz snižuje příležitost ke kouření a vede ke zvýšení počtu lidí, kteří chtějí přestat kouřit.
V České republice neexistuje žádný zákon, který by se zabýval kontrolou tabákových výrobků. V zákoně o opatřeních před škodlivinami [9] se zakazuje kouřit na veřejných místech, v dopravních prostředcích vyjma vlaků, kde je povinností mít vozy vyhrazené pro kuřáky, ve školách, v uzavřených zábavních prostorách, ve vnitřních prostorách zdravotnických zařízení, v budovách státních orgánů. V zařízeních společného stravování je kouření zakázáno, pokud tato zařízení nemají zvláštní prostory vyhrazené pro nekuřáky, které jsou zajištěny dostatečným větráním.
Léčba stabilní fáze CHOPN
U stabilní CHOPN se zahajuje léčba podle zjištěného stadia CHOPN. Na rozdíl od astmatu se u CHOPN intenzita léčby stupňuje v závislosti na progresi nemoci a mění se pouze v případě výskytu nežádoucích účinků léčby. Stupňovitý způsob léčby ukazuje obr. 1.
Každý z dosavadních léčebných způsobů CHOPN je schopen pouze zmírnit příznaky a komplikace, zlepšit toleranci tělesné zátěže a snížit počet a tíži 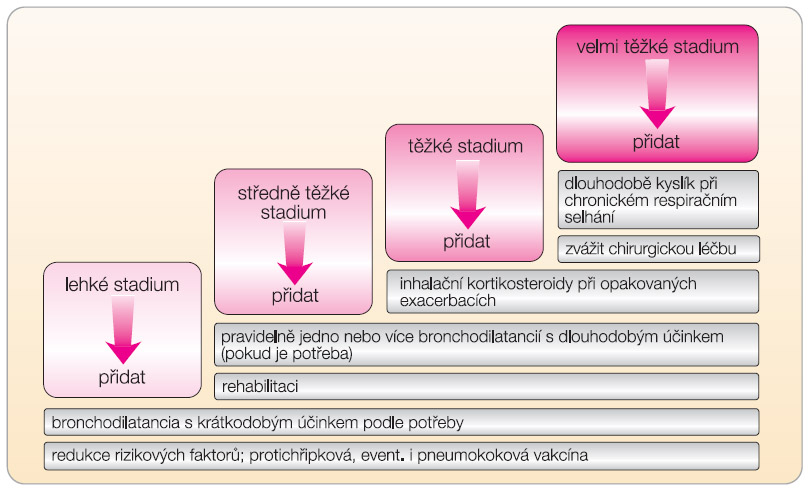 exacerbací nebo je oddálit, ale nikoli zabránit poklesu plicních funkcí v dlouhodobém průběhu nemoci.
exacerbací nebo je oddálit, ale nikoli zabránit poklesu plicních funkcí v dlouhodobém průběhu nemoci.
Léčebný režim by měl být individuální a kromě tíže obstrukce a příznaků by měl přihlížet též ke komorbiditám (hlavně kardiovaskulárním) či interakcím léčivých látek, jejich možným nežádoucím účinkům a k celkovému stavu nemocného. Jednoznačně se upřednostňuje léčba inhalační před jakoukoli jinou formou, neboť je nejúčinnější (intenzitou, rychlostí, s méně závažnými nežádoucími účinky). Při preskripci inhalačního preparátu je nezbytné vybrat takový inhalační systém, který bude nejlépe nemocnému vyhovovat, naučit ho správnou inhalační techniku a často ji kontrolovat.
Zanechání kouření
Zanechání kouření je nejúčinnějším opatřením v léčbě CHOPN, které jako jediné dokáže zpomalit pokles FEV1 [10, 11]. Kouření cigaret snižuje terapeutickou odpověď na některé léčivé přípravky, např. na podávání teofylinu, mechanismem indukce tvorby izoenzymů cytochromu P-450 v játrech. Kuřáci s astmatem a CHOPN mají sníženou citlivost na kortikosteroidy, pravděpodobně kvůli neeozinofilnímu zánětu v dýchacích cestách nebo v důsledku alterované aktivity glukokortikoidních receptorů anebo snížením aktivity histon deacetylázy [12].
Absolutního zanechání kouření lze dosáhnout motivací (vysvětlením, přesvědčováním, poukazem na tíži příznaků, objektivními nálezy), nikotinovou závislost lze ovlivnit náhradní nikotinovou léčbou (nikotinové náplasti, inhalátory, sublinguální tablety, nosní spreje, žvýkačky), případně léčivými látkami ovlivňujícími CNS – tablety obsahující bupropion a vareniklin. Bylo prokázáno, že krátká rada podaná lékaři, ale i farmaceuty vede k zanechání kouření. Farmaceuti totiž radí nemocným, jak užívat nikotinovou náhradní léčbu, a mají pro toto poradenství příležitost [13].
Náhradní terapie nikotinem má velký účinek na zanechání kouření [14]. Metaanalýzou kontrolovaných studií zabývajících se náhradní léčbou nikotinem bylo prokázáno, že se ve srovnání s placebem zvyšuje pravděpodobnost zanechání kouření 1,5krát až 2krát [15].
Vareniklin je perorální preparát s novým mechanismem působení cíleným na specifické nikotinové acetylcholinové receptory spojené s nikotinem indukovaným chováním (α4β2 nAChR). Vareniklin má agonistické i antagonistické vlastnosti. Zřejmě přispívá ke snížení touhy po cigaretě blokováním „požitků“ z kouření, což potvrzuje řada studií. Dvanáctitýdenní léčba vareniklinem signifikantně zvýšila ve srovnání s placebem nebo bupropionem počet jedinců, kteří zanechali kouření. Rovněž dlouhodobá abstinence po jednom roce od zanechání kouření byla vyšší u osob, které byly léčeny vareniklinem [16]. Vareniklin snižuje nutkání ke kouření a zmírňuje abstinenční příznaky [17].
Antidepresiva v léčbě nikotinismu zmírňují příznaky deprese při odvykání kouření nebo specificky ovlivňují neuronální cestu způsobující nikotinovou závislost (např. blokáda receptorů pro nikotin). Léčivé látky z této skupiny byly zkoušeny v dlouhodobých studiích pro odvykání kouření. Bupropion i nortriptylin zdvojnásobily pravděpodobnost zanechání kouření, pokud byly podány samostatně [18]. Bupropion upravuje hladiny dopaminu a adrenalinu v mozku, k jejichž snížení dochází u kuřáků, kteří přestanou kouřit. Tento fakt potvrdila i dvojitě slepá placebem kontrolovaná studie, kde byl podáván buď bupropion nebo nikotinová náplast, nebo bupropion a nikotinová náplast anebo placebo. Počet osob zanechavších kouření po 12 měsících byl 15,6 % ve skupině, která dostávala placebo, 16,4 % ve skupině, která dostávala nikotinové náplasti, 30,3 % u skupiny bupropionové (p < 0,001) a 35,5 % ve skupině léčené kombinací bupropion a náplasti (p < 0,001) [19].
Nebyl prokázán přínos akupunktury a hypnózy při odvykání kouření v porovnání s placebem [20, 21].
Farmakologická léčba
Bronchodilatancia
Inhalační krátkodobě působící β2-agonisté (SABA – short acting beta-agonists)
Fenoterol, salbutamol a terbutalin se doporučují podle potřeby ke zmírnění a k prevenci příznaků a pro pravidelné užívání. Zvyšují hlavně odolnost vůči tělesné zátěži, i když významně nezlepšují plicní funkce. Pro jednorázové použití se doporučují 1–2 dávky, maximální dávka je 8 vdechů (event. 4 x 2) za 24 hodin.
Jiné aplikační formy (tablety, injekce) by měly být kvůli riziku nežádoucích účinků používány jen u nemocných, kteří nezvládnou žádnou inhalační techniku.
Inhalační dlouhodobě působící β2-agonisté (LABA – long acting beta-agonists)
Formoterol a salmeterol se doporučují u pacientů od II. stadia CHOPN ve dvou denních dávkách, protože představují účinnější a pohodlnější léčbu než přípravky krátkodobě působící, které jsou podávány 3–4krát denně. Vybrat by se měla taková léková forma, která nemocnému nejlépe vyhovuje (inhalovaný prášek, dávkovaný aerosol).
Formoterol se vyznačuje rychlým nástupem účinku podobně jako salbutamol, ale svým dlouhodobým účinkem se podobá salmeterolu. Ve srovnání s ipratropiem nebo teofylinem formoterol více zlepšuje plicní funkce. Jeho účinnost se zvyšuje v kombinaci s ipratropiem. Formoterol více snižuje dynamickou hyperinflaci, která je zodpovědná za dušnost a intoleranci zátěže. Má synergický efekt s tiotropiem. Formoterol snižuje počet exacerbací, zvyšuje počet dní, při kterých se nemusí přidávat záchranná medikace. Zvyšuje kvalitu života. Má vynikající bezpečnostní profil a je lépe snášen než teofylin [22].
Rovněž salmeterol má stejný bronchodilatační účinek jako ipratropium bromid, ale toto působení je dlouhodobější a více konstantní, nerozvíjí se tolerance [23]. Podle některých prací způsobuje salmeterol sice signifikantní zvýšení FEV1, ale nedochází ke zlepšení statických plicních objemů a k lepší toleranci zátěže [24].
Otázkou bezpečnosti léčby LABA se zabývalo několik studií. U nemocných s CHOPN nebyly zjištěny žádné významné nežádoucí kardiální účinky při podávání formoterolu nebulizací nebo v práškové formě [25]. Ve studii na zdravých dobrovolnících bylo zjištěno, že salmeterol i salbutamol v závislosti na dávce prodlužují interval QTc, zvyšují tepovou frekvenci i koncentraci glukózy, naopak snižují koncentraci kalia [26]. LABA jsou preparáty bezpečné a účinné, jak potvrdila metaanalýza randomizovaných klinických studií. Byly vybrány studie, které trvaly alespoň jeden měsíc. Studie porovnávaly LABA s placebem nebo s ipratropiem. Bylo nalezeno celkem 27 studií. LABA snižovaly riziko těžkých exacerbací ve srovnání s placebem. Nebyl zjištěn rozdíl vůči placebu v mortalitě. Použití LABA s inhalačními kortikosteroidy (IKS) snížilo riziko úmrtí ve srovnání se samotnými LABA [27].
Inhalační krátkodobě působící anticholinergikum (SAMA – short acting muscarinic antagonist)
Ipratropium je neselektivní blokátor muskarinových receptorů zabraňující uvolňování acetylcholinu. Tím lze dosáhnout zmírnění bronchokonstrikce a snížení tvorby sekretu hlenových žlázek. Jeho výhodou je malé riziko předávkování oproti SABA. Opatrnosti při používání roztoku nebo i dávkovaného aerosolu je třeba u nemocných s glaukomem a při léčbě vysokými dávkami u pacientů s hypertrofií prostaty. Jednorázová dávka nejčastěji používaného dávkovaného aerosolu ipratropia je 2–6 vdechů (a` 20 mg), denní maximální dávka 4krát 4 vdechy (ani tyto vysoké dávky nevyvolávají většinou závažné nežádoucí účinky).
Inhalační dlouhodobě působící anticholinergikum (LAMA – long acting muscarinic antagonist)
Tiotropium působí nejméně 24 hodin. Na rozdíl od ipratropia selektivně blokuje muskarinové receptory M1 a M3, zatímco receptory M2 blokuje krátkodobě. Tiotropium je účinnější než ipratropium, zvyšuje odolnost vůči tělesné zátěži snížením plicní hyperinflace v klidu i během tělesné zátěže, zmírňuje dušnost a zlepšuje kvalitu života. Nežádoucí účinky jsou minimální, opatrnosti je třeba u nemocných s těžkou poruchou funkce ledvin.
Tiotropium je indikováno od II. stadia CHOPN. Ve formě prášku uzavřeného do kapsle k inhalaci se aplikuje jedenkrát denně v dávce 18 mg . Tiotropium je kompatibilní s jinými léčivými látkami, nedoporučuje se kombinace s jinými anticholinergiky.
Tiotropium má významné bronchodilatační účinky. Ve studii trvající 12 měsíců, kde nemocní užívali tiotropium nebo placebo, bylo prokázáno, že pacienti léčení tiotropiem měli výraznější zmírnění obstrukce, menší dušnost, lepší kvalitu života, méně exacerbací a méně hospitalizací. Pocit suchosti v ústech byl ale výraznější při léčbě tiotropiem [28]. Tyto výsledky potvrdila i další studie, která navíc prokázala, že tiotropium prodlužuje čas do první exacerbace a první hospitalizace [29]. V další studii trvající 12 týdnů, ve které bylo podáváno tiotropium jednou denně a kontrolní skupina byla léčena placebem, se prokázalo, že tiotropium ve srovnání s placebem signifikantně zvětšuje plochu pod křivkou FEV1 po podání účinné látky, a dokonce i FEV1 před podáním bronchodilatancia [30]. Tiotropium ve srovnání s placebem zlepšuje funkční reziduální kapacitu plic, zmírňuje dušnost při zátěži a její toleranci. Tyto účinky korelují se zvýšením inspirační kapacity [31].
V nedávné době byly zveřejněny výsledky studie cílené na ovlivnění poklesu FEV1 podáváním tiotropia [32]. V této studii bylo sledováno 5993 nemocných po dobu 4 let. Užívání tiotropia vedlo ke zlepšení plicních funkcí, neovlivnilo však pokles FEV1. Tiotropium prodlužuje dobu, za kterou dojde k první exacerbaci, snižuje celkový počet exacerbací, včetně těch, jež vedou k hospitalizaci. Výsledky studie potvrdily také bezpečnost jeho podávání. Tiotropium je velmi dobře snášeno. Nežádoucím účinkem je pouze suchost v ústech, výskyt ostatních nežádoucích účinků je stejný jako ve studiích s placebem, se salmeterolem nebo s ipratropiem [33]. Některé práce dokazují i protizánětlivé působení tiotropia. Bylo prokázáno, že tiotropium inhibuje acetylcholinem indukovanou proliferaci fibroblastů a myofibroblastů [34].
Kombinace bronchodilatancií
Kombinace bronchodilatancií se obecně doporučuje; má většinou lepší účinek než podávání jednotlivých léčivých přípravků a díky různým mechanismům působení jednotlivých léčivých látek lze dosáhnout potencování účinku bez použití vysokých dávek, čímž se zamezí vyvolání nežádoucích účinků. Kombinace se provádí pomocí fixních inhalačních forem nebo nefixními inhalačními bronchodilatancii s methylxantiny. Kombinace krátkodobě působících bronchodilatačních léčivých látek s látkami dlouhodobě působícími je doporučována od II. stadia CHOPN, jestliže se nedosáhne zklidnění krátkodobě působícími inhalačními přípravky. Fixní kombinace fenoterol/ ipratropium (dávkovaný aerosol) se nejčastěji akutně inhaluje v dávce 2 vdechy, maximální denní dávka je 4krát 2 vdechy, nebulizovaný roztok jednorázově 1 ml, maximální denní dávka 4krát 1 ml, prášková inhalační forma (inhalety) se v ČR používá omezeně.
Kromě krátkodobě působících léčivých přípravků se doporučuje podávat od II. stadia CHOPN kombinovanou léčbu; a to buď kombinaci tiotropium s LABA nebo i kombinaci tiotropium + fixní kombinace LABA + IKS.
O účinnosti této léčby svědčí řada publikovaných studií. Přidání formoterol fumarátu k léčbě tiotropiem vedlo ke zlepšení plicních funkcí a ke zlepšení v indexu přechodné dušnosti (TDI, transition dyspnea index) [35]. Rovněž další randomizovaná dvojitě slepá placebem kontrolovaná studie u 449 dospělých nemocných s CHOPN, která měla za cíl zjistit, zda tiotropium spolu s inhalačně podaným salmeterolem nebo s inhalačním flutikasonem poskytuje významnější zlepšení klinických výsledků ve srovnání s podáním samotného tiotropia, dospěla k závěru, že léčba trojkombinací těchto látek je nejúčinnější. Signifikantně se snížila četnost hospitalizací pro exacerbace CHOPN, zlepšily se plicní funkce a kvalita života. Nezvýšila se frekvence nežádoucích účinků [36]. Kombinovaná léčba tiotropiem a fixní kombinací salmeterol/flutikason signifikantně více zlepšuje plicní funkce (FEV1 a inspirační kapacitu) ve srovnání se samotným tiotropiem a samotnou fixní kombinací salmeterol + flutikason [37].
Přibývá důkazů, že IKS a LABA mají doplňující se a synergický účinek, jestliže jsou podávány v jednom inhalačním přípravku. V současnosti jsou k dispozici dvě fixní kombinace – salmeterol + flutikason propionát (SFC) a formoterol + budesonid (FBC). Studie prokázaly, že léčba se SFC nebo FBC vede k signifikantně většímu zlepšení plicních funkcí, ke snížení počtu exacerbací, zlepšení kvality života, zmírnění dušnosti ve srovnání s monoterapií včetně podávání komponentů fixních kombinací samostatně. V nedávno publikované studii TORCH (Towards a Revolution in COPD Health) snížení mortality při léčbě SFC jen těsně nedosáhlo statistické významnosti (17,5% snížení rizika, p = 0,052) [38].
Methylxantiny
V současné době se doporučují jen dlouhodobě (minimálně 12 hodin a déle) působící léčivé přípravky. Methylxantiny mohou vyvolat nežádoucí účinky (gastrointestinální, kardiální, CNS apod.), kterým lze zabránit vyšetřením koncentrace teofylinu v krevním séru. Toto vyšetření by se mělo provádět hlavně u osob, u kterých lze očekávat nežádoucí vlivy (jaterní, kardiovaskulární nemoci, epilepsie, interference a podávání vysokých dávek léčivých látek). Optimální koncentrace teofylinu v séru je 8–12 mg/l.
Methylxantiny jsou léky až druhé volby. Nemají přednost před inhalačními preparáty ani při akutní, ani při dlouhodobé léčbě. Mohou však zvýšit účinnost dlouhodobě působících inhalačních léčivých přípravků. Léčba se obvykle zahajuje nižšími dávkami, např. 2krát denně 200 mg, které se při dobré toleranci zvyšují až na eventuální denní dávku 750 mg.
Bylo prokázáno, že léčba teofylinem ve srovnání s léčbou LABA snižuje počet exacerbací. Rovněž kombinace teofylinu s IKS snížila počet exacerbací, a to více než kombinace IKS + LABA [39]. Teofylin má ale méně výrazný bronchodilatační účinek než salmeterol a kombinace salmeterol a flutikason [40].
Kortikosteroidy
Inhalační kortikosteroidy (IKS)
IKS se doporučují u nemocných s pobronchodilatační hodnotou FEV1 nižší než 50 % náležitých hodnot a s anamnézou opakovaných exacerbací CHOPN (2 za rok, 3 za 3 roky). IKS snižují četnost exacerbací, zlepšují zdravotní stav, ovšem neovlivňují mortalitu, což ukázala i studie TORCH. Do studie TORCH bylo zařazeno 6112 nemocných s CHOPN, kteří užívali po dobu tří let salmeterol, flutikason, kombinaci těchto dvou léčivých látek nebo placebo. Výsledky studie ukázaly, že ve skupině léčené kombinací salmeterol + flutikason došlo oproti skupině léčené placebem ke zpomalení poklesu FEV1 o 16 ml za rok [41]. Studie ISOLDE neprokázala ovlivnění poklesu FEV1 při léčbě flutikasonem, došlo však ke snížení počtu exacerbací a ke zpomalení poklesu kvality života [42].
Metaanalýza devíti studií provedených u nemocných s CHOPN, ve kterých byly IKS přidány do kombinace s LABA nebo s tiotropiem, dospěla k závěru, že poklesl počet exacerbací při léčbě zahrnující IKS, byla zaznamenána lepší kvalita života, ale zvýšil se počet pneumonií a orální kandidózy. Mortalita ovlivněna nebyla [43].
IKS nezmírňují u pacientů s CHOPN zánět, jako je tomu při léčbě nemocných s astmatem. Bylo prokázáno, že IKS nesnižují koncentrace TNF-a (tumor nekrotizující faktor a) a faktoru aktivujícího neutrofily. Ani perorální kortikosteroidy (KS) tyto hodnoty u nemocných s CHOPN – na rozdíl od nemocných s astmatem – neovlivňují [44]. IKS by se měly podávat ve středních a vyšších denních dávkách, beklometason v dávkách 250 mg a vyšších, budesonid v dávkách 1000 mg a vyšších a flutikason od 250 mg.
Perorální a další systémové kortikosteroidy (KS)
Pro nežádoucí účinky se u pacientů se stabilní fází CHOPN v současné době systémové kortikosteroidy nedoporučují. Pozitivní odpověď na léčbu lze očekávat pouze u nemocných se symptomy astmatu. Bylo zjištěno, že nemocní s CHOPN, kteří pozitivně reagovali na léčbu perorálními KS, tj. zlepšili se o více než 12 % a 200 ml FEV1, měli zesílenou bazální membránu, která se nachází u osob s astmatem, a rovněž větší množství eozinofilů v bronchoalveolární laváži [45].
Mukolytika
Ambroxol, erdostein, karbocystein a další. Postoj k všeobecnému doporučení těchto léčivých látek je prozatím rezervovaný [1].
Antioxidační látky
Acetylcystein a erdostein byly v posledních letech kladně hodnoceny zvláště v léčbě CHOPN s rekurentními exacerbacemi. Erdostein má nejen antioxidační účinek, ale může také potencovat vliv salbutamolu, IKS a antibiotik [1].
Nefarmakologická léčba
Rehabilitace
V léčbě stabilizované CHOPN se uplatňují i některé postupy nefarmakologické. Velmi důležitá je rehabilitace, která zvyšuje fyzickou kondici nemocných, zlepšuje jejich kvalitu života, příznivě ovlivňuje počet a délku hospitalizací a prodlužuje celkovou dobu přežití. Doporučená délka rehabilitačních programů je déle než 2 měsíce.
Dlouhodobá domácí oxygenoterapie (DDOT)
U nemocných se závažnou respirační insuficiencí je indikována DDOT. Před jejím zahájením je nezbytné vyšetření na specializovaném pracovišti, při kterém se zjistí, zda nejsou kontraindikace k této léčbě (např. z důvodu retence CO2 během podávání kyslíku nebo kvůli kouření), a stanoví se optimální průtok kyslíku. U pacientů je nutné kontrolovat především dodržování minimální denní doby aplikace kyslíku zajišťující účinnost této léčby (více než 15 hodin, přerušení maximálně na 2 hodiny). Toto je obvykle zajišťováno ambulantními pneumology.
Závěr
Základní přístup k léčbě stabilizované CHOPN může být charakterizován jako stupňovité přidávání léčivých látek v závislosti na závažnosti nemoci. U žádného z používaných léčivých přípravků nebylo přesvědčivě prokázáno ovlivnění dlouhodobého poklesu plicních funkcí, které je charakteristické pro toto onemocnění. Farmakoterapie CHOPN je proto používána ke zmírnění příznaků nebo komplikací. Pro symptomatickou léčbu CHOPN jsou hlavní bronchodilatancia, která se podávají buď podle potřeby, nebo pravidelně k zabránění vzniku příznaků nebo k jejich zmírnění. Hlavními bronchodilatačními látkami jsou β2-agonisté, anticholinergika, teofyliny a jejich kombinace. Pravidelná léčba inhalačními kortikosteroidy může být doporučena pouze u nemocných s CHOPN, kteří mají potíže a u nichž byla spirometricky prokázána pozitivní odpověď na léčbu kortikosteroidy, nebo u těch nemocných, kteří mají hodnoty FEV1 nižší než 50 % a mají časté exacerbace vyžadující léčbu antibiotiky a celkově podávanými kortikosteroidy. Je třeba se vyhýbat chronickému podávání systémových kortikosteroidů pro nepříznivý poměr mezi jejich přínosem a rizikem. Pro všechny nemocné s CHOPN jsou prospěšné programy zaměřené na zátěžová cvičení, která nejen zlepšují toleranci zátěže, ale současně zmírňují dušnost a únavu. Bylo prokázáno, že dlouhodobé podávání kyslíku (déle než 15 hodin denně) prodlužuje přežívání nemocných s chronickou respirační insuficiencí.
Seznam použité literatury
- [1] Světová iniciativa o chronické obstrukční plicní nemoci: Světová strategie diagnostiky, léčby a prevence chronické obstrukční plicní nemoci. Vltavín, Praha 2007.
- [2] Snider GL, Kleinerman J, Thurlbeck WM, et al. The definition of emphysema: report of a National Heart, Lung, and Blood Institute, Division of Lung Diseases, workshop. Am Rev Respir Dis 1985; 132: 182–185.
- [3] Rahman I. Oxidative stress in pathogenesis of chronic obstructive pulmonary disease: cellular and molecular mechanisms. Cell Biochem Biophys 2005; 43: 167–188.
- [4] MacNee W. Oxidative stress and lung inflammation in airways disease. Eur J Pharmacol 2001; 429: 195–207.
- [5] Ito K, Ito M, Elliott WM, et al. Decreased histone deacetylase activity in chronic obstructive pulmonary disease. N Engl J Med 2005; 352: 1967–1976.
- [6] Macklem, PT, Mead J. Resistance of central and peripheral airways measured by a retrograde catheter. J Appl Physiol 1967; 22: 395–401.
- [7] Yin P, Jiang CQ, Cheng KK, et al. Passive smoking exposure and risk of COPD among adults in China: the Guangzou Biobank Cohort Study. Lancet 2007; 370: 751–757.
- [8] Townsend J. Cigarette controversies. ASH official report for no smoking day 1997.
- [9] Sbírka zákonů. Zákon o opatřeních k ochraně před škodami působenými tabákovými výrobky, alkoholem a jinými návykovými látkami a o změně souvisejících zákonů. Sbírka zákonů. č.379/2005: 7093–7102.
- [10] Buist AS. The US Lung Health Study. Respirology 1997; 2: 303–307.
- [11] Anthonisen NR, Connett JE, Kiley JP, et al. Effects of smoking intervention and the use of inhaled anticholinergic bronchodilatator on the rate of decline of FEV1: the Lung Health Study. JAMA 1994; 272: 1497–1505.
- [12] Braganza G, Chaudhuri R, Thomson NC. Treating patients with respiratory disease who smoke. Ther Adv Respir Dis 2008; 2: 95–107.
- [13] Sinclair HK, Bond CM, Stead LF. Community pharmacy personnel interventions for smoking cessation. Cochrane Database Syst Rev 2004; 1: CD003698.
- [14] Etter JF, Burri M, Stapleton J. The impact of pharmaceutical company funding on results of randomized trials of nicotine replacement therapy for smoking cessation: a meta-analysis. Addiction 2007; 102: 815–822.
- [15] Stead LF, Perera R, Bullen C, et al. Nicotine replacement therapy for smoking cessation. Cochrane Database of Syst Rev 2008; 1: CD000146.
- [16] Gonzales D, Rennard Sl, Nides M, et al. Varenicline, an alpha4beta2 nicotinic acetylcholine receptor partial agonist, vs sustained-release bupropion and placebo for smoking cessation: a randomized controlled trial. JAMA 2006; 296: 47–55.
- [17] Jorenby DE, Hays JT, Rigotti NA, et al. Efficacy of varenicline, an alpha4beta2 nicotinic acetylcholine receptor partial agonist, vs placebo or sustained-release bupropion for smoking cessation: a randomized controlled trial. JAMA 2006; 296: 56–63.
- [18] Keir L. Smoking cessation – Making quitting an real option. Respiratory Medicine, COPD update 2007; 3: 128–134.
- [19] Jorenby DE, Leischow SJ, Nides MA, et al. A controlled trial of sustained-release bupropion, a nicotine patch, or both for smoking cessation. N Engl J Med 1999; 340: 685–691.
- [20] White AR, Rampes H, Ernst E. Acupuncture for smoking cessation. Cochrane Database Syst Rev 2002; 2: CD000009.
- [21] Abott NC, Stead LF, White AR, et al. Hypnotherapy for smoking cessation. Cochrane Database Syst Rev 2000; 2: CD001008.
- [22] Steiropoulos P, Tzouvelekis A, Bouros D. Formoterol in the management of chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis 2008; 3: 205–215.
- [23] Rennard Sl, Anderson W, ZuWallack R, et al. Use of a long-acting inhaled beta2-adrenergic agonist, salmeterol xinafoate, in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001; 163: 1087–1092.
- [24] Grove A, Lipworth BJ, Reid P, et al. Effects of regular salmeterol on lung function and exercise capacity in patients with chronic obstructive airways disease. Thorax 1996; 51: 689–693.
- [25] Nelson HS, Gross NJ, Levine B, et al. Cardiac safety profile of nebulized formoterol in adults with COPD: a 12-week, multicenter, randomized, double-blind, double-dummy, placebo- and active-controlled trial. Clin Ther 2007; 29: 2167–2178.
- [26] Bennett JA, Tattersfield AE. Time course and relative dose potency of systemic effects from salmeterol and salbutamol in healthy subjects. Thorax 1997; 52: 458–464.
- [27] Rodrigo GJ, Nannini LJ, Rodriguez-Roisin R. Safety of long-acting beta-agonists in stable COPD: a systematic review. Chest 2008; 133: 1079–1087.
- [28] Casaburi R, Mahler DA, Jones PW, et al. A long-term evaluation of once-daily inhaled tiotropium in chronic obstructive pulmonary disease. Eur Respir J 2002; 19: 217–224.
- [29] Vincken W, van Noord JA, Greefhorst AP, et al. Improved health outcomes in patients with COPD during 1 year's treatment with tiotropium. Eur Respir J 2002; 19: 209–216.
- [30] Johansson G, Lindberg A, Romberg K, et al. Bronchodilator efficacy of tiotropium in patients with mild to moderate COPD. Prim Care Respir J 2008; 17: 169–175.
- [31] O’ Donnell DE, Flüge T, Gerken F, et al. Effects of tiotropium on lung hyperinflation, dyspnoea and exercise tolerance in COPD. Eur Respir J 2004; 23: 832–840.
- [32] Tashkin DP, Celli B, Senn S, et al. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med 2008; 359: 1543–1554.
- [33] Keam SJ, Ketings GM. Tiotropium bromide: a review of its use an maintenance therapy in patients with COPD. Treat Respir Med 2004; 3: 247–268.
- [34] Pieper MP, Chaudhary NI, Park JE. Acetylcho-line-induced proliferation of fibroblasts and myofibroblasts in vitro is inhibited by tiotropium bromide. Life Sci 2007; 80: 2270–2273.
- [35] Tashkin DP, Littner M, Andrews CP, et al. Concomitant treatment with nebulized formoterol and tiotropium in subjects with COPD: a placebo-controlled trial. Respir Med 2008; 102: 479–487.
- [36] Aaron SD, Vandemheen KL, Fergusson D, et al. Tiotropium in combination with placebo, salmeterol or fluticasone-salmeterol for treatment of chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med 2007; 146: 545–555.
- [37] Singh D, Brooks J, Hagan G, et al. Superiority of „triple“ therapy with salmeterol/flutikasone propionate and tiotropium bromide versus individual components in moderate to severe COPD. Thorax 2008; 63: 592–598.
- [38] Hanania NA. The impact of inhaled corticosteroids and long-acting beta-agonist combination therapy on outcomes in COPD. Pulm Pharmacol Ther 2008; 21: 540–550.
- [39] Cyr MC, Beauchesne MF, Lemie`re C, Blais L. Effect of theophylline on the rate of moderate to severe exacerbations among patients with chronic obstructive pulmonary disease. Br J Clin Pharmacol 2008; 65: 40–50.
- [40] Cazzola M, Di Lorenzo G, Di Perna F, et al. Additive effects of salmeterol and fluticasone or theo-phylline in COPD. Chest 2000; 118: 1576–1581.
- [41] Celli BR, Thomas NE, Anderson JA, et al. Effects of pharmacotherapy on rate of decline of lung function in chronic obstructive pulmonary disease: results from the TORCH study. Am J Respir Crit Care Med 2008; 178: 332–338.
- [42] Burge PS, Calverley PM, Jones PW, et al. Randomized, double blind, placebo controlled study of fluticasone propionate in patients with moderate to severe chronic obstructive pulmonary disease: the ISOLDE trial. BMJ 2000; 320: 1297–1303.
- [43] Sobieraj DM, White CM, Coleman CI. Benefits and risks of adjunctive inhaled corticosteroids in chronic obstructive pulmonary disease: a meta-analysis. Clin Ther 2008; 30: 1416–1425.
- [44] Keatings VM, Jatakanon A, Worsdell YM, Barnes PJ. Effects of inhaled and oral glucocorticoids on inflammatory indices in asthma and COPD. Am J Respir Crit Care Med 1997; 155: 542–548.
- [45] Chanez P, Vignola AM, O'Shaugnessy T, et al. Corticosteroid reversibility in COPD is related to features of asthma. Am J Respir Crit Care Med 1997; 155: 1529–1534.