Farmakoterapie demencí – pokroky v léčbě a aktuální doporučení
Ve farmakoterapii kognitivních poruch se v současnosti používají především inhibitory acetylcholinesterázy a antagonisté N-methyl-D-
-aspartátových receptorů. V České republice jsou jimi donepezil, rivastigmin, galantamin a memantin. Rivastigmin je indikován u demence při Parkinsonově chorobě, nově je k dispozici i ve formě transdermálních náplastí. Memantin je doporučen k léčbě Alzheimerovy choroby těžkého stupně. Jeho účinnost je prokázána také v kombinaci s inhibitory acetylcholinesterázy při postižení středně těžkého stupně. Jednoznačná doporučení pro terapii vaskulárních demencí zatím nejsou k dispozici, předpokládá se mírně příznivý efekt inhibitorů acetylcholinesterázy. Další terapeutické postupy jsou ve fázi výzkumu či klinického testování.
Úvod
Demence je trvalý úbytek intelektových schopností oproti předchozí úrovni jedince. Definice americké klasifikace nemocí DSM IV (Diagnostic and Statistical Manual of Mental Disorders IV) uvádí, že nezbytným příznakem syndromu demence je porucha paměti. Současně musí být přítomna alespoň jedna z dalších poruch kognitivních funkcí: afázie (získaná porucha příjmu-percepce a produkce-exprese jazykové složky řeči), apraxie (ztráta schopnosti vykonávat účelné pohyby – výrazové posunky, pohybové stereotypy a naučené dovednosti), agnózie (porucha poznávání předmětů a dalších prvků zevního prostředí nebo vlastního těla) nebo narušení výkonných funkcí (exekutivní funkce – schopnost a dovednost plánovat, rozhodovat se a realizovat cílevědomé postupy a výkony, řešit problémy, tvořit analogie). Tento kognitivní deficit musí dle definice narušovat pacientovy každodenní aktivity [1]. Odhaduje se, že v České republice trpí demencí 100 000 osob [2]. Alzheimerova choroba (AD) představuje 50–70 % případů demence [3]. Demence s Lewyho tělísky (neurodegenerativní onemocnění na pomezí Parkinsonovy a Alzheimerovy choroby) a demence u Parkinsonovy choroby tvoří až 25 % případů a vaskulární demence až 20 % případů z celkového počtu onemocnění [4].
Plně rozvinutý syndrom demence se ve většině případů vyvíjí ze stavu nazývaného mírná kognitivní porucha (MCI, mild cognitive impairment). Jde o poškození kognitivních funkcí, které však nenarušuje běžné aktivity a soběstačnost pacienta [5]. U mírných kognitivních poruch je nejčastěji postiženou funkcí paměť; v takovém případě stav typicky progreduje v Alzheimerovu chorobu. Mírné kognitivní poruchy, při kterých je postižena jiná funkce než paměť, se častěji vyvíjejí ve vaskulární demenci nebo v demenci s Lewyho tělísky [6].
Vzhledem ke snahám o co nejčasnější diagnostiku demencí se na MCI upíná značná pozornost. V současnosti neexistují oficiální doporučení pro její terapii. Studie však ukazují, že podávání donepezilu zpomaluje přechod MCI v Alzheimerovu chorobu. Tento efekt je pozorován prvních osmnáct měsíců léčby, u některých podskupin pacientů s MCI i déle [7].
Terapie
Etiologie většiny demencí včetně Alzheimerovy choroby není dosud objasněna natolik, abychom dokázali vyvinout a používat terapii kauzálně. Tento postup je možný pouze u malého množství typů kognitivních poruch, a to zejména sekundárních. Příkladem je demence při normotenzním hydrocefalu.
Léčebný přístup k pacientovi s demencí by měl být koncipován komplexně, nelze spoléhat pouze na farmakologickou terapii. Nutná je kombinace biologického a psychosociálního přístupu. Doporučuje se vést pacienty k přiměřené fyzické aktivitě a zapojit je do smysluplných činností. Užitečný je kognitivní trénink například v podobě čtení a interpretace textů, her se slovy a křížovek. Osvědčila se také muzikoterapie. Prostředí pacienta bychom měli upravit tak, aby se v něm lépe orientoval.
Farmakoterapeutické možnosti léčby demencí zahrnují i symptomatickou léčbu nekognitivních poruch spojených se syndromem demence. Při depresi a úzkosti podáváme antidepresiva typu SSRI (selective serotonin reuptake inhibitors) či SNRI (serotonin-norepinephrine reuptake inhibitors), při psychotických projevech ordinujeme atypická antipsychotika. K užití psychofarmak přistupujeme až po vyčerpání nefarmakologických postupů vzhledem k rizikům spojeným s jejich podáváním u pacientů vyššího věku. V tomto článku se zaměříme na farmakoterapii kognitivních poruch.
Inhibitory acetylcholinesterázy
Kognitiva ze skupiny inhibitorů acetylcholinesterázy (AChE) zvyšují koncentraci acetylcholinu na cholinergních synapsích. Cholinergní teorie je nejpodrobněji rozpracována u AD. Nízkou koncentraci acetylcholinu nacházíme i u demencí z Lewyho spektra a také u vaskulárních demencí [8]. Inhibitory AChE dokáží pozitivně ovlivnit nejen kognitivní funkce pacienta, ale také snižují tvorbu a toxicitu beta-amyloidu [9]. Zlepšují tak kvalitu života nemocných, oddalují nástup závažných stadií nemoci a prodlužují čas zachované soběstačnosti pacienta. Účinné jsou i při mírných neuropsychiatrických příznacích u pacientů s demencí.
Nežádoucí účinky inhibitorů AChE vycházejí z jejich cholinomimetického působení zejména na periferní cholinergní systém. Mez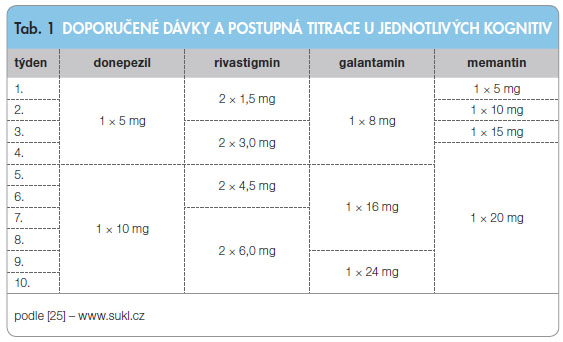 i nejčastější nežádoucí účinky patří gastrointestinální obtíže (nevolnost, zvracení, průjmy, úbytek tělesné hmotnosti), bolesti hlavy, závratě, halucinace a neklid. Projevují se zejména při zahájení léčby, čemuž lze částečně předcházet postupnou titrací dávky (tab. 1), podáváním léku s jídlem nebo v případě léčby rivastigminem využitím transdermální formy léčiva. Zvýšené opatrnosti je třeba u pacientů s poruchami srdečního rytmu, zejména se sklonem k bradykardiím. Inhibitory AChE by neměly být podávány současně s betablokátory nebo digoxinem, pacientům s asthma bronchiale, obstrukční chorobou plicní a vředovou chorobou gastroduodenální v anamnéze. Opatrnost je nutná při celkové anestezii, při níž se v úvodu používají myorelaxancia sukcinylcholinového typu, jejichž účinek může být inhibitory AChE prohlouben.
i nejčastější nežádoucí účinky patří gastrointestinální obtíže (nevolnost, zvracení, průjmy, úbytek tělesné hmotnosti), bolesti hlavy, závratě, halucinace a neklid. Projevují se zejména při zahájení léčby, čemuž lze částečně předcházet postupnou titrací dávky (tab. 1), podáváním léku s jídlem nebo v případě léčby rivastigminem využitím transdermální formy léčiva. Zvýšené opatrnosti je třeba u pacientů s poruchami srdečního rytmu, zejména se sklonem k bradykardiím. Inhibitory AChE by neměly být podávány současně s betablokátory nebo digoxinem, pacientům s asthma bronchiale, obstrukční chorobou plicní a vředovou chorobou gastroduodenální v anamnéze. Opatrnost je nutná při celkové anestezii, při níž se v úvodu používají myorelaxancia sukcinylcholinového typu, jejichž účinek může být inhibitory AChE prohlouben.
Donepezil
Donepezil je centrálně působící reverzibilní nekompetitivní vysoce selektivní inhibitor AChE, chemicky se řadí k piperidinovým derivátům. Studie u pacientů užívajících donepezil prokázaly zlepšení v kognitivních testech. Jen malý počet studií prokázal jeho účinnost na denní aktivity života pacienta, které více odrážejí klinický význam přípravku [10]. Donepezil má z používaných inhibitorů AChE nejdelší biologický poločas eliminace (70 hodin). Metabolizován je v játrech za účasti cytochromu P450. K dispozici je ve formě potahovaných a dispergovatelných tablet. Přípravek je dobře snášen. Mimo výše zmíněné nežádoucí účinky byl velmi vzácně hlášen maligní neuroleptický syndrom, většinou při současném podávání s antipsychotiky. V současné době jsou k dispozici data o větší efektivitě a snášenlivosti vyšších dávek donepezilu (23 mg/den) v léčbě AD. Maximální dávka doporučená v České republice je 10 mg pro die (viz tab. 1).
Rivastigmin
Rivastigmin je karbamátový derivát dobře pronikající přes hematoencefalickou bariéru, který působí jako reverzibilní inhibitor AChE. Z užívaných cholinomimetických kognitiv je jako jediný také inhibitorem butyrylcholinesterázy. Metabolizován je přímo AChE, proto vykazuje minimum lékových interakcí. Rivastigmin je k dispozici ve formě tablet a nově také ve formě náplastí. Podáváním této formy lze zmírnit nežádoucí účinky plynoucí z ovlivnění gastrointestinálního traktu. Rivastigmin byl účinný ve studiích sledujících kognitivní výkon pacientů. Tohoto účinku bylo častěji dosaženo při vyšším dávkování. U studií hodnotících ovlivnění chování a kvality života nebylo prokázáno signifikantní zlepšení v důsledku léčby [10, 11].
Galantamin
Galantamin je terciární alkaloid, který v sobě kombinuje účinek reverzibilní kompetitivní inhibice AChE a alosterickou modifikaci nikotinových receptorů usnadňující cholinergní transmisi. Metabolizován je v játrech za účasti cytochromu P450. V České republice je k dispozici ve formě kapslí. Galantamin pozitivně ovlivňuje kognitivní funkce, některé studie uvádějí také pozitivní působení na chování a kvalitu života [11].
Tacrin
Distribuce tohoto nekompetitivního inhibitoru AChE byla zastavena pro hepatotoxicitu.
Antagonisté receptorů NMDA
Glutamát je hlavní excitační neurotransmiter centrálního nervového systému. Podílí se i na patogenezi některých neurodegenerativních chorob. Jeho nadměrné uvolňování při AD a vaskulární demenci vede k excitotoxickému poškození neuronů. Glutamát se váže na několik typů receptorů, jedním z nich je receptor pro N-methyl-D-aspartát (NMDA). V terapii kognitivních poruch používáme přípravky, které ovlivňují receptory NMDA a omezují tak glutamátem navozenou neurotoxicitu.
Memantin
Memantin je nekompetitivní antagonista receptorů NMDA. Z 80 % se v organismu nemetabolizuje a vylučuje se nezměněný ledvinami. Na trhu je ve formě tablet a perorálního roztoku. Mezi nežádoucí účinky patří závratě, cefalea, únavnost a halucinace. Závažné nežádoucí účinky nebyly zaznamenány. Jeho podávání vedlo ke zlepšení kognitivních funkcí. V kombinaci s donepezilem významně zmírňoval poruchy chování [12]. Memantin je tak možno s efektem a bezpečně přidat k probíhající léčbě inhibitory AChE [13].
Huperzin A
Lykodinový alkaloid z mechu Huperzia serrata působí jako inhibitor AChE a současně jako antagonista receptorů NMDA [14]. Je dostupný jako léčivo v Číně a je deklarován jako složka některých doplňků stravy i u nás. V současnosti není v USA a Evropě schválen jako léčivo pro AD.
Doporučené postupy při léčbě kognitivy v České republice
Pro zhodnocení míry kognitivního deficitu se používá škála MMSE (Mini-Mental State Examination). Tento postup vychází z preskripčních omezení stanovených zdravotními pojišťovnami a neodráží skutečné potřeby pro posouzení tíže, průběhu a léčby onemocnění. Terapie inhibitory AChE je indikována u AD při hodnotě skóre MMSE 25–13 bodů (tab. 2). Po třech měsících provádíme kontrolní vyšetření MMSE. Jestliže od poslední kontroly dojde k poklesu o více než dva body, považuje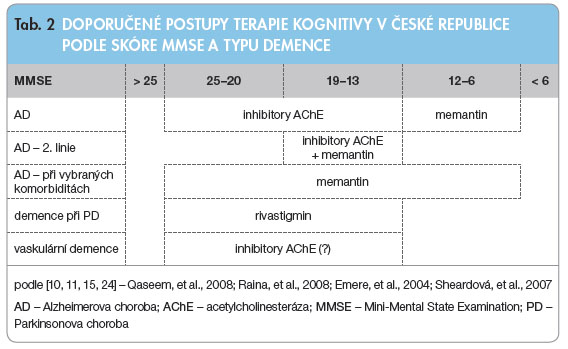 me terapii za neefektivní a léčbu změníme. Kontroly MMSE je nutné opakovat každé tři měsíce.
me terapii za neefektivní a léčbu změníme. Kontroly MMSE je nutné opakovat každé tři měsíce.
U pacientů s těžkou AD, jejichž postižení je vyjádřeno na škále MMSE v rozmezí 12–6 bodů, je indikována terapie memantinem. Memantin používáme také u pacientů s AD, jejichž kognitivní deficit se pohybuje v rozmezí 19–13 bodů a kteří přitom nemohou být léčeni inhibitory AChE z důvodu přidruženého kardiovaskulárního nebo gastrointestinálního onemocnění. Memantin podáváme v kombinaci s inhibitory AChE u pacientů s AD při skóre MMSE 19–13 bodů, pokud se monoterapie inhibitory AChE ukázala jako neefektivní. Většina odborníků si uvědomuje nedostatky a problémy spojené s tímto legislativním omezením a očekává se revize tohoto nařízení.K léčbě demence při Parkinsonově nemoci (MMSE 25–13 bodů) je v České republice jediným registrovaným léčivem rivastigmin [15].
V případě vaskulární demence zatím není k dispozici jasný terapeutický algoritmus. Důraz je kladen na primární a sekundární prevenci cerebrovaskulárního postižení, zejména tedy na kompenzaci arteriální hypertenze, diabetu mellitu a hyperlipidemie. Nebyl prokázán kladný účinek kyseliny acetylsalicylové na kognici pacientů s vaskulární demencí. Předpokládá se komplexní kladný a mírný efekt inhibitorů AChE [10, 11].Nespecifická skupina pacientů s demencí má mírný užitek i z léčby, při níž je podáván výtažek z rostliny ginkgo biloba [16].
Nově zkoumané a klinicky testované terapeutické přístupy
V![Obr. 1 Amyloidová kaskáda. Za fyziologických podmínek je amyloidový prekurzorový protein štěpen za vzniku proteinu sAPPα, který má neuroprotektivní charakter a je solubilní. Za patologických okolností vznikají insolubilní produkty, které po agregaci vytvářejí jádra neuritických plak; podle [25] – Koukolík, et al., 2004. APP – amyloidový prekurzorový protein](https://www.remedia.cz/photo-a-29535---.jpg) ětšina nově zkoumaných přípravků je cílena na ovlivnění amyloidové kaskády v souladu s předpokladem, že primárním etiopatogenetickým mechanismem vzniku demence je ukládání neuritických plak vznikajících chybným štěpením amyloidového prekurzoru enzymy β- a γ-sekretázou za vzniku neurotoxického beta-amyloidu (obr. 1).
ětšina nově zkoumaných přípravků je cílena na ovlivnění amyloidové kaskády v souladu s předpokladem, že primárním etiopatogenetickým mechanismem vzniku demence je ukládání neuritických plak vznikajících chybným štěpením amyloidového prekurzoru enzymy β- a γ-sekretázou za vzniku neurotoxického beta-amyloidu (obr. 1).
Shenck a kol. v roce 1999 prokázali možnost zabránění vzniku neuritických plak aktivní imunizací látkou označenou jako 1792 a její pozitivní vliv na kognitivní funkce, avšak testování muselo být zastaveno pro výskyt závažné postvakcinační encefalitidy u 6 % pacientů [17]. Nyní jsou testovány další látky k pasivní či aktivní imunizaci včetně upravené verze látky 1792 bez neurotoxického potenciálu [18]. Pasivní imunoterapie je založena na udržování umělých hladin protilátek IgG proti beta-amyloidu. Předpokládá se vyšší efektivita u časných stadií AD zabráněním ukládání toxického beta-amyloidu. Klinicky testované jsou např. gantenerumab a solanezumab [18]. Tato léčba je přijímána s opatrností vzhledem k obavám z možných pozdních nežádoucích účinků.Jiným přístupem k pasivní imunizaci je intravenózní podávání imunoglobulinů (IVIG, intravenózní imunoglobulin); IVIG je směs přirozených lidských imunoglobulinů včetně protilátek proti beta-amyloidu. Výsledky pilotních studií ukazují, že IVIG brání tvorbě beta-amyloidu, napomáhají jeho vylučování z mozku a mají protektivní efekt proti beta-amyloidové neurotoxicitě. K běžnému použití v praxi by se přistoupilo po dokončení studií jednoznačně prokazujících klinický účinek této léčby [18].
Další možnou léčebnou strategií je inhibice enzymů zodpovědných za vznik beta-amyloidu. Inhibitory β-sekretázy hůře procházejí přes hematoencefalickou bariéru a jejich významné ovlivnění kognitivních funkcí a kvality života nebylo prokázáno. Inhibitory γ-sekretázy vykazovaly závažné nežádoucí účinky na imunitní systém [19]. Byly testovány i modulátory γ-sekretázy, které ovlivňují pouze část enzymu odpovědnou za štěpení amyloidového prekurzoru. Příkladem může být tarenflurbil, u kterého však nebyl prokázán efekt na paměť a kvalitu života [20].
Enzym α-sekretáza štěpí amyloidový prekurzorový protein za fyziologických podmínek, enzym γ-sekretáza jej štěpí za podmínek patologických a jeho působení vede k nežádoucí amyloidogenní dráze. Na základě skutečnosti, že nízká hladina cholesterolu je asociována se zvýšenou aktivitou α-sekretázy, byly testovány statiny jako její nepřímé aktivátory. Sice byl prokázán účinek ve smyslu snížení incidence AD a redukce neuropatologických změn, nebyl však dostatečně významný pro využití v léčbě [21].
Další zkoumanou možností terapie je plazmaferéza. Použití této metody předpokládá existenci dynamické rovnováhy mezi koncentrací beta-amyloidu v krvi a v likvoru. Plazmaferézou snižujeme sérovou koncentraci beta-amyloidu a tím nepřímo koncentraci této látky v likvoru [22]. První dostupné výsledky prokazují zlepšení kognitivních funkcí. Širokému rozšíření do praxe brání zejména procedurální náročnost léčby (zajištění centrálního žilního katétru, monitoring pacienta, personální zatížení).
Současné studie zkoumají také odezvu na farmakoterapii AD v závislosti na fenotypu (věk, propuknutí onemocnění, jeho závažnost a dynamika) a genotypu apolipoproteinu E. S tímto tzv. farmakogenomickým přístupem bychom dosáhli efektivnějšího využití již dostupných léčiv [23]. Dalšími směry, kterými se ubírají terapeutické snahy, je ovlivnění primárních, respektive sekundárních zánětlivých změn či ovlivnění degenerativních změn rozvíjejících se v rámci neurodegenerativního procesu. Testují se antagonisté fosfodiesteráz, agonisté nikotinových receptorů, antagonisté receptorů pro konečné produkty pokročilé glykace, látky ovlivňující mitochondriální funkce a modulující zánětlivé reakce, vakcíny proti patologicky změněnému τ-proteinu a další [18].
Závěr
V současné době máme pro léčbu demencí k dispozici inhibitory AChE a memantin. V odborných periodikách se stále setkáváme s informacemi o nových výzkumech a probíhají klinické studie zabývající se vývojem léčby kognitivních poruch. Jejich výsledky je ale potřeba přijímat s jistou dávkou skepse. Samotná šíře testovaných skupin látek svědčí o tom, že etiopatogeneze degenerativních onemocnění mozku je stále málo prozkoumaná a není jasný relativní význam jednotlivých patologických dějů. Například některými autory začíná být zpochybňována zásadní úloha amyloidových plak. Ukazuje se, že míra jejich výskytu nekoreluje s tíží klinického obrazu. Dalším problémem je včasná a správná diagnostika demencí, respektive kognitivních poruch. Dosud nemáme spolehlivý laboratorní ukazatel pro stanovení diagnózy a sledování efektivity léčby. Vývoj nových léčiv také znesnadňuje nedostupnost plnohodnotného zvířecího modelu a faktická nemožnost testovat jej psychologickými testy, které jsou v diagnostice kognitivních funkcí zásadní.Vzhledem k rostoucím přímým i nepřímým nákladům na léčbu a ošetřování pacientů s demencí a k celosvětovému stárnutí populace je zřejmé, že demence bude extrémním způsobem zatěžovat zdravotní systémy. Potřeba zvládnout tento nejen vědecký, ale také socioekonomický problém je proto velká.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00179906.
Seznam použité literatury
- [1] American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition (DSM-IV). Washington: American Psychiatric Association 1994: 143–147.
- [2] Jirák R. a kol. Demence a jiné poruchy paměti. Grada Publishing, 2009.
- [3] Alzheimer’s Association. Alzheimer‘s Disease Facts and Figures. www.alz.org [Accessed March 15, 2008].
- [4] Kalvach Z, Zadák Z, Jirák R, Zavázalová H, Sucharda P. a kol. Geriatrie a gerontologie. Grada Publishing, 2004.
- [5] Petersen RC, Smith GE, Waring SC, et al. Mild cognitive impairment: clinical characterization and outcome. Arch Neurol 1999; 56 : 303–308.
- [6] Sheardová K. Mírná kognitivní porucha v praxi. Psychiatrie pro praxi 2010; 11: 62–65.
- [7] Petersen RC, Thomas RG et al for the ADCS Group: Vitamin E and donepezil for the treatment of mild cognitive impairment. N Engl J Med 2005; 352: 2379–2388.
- [8] Lemstra AW, Eikelenboom P, van Gool WA. The cholinergic deficiency syndrome and its therapeutic implications. Gerontology 2003; 49: 55–60.
- [9] Francis PT, Palmer AM, Snape M, et al. The cholinergic hypothesis of Alzheimer‘s disease: A review of progress. J Neurol Neurosurg Psychiatry 1999; 66: 137–147.
- [10] Qaseem A, Snow V, Cross Jr. JT, et al. Current pharmacologic treatment of dementia: A clinical practice guideline from the American College of Physicians and the American Academy of Family Physicians. Ann Intern Med 2008; 148: 370–378.
- [11] Raina P, Santaguida P, Ismaila A, et al. Effectiveness of cholinesterase inhibitors a memantine for treating dementia: evidence review for a clinical practice guideline. Ann Intern Med 2008; 148: 379–397.
- [12] Tariot PN, Farlow MR, Grossberg GT, et al. Memantine treatment in patients with moderate to severe Alzheimer disease already receiving donepezil: A randomized controlled trial. J Am Med Assoc 2004; 291: 317–324.
- [13] McCulloch DK, Cohen A, Chris A, et al. Dementia and Cognitive Imapairment Diagnosis and Treatment Guideline, GroupHealth, Guideline Oversight Group 2012; 1–27.
- [14] Drtinová L, Pohanka M. Možnosti využití huperzinu A v léčbě Alzheimerovy nemoci. Chem Listy 2013; 107: 12–15.
- [15] Emere M, Aarsland D, Albanese A, et al. Rivastigmine for dementia associated with Parkinson´s disease. N Engl J Med 2004; 351: 2509–2518.
- [16] Le Bars PL, Katz MM, Berman N, et al. A placebo-controlled, double-blind, randomized trial of an extract of ginkgo biloba for dementia. J Am Med Assoc 1997; 278: 1327–1332.
- [17] Shenk D, Barbour R, Dunn W, et al. Immunization with amyloid-beta attenuates Alzheimer-disease-like pathology in the PDAPP mouse. Nature 1999; 400: 173–177.
- [18] Lemere CA, Masliah E. Erratum: Can Alzheimer disease be prevented by amyloid-β immunotherapy? Nat Rev Neurol 2010; 6: 108–119. DOI: 10.1038/nrneurol.2009.219). Nat Rev Neurol 2010; 6: 183.
- [19] Jirák R. Nové postupy v biologické terapii demencí. Psychiat pro Praxi 2010; 11: 143–144.
- [20] Green RC, Schneider LS, Amato DA, et al. Effect of tarenflurbil on cognitive decline and activities of daily living in patients with mild Alzheimer disease: A randomized controlled trial. JAMA 2009; 302: 2557–2564.
- [21] Hussain HM, Zakria M, Arshad AR. Statins, incident Alzheimer disease, change in cognitive function, and neuropathology. Neurology 2008; 71: 2019.
- [22] Boada M, Ortiz P, Anaya F, et al. Amyloid-targeted therapeutics in Alzheimer’s disease: Use of human albumin in plasma exchange as a novel approach for Aβ mobilization. Drug News Perspect 2009; 22: 325–339.
- [23] Sampaio C. Alzheimer disease: Disease modifying trials; where are we? Where do we need to go? A reflective paper. Research and Practice in Alzheimer’s Disease 2006; 11: 34–40.
- [24] Sheardová K, Hort J, Rusina R, et al. Doporučené postupy pro léčbu Alzheimerovy nemoci a dalších onemocnění spojených s demencí. Cesk Slov Neurol N 2007; 70: 589–594.
- [25] Koukolík F, Jirák R. Demence. Galén, 2004.
- [26] Databáze léků, www.sukl.cz.