Farmakoterapie jaterní cholestázy
Poslední desetiletí přineslo zásadní změny v pochopení mechanismu tvorby žluče, transportu jednotlivých složek žluče ze sinusoidální do bazolaterální membrány a do žluče. Pokrok nastal objevením specifických transportních nosičů a vyvrcholil pochopením významu nukleárních receptorů při tvorbě žluče. Původně pouze empirická léčba je nyní opřena o přesně definované mechanismy zásahu do jednotlivých transportních mechanismů. Do popředí se dostalo studium adaptačních mechanismů provázejících cholestázu. Nové terapeutické možnosti vycházejí především z podpory a posílení adaptačních mechanismů. Centrální postavení v léčbě chronických cholestatických onemocnění zaujímá kyselina ursodeoxycholová (UDCA). Po prvých rozpacích při její aplikaci je dnes léčba opřena jak o experimentální výsledky, tak o dlouhodobé randomizované studie. Je možno konstatovat, že kyselina ursodeoxycholová změnila život nemocných s dlouhodobou cholestázou. Daří se, především při zahájení léčby v časném stadiu onemocnění, tyto nemocné dlouhodobě stabilizovat a zabránit rychlé progresi onemocnění. Další dosud nevyužité možnosti jistě přináší i dlouhodobá aplikace rifampicinu. Vzhledem k tomu, že obě tyto látky uplatňují svůj léčebný efekt přes různé skupiny transportérů, je v krátké době možno očekávat výsledky kombinované léčby UDCA s rifampicinem. Zcela nové možnosti přináší objevení centrální role nukleárních receptorů v mechanismu tvorby žluče a při adaptačních procesech při chronické cholestáze. Především využití vysoce účinných agonistů FXR by v brzké době mělo přinést další pokrok v léčbě těchto závažných stavů. Aplikace byly již provedeny experimentálně a výsledky prvých klinických studií je možno očekávat v krátké době. Chronická cholestáza je klasickým příkladem promítnutí výsledků základního výzkumu do oblasti terapie. Je to cesta dlouhá, ale velmi účinná.
Úvod
Poslední desetiletí znamenají velký pokrok v pochopení mechanismu tvorby žluče, molekulární patobiochemie cholestázy, odhalení řady genetických defektů podílejících se na vzniku cholestatických onemocnění, ale i významný pokrok v oblasti terapie cholestatických onemocnění.
Cholestatických onemocnění v posledních desetiletích významně přibývá – hormonálně podmíněné cholestázy v klimakteriu, vzrůstá počet polékových poškození i cholestáz provázejících zánětlivá onemocnění. Na vzestupu jsou i chronická cholestatická onemocnění, především primární biliární cirhóza (PBC) a primární sklerotizující cholangoitida (PSC). Syndrom cholestázy provází velký počet velmi různorodých poškození jater a žlučových cest. Řada cholestatických změn je v prvé fázi plně reverzibilní. Při dlouhodobém trvání cholestázy však dochází k rozsáhlému poškození funkce hepatocytů, onemocnění progreduje a řada cholestatických syndromů končí ireverzibilním poškozením jater a jaterním selháním. Cholestatická onemocnění jater představují významnou skupinu onemocnění jater, která jsou indikována k jaterní transplantaci.
Definice cholestázy
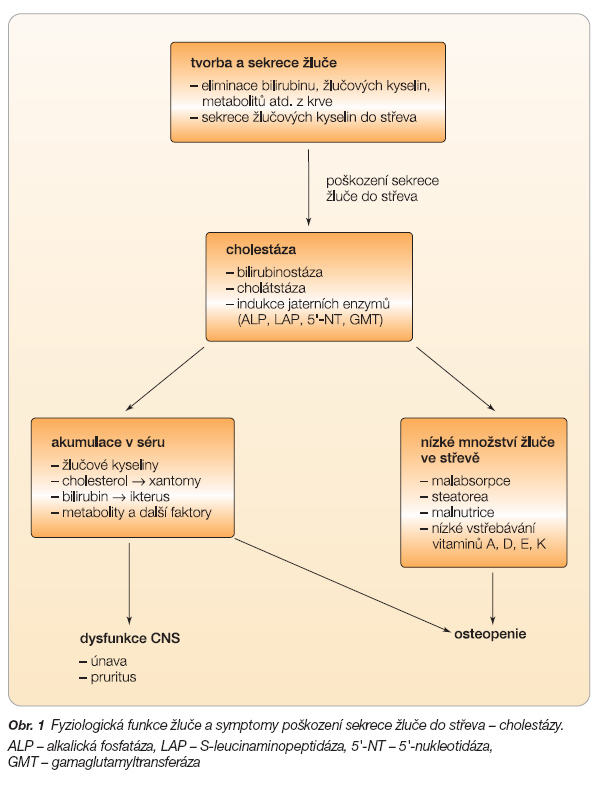
Cholestáza je porucha tvorby a vylučování žluče nebo selhání schopnosti organismu dodat do duodena dostačující množství žluče odpovídajícího složení.
Cholestáza vede ke kumulaci složek žluče v játrech (bilirubinostáza, cholátstáza, indukce jaterních enzymů), druhotně pak ke kumulaci složek žluče v séru, k modulaci funkce CNS a poruše sekrece do střeva, viz obr. 1.
Porucha může být lokalizována od jaterní buňky přes primární žlučovody a vývodné cesty žlučové až po Vaterskou papilu. Je-li příčina v játrech, je porucha označována jako intrahepatální cholestáza (příčina může být hepatocelulární nebo cholangiocelulární). Je-li příčina mimo játra, označujeme cholestázu jako extrahepatální.
Cholestázu můžeme dělit podle různých hledisek: akutní cholestáza (septické stavy, léky, hormony), chronická cholestáza (primární biliární cirhóza – PBC, primární sklerotizující cholangoitida – PSC, léky, syndrom mizejících žlučovodů – VBDS), cholestáza anikterická, cholestáza ikterická, cholestáza s poškozením hepatocytů, cholestáza bez poškození hepatocytů.
Z klinického pohledu se ukazuje jako velmi prospěšné dělení cholestáz do čtyř velkých skupin:
– ‑nezánětlivé cholestázy (hormony, léky, sepse, intrahepatální cholestáza těhotných, cholestázy při parenterální výživě, paraneoplastická cholestáza),
– ‑cholestázy zánětlivé (cholestatické hepatitidy, virové hepatitidy, léky, alkohol),
– ‑cholestázy při poškození žlučovodů (PBC, PSC, VBDS),
– ‑mechanické cholestázy (tumory, konkrementy, PSC, extraluminální komprese).
Ve spektru cholestáz jednoznačně dominují cholestázy extrahepatální, kde převažující část – až 50 % – tvoří maligní onemocnění, na druhém místě je cholelitiáza. Velmi častou příčinou cholestázy jsou septické stavy, polékové cholestázy se podílejí necelými 10 %, virové a autoimunitní hepatitidy 5–7 %.
V diferenciální diagnostice u intrahepatální cholestázy je zásadní vyšetření laboratorní – biochemické markery cholestázy, imunologické vyšetření a při nejasném nálezu genetické testování. Významným přínosem je provedení jaterní biopsie, která umožňuje odlišit zánětlivou a nezánětlivou cholestázu a poškození malých žlučovodů.
U extrahepatální cholestázy je diagnóza opřena především o zobrazovací metody. V klinickém spektru cholestáz se v posledním období objevily i nové klinické jednotky, jakými jsou syndrom mizejících žlučovodů (VBDS) a překryvné syndromy (AIH-PBC-PSC).
Molekulární mechanismus tvorby žluče
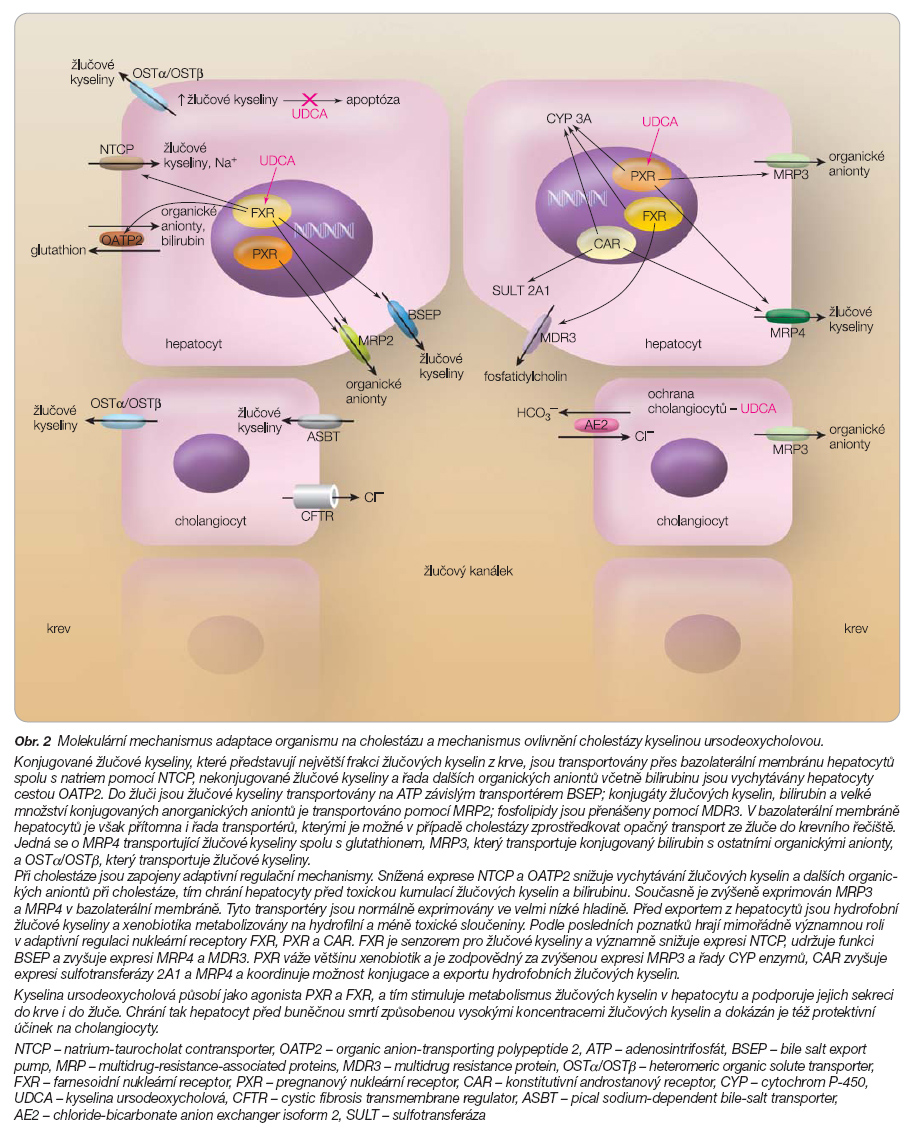
Nejvýznamnějším mechanismem pro tvorbu hepatocelulární žluče je sekrece žlučových kyselin ze sinusoidální krve do žluče. Konjugované žlučové kyseliny, které představují největší frakci žlučových kyselin z krve, jsou transportovány přes bazolaterální membránu hepatocytů spolu s natriem cestou natrium-taurocholate contransporter (NTCP, SLC10A1), nekonjugované žlučové kyseliny a řada dalších organických aniontů včetně bilirubinu jsou vychytávány hepatocyty cestou organic anion-transporting polypeptide 2 (OATP2, SLC21A6). Limitujícím krokem při tvorbě žluče je aktivní transport žlučových kyselin a ostatních solutů přes kanikulární membránu hepatocytů.
Transport je řízen řadou na ATP závislých exportních pump (ATP-binding-cassette-transport protein) – také známých jako ABC transportéry. Žlučové kyseliny jsou transportovány prostřednictvím bile salt export pump (BSEP, ABCB11), zatímco bilirubin diglukuronid, glutathion, divalentní konjugáty žlučových kyselin a velké množství konjugovaných organických aniontů je transportováno cestou multidrug resistance associated protein 2 (MRP2, ABCB4). Translokace fosfolipidů z vnitřní vrstvy kanalikulární membrány na zevní vrstvu je zprostředkována dalším proteinem ze skupiny ABC transportních proteinů – multidrug resistance protein 3 (MDR 3, ABCB4) [1]. Tyto kroky jsou nezbytné pro tvorbu smíšených micel v jaterní žluči tvořené z cholesterolu, žlučových kyselin a fosfolipidů. Definitivní složení žluče je pak ovlivňováno dalšími transportéry v kanalikulární membráně hepatocytů, ale také transportéry v cholangiocytech, které mění jaterní žluč na cholangiocelulární žluč. Směnný transportér chloridů za bikarbonát (chlorid-bicarbonat anion exchange 2, AE2, SLC10A2) je přítomen jak v apikální membráně hepatocytů, tak v epiteliálních buňkách žlučových duktů, zatímco další transportér, regulátor chloridového kanálu (cystic fibrosis transmembrane conductance regulator, CFTR, ABCC7), je lokalizován pouze v apikální membráně epiteliálních buněk žlučových cest [2].
V bazolaterální membráně hepatocytů je však přítomna i řada transportérů, kterými je možné v případě cholestázy zprostředkovat opačný transport ze žluče do krevního řečiště. Jedná se o MRP4 (ABCC4) transportující žlučové kyseliny spolu s glutathionem, MRP3 (ABCC3), který transportuje konjugovaný bilirubin s ostatními organickými anionty, a OSTa/OSTb (heteromeric organic solute transporter), transportér žlučových kyselin. Při cholestáze jsou MRP3 a OSTa/OSTb zvýšeně exprimovány v bazolaterální membráně cholangiocytů.
Molekulární mechanismus cholestázy
Poruchy sekrece žluče mohou být vrozené, např. různé formy progresivní familiární intrahepatální cholestázy (PFIC), benigní rekurentní intrahepatální cholestázy (BRIC) nebo cystické fibrózy. Mnohem častější jsou však získané poruchy sekrece žluče způsobené záněty, toxiny, hormony, léky nebo cizorodými látkami [3].
Dojde-li v důsledku mutace v genu pro BSEP k defektu, porucha se manifestuje buď jako PFIC2 (progresivní familiární intrahepatální cholestáza 2. typu), nebo jako BRIC2 (benigní rekurentní intrahepatální cholestáza 2. typu); PFIC2 může být identifikována imunosteningem BSEP v jaterní biopsii.
Mutace MRP2 je příčinou Dubinova-Johnsonova syndromu, který nemá manifestaci úplné cholestázy, ale je spíše selektivní poruchou sekrece organických aniontů, především bilirubinu. Mutace v MDR3 je příčinou PFIC3 (progresivní familiární intrahepatální cholestáza 3. typu) a mutace CFTR způsobuje cystickou fibrózu.
Získané poruchy sekrece žluče – při zánětlivých onemocněních, jako je sepse, bakteriální infekce, virové hepatitidy – stejně jako toxická nebo léky indukovaná hepatitida či zánětlivé cytokiny mohou vést k poruše sekrece žluče. TNF-a a IL-1b snižují expresi NTCP a BSEP a MRP2, který je odpovědný za transport bilirubinu a dalších organických aniontů. Rovněž léky mohou inhibovat funkci hepatobiliárních transportních proteinů. Některé léky mohou inhibovat BSEP přímo uvnitř hepatocytu, což je označováno jako cis-inhibice, příkladem je cyklosporin A, glibenklamid, troglitazon nebo bosentan. Další léky jako estradiol 17b D-glukuronid musí však být nejdříve transportovány do kanalikulární membrány cestou MRP2 a zde inhibují BSEP z vnitřního listu dvojvrstvy. To je označováno jako transinhibice.
Obstrukce toku žluče může být také způsobena vrozeným defektem, jako je tomu např. u cystické fibrózy nebo u PFIC3, ale může být i získaná, např. u PBC, PSC, VBDS.
U cholestatických onemocnění způsobených primárně poškozením cholangiocytů, příkladem je imunologické poškození v případě PBC, nebo vysokou koncentrací hydrofobních žlučových kyselin (v milimolární koncentraci) může prohlubující se poškození žlučovodů vést k jejich destrukci až k jejich vymizení a k progresi obstruktivní cholestázy. Tento jev bývá označován jako extracelulární toxicita žlučových kyselin v kontrastu k intracelulární toxicitě při akumulaci žlučových kyselin v hepatocytech (v mikromolární koncentraci). Extracelulární toxicita žlučových kyselin proti epitelu žlučových cest se také může manifestovat, jestliže je nízký obsah fosfolipidů ve žluči, např. při vrozeném defektu u PFIC3 (progresivní familiární intrahepatální cholestázy 3. typu) nebo při tzv. nízkofosfolipidovém syndromu, nízkofosfolipidové cholelitiáze [4] nebo při inbalanci fosfolipidů po jaterní transplantaci.
Adaptivní odpověď na cholestázu
Při cholestáze jsou zapojeny adaptivní regulační mechanismy, a to jak v játrech, tak i v ledvinách a ve střevě [5].
Snížená exprese NTCP a OATP2 snižuje vychytávání žlučových kyselin a dalších organických aniontů při cholestáze, tím chrání hepatocyty před toxickou kumulací žlučových kyselin a bilirubinu. Současně je zvýšeně exprimován MRP3 a MRP4 v bazolaterální membráně. Tyto transportéry jsou normálně exprimovány ve velmi nízké hladině. MRP4 pumpuje žlučové kyseliny a konjugáty žlučových kyselin spolu s glutathionem z buněk do krve, a tím snižuje retenci žlučových kyselin v cholestatických hepatocytech. MRP3 pak exportuje ostatní organické anionty. Před exportem z hepatocytů jsou hydrofobní žlučové kyseliny a xenobiotika metabolizovány na hydrofilní a méně toxické sloučeniny cytochromem P-450 3A. Velká frakce žlučových kyselin je sulfátována sulfotransferázou [6].
Podle posledních poznatků hrají mimořádně významnou roli v adaptivní regulaci nukleární receptory FXR, PXR, CAR a VDR (obr. 2) [7, 8].
FXR – farnesoidní nukleární receptor – je senzorem pro žlučové kyseliny a významně snižuje expresi NTCP, udržuje funkci BSEP a zvyšuje expresi MRP4 a MDR3.
PXR – pregnanový nukleární receptor – váže většinu xenobiotik a je zodpovědný za zvýšenou expresi MRP3 a řady CYP enzymů, zvláště CYP3A. Je zřejmé, že některé z těchto nukleárních receptorů mohou působit na transportéry.
Nedávno bylo ukázáno, že CAR – constitutive androstane receptor – zvyšuje expresi sulfotransferázy 2A1 a MRP4 a koordinuje možnost konjugace a exportu hydrofobních žlučových kyselin. Ve vazbě na PXR je zvýšena exprese PPAR-a (peroxisome-proliferator activated receptor), který zvyšuje expresi MDR3 [9].
Je významné, že kromě vazby přirozených žlučových kyselin jsou některé deriváty žlučových kyselin, jako je ethyl-chenodeoxycholová kyselina, vázány na FXR. Na PXR je vázána řada xenobiotik, ale také některá léčiva, např. rifampicin [10]. Bilirubin a fenobarbital jsou ligandy pro CAR. Fibráty a statiny jsou ligandy pro PPAR-a [11].
Dalším významným nukleárním receptorem je VDR (NR111) vitamin D receptor, na který jsou významně vázány hydrofobní žlučové kyseliny, především kyselina litocholová [12].
Především tyto objevy otvírají možnosti pro nové terapeutické cesty při vývoji látek, které vazbou na nukleární receptory budou schopny stimulovat normální kompenzatorní mechanismy při cholestáze a stimulovat eliminaci toxických látek, hromadících se při cholestáze v hepatocytech i mimo ně cestou alternativních exkrečních cest.
Farmakoterapie cholestázy
Cíle farmakoterapeutického zásahu
Všechny formy cholestázy vedou k retenci žlučových kyselin v hepatocytech. Elevace žlučových kyselin vede k apoptóze a nekróze hepatocytů a tím k chronickým cholestatickým onemocněním jater. Některá cholestatická onemocnění jsou provázena únikem žlučových kyselin do peribiliárních prostorů, a tím se stávají příčinou portálního zánětu a fibrotizace indukcí chemokinů a cytokinů.
Léčba pacientů s cholestatickými jaterními onemocněními by měla být zaměřena na tyto cíle:
1. ‑stimulace ortográdní i retrográdní sekrece žlučových kyselin a ostatních toxických komponent do systémové cirkulace pro zvýšenou exkreci ledvinami, dochází ke snížení jejich koncentrace v cirkulaci i v hepatocytech;
2. ‑stimulace metabolismu hydrofobních žlučových kyselin a ostatních toxických látek na více hydrofilní, a proto méně toxické metabolity;
3. ‑ochrana cholangiocytů proti toxickému působení žluče;
4. ‑inhibice apoptózy a nekrózy jaterních buněk způsobených zvýšenou hladinou cytotoxických žlučových kyselin a cytokinů;
5. ‑inhibice fibrózy způsobené únikem žlučových kyselin do peribiliárních prostorů.
Stimulace sekrece
Sekrece žlučových kyselin a ostatních potenciálně toxických látek může být stimulována zvýšenou expresí transportérů nebo jejich funkce na různé úrovni především na hladině transkripce, translace a aktivace proteinů.
U myší bylo prokázáno, že kyselina cholová a ursodeoxycholová stimuluje expresi BSEP a MRP2 mRNA. To nemusí plně platit u lidí vzhledem k druhové odlišnosti vazby žlučových kyselin na nukleární receptory [3]. O rifampicinu, který se váže na nukleární receptor PXR, však bylo prokázáno, že stimuluje expresi MRP2 a úroveň transkripce, a tím zvyšuje sekreci žlučových kyselin do krve. Pro ursodeoxycholovou kyselinu byla prokázána stimulace transportéru BSEP a MRP2 na kanalikulární membráně hepatocytů. BSEP a MRP2 na kanalikulární membráně jsou inhibovány taurolitocholovou kyselinou, která je výrazně elevována při cholestáze [13]. Tento nepříznivý efekt je možno inhibovat podáním tauroursode-oxycholové kyseliny [14]. Tomu odpovídají klinické zkušenosti. U osob s PBC snižuje podání kyseliny ursodeoxycholové sérovou hladinu hydrofobních žlučových kyselin a kyseliny chenodeoxycholové. U osob s PBC bylo rovněž prokázáno, že podání kyseliny ursodeoxycholové zvyšuje expresi MRP2 mRNA v jaterní tkáni. Z toho je možno vyvodit závěr, že kyselina ursodeoxycholová zlepšuje exkreční schopnosti u osob s PBC. Tento fakt byl potvrzen v randomizované studii Pouponem. Dvouleté léčení osob s PBC kyselinou ursodeoxycholovou je provázeno statisticky významným poklesem hladiny bilirubinu.
Stimulace metabolismu
Základním krokem je přeměna hydrofobních žlučových kyselin na více hydrofilní a méně toxické substance. Pro rifampicin bylo prokázáno jak v experimentu, tak v klinických studiích, že významně stimuluje expresi CYP3 mRNA a podporuje močovou exkreci 6b-hydroxykortisolu. Tento efekt nemá UDCA.
Ochrana cholangiocytů
V této oblasti je důležitý především efekt UDCA, která významně mění složení žluče vzestupem obsahu hydrofilních žlučových kyselin a zvýšením exkrece fosfolipidů do žluče.
Inhibice apoptózy
U potkanů krmených hydrofobní žlučovou kyselinou – kyselinou deoxycholovou – stoupá apoptóza hepatocytů provázená jejich zánikem. Přidáním UDCA je možno tento efekt inhibovat [15]. Podání kyseliny chenodeoxycholové vede k apoptóze cestou aktivace receptoru CD95, který indikuje zánik hepatocytů aktivací signálního komplexu DISC (death inducing signalling complex) a aktivací kaspázy 8. Kaspáza 8 vede k zániku buněk cestou poškození mitochondriální membrány. Přidání UDCA stabilizuje mitochondriální membránu, inhibuje kaspázu 8 a apoptózu. Antiapoptotický efekt byl prokázán i na lidských hepatocytech [16].
Inhibice fibrózy
Inhibice fibrózy je jistě zásadním krokem v léčbě cholestatických onemocnění. U krys byla prokázána inhibice fibrózy podáváním 6-ethyl chenodeoxycholové kyseliny [17]. Tento antifibrotický efekt byl zprostředkován cestou FXR a SHD jaderných receptorů [18]. V nedávné době byl demonstrován i antifibrotický efekt NOR-UDCA u knockoutovaných myší. Zbývá prokázat, že tyto experimentální výsledky jsou platné i pro lidskou populaci. Zde se otvírá nová významná cesta k vývoji látek schopných inhibovat fibrotizaci u cholestatických onemocnění.
Charakteristika léčivých látek
Modelovým onemocněním je primární biliární cirhóza (PBC). PBC je charakterizována zánětlivým poškozením intratubulárních žlučovodů vedoucím k jejich destrukci, postupně k fibrotizaci až k jaterní cirhóze. Patogeneze zvolna progredujícího onemocnění je neznámá, jedná se o imunologickou destrukci drobných žlučovodů, která je prohlubována přítomností cytotoxických žlučových kyselin. Onemocnění vede k obstrukci, zániku malých žlučovodů, k cholestáze, retenci žlučových kyselin, k poškození hepatocytů, apoptóze, k fibrotizaci, jaterní cirhóze a v pokročilých případech až k jaternímu selhání. Vzhledem k neznámé etiologii jsou současné terapeutické snahy zaměřeny na zpomalení jaterního poškození, oddálení progrese choroby.
Ursodeoxycholová kyselina
V terapii byla zkoušena řada postupů a látek, ale je nutné konstatovat, že pouze podávání kyseliny ursodeoxycholové (UDCA) je jedinou účinnou léčbou, která vychází z výsledků randomizovaných a dlouhodobých klinických studií.
Všechny ostatní terapeutické pokusy byly buď neúspěšné, nebo byly provázeny výskytem závažných vedlejších účinků. Základem terapeutického účinku je změna složení žluče po podání UDCA – nastává vzestup obsahu hydrofilních žlučových kyselin, což vede k poklesu toxického poškození epitelu žlučových cest, k poklesu retence žlučových kyselin v hepatocytech a k inhibici apoptózy. UDCA významně ovlivňuje složení smíšených micel bohatých na fosfolipidy, čímž brání přímému kontaktu žluče s cholangiocyty. Další mechanismy byly již zmíněny v předchozích odstavcích. Jedná se především o stimulaci exprese trasportérů BSEP, MDR3, MRP2, fosforylaci proteinových nosičů a proteinových kináz a fosfatáz. Za zásadní se považuje ovlivnění nukleárního receptoru PXR (pregnanového nukleárního receptoru) a FXR (farnesoidního nukleárního receptoru), UDCA je jejich silným agonistou. UDCA rovněž stimuluje sekreci chloridů a bikarbonátu cholangiocyty. Lidské cholangiocyty secernují na bikarbonáty a chloridy bohatou tekutinu, která tvoří až 25 % objemu denně vytvořené žluče.
Samotné podání imunosupresivních látek v terapii PBC mělo omezený efekt. Imunosupresiva – methotrexát, cyklosporin A, kolchicin, budesonid, prednisolon – byla nejčastěji používána v kombinaci s UDCA. Některé publikace podporují názor, že kombinace UDCA s budesonidem potencuje efekt UDCA [19].
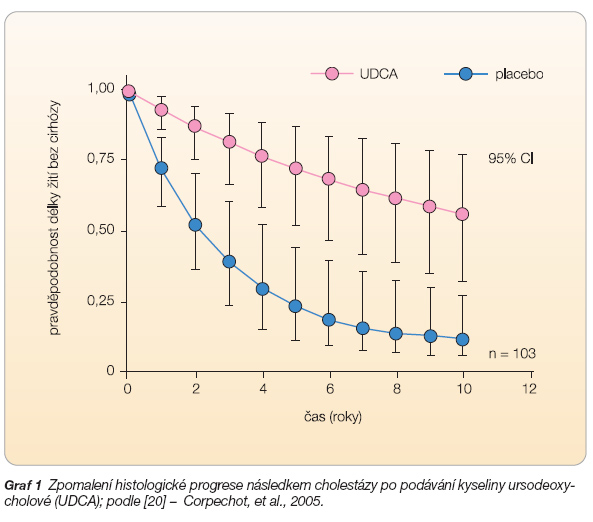
Ve dvojitě slepých studiích bylo jednoznačně potvrzeno, že podávání UDCA v dávce 13–15 mg/kg hmotnosti zlepšuje biochemické parametry – hladinu bilirubinu, obstrukčních enzymů, Mayo risk skóre i jaterní histologii. UDCA inhibuje především histologickou progresi v časných stadiích PBC (graf 1) [20].
Léčba vede k oddálení vzniku portální hypertenze a objevení se jícnových varixů.
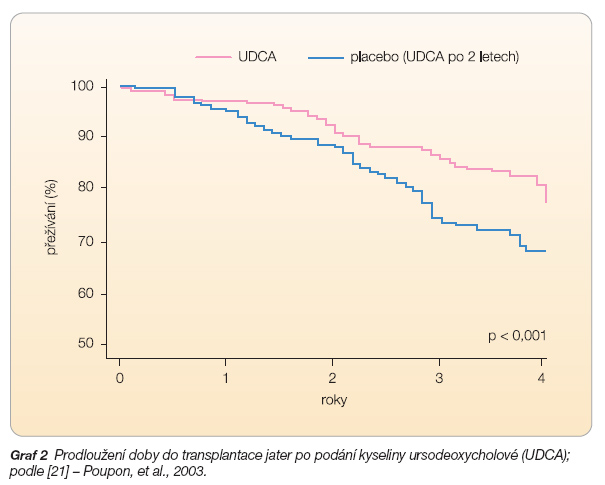
V rozsáhlé randomizované studii bylo rovněž prokázáno, že 4leté podávání UDCA oddálí čas nezbytnosti jaterní transplantace i úmrtí. Tento efekt byl zaznamenán až po více než 2 letech podávání UDCA (graf 2). Dávka nižší než 10 mg/kg/den je nedostatečná a její podávání nevede ke zlepšení prognózy PBC [21].
Příznivý a prokázaný pozitivní efekt podání UDCA byl potvrzen i u řady dalších cholestatických onemocnění – primární sklerotizující cholangoitidy (PSC) [22], těhotenské cholestázy [19], jaterních poruch u cystické fibrózy a u cholestáz indukovaných léčivy. Pozitivní efekt byl prokázán rovněž v léčbě pediatrických cholestatických poruch [23]. Data z poslední doby ukazují, že podání UDCA snižuje i riziko vzniku jaterních i extrahepatálních malignit u PSC – včetně cholangiocelulárního karcinomu a karcinomu kolon.
Velmi pozitivním zjištěním je i skutečnost, že mnohaletá aplikace UDCA není provázena závažnějšími vedlejšími účinky. Pro řadu pacientů s chronickým cholestatickým onemocněním se jedná o celoživotní léčbu.
Rifampicin
Rifampicin je silným ligandem PXR jaderného receptoru. Byl opakovaně úspěšně použit v léčbě pruritu u dětí i dospělých [24]. Rifampicin zlepšuje jaterní funkce i u nemocných s PBC. Rifampicin je silným blokátorem lidského CYP7A a tímto mechanismem blokuje syntézu žlučových kyselin [25]. Bylo prokázáno, že zvyšuje exkreci konjugátů žlučových kyselin s glukuronidy do moče. Rovněž stimuluje 6a-hydroxylaci žlučových kyselin stimulací CYP 3A4 [26]. Po podávání rifampicinu se zvyšuje exprese mRNA pro CYP3A4 a MPR2, které reguluje prostřednictvím nukleárního receptoru PXR.
Je podáván v dávce 300–450 mg/den. Ústup pruritu je významný již po 7 dnech. Dlouhodobá léčba je však omezena některými nežádoucími příznaky. V průběhu léčby je nebezpečí hepatotoxicity až vzniku medikamentózně indukované hepatitidy. Bylo pozorováno i zvýšené riziko tvorby žlučových konkrementů a snížení hladiny 25-OH cholekalciferolu. Dlouhodobé podávání je omezeno i rizikem vzniku rezistentních bakteriálních infekcí. Většina nemocných však léčbu dobře toleruje. Dlouhodobé zkušenosti pocházejí především z terapie dětí, kde v publikovaných pracích bylo zaznamenáno 18měsíční léčení bez zvýšeného výskytu nežádoucích reakcí. Nemocné pro tento typ léčby je třeba pečlivě vybírat a pravidelně monitorovat.
Fenobarbital
Je silným aktivátorem CAR nukleárního receptoru (constitutive androstane receptor, CAR, NR113). Stimuluje translokaci CAR z cytoplazmy do nukleolů, kde má řadu efektů na jaderné transkripci. Fenobarbital byl opakovaně podáván nemocným s PBC a vedl k poklesu sérového bilirubinu, sérové hladiny žlučových kyselin a ke změně poměru chenodeoxycholová kyselina/cholová kyselina. Velmi pozitivní byl jeho efekt na ovlivnění pruritu [24]. Vedlejšími efekty byl především různý stupeň sedace a formace neaktivních metabolitů vitaminu D. Vedlejší účinky jsou významným omezením jeho dlouhodobého klinického použití. Ve studii srovnávající efekt fenobarbitalu s rifampicinem v léčbě nemocných s PBC byla prokázána jeho nižší účinnost [27].
S-adenosyl-L-methionin (SAME)
Byl rovněž zkoušen v léčbě nemocných s cholestatickými onemocněními, především u cholestázy těhotných. Byl podáván v dávce 750–1500 mg/den perorálně a rovněž intravenózně. Byl prokázán jeho pozitivní efekt jak v léčbě pruritu, tak při ovlivňování biochemických parametrů. Efekt jeho podávání by měl být opřen především o jeho antioxidační účinky a zlepšení membránové fluidity [28]. Ověřen byl i v dvojitě slepé studii. Zatím chybí ověření těchto výsledků v dalších studiích a většina autorů zaujímá k jeho použití velmi rezervovaný postoj. Aplikace není provázena závažnějšími nežádoucími účinky.
Ovlivnění nukleárních receptorů CAR, PXR a FXR v léčbě cholestatických onemocnění
Především v této oblasti je možno očekávat v brzké době velký pokrok. Teoretické podklady pro ovlivnění těchto receptorů a terapeutické využití jsou přesvědčivé. Jako nejperspektivnější se jeví využití agonistů FXR receptorů. Bohužel, většina prací nepřekročila experimentální rámec a výsledky klinických studií zatím chybějí.
Nedávné studie ukázaly, že Yin shi huang, herbální medicína obsahující Yin chin (Artemisia capillaris) a několik dalších rostlinných látek používaných v Asii k léčení neonatální žloutenky, je potentním aktivátorem nukleárního receptoru CAR. Aplikace Yin shi huang u myší stimuluje expresi všech kritických kroků v exkreci bilirubinu včetně SLCA6 a MRP2. Další látka z armamentaria herbální medicíny, Inchin-ko-to, která se používá v léčbě ikteru v Japonsku a Číně, má významné choleretické efekty vyvolané ovlivněním MRP2.
Poznání centrální role receptoru FXR v patogenezi chronických cholestáz vedlo k přípravě velmi silných ligandů pro tento receptor. Mají výraznější afinitu k receptoru než chenodeoxycholová kyselina (CDCA) a označují se jako GW4064 [29] a 6-ethyl chenodeoxycholová kyselina (6-ECDCA) [17]. Podání těchto ligandů u experimentální cholestázy potkanů a myší včetně podvazu žlučových cest, cholestázy indukované ethinylestradiolem nebo kyselinou litocholovou vedlo k ústupu symptomů cholestázy. 6-ECDCA má i významné antifibrotické vlastnosti. Podobné výsledky byly zaznamenány i při podání kyselin NOR-UDCA [30]. Zatím se jedná jen o krátkodobé experimenty. Výsledky podání těchto látek v klinických studiích jsou očekávány s velkým zájmem.
Léčba protilátkami antiTNF-a patří zatím spíše do oblasti experimentů.
Terapie pruritu
Pruritus je konstantním a pro nemocné často nejvíce obtěžujícím příznakem chronické cholestázy. Snaha o jeho ovlivnění často přináší mimořádné obtíže.
Zásadní je ovlivnění pruritu podáváním UDCA nebo rifampicinu, které vyvolá ústup cholestázy [31]. Pokud tato léčba není dostačující, pokoušíme se ovlivnit tento symptom dalšími léčivy.
Rutinně je nejčastěji podáván cholestyramin. Je účinný v léčbě nemocných s částečnou obstrukcí žlučových cest. Tato pryskyřice váže ve střevě žlučové kyseliny, mechanismus účinku není zcela jasný. Při dlouhodobém podávání klesá i koncentrace žlučových kyselin v séru a hladina cholesterolu. Podávají se 3–4 dávky po 4 g dvakrát – před snídaní a po snídani –, další dávky se podávají před obědem a večeří. Udržovací dávka je většinou 12 g/den. Lék je chuťově nepříjemný a vyvolává nauzeu. Ke kontrole pruritu je třeba využít nejnižší účinnou dávku. Cholestyramin zvyšuje vylučování tuku do stolice a váže vápník a v tucích rozpustné vitaminy, které je nutno substituovat. Lék je třeba užívat odděleně od ostatní medikace.
Antihistaminika jsou účinná minimálně.
Naloxon je opiátový antagonista, je třeba jej podávat v infuzi. Snižuje svědění, ale je nevhodný k dlouhodobé terapii. Nalmefen a naltrexon jsou další antagonisté opiátů, jejichž podávání tlumilo pruritus, léčiva však nejsou běžně dostupná. Účinnost ondansetronu je zpochybňována. Byl zkoušen i propofol, intravenózní hypnotikum. Zatím jsou známy jen krátkodobé účinky.
Určitý nevelký efekt má i světelná terapie.
Další léčebné postupy patří již do oblasti obtížně ovlivnitelného pruritu – ileální diverze, plazmaferézy. U zcela neovlivnitelných stavů je možno zvážit i možnost jaterní transplantace.
Nezbytnou součástí léčby chronických cholestatických onemocnění je i úprava dietních režimů, substituce vitaminy a ovlivnění kostních změn.
U nemocných se steatoreou je třeba snížit obsah tuku v dietě a nahradit jej triglyceridy středně dlouhého řetězce (MCT). MCT tuky jsou i při nepřítomnosti žlučových kyselin dobře vstřebávány do portálního oběhu. Mohou být podávány buď ve formě emulzí nebo jako kokosový olej. U chronických cholestáz je nutno sledovat protrombinový čas a hladinu vitaminů A, D, E, K a v případě nemožnosti stanovení je empiricky doplňovat.
Osteopenie u cholestatických jaterních onemocnění je převážně osteoporózou. Malabsorpce vitaminu D s následnou osteo- malacií je méně častá. Je nutno se snažit o perorální podávání nejméně 1,5 g elementárního kalcia. Podává se vitamin D 50 000 jednotek perorálně 3krát denně nebo 100 000 jednotek intramuskulárně jednou měsíčně. U nemocných se symptomatickou osteomalacií se podává perorálně nebo parenterálně 1,25-dihydroxyvitamin D3. Je možno zvážit i podávání bisfosfonátů (alendronát).
Seznam použité literatury
- [1] Bloomer J, Boyer JL. Phenobarbital effects in cholestatic liver disease. Ann Int Med 1975; 82: 310–317.
- [2] Trauner M, Boyer JL. Bile salt transporters: molecular characterization, function, and regulation. Physiol Rev 2003; 83: 633–671.
- [3] Trauner M, Meier PJ, Boyer JL. Molecular pathogenesis of cholestasis. N Eng J Med 1998; 339: 1217–1227.
- [4] Rosmorduc O, Hermelin B, Poupon R. MDR3 gene defect in adults with symptomatic intrahepatic and gallbladder cholesterol cholelithiasis. Gastroenterology 2001; 120: 1459–1467.
- [5] Lee J, Azzaroli F, Wang L, et al. Adaptive regulation of bile salt transporters in kidney and liver in obstructive cholestasis in the rat. Gastroenterology 2001; 121: 1473–1484.
- [6] Paumgartner G. Medical treatment of cholestatic liver diseases: from pathobiology to pharmacological targets. World J Gastroenterol 2006; 12: 4445–4451.
- [7] Boyer JL. Nuclear receptor ligands: rational and effective therapy for chronic cholestatic liver disease? Gastroenterology 2005; 129: 735–740.
- [8] Boyer JL. New perspectives for the treatment of cholestasis: Lessons from basic science applied clinically. J Hepatol 2007; 46: 351–371.
- [9] Staudinger JL, Goodwin B, Jones SA, et al. The nuclear receptor PXR is a lithocholic and sensor that protects against liver toxicity. Proc Natl Acad Sci USA 2001; 98: 3369–3374.
- [10] Li T, Chiang JY. Mechanism of rifampicin and pregnane X receptor inhibition of human cholesterol 7 alpha-hydroxylase gene transcription. Am J Physiol Gastrointest Liver Physiol 2005; 288: G74–G84.
- [11] Chiang JYL. Regulation of bile acid synthesis: pathways, nuclear receptors and mechanisms. J Hepatol 2004; 40: 539–551.
- [12] Zollner G, Marschall HU, Wagner M, Trauner M. Role of nuclear receptors in the adaptive response to bile acids and cholestasis: pathogenetic and therapeutic considerations. Mol Pharm 2006; 3: 231–251.
- [13] Stieger B, Fattinger K, Madon A, et al. Drug- and estrogen-induced cholestasis through inhibition of the hepatocellular bile salt export pump (Bsep) of rat liver. Gastroenterology 2000; 118: 422–430.
- [14] Dombrowski F, Stieger B, Beuers U. Tauroursodeoxycholic acid inserts the bile salt export pump into canalicular membranes of cholestatic rat liver. Lab Invest 2006; 86: 166–174.
- [15] Benz C, Angermuller S, Otto G, et al. Effect of tauroursodeoxycholic acid on bile acid-induced apoptosis in primary human hepatocytes. Eur J Clin Invest 2000; 30: 203–209.
- [16] Rodrigues CM, Fan G, Wong PY, et al. Ursodeoxycholic acid may inhibit deoxycholic acid-induced apoptosis by modulating mitochondrial transmembrane potential and reactive oxygen species production. Mol Med 1998; 4: 165–178.
- [17] Pellicciari R, Fiorucci S, Camaioni E, et al. 6Alpha-ethyl-chenodeoxycholic acid (6-ECDCA), a potent and selective FXR agonist endowed with anticholestatic activity. J Med Chem 2002; 45: 3569–3572.
- [18] Fiorucci S, Antonelli E, Rizzo G, et al. The nuclear receptor SHP mediates inhibition of hepatic stellate cells by FXR and protects against liver fibrosis. Gastroenterology 2004; 127: 1497–1512.
- [19] Rautiainen H, Karkkainen P, Karvonen AL, et al. Budesonide combined with UDCA to improve liver histology in primary biliary cirrhosis: a three-year randomized trial. Hepatology 2005; 41: 747–752.
- [20] Corpechot C, Carrat F, Bahr A, et al. The effect of ursodeoxycholic acid therapy on the natural course of primary biliary cirrhosis. Gastroenterology 2005; 128: 297–303.
- [21] Poupon RE, Lindor KD, Pares A, et al. Combined analysis of the effect of treatment with ursodeoxycholic acid on histologic progression in primary biliary cirrhosis. J Hepatol 2003; 39: 12–16.
- [22] Mitchell SA, Bansi DS, Hunt N, et al. A preliminary trial of high-dose ursodeoxycholic acid in primary sclerosing cholangitis. Gastroenterology 2001; 121: 900–907.
- [23] Jacquemin E, Hermans D, Myara A, et al. Ursodeoxycholic acid therapy in pediatric patiens with progressive familial intrahepatic cholestasis. Hepatology 1997; 25: 519–523.
- [24] Ghent CN, Carruthers SG. Treatment of pruritus in primary biliary cirrhosis with rifampin. Results of a double-blind, crossover, randomized trial. Gastroenterology 1988; 94: 488–493.
- [25] Marschall HU, Wagner M, Zollner G, et al. Complementary stimulation of hepatobiliary transport and detoxification systems by rifampicin and ursodeoxycholic acid in humans. Gastroenterology 2005; 129: 476–485.
- [26] Wietholtz H, Marschall HU, Sjovall J, Matern S. Stimulation of bile acid 6 alpha-hydroxylation by rifampicin. J Hepatol 1996; 24: 713–718.
- [27] Bachs L, Elena M, Pares A, et al. Comparison of rifampicin with phenobarbitone for treatment of pruritus in biliary cirrhosis. Lancet 1989; 1: 574–576.
- [28] Frezza M, Surrenti C, Mantilko G, et al. Oral S-adenosylmethionine in the symptomatic treatment of intrahepatic cholestasis. A double-blind, placebo-controlled study. Gastroenterology 1990; 99: 211–215.
- [29] Liu Y, Binz J, Numerick MJ, et al. Hepatoprotection by the farnesoid X receptor agonist GW4064 in rat models of intra – and extrahepatic cholestasis. J Clin Invest 2003; 112: 1678–1687.
- [30] Fickert P, Wagner M, Marschall HU, et al. 24-norUrsodeoxycholic acid is superior to ursodeoxycholic acid in the treatment of sclerosing cholangitis in Mdr2 (Abcb4) knockout mice. Gastroenterology 2006; 130: 465–481.
- [31] Mazzela G, Rizzo N, Azzaroli F, et al. Ursodeoxycholic acid administration in patiens with cholestasis of pregnancy: effects on primary bile acids in babies and mothers. Hepatology 2001; 33: 504–508.