Farmakoterapie karcinomu prostaty
Světová zdravotnická organizace řadí nádory prostaty k chronickým onemocněním. Jeden z důvodů, které k tomu vedly, je možnost významného farmakologického ovlivnění průběhu nádorového onemocnění. Karcinom prostaty zaujímá v současné době v České republice třetí místo mezi zhoubnými nádory mužské populace. Objev prostatického specifického antigenu (PSA) jako citlivého markeru přítomnosti karcinomu prostaty významně posunul naše diagnostické možnosti směrem k diagnostikování časných fází onemocnění. Téměř u jedné třetiny nemocných se daří odhalit nádor dosud lokalizovaný jen na žlázu. To umožňuje kurabilní léčebné postupy, nejčastěji chirurgické – radikální prostatektomii. Stále však přichází velká část nemocných s lokálně pokročilým či generalizovaným onemocněním, kde je možná již jen léčba paliativní, i když dlouhodobě stabilizující. Biologické chování karcinomu prostaty je značně odlišné od ostatních solidních nádorů a od toho se odvíjí i filosofie výběru terapeutických modalit.
Epidemiologie
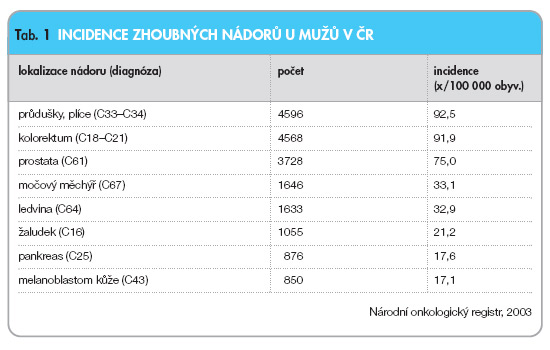
V posledních třech desetiletích je zaznamenáván trvalý významný vzestup počtu diagnostikovaných karcinomů prostaty. V roce 2003 dosáhla incidence 75,0/ 100 000 obyvatel (tab. 1) a tím se karcinom prostaty (CaP) řadí na 3. místo mezi nádorovými onemocněními mužů v České republice. S nevýznamnými výkyvy je incidence shodná po celém území republiky.
Incidence onemocnění narůstá s věkem, od 50. roku věku počet onemocnění charakterizuje strmější vzestup. V autoptickém materiálu u osmdesátiletých mužů lze prokázat CaP prakticky u 100 %. Hereditární výskyt posouvá incidenci o dekádu níže, tedy od 40. roku a výše. Autozomálně dominantní závislost je dávána do souvislosti se změnou exprese tumor-supresorových genů (např. TrKA, PTEN, MXI1, CD44, p53 a další). Ze zevních vlivů se uplatňují dietní návyky a výživa, v kancerogenezi CaP předpokládáme procentuálně vyčíslenou míru jejich vlivu mezi 30–40 %. Směrem na východ klesá výskyt karcinomu prostaty a v Japonsku je nejnižší. To je přičítáno převážně rostlinné stravě. Prudký nárůst incidence ale provází jen mírný vzestup mortality.
Zmíněný vzestup incidence onemocnění je způsoben dvěma faktory: máme k dispozici jeden z nejcitlivějších onkologických markerů a vyhledávání karcinomu je plošně organizováno. Možnosti prevence nemoci jsou velmi omezené, snad by mohly být účinné dietní návyky, ovšem uplatňované od mládí, a jisté možnosti skýtá chemoprevence CaP, i když definitivní studie ještě nejsou ukončeny. Bývá zmiňován dutasterid, inhibitor obou typů 5a-reduktázy.
Patofyziologie
Karcinom prostaty na rozdíl od ostatních solidních nádorů roste jen pomalu a má dlouhý doubling time (čas nutný k zdvojnásobení velikosti). Patří k nádorům, které jsou, alespoň po určitou dobu, vnímavé vůči androgenní supresi.
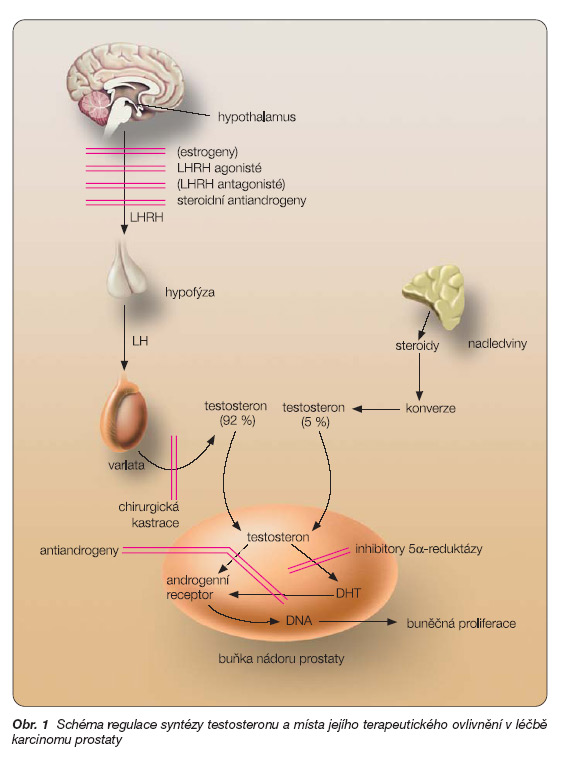
Základním stimulem replikace prostatické buňky je testosteron, androgen produkovaný Leydigovými buňkami varlete. Produkce testosteronu je řízena osou hypo-thalamus-hypofýza-testis prostřednictvím gonadotropin releasing hormonů (GnRH) stimulujících následně LH (lutropin) s FSH a tlumená zpětnovazebnými mechanismy. Testikulární produkce testosteronu přesahuje 92 % z celkového objemu hormonu, cca 5 % pochází z kůry nadledvin a asi 2 % vznikají periferní konverzí v tukové tkáni z estradiolu. Působením enzymu 5a-reduktázy na testosteron vzniká v prostatické buňce vlastní účinný androgen, dihydrotestosteron (DHT). 5a-reduktáza existuje ve dvou izomerech, především typ II dosahuje vysoké koncentrace v prostatě, kůži i tukové tkáni. Vazbou DHT na specifické androgenní receptory vytváří komplex DHT-AR a spouští kaskádu proteosyntézy a replikace buňky. Cíleným zásahem na jednom nebo několika místech bráníme buněčné replikaci a navodíme apoptózu hormonálně citlivých nádorových buněk (obr. 1).
Obecně je fyziologická integrita humánních tkání kontrolována aktivitou kmenových buněk (stem cells). Charakteristická je pro ně vysoká proliferační aktivita, dlouhá životnost a z hlediska tkáňové specificity relativně nediferencovaný stav. Prostatický epitel tvoří dva základní morfologicky odlišné typy buněk, a to buňky bazální a luminální [6]. Bazální buňky mají vlastnosti kmenových buněk, vytvářejí tzv. bazální kompartment. Kromě obecných vlastností jsou charakterizovány prakticky nedetekovatelnou hladinou androgenů, nepodléhají proto stimulačnímu vlivu androgenů. Luminální buňky mají exokrinní schopnosti, jsou orientovány intraluminálně, obsahují velký počet androgenních receptorů a jejich činnost a přežití jsou závislé na androgenech. Do lumina žláz produkují prostatický specifický antigen a další látky. Imunohistochemicky můžeme detekovat ještě buňky intermediální, které jsou přechodnou formou mezi bazálními a luminálními buňkami, a buňky neuroendokrinní. Funkce neuroendokrinních buněk není zcela objasněna. Jsou v epitelu disperzně uloženy, charakteristická je parakrinní sekrece neuropeptidů chromatograninu A a synaptofyzinu. Jejich působením dochází k proliferaci sousedních buněk.
Diferenciace buněk prostatického epitelu zahájí asymetrické dělení bazální buňky se vznikem nové kmenové buňky jako progenitoru, z něhož se po několika cyklech utvoří luminální nebo neuroendokrinní buňka. Ta po několika dalších cyklech programově zaniká (apoptóza) [19]. Poměrem mezi apoptózou a proliferací je dána homeostáza buněk prostatického epitelu. Důsledkem poruchy homeostázy glandulárního epitelu prostatické buňky jsou atrofické změny dvojího typu: plošné (typicky navozené androgenní deprivací), využívané terapeuticky v léčbě CaP, a ložiskové (nezávislé na androgenní supresi), které jsou označovány jako proliferativní zánětlivá atrofie (PIA). PIA má shodnou lokalizaci jako proliferativní intraepiteliální neoplazie (PIN), tyto buňky jsou prekurzorem karcinomu. PIN je prekancerózou, pravděpodobně předchází vzniku karcinomu o 15–20 let.
Složitý mitogenní proces je řízen podle dnešních představ signální cestou androgenního receptoru (AR) a signální transdukční cestou, zvanou fosforylační kaskáda. Vyvážený vztah mezi oběma signálními cestami je nezbytný pro náležitou androgenní odpověď normální i nádorové epiteliální prostatické buňky. Předpokládá se, že AR signální cesta je alespoň na základní úrovni aktivní i při chybění DHT, a to formou nezávislou na ligandech. Znamená to, že maximální androgenní blokáda (MAB, viz dále) může eliminovat vliv DHT na nádorový růst, avšak nedokáže snížit úroveň androgenních receptorů. Bazální buňky se pomocí stimulace růstovými faktory (GF) dále dělí. Receptory GF byly detekovány také v neuroendokrinních a intermediálních buňkách normální i nádorové tkáně prostaty. Propojením aktivní AR signální cesty s dalšími kaskádami (např. GF) je na molekulární úrovni vysvětlována nádorová progrese androgen-independentních linií.
Diagnostika
Každý zhoubný nádor prostaty musí být histologicky před zahájením léčby verifikován.
Diagnostika se opírá o stanovení hladiny prostatického specifického antigenu (PSA), vyšetření per rectum a transrektální ultrasonografii s odběrem tkáně k histopatologickému vyšetření. Obvykle odebíráme tkáň prostaty transrektálně pod ultrasonografickou kontrolou. Počet pozitivních vzorků, stanovení Gleasonova skóre, případné perineurální šíření a iniciální hladina PSA jsou u časných forem onemocnění důležitými prognostickými znaky a významně ovlivňují úvahy o adjuvantní terapii. K určení stagingu (rozsahu onemocnění) kromě hladiny PSA, transrektální ultrasonografie (TRUS) a vyšetření per rectum, doplňujeme scintigrafii skeletu a ultrasonografii parenchymových orgánů. Postižení uzlin verifikujeme pánevní lymfadenektomií.
Terapie karcinomu prostaty
Výběr léčebných postupů u karcinomu prostaty se odvíjí od stadia onemocnění a přítomnosti rizikových faktorů progrese onemocnění.
Pro nemocné v klinickém stadiu I a II (karcinom ohraničen na žlázu) můžeme využít několik léčebných modalit, od přísného dohledu („watchful waiting") až po kurativní radikální prostatektomii či radikální radioterapii. Volba do značné míry také závisí na preferenci poučeného pacienta. Orientačně však platí, že pro nemocné s nízkým nádorovým grade (stupněm buněčné dediferenciace) a Gleasonovým skóre, ve vyšším věku preferujeme watchful waiting. Pro mladší nemocné s dlouhou předpokládanou dobou života bývá metodou volby radikální prostatektomie, pro ostatní radioterapie samostatně, či s konkomitantním podáváním hormonální terapie. Při prorůstání nádoru pouzdrem žlázy (stadium III) není již léčba kurabilní, ale pouze paliativní.
Hormonální terapie
Principem hormonální léčby je blokování účinku nebo potlačení tvorby androgenů. Absence androgenů navozuje apoptózu androgen-dependentních buněk. Proto léčba karcinomu prostaty orchiektomií znamenala začátek hormonální terapie a bystrý úsudek z pozorování efektu kastrace u diseminovaného CaP [5] přinesl Hugginsovi a Hodgesovi Nobelovu cenu.
V době diagnózy bývá obvykle více než 80 % nádorů citlivých na hormonální léčbu. Trvání léčebné odpovědi se pohybuje mezi 12–18 měsíci, průměrné přežití relapsu má medián 6–12 měsíců.
Redukce hladin testosteronu lze dosáhnout chirurgicky – orchiektomií, nebo farmakologicky, podáváním LHRH analog (agonistů), LHRH antagonistů (nejsou u nás k dispozici), antiandrogenů a estrogenů (nejsou k dispozici, jejich hlavním představitelem je diethylstilbestrol – viz. obr. 1).
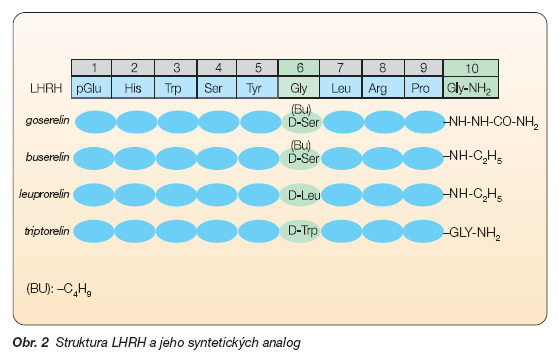
Roku 1971 byla chemicky systetizována Andrewem Schellym LHRH analoga. Jejich molekula je podobná struktuře přirozeného LHRH. Odlišuje se na pozici 6 a 10 (obr. 2).
Podávání LHRH analog navodí medikamentózní kastraci obdobnou chirurgické orchiektomii. Mechanismus účinku je vysvětlován účinkem nazývaným „down regulation", jakýmsi vyčerpáním tvorby hormonu po předchozí hyperstimulaci hypofýzy. Důsledkem je pokles produkce LH a následně testosteronu. Při nasazení analog nejprve stoupne produkce LH a testosteronu asi po dobu 1–3 týdnů, pak 2–4 týdny klesá ke kastračním hodnotám. Jsou-li podány v monoterapii nemocným s generalizovaným onemocněním, vzestup hladiny testosteronu vyvolává návaly, „flare up" fenomén, doprovázené zhoršením klinických obtíží a elevací PSA. Ke tlumení těchto příznaků bývá v úvodu přidáván antiandrogen. Z LHRH analog jsou k dispozici goserelin, leuprorelin, buserelin a triptorelin. Nově byl připraven analog II. generace – leuprorelin Eligard. Analoga jsou aplikována parenterálně, obvykle s.c. či i.m., pouze buserelin se podával intranazálně. Jednotlivé přípravky navozují různou míru kastračních hodnot PSA [24] a udržují ji bezpečně v určeném rozmezí po dobu stanovenou výrobcem. Historicky byla za kastrační mez považována hodnota 5 nmol/l, v současné době je za optimální při léčbě analogy stanovena hladina testosteronu 2 nmol/l [25]. Po vysazení analog LHRH hladiny testosteronu zvolna stoupají, nedosahují však podle našich sledování úrovně hladin před léčbou [11]. Srovnání mezi jednotlivými analogy LHRH nebylo dosud provedeno. Jejich účinnost je porovnávána nepřímo orchiektomií. Pro všechna stadia hormonálně dependentního karcinomu je vhodný pouze goserelin, ostatní přípravky mají registraci pouze pro pokročilý či metastatický karcinom prostaty. Goserelin může být rovněž podáván premenopauzálním pacientkám s karcinomem mammy. V rozhodování při výběru analoga LHRH nepochybně hraje roli i nutnost finální přípravy některých analog (leuprorelin, triptorelin) před vlastní aplikací, bolestivost aplikace (jehla 14 G u goserelinu vs 21 G u leuprorelinu), četnost lokálních vedlejších účinků v místě aplikace (goserelin či leuprorelin 1–2 % vs nová léková forma leuprorelinu kolem 30 %), ale i v zabezpečení personálu speciálními systémy ochrany aplikačních zařízení.
Na úrovni prostatické buňky se kompetitivní vazbou k androgennímu receptoru vážou antiandrogeny. Rozlišujeme dva typy antiandrogenů, a to steroidní, jejichž jediným zástupcem je cyproteronacetat (CPA), a nesteroidní, tzv. čisté. Cyproteron-acetat působí na prostatickou tkáň inhibicí vazby 5a-dihydrotestosteronu na jeho cytosolový receptor. Má dvojí mechanismus účinku: antigonadotropní – inhibicí LH – a antiandrogenní – blokováním aktivity C21-19 desmolázy. To umožňuje bezpečné podávání při HD (high dose) monoterapii podáváním 300 mg denně, stejně u kombinované terapie v rámci maximální androgenní blokády spolu s LHRH analogy nebo po orchiektomii. CPA podáváme také v úvodu léčby analogy, jak již zmíněno, k potlačení „flare up" fenoménu. Ze stejného důvodu může být podáván dlouhodobě po orchiektomii. V úvodu léčby je nezbytné kontrolovat hladinu transamináz.
K čistým antiandrogenům patří flutamid, bicalutamid, nilutamid. Rozdíly v endokrinním profilu steroidních a nesteroidních antiandrogenů ukazuje tab. 2.
Podobně jako u LHRH analog nebyla též mezi jednotlivými antiandrogeny dosud provedena srovnávací studie. Gynekomastii, která provází léčbu nesteroidními antiandrogeny, lze příznivě ovlivnit radiací mléčných žláz před zahájením terapie nebo podáváním tamoxifenu [2], popřípadě inhibitorů aromatázy. Pokles libida a erektilní dysfunkce jsou pro část nemocných velmi nepříznivě vnímaným vedlejším účinkem hormonální suprese. Mladší muži se obtížně vyrovnávají s orchiektomií. Je pro ně výhodou monoterapie antiandrogeny zachovávající potenci a libido. V ovlivnění sexuální dysfunkce nebyl pozorován rozdíl mezi oběma typy antiandrogenů. Další výhodou monoterapie antiandrogeny je předcházení symptomům hypogonadismu, jako je osteoporóza, anémie, obezita, deprese, poruchy kognitivních funkcí, svalová dystrofie, změny v profilu lipidů, gynekomastie a další.
Další variantou léčby je maximální androgenní blokáda (MAB). Je významně nákladnější a provází ji vyšší procento vedlejších nežádoucích účinků oproti monoterapii. MAB má za cíl blokování testikulárních i nadledvinových androgenů. Metaanalýza 5710 pacientů [26] dokládá, že MAB představuje přínos pro pouhých 3,6 % pacientů. Další práce tyto závěry nejen potvrzují, ale poukazují dále na ekonomickou neefektivnost léčby a zvýšení počtu nežádoucích účinků. Pro klinickou praxi vyplývá, že: MAB není vhodnou léčbou první volby. MAB prodlužuje odpověď na léčbu o cca 6 měsíců po přidání k monoterapii ve druhé linii léčby.
Náhlé vysazení čistých antiandrogenů, podávaných v režimu MAB při progresi onemocnění vede u části nemocných ke zlepšení klinického stavu i laboratorních parametrů (withdrawal fenomen). Má průměrné trvání 5 měsíců.
Intermitentní androgenní suprese (IAS) spočívá v přerušování kontinuální suprese androgenů s cílem zabránit vzniku a selekci androgen-independentních klonů buněk. Prostředí dlouhodobě chudé na androgeny navozuje apoptózu diferencovaných nádorových buněk a hypersenzitivitu AR. Neovlivněny jsou buňky intermediální a neuroendokrinní, které vyzrávají v androgen-independentní populaci. Adaptací nádorových kmenových buněk dochází k selekci androgen-nezávislých buněk. Doplnění androgenů po cyklu apoptotické regrese vede k regeneraci diferencovaných nádorových buněk se schopností nové hormonální odpovědi. V léčbě je možno využít jak analoga LHRH, tak i antiandrogeny [22]. Cykly je možno opakovat několikrát po sobě, medián trvání prvního cyklu je 18 měsíců, další cykly se zkracují, při neúspěchu je možno přejít na kontinuální podávání. Indikací k léčbě jsou lokálně pokročilá onemocnění nebo generalizace do 4 kostních ložisek, selhání po radikální léčbě, konkomitantní režimy se zářením.
Konkomitantní režim radiace a hormonální suprese vychází z předpokladu „down stagingu" při podání neoadjuvantní endokrinní léčby s redukcí ozařovaného objemu a zlepšením citlivosti buněk k radiaci. Navíc pak může eradikovat mikrometastázy při dalším adjuvantním podávání. Obvykle je podávána pacientům s vyšším rizikem a pacientům s lokálně pokročilým nádorem T3, T4.
Inhibitory 5a-reduktázy (finasterid, dutasterid) snižují hladinu DHT. V současné době jsou součástí tzv. minimální androgenní blokády, kdy je podáváme současně s antiandrogeny, obvykle flutamidem. Předpokládaným efektem je menší množství DHT, které je blokováno antiandrogenem. Finasterid není v současné době doporučován v rámci chemoprevence CaP, snižoval sice počet detekovaných karcinomů v kontrolované skupině, avšak u nemocných s verifikovaným karcinomem se změnilo rozložení Gleasonova skóre v neprospěch dobře diferencovaných karcinomů. Slibným se zdá dutasterid, zatím je však třeba vyčkat na výsledky studií.
Nedořešenou otázkou zatím zůstává, zda hormonální supresi zahajovat ihned při průkazu generalizace, nebo až při klinických projevech. Pro oba postupy, i proti nim, existují četné argumenty. Jednoznačné odpovědi zatím nejsou k dispozici, i když nyní se pomyslný jazýček vah více kloní k léčbě časné. Poslední slovo v léčbě karcinomu prostaty vždy patří poučenému pacientovi, který musí spolu s ošetřujícím lékařem zvažovat všechna pro a proti, včetně ovlivnění kvality života.
Lokalizovaný karcinom prostaty T1–2 N0 M0
Neoadjuvantní léčba před radikální chirurgickou léčbou nesplnila očekávané snížení počtu biochemických relapsů. V současné době je podávána omezeně.
Adjuvantní hormonální terapie zahájená časně po chirurgické léčbě má za cíl eliminaci reziduální nemoci jak místní, tak i mikrometastáz. Časná léčba LHRH analogem goserelinem nebo orchiektomií podle studie ECOG 7887 [27] vede ke zlepšení bezpříznakového i celkového přežití. V rámci projektu EPC (Early prostate cancer) jsou uváděna stále nová data při podávání bicalutamidu velké skupině 4454 nemocných s CaP [7, 8]. U lokálně pokročilého onemocnění došlo po aplikaci bicalutamidu ke snížení rizika progrese o 29 % po 5,4 letech ve srovnání se samotnou radikální prostatektomií. Indikací k časné adjuvantní léčbě jsou rizikové faktory progrese – pT3, Gleasonovo skóre > 7, PSA > 10 ng/ml, časný doubling time PSA, event. výskyt perineurálního šíření a další.
Nejčastější indikací k zahájení hormonální léčby po radikální chirurgické léčbě je biochemické selhání – vzestup PSA [9]. Při desetiletém sledování po RAPE jej prokážeme u 25–40 % mužů. Medián do rozvoje metastáz u této skupiny dosahuje 8 let, do dalších 5 let pacient umírá. Pokud zahájíme hormonální supresi časně po biochemickém relapsu, nemocní dobře odpovídají na léčbu a významně, až o 10–15 let, prodlužujeme jejich život [18, 22].
Radiační léčba spolu s hormonální supresí je u lokalizovaných nádorů vyhrazena nemocným s rizikovými faktory PSA > 10, GS > 7, event. s extraprostatickým šířením. Obvyklý režim bývá šestiměsíční s aplikací analog LHRH či antiandrogenu ve vysokých dávkách. Oproti terapii zářením zvyšuje pětileté přežití ze 78 % na 88 % [1, 3, 15, 18].
Pokročilý karcinom prostaty
Do skupiny patří nemocní s lokálně pokročilým či generalizovaným onemocněním, nově přiřazena je skupina pacientů s relapsem PSA po radikální terapii. Na celou skupinu se pak vztahují tři základní otázky:
1. ‑Kdo má být léčen?
2. ‑Jaký typ hormonální léčby má být podán?
3. ‑Jaký časový plán léčby má být zvolen?
V současné době jsou sledovány velké skupiny nemocných se vzestupem hladin PSA po radikální léčbě. Doubling time PSA se zdá být důležitým ukazatelem v rozhodování, které pacienty léčit. Nejvíce preferovanou modalitou v léčbě nemocných s biochemickým relapsem je aplikace analog LHRH v monoterapii, ekonomicky výhodným a onkologicky bezpečným režimem při zachování dobré kvality života je IAS.
Léčbou volby generalizovaného onemocnění je hormonální deprivace. Řadu let byla orchiektomie standardem léčby a zůstává jím i nadále. Nicméně velká skupina nemocných není psychicky schopna trvalý mutilující zákrok přijmout. Jednoznačnou indikací k chirurgické kastraci je hrozící míšní léze, dále pak nemocní, kteří nemohou nebo nejsou schopni při léčbě spolupracovat. U ostatních můžeme s přihlédnutím ke kvalitě života zvolit endokrinní manipulaci. Ovšem i v USA se ozývají hlasy o nákladnosti léčby.
Hormonálně independentní karcinom prostaty
Ke vzniku a rozvoji hormonálně independentního karcinomu prostaty (HICaP) dochází přirozenou progresí onemocnění od lokalizovaného stadia přes stadium lokálně pokročilé a generalizované. Pro HICaP je charakteristické kontinuální zvyšování hladiny prostatického specifického antigenu (PSA) při kastračních hladinách testosteronu a adekvátní androgenní supresi. Medián přežití mužů s HICaP dosahuje 12 měsíců.
V klinickém obraze dominuje algický syndrom při kostním postižení, anémie a zhoršený performance status. Skeletové komplikace při kostním postižení – patologické zlomeniny, komprese míšní a myelosuprese – významně ovlivní kvalitu života nemocných. Kostní postižení není plošně měřitelné, ostatní metastatické léze (lymfatické uzliny, parenchymové orgány, měkké tkáně a další) hodnotíme dvojdimenzionálním měřením. Předpokládaná doba přežití závisí na rozsahu postižení a symptomech onemocnění (tab. 3).
Hladina prostatického specifického antigenu (PSA) je indikátorem léčebné odpovědi ve všech stadiích onemocnění. Účinnost cytotoxické léčby dokládá pokles PSA, jako efektivní je stanovena hranice poklesu o 50 %, resp. 75 %. Čas zdvojnásobení hladin PSA při cytotoxické léčbě je pomocným ukazatelem ovlivnění stabilizace onemocnění. Pokles PSA o méně než 50 % a časná progrese PSA (krátký doubling time) jsou nepříznivými faktory.
Pacienti s hormonálně independentním karcinomem prostaty dostávají multimodální léčbu, která závisí na jejich klinickém stavu. Její součástí je léčba cytotoxická.
Chemoterapie CaP
Malá úspěšnost léčby a nepříznivá prognóza léčených pacientů je dokládána historickými studiemi, kdy jednotlivá cytostatika nedosahovala více než 30% odpovědi. Přesvědčivý zlom s účinným ovlivněním algického syndromu přinesla kombinace mitoxantronu s prednisonem [20, 21]. Význam pro přežití nebyl zásadní, ačkoliv podle nových prací i našich zkušeností prolongoval přežití až na 16 měsíců [10, 14]. U 65 % hormonálně independentních karcinomů byla detekována nadměrná exprese bcl-2. Recentní studie se zaměřují na proteiny regulující apoptózu jako cílová místa léčby HICaP. Estramustin (inhibice mikrotubulů) a taxany (tlumí expresi bcl-2) [14] mají vysokou aktivitu u hormonálně independentního karcinomu prostaty.
Kombinovaná léčba estramustinem (EMP) s docetaxelem dosahuje vyšší odpovědi než docetaxel v monoterapii. Současně však vzrůstá množství nežádoucích účinků jako nauzea, zvracení, metabolický rozvrat a tromboembolické komplikace neovlivnitelné antikoagulační profylaxí. Kombinovaná léčba vyžaduje redukci dávky EMP. Srovnání režimu mitoxantron s prednisonem a docetaxel s estramustinem u mužů s HICaP zhodnotil Petrylac v souboru 770 pacientů ve studii SWOG 99–16 [14]. Režim docetaxelu s EMP vedl k signifikantnímu prodloužení přežití, prodloužení doby do progrese onemocnění a zlepšení odpovědi jak biochemické, tak i objektivní. Studie TAX 327 s 1006 pacienty přinesla obdobné závěry [23, 4]. Třítýdenní aplikace docetaxelu se zdá být optimální.
Chemoterapie u hormonálně dependentního karcinomu prostaty
Recentní studie jsou zaměřeny na časnou adjuvantní léčbu pacientů s rizikovými faktory při radikální léčbě. RTOG-9902 porovnává hormonální léčbu s chemohormonální terapií (EMP, paclitaxel a etoposid) po zevní radiaci [13]. Velmi rizikové nemocné po radikální prostatektomii sleduje ve dvou ramenech studie SWOG 9921, a to léčbu goserelinem s bicalutamidem proti terapii goserelinem s mitoxantronem. Studie AUO randomizuje rizikové pacienty po radikální prostatektomii do tří ramen se sledováním po dobu tří let. Srovnává hormonální léčbu v monoterapii a spolu s ibandronatem, posledním ramenem je hormonální léčba, ibandronat plus docetaxel.
Možnosti farmakoterapie kostních procesů při CaP
Bohatě vaskularizovaná tkáň skeletu (především obratle a proximální části dlouhých kostí) bývá místem vzniku metastáz zhoubných národů. Kromě vaskularizace podporují vznik kostního postižení i mechanismy chemoatrakce a speciální mikroprostředí („seed and soil"). Nečastěji bývá skelet postižen u mnohočetného myelomu, následován dvěma hormonálně dependentními nádory – karcinomem prsu a prostaty, kdy prevalence se pohybuje mezi 35–85 %. Karcinom prostaty bývá zdrojem osteoblastických, event. smíšených metastáz, jen v procentech lze detekovat osteolytické metastázy.
Klinicky provází kostní metastázy algický syndrom s možnými skeletovými komplikacemi (míšní komprese, patologické zlomeniny), hyperkalcémie a myelosuprese při útlaku kostní dřeně. Počet metastatických ložisek v kostech u karcinomu prostaty koreluje s dobou přežití, počet menší než 4,6 metastáz vykazuje signifikantně lepší přežití. Naopak patologická zlomenina přežití významně zkracuje.
Léčba kostního postižení je obvykle konzervativní. U karcinomu prostaty, který je hormonálně dependentní, je hormonální ablace léčbou volby. Podání radionuklidů (samarium, strontium) u nemocných bez postižení dřeně má příznivý analgetický efekt. Moderním lékem volby kostní generalizace jsou bisfosfonáty, obvykle v kombinaci s kalciem a vitaminem D. Bisfosfonáty jsou odvozeny od pyrofosfátu, mají vysokou afinitu ke kostnímu hydroxyapatitu, zvyšují mechanickou odolnost kosti a jsou rezistentní vůči chemické i enzymatické hydrolýze. Bisfosfonáty inhibují aktivované osteoklasty a jejich apoptózu, omezují účinnost PGE, TNF-a, IL1, mají analgetické a angiogenní účinky, inhibují buněčnou proliferaci (inhibice fermentace ras) a cestou fosforylační kaskády indukují apoptózu nádorových buněk. Biologická dostupnost je u perorálních a perenterálních přípravků odlišná, nicméně i zde je vhodné nasazovat terapii po dohodě s pacientem. Indikace k nasazení terapie bisfosfonáty nemocným s karcinomem prostaty uvádí tab. 4. Fred Saad prokázal v dvojitě slepé randomizované studii 039 (III. fáze) významný vliv zoledronatu u 643 nemocných s HICaP. Dokládá (po 15 měsících léčby) snížení počtu pacientů se skeletálními příhodami (např. zlomeniny, nutnost radioterapie a terapie bolesti v kostech) o 11 %, s patologickými frakturami o 9 % [16, 28]. Dále pozoroval snížení rizika rozvoje kostních komplikací o 36 %, snížení rizika II o 40 % a prolongaci střední doby výskytu kostní komplikace o více než 5 měsíců [17, 29]. Analgetický efekt ve srovnání s placebem byl statisticky významný.
Nedílnou součástí multimodální léčby je i podpůrná léčba, ovlivnění výživy, anémie atd. přesahující daleko možnosti sdělení.
Závěr
V devadesátých letech minulého století se změnil pohled na léčbu karcinomu prostaty (obr. 3). Systémová léčba přestala být doménou pouze generalizovaného onemocnění. Moderní trendy endokrinní léčby se soustředí na adjuvantní a konkomitantní režimy u pacientů s rizikovými faktory při radikální terapii lokalizovaných forem hormonálně dependentního karcinomu prostaty. Zlom v pohledu na chemoterapii představuje zařazení taxanů do první line léčby hormonálně independentního karcinomu prostaty. I zde recentní klinické studie hledají možnosti chemoterapie u rizikových nemocných v časné adjuvanci. V neposlední řadě možnost ovlivnění kostních metastáz a oddálení rozvoje jejich komplikací bisfosfonáty rozšiřuje armamentárium péče o nemocné s pokročilým karcinomem prostaty. Cílem léčby pacientů s karcinomem prostaty je zachování uspokojivé kvality života, limitujícím faktorem zůstane cena této léčby.
Seznam použité literatury
- [1] Bolla M, Collette L, Blank L, et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomized trial. Lancet 2002; 360: 103–108.
- [2] Conti G, Cretarola E, Boccardo F, et al. Tamoxifen is a safe and effective in preventing gynecomastia and brest pain induced by bicalutamide monotherapy of prostate cancer and does not alter treatment efficiency. Eur Urol 2004; 3 (suppl. 58): 221.
- [3] Denham JW, Steigler A, Lamb DS, et al. Short-term androgen deprivation and radiotherapy for locally advanced prostate cancer: results from the Trans-Tasman Radiation Oncology Group 96-01 randomised controlled trial. The Lancet Oncology 2005; 6: 841–850.
- [4] Foldyna J. Docetaxelum. Remedia 2005; 15: 346–354.
- [5] Huggins C, Hodges CV. The effects of castration, of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Cancer Res 1941; 1: 293–297.
- [6] Isaacs JT. The biology of hormone refractory prostate cancer. Why does it develop? Clin North Am 1999; 26: 263–273.
- [7] Iversen P, McLeod DG, See WA, et al. Bicalutamide 150 mg for early non-metastatic prostate cancer in patients who would otherwise undergo watchful waiting:latest results at a median 5. 4 years´ follow-up. J Urol 2004; 171: 280 (1061).
- [8] Jarolím L. Early prostate cancer program. Urologie pro praxi 2006; 1: 38.
- [9] Klotz L. Active surveillance with selective delayed intervention using PSA doubling time for good risk prostate cancer. Eur Urol 2005; 47; 16–21.
- [10] Matoušková M, Hanuš M. Mitoxantron v léčbě hormonálně independentního karcinomu prostaty. Urológia 2000; 6: 35–36.
- [11] Matoušková M, Hanuš M. Intermitentní androgenní suprese (IAS) v léčbě karcinomu prostaty. Česká urologie 2003; 7: 11–15.
- [12] Matoušková M, Hanuš M, Dušek P, et al. Concomitant regime of hormonal suppression and actinotherapy, an alternative theraupetic modality of prostate cancer. The Aging Male 2004; 7: 95.
- [13] Millikan RE, Brown M, Moomey B, Logothetis CJ. Preliminary results of a phase III trial of hormonal therapy vs. chemohormonal therapy as initial treatment for non-localized prostate cancer. J Urol 2004; 171: 384 (1459).
- [14] Petrylac DP. Future directions in the treatment od androgen-independent prostate cancer. Urology 2005; 65: (suppl 6a): 8–12.
- [15] Pilepich MV, Vinter K, John MJ, et al. Phase III Radiation Therapy Oncology Group (RTOG) trial 86-10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Bio Phys 2001; 50: 1243–1252.
- [16] Saad F, Gleason DM, Murray R, et al. A randomized, placebo-controlled trial of zoledronic acid in patients with hormone-refractory metastatic prostate carcinoma. J Nat Cancer Indy 2002; 94:1458–1468.
- [17] Saad F, Schulman CC. Role of bisphosphonates in prostate cancer. Eur Urol 2004; 45: 26–34.
- [18] See WA. Adjuvant hormone therapy after radiation or surgery for localized and locally advanced prostate cancer. Curr Treat Options Oncol 2003; 4: 351–362.
- [19] Schalken JA. Apoptosis in the human prostate. Drugs of today 2001; (Suppl. 37): 23–26.
- [20] Tannock IF, Osoba D, Stockler R, et al. Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resi-stant prostate cancer: a Canadian randomized trial with palliative end points. J Clin Oncol 1996; 14: 1756–1764.
- [21] Tannock IF, de Witt R, Berry WR, et al. Docetaxel plus prednisone or Mitoxantrone plus prednisone for advanced prostate cancer. New Engl J Med 2004; 351: 1502–1512.
- [22] Tunn U, Kurek R, Kiele E, Maubach L. Intermittent is as effective as continuous androgen deprivation in patients with PSA-relapse after radical prostatectomy (RP). J Urol 2004; 171: 384 (1458).
- [23] de Wit R. Shifting paradigms in prostate cancer; docetaxel plus low-dose prednisone – finally an effective chemotherapy. Eur J Cancer 2005; 41: 502–507.
- [24] Yri OE, Bjoro T, Fossa SD. Failure to achieve castration levels in pattients using leuprolide acetate in locally advanced prostate cancer. Eur Urol 2006; 49: 54–58.
- [25] Zlotta A, Debruyne FMJ. Expert opinion on optimal testosterone control in prostate cancer. Eur Urol Suppl 2005; 4: 37–41.
- [26] Prostate cancer trialists collaborative group. Maximum androgen blocade in advanced prostate cancer: an overwiev of 22 randomised trials with 3283 death in 5710 patients. Lancet 1995; 346: 265–276.
- [27] Messing EM, Manola J, Sarosdy M et al. Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. N Engl J Med 1999; 341: 1781–1788.
- [28] Saad F, Gleason DM, Murray R, et al. Long-term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormone-refractory prostate cancer. J Natl Cancer Inst 2004; 96: 879–882.
- [29] Saad F, Gleason DM, Murray R, et al. Long-term reduction of bone pain with zoledronic acid in patients with advanced prostate cancer metastatic to bone. J Urol 2003; 169 (suppl) 394. Abstract 1473.