Farmakoterapie masivního krvácení do gastrointestinálního traktu
Masivní krvácení do gastrointestinálního traktu (GIT) je závažný, život ohrožující stav s přetrvávající vysokou morbiditou a mortalitou. Krvácení do horní části GIT se projevuje buď hematemezou, nebo melenou, vzácně je možno pozorovat i enteroragii. Podle etiologie lze krvácení rozdělit na krvácení varikózní a krvácení nevarikózní. V případě nevarikózního krvácení se nejčastěji jedná o krvácení z vředových lézí a erozí v oblasti gastroduodena. V případě krvácení varikózního jde o krvácení z varixů jícnu či z varixů oblasti fundu a subkardie u nemocných s významnou portální hypertenzí. Jak při krvácení varikózní etiologie, tak při krvácení nevarikózním je většinou nezbytná léčba kombinovaná, tj. medikamentózní a endoskopická. Základním opatřením je stabilizace stavu nemocného s následnou volbou nejvhodnějšího typu instrumentálního a medikamentózního opatření. Rizikoví pacienti jsou nemocní hemodynamicky nestabilní, se známkami masivního krvácení, se závažnými komorbiditami, vyšším věkem (> 60 let), koagulopatií apod. Medikamentózně je parenterální terapie H+ blokátory, zejména v případě nevarikózního krvácení, nezbytností. V případě varikózního krvácení má své nezastupitelné místo ve farmakoterapii terlipresin, event. somatostatin. K lokální hemostáze lze využít řady endoskopických metod (injekční, termické, mechanické), které je možno volit podle etiologie krvácení. Včasná stabilizace stavu a následná kombinovaná medikamentózní a endoskopická terapie s dosažením primární hemostázy vede především ke snížení rizika recidivy krvácení a ke snížení počtu urgentních chirurgických zákroků.
Varikózní krvácení
Krvácení z varixů jícnu a žaludku při portální hypertenzi představuje asi 15–30 % masivních krvácení do zažívacího traktu. I přes značné pokroky v terapii v posledních desetiletích je stále 20–30 % těchto příhod smrtelných. Dominující příčinou portální hypertenze je jaterní cirhóza. Zástavu krvácení způsobují vazoaktivní látky konstrikcí splanchnického tepenného řečiště. V jejím důsledku dochází ke snížení průtoku i tlaku v portální žíle. Z podslizničních pletení jsou v horní části gastrointestinálního traktu nejvíce postiženy hluboké vnitřní žíly pod lamina propria a lamina muscularis mucosae v tzv. perforační zóně distálního jícnu. Ty jsou přítomny u 30 % jedinců s kompenzovanou a u 60 % jedinců s dekompenzovanou cirhózou. Rozhodující klinicky měřitelnou veličinou predikující hrozící krvácení je rozdíl tlaků mezi jaterními žílami a portální žílou. Dojde-li ke zvýšení tohoto portosystémového gradientu (HPVG) na 12 mm Hg, je pravděpodobnost ruptury varixů velká. Tato explozivní teorie vzniku varikózního krvácení nahradila původní teorii erozivní, která považovala za nejvýznamnější patogenetický faktor předcházející hemoragii působení volné HCl na sliznici a žilní stěnu varixů.
Rizikovými faktory prvního krvácení z varixů je vedle tlaku v portální žíle pokročilost jaterní dysfunkce, velikost varixů a přítomnost endoskopických známek hrozícího krvácení.
Komplexní farmakoterapie varikózního krvácení spočívá ve třech základních a řadě dalších podpůrných opatření:
1. ‑volumová resuscitace,
2. ‑parenterální podání vazoaktivních látek snižujících průtok a tím tlak v portálním řečišti po dobu pěti dnů se zahájením již v přednemocniční péči [3],
3. ‑přednostně perorální podání širokospektrých antibiotik k profylaxi bakteriálních infekcí u pacientů imunosuprimovaných jaterní chorobou [4], a dále:
– ‑podání látek potlačujících sekreci volné HCl jako prevence stresových slizničních lézí,
– ‑úprava koagulopatie,
– ‑prevence jaterní encefalopatie podáním nevstřebatelných disacharidů,
– ‑zvýšení tonu dolního jícnového svěrače metoklopramidem,
– ‑sekundární profylaxe recidivy krvácení neselektivními b-blokátory.
Vedle farmakoterapie je v péči o nemocného samozřejmostí hrazení krevních ztrát a korekce koagulopatie krevními deriváty a časná endoskopická léčba.
Vazoaktivní látky
Vysoká účinnost těchto látek je dána přímým ovlivněním výše popsaných patofyziologických mechanismů spouštějících krvácení. V klidových podmínkách protéká portálním řečištěm 750 ml krve za minutu, postprandiálně 1500 ml/min a u cirhotiků je toto množství dále zvýšeno hyperkinetickou cirkulací a splanchnickou vazodilatací. Zástavu krvácení způsobují vazokonstriktory snížením průtoku krve, a v důsledku toho i snížením tlaku v portální žíle konstrikcí splanchnického tepenného řečiště. Další evidentní výhodou vazokonstriktorů je možnost zahájení účinné terapie i v případě nedostupnosti okamžité endoskopické léčby. Jejich účinnost není navíc závislá na schopnostech a dovednostech lékaře, tak jako je tomu u terapeutických endoskopických metod.
Do skupiny vazoaktivních látek používaných v této indikaci patří přirozené hormony vazopresin a somatostatin a jejich syntetická analoga – terlipresin, resp. oktreotid, vapreotid a lanreotid (tab. 1).
Vazopresin
Tento hormon zadního laloku hypofýzy, způsobující arteriální vazokontrikci a reabsorpci vody v ledvinách, byl vůbec prvním vazokonstriktorem užitým v léčbě krvácení z jícnových varixů již před více než čtyřiceti lety. Jeho použití však provází časté a závažné komplikace způsobené ischémií řady orgánů včetně myokardu. V Evropě bylo jeho podávání již opuštěno, v USA je stále v kombinaci s parenterálním podáním nitrátů přípustnou možností léčby [5].
Terlipresin
Terlipresin (synonymum glypresin) – analog vazopresinu, syntetizovaný poprvé v roce 1964 v Praze – je dle současných doporučení České hepatologické společnosti lékem první volby při respektování jeho kontraindikací. Je jedinou látkou, při jejímž podávání studie prokázaly snížení mortality krvácení z jícnových varixů [6]. Relativně dlouhý biologický poločas 3,5 hodiny umožňuje jeho intermitentní podávání. Lepší výsledky léčby terlipresinem lze přičítat nárůstu arteriálního zásobení jater s příznivým ovlivněním jaterních funkcí a účinnému ovlivnění hepatorenálního syndromu, který je daleko častější konečnou příčinou smrti u krvácejícího cirhotika než samotná hemoragie (obr. 1) [7].
První podání 1 mg terlipresinu i.v. by mělo být při podezření na varikózní zdroj krvácení a při nepřítomnosti kontraindikací učiněno již v přednemocniční péči. Lze tak snížit riziko časné recidivy krvácení a především mortalitu v následujících týdnech. Na monitorovaném lůžku by se po endoskopickém ověření a ošetření varikózního původu krvácení mělo pokračovat ve farmakologické léčbě terlipresinem v dávce 1–2 mg i.v. každé 4 hodiny po dobu 2–5 dnů, minimálně 24–48 hodin po zástavě krvácení. Hlavními kontraindikacemi léčby terlipresinem je pokročilá ateroskleróza, ischemická choroba srdeční, ischemická choroba končetin, závažné srdeční arytmie a nekorigovaná hypertenzní choroba. Pro možnost místní nekrózy se nesmí aplikovat intramuskulárně.
Somatostatin
Fyziologickou funkcí přirozeného hormonu produkovaného v hypotalamu a gastrointestinálním traktu je regulace růstového hormonu, potlačení sekrece glukagonu i inzulinu, a dále inhibice žaludeční, pankreatické, biliární a intestinální motility a sekrece.
Vzhledem k selektivní vazokonstrikci pouze splanchnických tepen se užívá při kontraindikacích nebo při projevech nežádoucích účinků terlipresinu. Zahajuje se bolusovým intravenózním podáním 250 mg. Vzhledem k velmi krátkému biologickému poločasu je nutno pokračovat formou kontinuální i.v. infuze v dávce 250 mg/h po dobu pěti dnů. Vedle snížení portosystémového gradientu somatostatin signifikantně snižuje průtok žaludeční sliznicí, a tím významně ovlivňuje krvácení při portální hypertenzní gastropatii. Bylo prokázáno, že somatostatin snižuje riziko recidivy krvácení více než vazopresin a stejně účinně jako terlipresin [8–9]. Je považován za stejně účinnou a bezpečnější léčbu než endoskopická skleroterapie [10]. Nicméně žádná z dosud uskutečněných studií neověřila signifikantní pokles mortality v týdnech následujících po akutním varikózním krvácení.
Oktreotid
Syntetický oktapeptidový derivát somatostatinu má léčebné užití především u neuroendokrinních nádorů, akromegalie a úporných průjmů při AIDS. Byla s ním provedena řada studií v léčbě varikózního krvácení. Prokázán byl nižší výskyt komplikací než při léčbě terlipresinem, stejný efekt jako při skleroterapii, v jiné studii podání oktreotidu po provedené skleroterapii snížilo procento recidivy krvácení oproti samotnému endoskopickému ošetření varixů [11]. Vliv na přežití ověřen nebyl.
Vapreotid, lanreotid
Z více než dvaceti dalších známých syntetických analog somatostatinu jsou předmětem klinických zkoušek především vapreotid a lanreotid. V klinické praxi prozatím nejsou užívány.
Antibiotika
Podání širokospektrých antibiotik je vedle terlipresinu jediným známým farmakologickým opatřením, které snižuje mortalitu varikózního krvácení u cirhotiků. Zahájení ATB léčby by mělo předcházet úvodnímu endoskopickému výkonu. Vysvětlením jejich efektu je prevence vzniku často fatální spontánní bakteriální peritonitidy (SBP) a jiných život ohrožujících bakteriálních infekcí. Dekontaminací střevního obsahu brání rozvoji jaterní encefalopatie [12]. Přítomnost endotoxinů v portálním řečišti sama o sobě zvyšuje portální tlak a může vyvolat krvácení, zhoršit již tak porušenou agregaci trombocytů a aktivací mediátorů zánětu způsobit až nekrózu sliznic v gastrointestinálním traktu [13].
Lékem volby jsou fluorochinolony. Přednostně by měly být podávány perorálně. V zahraničních doporučeních je právě s ohledem na riziko bakteriální translokace a vzniku SBP nejčastěji uváděn jako ATB první volby norfloxacin v dávce 400 mg/12 h p.o., obdobně lze užít i ciprofloxacin nebo ofloxacin v běžném terapeutickém dávkování. Stejně účinný je i cefotaxim. V kombinaci s chinolony byly s úspěchem podávány kombinované preparáty amoxicilinu a ampicilinu s ireverzibilními inhibitory bakteriálních b-laktamáz.
Rekombinantní aktivovaný koagulační faktor VII
Podání rekombinantního aktivovaného koagulačního faktoru VII (rFVIIa) pacientům s pokročilou jaterní cirhózou a krvácením do zažívacího traktu upravuje prodloužený protrombinový čas. Prokazatelně snižuje podíl selhání farmakologické zástavy krvácení u funkčního stadia Child B–C bez ovlivnění mortality [14]. Své uplatnění by rFVIIa v terapeutickém algoritmu varikózního krvácení, po ověření dalšími studiemi, mohl nalézt při selhání v současnosti zavedené vazoaktivní léčby [15] nebo při aktivním krvácení v době endoskopického výkonu [16].
b-blokátory
Po první epizodě varikózního krvácení se riziko jeho opakování během dvou let pohybuje v rozmezí 60–70 %. Úloha neselektivních b-blokátorů spočívá v jeho sekundární profylaxi po ukončení podávání vazoaktivních látek. Jejich efekt by měl být kontrolován změřením portosystémového tlakového gradientu (s dokumentovaným poklesem na < 12 mm Hg) v odstupu dvou až tří měsíců od zahájení léčby [17]. Je doporučováno dosáhnout snížení klidové tepové frekvence o 20–25 %. S ohledem na nedostupnost neselektivních b-blokátorů propranololu a nadololu v ČR, jejichž účinnost byla ověřena studiemi, byl v běžné klinické praxi dosud podáván metipranol. Po zastavení jeho distribuce lze s výhradami připustit používání karvedilolu [18].
Nevarikózní krvácení
Nevarikózním krvácením do horní části gastrointestinálního traktu se rozumí krvácení probíhající orálně od Treitzova ligamenta. Toto krvácení se manifestuje většinou jako melena nebo hemateméza, ale výjimečně i jako enteroragie. Incidence je poměrně vysoká – 100–170/100 000. Nejčastější příčinou je krvácení z peptických lézí gastroduodena (tab. 2).
Infekce Helicobacter pylori, abúzus nesteroidních antirevmatik a kyseliny acetylsalicylové patří mezi hlavní rizikové faktory krvácení. Ke spontánní zástavě krvácení dochází v 70–80 % případů. Pokračující krvácení či jeho časná recidiva (do 24–72 hodin od první ataky krvácení) se vyskytuje ve více než 20 % případů. Přes veškerý pokrok je mortalita stále vysoká a pohybuje se podle různých studií mezi 8–14 %. Nezávislými prediktory mortality jsou věk, šokový stav, závažné komorbidity, stigmata recentního krvácení a recidiva krvácení [19]. K identifikaci rizikových pacientů ohrožených recidivou krvácení je používána Forrestova klasifikace aktivity krvácení z vředových lézí (tab. 3). U pokračujícího a recidivujícího krvácení se mortalita zvyšuje až 10krát.
Nepříznivými prognostickými kritérii jsou věk nad 60 let, závažné komorbidity, probíhající (pokračující) krvácení, recidiva krvácení během hospitalitace, masivní krvácení vyžadující více než 6 jednotek EM za 24 hodin.
Komplexní farmakoterapie masivního nevarikózního krvácení spočívá v následujících základních opatřeních:
1. ‑volumová resuscitace a stabilizace stavu,
2. ‑parenterální podání blokátorů protonové pumpy k potlačení volné sekrece HCl (omeprazol, pantoprazol),
3. ‑event. parenterální podání vazoaktivních látek snižujících průtok splanchnickým řečištěm (somatostatin).
Vedle zmíněné farmakoterapie je samozřejmostí hrazení krevních ztrát, korekce případné koagulopatie a časná endoskopická léčba.
Medikamentózní terapie nevarikózního krvácení do horní části GIT se opírá především o léky, které potlačují produkci volné HCl. Již v předchozí části zmíněný, parenterálně podávaný somatostatin redukuje průtok splanchnickým řečištěm a navozuje supresi kyselé sekrece v žaludku, avšak v terapii nevarikózního krvácení má dominantní postavení parenterální podání blokátorů protonové pumpy. Zavedením této léčby došlo k významnému posunu ve výsledcích kozervativní léčby nevarikózního krvácení do horní části GIT a k razantnímu snížení chirurgických zásahů z této indikace.
Blokátory protonové pumpy
Základní a nejrozšířenější blokátor protonové pumpy s možností parenterální aplikace je omeprazol (obr. 2). Jedná se o antiulcerózum specificky ireverzibilně blokující H+/K+ATPázu (protonovou pumpu) lokalizovanou v membráně sekretorického kanálku parietální buňky sliznice žaludku. Vlastní omeprazol je proléčivo s vysokou afinitou ke kyselému prostředí, ve kterém se rychle konvertuje na vlastní účinnou látku – sulfenamid. Funkce protonové pumpy může být obnovena až po nové syntéze enzymu H+/K+ATPázy parietální buňkou, ke které dochází v průběhu 24 hodin. Jednorázovým podáním 20 mg omeprazolu je dosaženo 80% snížení 24hodinové acidity; pH blízké neutralitě, nezbytné pro hojení peptických lézí, je udrženo po dobu přibližně 17 hodin, kdy dochází k postupné obnově syntézy H+ iontů a k nové sekreci HCl [20]. Zvýšené pH je rovněž nezbytné pro správnou funkci trombocytů, umožňuje stabilizaci koagula a brzdí fibrinolytické procesy [21]. Bezpečnostní profil blokátorů protonové pumpy je srovnatelný s H2 antagonisty a vážnější nežádoucí účinky nebyly prokazatelně pozorovány. Nežádoucí účinky se vyskytují přibližně u 1–3 % pacientů a jsou nejčastěji charakteru dyspeptických obtíží (nevolnost, flatulence, průjem), bolesti hlavy, kožní příznaky (rash, svědivky apod). Počáteční obavy z možné hyperplazie enterochromafinních buněk s rozvojem následných gastrických tumorů charakteru karcinoidu nebyly za období podávání omeprazolu u člověka potvrzeny [22]. Kontraindikací podávání je přecitlivělost na účinnou látku či jinou složku přípravku. Jiná kontraindikace podávání omeprazolu zatím není známa.
Khuroo a kol. v metaanalýze 26 studií hodnotících efekt terapie blokátory protonové pumpy ve srovnání s H2 antagonisty nebo s placebem prokázali signifikantní snížení rizika recidivy krvácení, snížení množství chirurgických zákroků a snížení spotřeby krevních derivátů. Celková mortalita však překvapivě zůstává bez významných změn. Nejlepších výsledků je dosaženo kombinací medikamentózní terapie omeprazolem s časným endoskopickým vyšetřením s dosažením hemostázy za pomoci různých endoskopických technik [23].
Lau a kol. ve své studii [24] prokázali příznivý účinek podání bolusu 80 mg omeprazolu intravenózně s následným kontinuálním podáním omeprazolu v infuzi v dávce 8 mg/h po dobu 72 hodin. Tento postup se v případě masivního nevarikózního krvácení do horní části GIT stále jeví jako optimální.
Zahájení léčby omeprazolem s následným kontinuálním podáváním by mělo být co nejčasnější, a to – jak ukazují některé studie – ještě před endoskopickým vyšetřením [25, 26]. Včasné podání vede k redukci nálezu endoskopických stigmat krvácení a snižuje i celkovou potřebu endoskopických výkonů, rozhodně ale urgentní endoskopii nenahrazuje. Endoskopické vyšetření umožňuje stanovení zdroje krvácení, lokální terapii, odhad rizika recidivy krvácení a tím i stanovení možné prognózy. Podání bolusu omeprazolu s následnou kontinuální aplikací vede k významné supresi kyselé sekrece, při které dochází k udržení pH > 6 po přibližně 85–90 % celkového času. To vede k rychlejší stabilizaci koagula, snížení mukolytické aktivity, inaktivaci pepsinu a k zahájení hojení [27].
Nejsou-li známky pokračujícího či recidivujícího krvácení, parenterální aplikace delší než 72 hodin nemá význam; je-li možný perorální příjem, pacient má být převeden na terapii perorální, která je stejně účinná a ekonomicky méně náročná než podávání parenterální [28, 29].
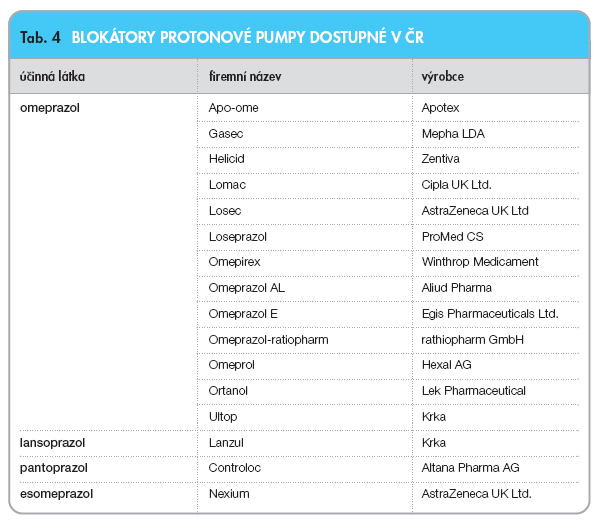
K dispozici je na našem trhu celá řada perorálních blokátorů protonové pumpy (tab. 4), v parenterální formě je u nás nejrozšířenější omeprazol, v zahraničí je velice oblíbený také pantoprazol.
Závěr
Masivní krvácení do gastrointestinálního traktu je závažný stav vyžadující komplexní přístup s cílem co nejrychlejší stabilizace stavu, lokalizace zdroje krvácení a jeho zastavení. Cílená farmakoterapie má spolu s lokální endoskopickou léčbou klíčovou roli. V případě varikózního krvácení je lékem první volby intravenózní aplikace terlipresinu, jehož podání prokazatelně snižuje mortalitu krvácení z jícnových varixů. Jistou alternativou při kontraindikaci terapie terlipresinem je parenterální terapie somatostatinem.
Nejčastější příčinou masivního nevarikózního krvácení do horní části GIT jsou peptické léze gastroduodena. Zde má nezastupitelné místo intenzivní antisekreční terapie blokátory protonové pumpy – omeprazolem. Iniciální intravenózní podání bolusu omeprazolu s jeho následnou kontinuální infuzí po dobu 72 hodin je spolu s endoskopickým řešením optimálním postupem.
Seznam použité literatury
- [1] de Franchis R. Updating Consensus in Portal Hypertension: Report of the Baveno III Consensus Workshop on definitions, methodology and therapeutic strategies in portal hypertension. J Hepatol 2000; 33: 846–852.
- [2] Jalan R, Hayes PC. UK guidelines on the management of variceal haemorrhage in cirrhotic patients. Gut 2000; 46 (Suppl. 34): 111–115.
- [3] Goulis J, Burroughs AK. Role of vasoactive drugs in the treatment of bleeding oesophageal varices. Digestion 1999; 60 (Suppl. 3): 25–34.
- [4] Lata J, Vaňásek T, Příbramská V, Husová L. Medikamentózní léčba akutního krvácení z jícnových varixů – možnosti ovlivnění portální hypertenze a terapie infekce. Remedia 2003; 13: 319–323.
- [5] Pulanic R. Drug therapy of hemorrhage in esophageal and gastric varices: role of vasoactive drugs. Lijec Viesn 2000; 122: 276–283.
- [6] Ioannou GN, Doust J, Rockey DC. Systematic review: terlipressin in acute oesophageal variceal haemorrhage. Aliment Pharmacol Ther 2003; 17: 53–64.
- [7] Dohler KD, Walker S, Mentz P, et al. Vasoconstrictive Therapies for Bleeding Esophageal Varices and their Mechanisms of Action. Z Gastroenterol 2003; 41: 1001–1016.
- [8] Avgerinos A. Approach to the management of bleeding esophageal varices: role of somatostatin. Digestion 1998; 59 (Suppl. 1): 1–22.
- [9] De Franchis R. Somatostatin, somatostatin analogues and other vasoactive drugs in the treatment of bleeding oesophageal varices. Dig Liver Dis 2004; 36 (Suppl. 1): S93–S100.
- [10] Planas R, Quer JC, Boix J, et al. A prospective randomized trial comparing somatostatin and sclerotherapy in the treatment of acute variceal bleeding. Hepatology 1994; 20: 370–375.
- [11] Besson I, Ingrand P, Person B, et al. Sclerotherapy with or without octreotide for acute variceal bleeding. N Engl J Med 1995; 333: 555–560.
- [12] Bernard B, Grange JD, Nyugen Khao E, et al. Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a metaanalysis. Hepatology 1999; 29: 1655–1661.
- [13] Goulis J, Armonis A, Patch D, et al. Bacterial infection is independently associated with failure control bleeding in cirrhotic patients with gastrointestinal hemorrhage. Hepatology 1998; 27: 1207–1212.
- [14] Bosch J, Thabut D, Bendtsen F, et al. Recombinant factor VIIa for upper gastrointestinal bleeding in patients with cirrhosis: a randomized, double-blind trial. Gastroenterology 2004; 127: 1123–1130.
- [15] Romero-Catro R, Jiménez-Sáenz M, Pellicer-Bautista F, et al. Recombinant-activated factor VII as hemostatic therapy in eight cases of severe hemorrhage from esophageal varices. Clin Gastroenterol Hepatol 2004; 2: 78–84.
- [16] Thabut D, Bernard-Chabert B. Management of acute bleeding from portal hypertension. Best Pract Res Clin Gastroenterol 2007; 21: 19–29.
- [17] Grace ND. Pharmacologic therapy of portal hypertension and variceal hemorrhage. Clin Liver Dis 1997; 1: 59–75.
- [18] Česká hepatologická společnost. Doporučený postup pro diagnostiku a léčbu krvácení do zažívacího traktu při portální hypertenzi. 6.12. 2005. www.ceska-hepatologie.cz.
- [19] Rockall TA, Logan RFA, Devlin HB, et al. Risk assessment after acute upper gastrointestinal haemorrhage. Gut 1996; 38: 316–321.
- [20] Novotný A. Omeprazolum. Remedia 2001; 11: 2–9.
- [21] Palmer KR. Non-variceal upper gastrointestinal haemorrhage: guidelines. Gut 2002; 51 (Suppl. IV): 1–6.
- [22] Wolfe MM., Sachs G. Acid suppression: Optimizing therapy for gastroduodenal ulcer healing, gastroesophageal reflux disease and stress-rela ted erosive syndrome. Gastroenterology 2000; 118: S9–S31.
- [23] Khuroo MS, Farahat KLC, Kagevi IE. Treatment with proton pump inhibitors in acute non-variceal upper gastrointestinal bleeding: A meta-analysis. J Gastroenterol Hepatol 2005; 20: 11–25.
- [24] Lau JYW, Sung JJY, Lee KKC. Effect of intravenous omeprazole on recurrent bleeding after endoscopic treatment of bleeding peptic ulcers. N Engl J Med 2000; 343: 310–316.
- [25] Keyvani L, Murthy S, Leeson S et al. Pre-endoscopic proton pump inhibitor therapy reduces recurrent adverse gastrointestinal outcomes in patients with acute non-variceal upper gastrointestinal bleeding. Aliment Pharmacol Ther 2006; 24: 1245–1255.
- [26] Lau JY, Leung WK, Wu JC, et al. Omeprazole before endoscopy in patients with gastrointestinal bleeding. N Engl J Med 2007; 19: 1631–1640.
- [27] Yacyshyn BR., Thomson ABR. Critical review of acid suppression in nonvariceal, acute, upper gastrointestinal bleeding. Dig Dis 2000; 18: 117–128.
- [28] Triadafilopoulos G. Review article: the role of antisecretory therapy in the management of non-variceal upper gastrointestinal bleeding. Aliment Pharmacol Ther 2005; 22 (Suppl. 3): 53–58.
- [29] Rivkin K, Lyakhovetskiy A. Treatment of nonvariceal upper gastrointestinal bleeding. Am J Health Syst Pharm 2005; 62: 1159–1170.