Farmakoterapie metastatického kolorektálního karcinomu – současné možnosti
Systémová léčba metastatického kolorektálního karcinomu má nezastupitelné místo v léčebné strategii. Nejčastější lokalizací vzdálených metastáz jsou játra. Indukční systémová léčba je indikovaná u nemocných s potenciálně operabilním onemocněním. Chemoterapie a cílená léčba probíhá v případě dobrého zdravotního stavu u nemocných s neresekabilními vzdálenými metastázami. Největšího uplatnění dosáhly režimy kombinující fluoropyrimidiny, oxaliplatinu, irinotekan, bevacizumab, cetuximab a panitumumab.
Úvod
Kolorektální karcinom představuje závažný celospolečenský zdravotní i ekonomický problém. Incidence onemocnění má trvale stoupající charakter. Česká republika bohužel patří mezi země s nejvyšší incidencí tohoto závažného onemocnění. Mortalita i díky screeningu, diagnostice časnějších stadií a konečně i v důsledku zlepšení onkologické terapie nekopíruje trend incidence, ale její vývoj je stacionární. Dle dat z roku 2008 představovala incidence kolorektálního karcinomu 78,68/100 000 obyvatel, mortalita byla 41,2/100 000 obyvatel [1]. Zhruba 50 % všech nemocných s kolorektálním karcinomem dospěje do stadia vzdálené generalizace. Při nejlepší podpůrné léčbě dosahuje přežití u této skupiny nemocných jenom asi 6 měsíců. V posledních letech je do praxe zaváděno mnoho účinných cytostatik a monoklonálních protilátek. Tyto postupy zlepšily špatnou prognózu nemocných. Nyní při aplikaci nejúčinnějších léčebných postupů lze dosáhnout přežití přesahující 24 měsíců a generalizované onemocnění se stává již potenciálně léčitelným. Důležitou součástí léčebné strategie je také vytipování skupiny pacientů, u nichž lze předpokládat chirurgické odstranění metastáz, po kterém lze očekávat i víceletou remisi onemocnění. Článek je zaměřen hlavně na současné možnosti farmakoterapie kolorektálního karcinomu.
Cytostatika používaná v léčbě metastatického kolorektálního karcinomu
V léčbě metastatického kolorektálního karcinomu (mCRC) má nezastupitelné místo systémová chemoterapie. Nyní uvedeme stručnou charakteristiku cytostatik, jež dosáhla největšího uplatnění v léčbě.
5-fluorouracil, analog citidinu, je základním cytostatikem používaným v onkologické léčbě mCRC. Po podání se rychle metabolizuje v játrech, 20 % se vylučuje do moči. Biologický poločas eliminace je 10–25 minut. Jeho protinádorová účinnost byla poprvé zdokumentována v roce 1957 u hlodavců s následným uvedením i do klinické praxe. Účinnost 5-fluorouracilu (5-FU) v monoterapii je v rozmezí 10–15 % léčebných odpovědí s mediánem přežití 11–16 měsíců. Relativně nízký účinek 5-FU podnítil snahy o jeho zvýšení. Bylo zjištěno, že kyselina listová ve formě leukovorinu vytváří s 5-fluorouridindeoxymonofosfátem a enzymem thymidilátsyntázou terciární komplex, který blokuje další syntézu thymidinu a tím i DNA. Tato biomodulace pomocí leukovorinu podle metaanalýzy ACCDA v roce 1992 prokázala zlepšení léčebné odpovědi na 23 % [45]. Došlo též k signifikantnímu prodloužení přežití bez progrese onemocnění (PFS, progression free survival) i mediánu celkového přežití (OS, overall survival). Bezpečnostní profil této kombinace a monoterapie 5-FU je srovnatelný. 5-flurouracil je v buňkách metabolizován na neaktivní metabolity pomocí enzymu dihydropyrimidindehydrogenázy (DPD) [2]. Nedostatečná aktivita enzymu DPD ve zdravých buňkách je spojena s vysokou toxicitou léčby, naopak nadměrná koncentrace enzymu DPD v buňkách tumoru je spojena s rezistencí nádoru vůči léčbě fluoropyrimidiny. Defekty DPD jsou nejčastěji způsobeny bodovou nebo střihovou mutací. Prevalence v populaci se odhaduje na 1–5,8 %. 5-FU lze podat kontinuální formou (např. režim podle de Gramonta) nebo bolusovou formou (např. režim Mayo). Kontinuální režim dosahuje vyššího procenta léčebných odpovědí (33 % vs. 14 %) i delšího času do progrese (26 vs. 22 týdnů). Celkové přežití je bez statisticky významného rozdílu [3]. Kontinuální režim má ale lepší profil toxicity. 5-FU lze také podat intraperitoneálně, intraarteriálně do arteria hepatica při léčbě jaterních metastáz. Nejčastějšími nežádoucími účinky léčby 5-FU jsou nevolnost, zvracení, mírná alopecie, slizniční změny, průjmy. Dále se vyskytuje hematologická toxicita (leukopenie, trombocytopenie) a kardiotoxicita.
Irinotekan patří mezi inhibitory DNA topoizomerázy I, je vylučován ledvinami. Biologický poločas eliminace této látky je třífázový (poločasy 12 min., 2,5 hod. a 14,2 hod.). Irinotekan nepodléhá mechanismům mnohočetné rezistence (multidrug resistance, MDR) a vykazuje synergický účinek s cisplatinou a 5-FU. Při léčbě mCRC lze podat irinotekan v monoterapii nebo v kombinaci s 5-FU a leukovorinem (např. režimy FOLFIRI, IFL atd.). Kombinované režimy prokázaly vyšší počet klinických odpovědí (49 % vs. 31 %), delší čas do progrese (7 měsíců vs. 4 měsíce) a také mírně delší celkové přežití (17 měsíců vs. 14 měsíců) v porovnání s kobinací 5-FU/leukovorin [4]. Irinotekan má inhibiční účinek na cholinesterázu, čímž může způsobit cholinergní syndrom, který se u nemocných projeví jako akutní průjem, křeče v břiše, slzení, salivace, mióza, pocení. Proto je vhodné pacientům, u nichž byly pozorovány příznaky akutního cholinergního syndromu, podat před další aplikací irinotekanu atropin profylakticky. Dalšími nežádoucími účinky jsou myelotoxicita, nevolnost, zvracení.
Oxaliplatina je platinový komplex s alkylačním účinkem. Ve srovnání s cisplatinou má nízkou nefrotoxicitu. Byla pozorována rozdílná účinnost i tolerance léčby v závislosti na chronobiologii. Optimální je kontinuální infuze s maximem dávky kolem 16. hodiny. Oxaliplatina je podobně jako irinotekan součástí mnoha režimů kombinujících také 5-fluorouracil a leukovorin (režimy FOLFOX4, 6 a 7 – dle dávky oxaliplatiny, bFOL atd.). Kombinovaný režim FOLFOX4 prokázal v porovnání s režimem podle de Gramonta vyšší procento celkové léčebné odpovědi (kolem 50 %) i o 3 měsíce delší přežití bez progrese onemocnění [5]. Mezi nežádoucí účinky léčby oxaliplatinou patří nevolnost a zvracení. Častým projevem je periferní neurotoxicita, která může být limitujícím faktorem užití oxaliplatiny.
Kapecitabin je perorální forma fluoropyrimidinu. Využívá vyšší koncentrace thymidinfosforylázy v nádorových tkáních ke konverzi na 5-FU. Kapecitabin je beze změny a téměř kompletně resorbován z trávicího traktu a primárně metabolizován v játrech a nádorové tkáni. Výhodou je užití této látky u nemocných s insuficientním žilním přístupem. Mezi nežádoucí účinky patří průjem, kožní změny (tzv. hand-foot syndrom), mírná nevolnost, zvracení. Kapecitabin se stal součástí chemoterapeutických režimů v kombinaci s irinotekanem i oxaliplatinou (režimy XELOX, XELIRI, CAPOX, CAPIRI). Kapecitabin lze podávat i v monoterapii. Uskutečnilo se mnoho klinických studií, které hodnotily účinnost kapecitabinu v porovnání s 5-FU v léčbě mCRC. Účinnost kapecitabinu je minimálně ekvivalentní s kontinuálními režimy 5FU. Kapecitabin v monoterapii je účinnější než bolusový režim 5-FU [46]. Randomizovaná klinická studie NO16968 prokázala lepší účinnost režimu XELOX v porovnání s bolusovým režimem 5-FU s leukovorinem v adjuvantní léčbě kolorektálního karcinomu. Pacienti léčení režimem XELOX měli vyšší výskyt neuropatie a palmoplantárního syndromu. Nežádoucí účinky se u starších pacientů v obou ramenech studie nevyskytly častěji s výjimkou průjmu, jehož incidence byla asi o jednu třetinu vyšší než u pacientů mladších [47].
Mezi další cytostatika, která nepatří ke standardnímu klinickému použití v léčbě mCRC, patří tegafur, raltitrexed, mitomycin C a jiná.
Cílená terapie metastatického kolorektálního karcinomu
V posledních letech se v klinické praxi léčby mCRC objevila i cílená terapie. Největší uplatnění prozatím získaly protilátky bevacizumab, cetuximab a panitumumab.
Bevacizumab je rekombinantní monokonální protilátka IgG1 proti vaskulárnímu endoteliálnímu růstovému faktoru (VEGF, vascular endothelial growth factor), který je stimulátorem novotvorby endoteliálních buněk a tím tvorby cév [6, 7]. Po navázání bevacizumabu na VEGF dochází k zablokování angiogeneze, která je mnohem intenzivnější v nádorových tkáních, hlavně při velikosti tumoru nad 2 mm. Také dochází k blokování vzniku metastáz. Dávkování je 5 mg/kg tělesné hmotnosti každé 2 týdny nebo 7,5 mg/kg každé 3 týdny. V případě použití bevacizumabu ve 2. linii je doporučena dávka dvojnásobná – tedy 10 mg/kg každé 2 týdny. První dávka bevacizumabu by měla být podávána ve formě nitrožilní infuze trvající 90 minut. Jestliže je první infuze dobře snášena, druhá infuze může být podávána 60 minut. Jestliže je i tato dobře snášena, všechny následující infuze mohou být podávány během 30 minut. Mezi nežádoucí účinky bevacizumabu patří vznik arteriální hypertenze, proto je při podávání nutné sledovat krevní tlak a při rozvoji hypertenze podat antihypertenziva [8]. Mezi další nežádoucí účinky bevacizumabu patří proteinurie, vznik tromboembolické nemoci, gastrointestinální perforace. Vzhledem k blokování tvorby cév při terapii bevacizumabem a tím i zhoršení hojení ran by léčba bevacizumabem měla být zahájena 28 dnů od operačního výkonu. Naopak elektivní operace by měla být naplánována s odstupem 6–8 týdnů po ukončení terapie bevacizumabem.
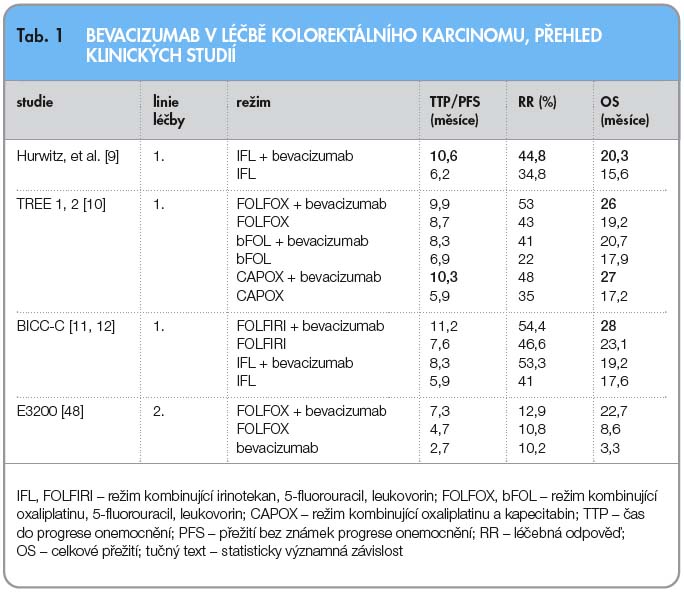 Pilotní studie prokazující účinnost bevacizumabu v léčbě mCRC byla prezentována v roce 2004 [9]. Celkem 813 nepředléčených nemocných bylo randomizováno v poměru 1 : 1 do dvou ramen. Nemocní v prvním rameni byli léčeni kombinací irinotekanu, 5-FU a leukovorinu (režim IFL), ve druhém rameni byl přidán ke kombinaci bevacizumab v dávce 5 mg/kg ve 2týdenních intervalech. Medián celkového přežití byl v rameni s bevacizumabem 20,3 měsíce v porovnání s ramenem bez bevacizumabu, kde byl medián přežití 15,6 měsíce (HR 0,66; p < 0,001). Medián PFS byl významně větší v rameni s užitím bevacizumabu (10,6 měsíce vs. 6,2 měsíce; HR 0,54; p = 0,001), podobně i léčebná odpověď (44,8 % vs. 34,8 %; p = 0,001). Arteriální hypertenze stupně 3 byla při užití bevacizumabu pozorována v 11 % případů, v rameni bez bevacizumabu ve 2,3 %. Bevacizumab je nyní indikován v terapii metastazujícího karcinomu tlustého střeva nebo rekta v kombinaci s chemoterapeutickým režimem obsahujícím fluoropyrimidin. Základní studie s užitím bevacizumabu v terapii mCRC jsou uvedeny v tab. 1.
Pilotní studie prokazující účinnost bevacizumabu v léčbě mCRC byla prezentována v roce 2004 [9]. Celkem 813 nepředléčených nemocných bylo randomizováno v poměru 1 : 1 do dvou ramen. Nemocní v prvním rameni byli léčeni kombinací irinotekanu, 5-FU a leukovorinu (režim IFL), ve druhém rameni byl přidán ke kombinaci bevacizumab v dávce 5 mg/kg ve 2týdenních intervalech. Medián celkového přežití byl v rameni s bevacizumabem 20,3 měsíce v porovnání s ramenem bez bevacizumabu, kde byl medián přežití 15,6 měsíce (HR 0,66; p < 0,001). Medián PFS byl významně větší v rameni s užitím bevacizumabu (10,6 měsíce vs. 6,2 měsíce; HR 0,54; p = 0,001), podobně i léčebná odpověď (44,8 % vs. 34,8 %; p = 0,001). Arteriální hypertenze stupně 3 byla při užití bevacizumabu pozorována v 11 % případů, v rameni bez bevacizumabu ve 2,3 %. Bevacizumab je nyní indikován v terapii metastazujícího karcinomu tlustého střeva nebo rekta v kombinaci s chemoterapeutickým režimem obsahujícím fluoropyrimidin. Základní studie s užitím bevacizumabu v terapii mCRC jsou uvedeny v tab. 1.
Cetuximab je chimérická monoklonální rekombinantní protilátka IgG1, která se váže na extracelulární část receptoru pro epidermální růstový faktor (EGFR, epidermal growth factor receptor). EGFR je glykoprotein a je členem rodiny HER-receptorů [14]. Po zablokování EGFR cetuximabem dochází k blokování fosforylace a aktivity tyrozinkináz, což vede k inhibici buněčné proliferace, angiogeneze, vzniku metastáz, k indukci apoptózy. V různých preklinických modelech i v klinických studiích byla prokázána synergická účinnost cetuximabu s mnoha cytostatiky i s radioterapií. Většinou se cetuximab podává 1krát týdně s využitím úvodní nasycovací dávky 400 mg/m2 tělesného povrchu podávané intravenózní infuzí po dobu 120 minut. Všechny následující týdenní dávky představují 250 mg/m2 podávaných intravenózní infuzí po dobu 60 minut. Cetuximab lze podávat samostatně nebo v kombinaci s irinotekanem, který se aplikuje s časovým odstupem minimálně 1 hodiny od ukončení aplikace cetuximabu v dávce 350 mg/m2 tělesného povrchu 1krát za 3 týdny. Před zahájením první infuze je nutná premedikace pacientů antihistaminiky a kortikosteroidy.
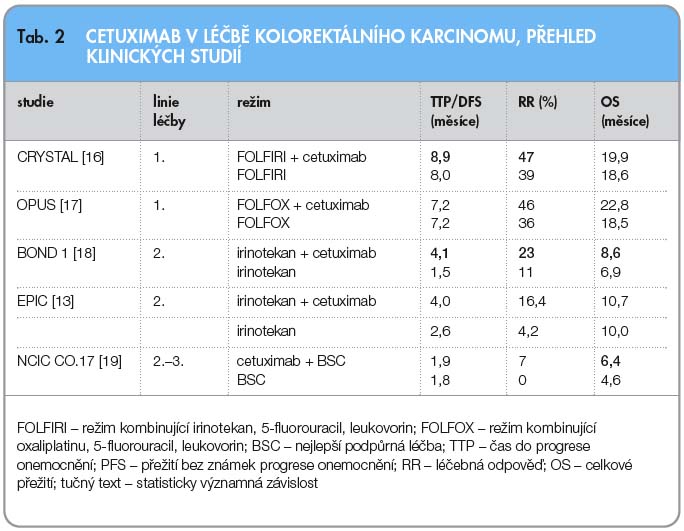 Mezi nežádoucí účinky cetuximabu patří kožní reakce, které se mohou vyvinout u více než 80 % pacientů a projevují se hlavně jako akneiformní vyrážka, pruritus, suchá kůže, deskvamace a hypertrichóza. Lze pozorovat také anafylaktickou reakci po podání látky. V pilotní studii [15] byli nemocní po selhání léčby irinotekanem a s expresí EGFR randomizováni do dvou ramen: cetuximab + irinotekan (i přes předešlé selhání léčby tímto přípravkem) a cetuximab v monoterapii. Celková léčebná odpověď při kombinaci irinotekan + cetuximab byla 22,9 % oproti 10,8 % při aplikaci monoterapie cetuximabem (p = 0,007). Medián času do progrese (TTP, time to progression) byl 4,1 měsíce vs. 1,5 měsíce (p = 0,01) ve prospěch kombinace irinotekan + cetuximab. Medián celkového přežití byl 8,6 měsíce v kombinaci v porovnání s 6,9 měsíce při monoterapii cetuximabem (p = 0,48). Účinnost režimu s cetuximabem byla nezávislá na počtu cyklů předchozí chemoterapie a expresi EGFR. Byla pozorována závislost účinku léčby cetuximabem na stupni kožní toxicity. Podobnou korelaci prokázalo i mnoho dalších studií s cetuximabem. Na ASCO 2011 bylo proto doporučeno ukončit terapii cetuximabem i další anti-EGFR terapie, dokud není kožní toxicita vyjádřena alespoň stupněm II. Bylo dokonce pozorováno, že při kožní toxicitě stupně 0 či 1 jsou výsledky kombinované léčby horší než při užití samotné chemoterapie. Účinnost cetuximabu byla hodnocena i v další studii fáze III (NCIG CTG CO 17), kam byly zařazeni nemocní s mCRC po selhání léčby nebo nesnášející všechny standardní režimy chemoterapie. Cetuximab byl hodnocen v porovnání s podpůrnou samotnou léčbou. Celkově vedlo přidání cetuximabu k významnému prodloužení doby celkového přežití (6,1 vs. 4,6 měsíce). Přehled klinických studií s cetuximabem uvádí tab. 2.
Mezi nežádoucí účinky cetuximabu patří kožní reakce, které se mohou vyvinout u více než 80 % pacientů a projevují se hlavně jako akneiformní vyrážka, pruritus, suchá kůže, deskvamace a hypertrichóza. Lze pozorovat také anafylaktickou reakci po podání látky. V pilotní studii [15] byli nemocní po selhání léčby irinotekanem a s expresí EGFR randomizováni do dvou ramen: cetuximab + irinotekan (i přes předešlé selhání léčby tímto přípravkem) a cetuximab v monoterapii. Celková léčebná odpověď při kombinaci irinotekan + cetuximab byla 22,9 % oproti 10,8 % při aplikaci monoterapie cetuximabem (p = 0,007). Medián času do progrese (TTP, time to progression) byl 4,1 měsíce vs. 1,5 měsíce (p = 0,01) ve prospěch kombinace irinotekan + cetuximab. Medián celkového přežití byl 8,6 měsíce v kombinaci v porovnání s 6,9 měsíce při monoterapii cetuximabem (p = 0,48). Účinnost režimu s cetuximabem byla nezávislá na počtu cyklů předchozí chemoterapie a expresi EGFR. Byla pozorována závislost účinku léčby cetuximabem na stupni kožní toxicity. Podobnou korelaci prokázalo i mnoho dalších studií s cetuximabem. Na ASCO 2011 bylo proto doporučeno ukončit terapii cetuximabem i další anti-EGFR terapie, dokud není kožní toxicita vyjádřena alespoň stupněm II. Bylo dokonce pozorováno, že při kožní toxicitě stupně 0 či 1 jsou výsledky kombinované léčby horší než při užití samotné chemoterapie. Účinnost cetuximabu byla hodnocena i v další studii fáze III (NCIG CTG CO 17), kam byly zařazeni nemocní s mCRC po selhání léčby nebo nesnášející všechny standardní režimy chemoterapie. Cetuximab byl hodnocen v porovnání s podpůrnou samotnou léčbou. Celkově vedlo přidání cetuximabu k významnému prodloužení doby celkového přežití (6,1 vs. 4,6 měsíce). Přehled klinických studií s cetuximabem uvádí tab. 2.
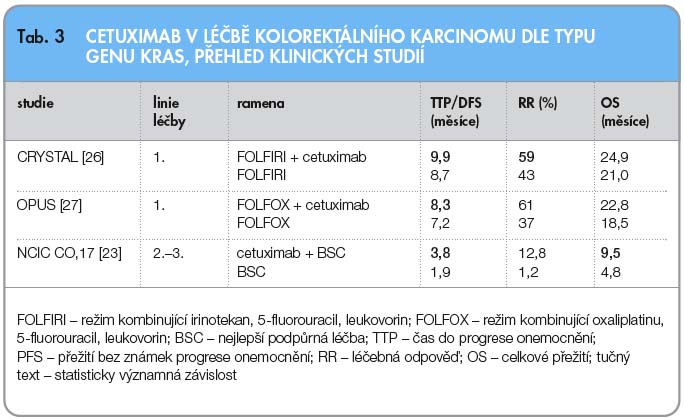 Většina studií zařazovala nemocnou populaci na základě exprese EGFR na povrchu nádorové buňky. Výsledky ale prokázaly, že kolem 25 % nemocných s negativní expresí EGFR zareaguje na léčbu cetuximabem a malá část nemocných s expresí EGFR na léčbu neodpoví. Proto se hledaly další potenciální prediktivní faktory pro léčbu cetuximabem. Nejlepší výsledky prokázal stav genu KRAS [20–22]. Gen KRAS hraje důležitou roli v časném procesu kancerogeneze, ale jeho úloha není dosud ještě plně objasněna. Jedná se o protoonkogen z rodiny genů RAS. Jeho produktem je GTPáza zodpovědná za přenos informací buňkou. Po navázání ligandu na EGFR dojde k dimerizaci receptoru, autofosforylaci tyrozinkinázové domény a k aktivaci signálních drah RAS-RAF-MEK-MAPK a PI3K-AKT-mTOR-S6K, po níž je následně aktivována transkripce genů pro pozitivní regulaci buněčné proliferace, angiogeneze a migrace pro negativní regulaci apoptózy. Nejčastější mutací genu KRAS je bodová mutace. U karcinomu tračníku se vyskytuje ve 20–50 % případů. U nemocných, kde není přítomna mutace genu KRAS, se mluví o nemutovaném, přirozeném typu (wild-type, wt) genu KRAS. Ve výše zmíněné studii NCIC CTG CO.17 byly výsledky celkového přežití u osob s KRAS wild-type významně lepší (9,5 vs. 4,8 měsíce) [23]. Přehled dalších klinických studií s cetuximabem uvádí tab. 3.
Většina studií zařazovala nemocnou populaci na základě exprese EGFR na povrchu nádorové buňky. Výsledky ale prokázaly, že kolem 25 % nemocných s negativní expresí EGFR zareaguje na léčbu cetuximabem a malá část nemocných s expresí EGFR na léčbu neodpoví. Proto se hledaly další potenciální prediktivní faktory pro léčbu cetuximabem. Nejlepší výsledky prokázal stav genu KRAS [20–22]. Gen KRAS hraje důležitou roli v časném procesu kancerogeneze, ale jeho úloha není dosud ještě plně objasněna. Jedná se o protoonkogen z rodiny genů RAS. Jeho produktem je GTPáza zodpovědná za přenos informací buňkou. Po navázání ligandu na EGFR dojde k dimerizaci receptoru, autofosforylaci tyrozinkinázové domény a k aktivaci signálních drah RAS-RAF-MEK-MAPK a PI3K-AKT-mTOR-S6K, po níž je následně aktivována transkripce genů pro pozitivní regulaci buněčné proliferace, angiogeneze a migrace pro negativní regulaci apoptózy. Nejčastější mutací genu KRAS je bodová mutace. U karcinomu tračníku se vyskytuje ve 20–50 % případů. U nemocných, kde není přítomna mutace genu KRAS, se mluví o nemutovaném, přirozeném typu (wild-type, wt) genu KRAS. Ve výše zmíněné studii NCIC CTG CO.17 byly výsledky celkového přežití u osob s KRAS wild-type významně lepší (9,5 vs. 4,8 měsíce) [23]. Přehled dalších klinických studií s cetuximabem uvádí tab. 3.
Cetuximab je indikován v terapii mCRC exprimujícího receptor epidermálního růstového faktoru (EGFR) a vykazujícího gen KRAS divokého typu v léčbě 1. linie v kombinaci s režimy FOLFIRI a FOLFOX4, dále v léčbě 2. linie v kombinaci s irinotekanem po selhání cytotoxické léčby zahrnující irinotekan nebo oxaliplatinu, v monoterapii, pokud jej nelze vzhledem ke stavu pacienta kombinovat s irinotekanem, nakonec v léčbě 3. linie a dalších linií v monoterapii, pokud nebyl cetuximab použit v předcházející léčbě.
Panitumumab představuje na rozdíl od cetuximabu plně humánní monoklonální protilátku působící proti EGFR. Podává se v dávce 6 mg/kg tělesné hmotnosti v jednohodinové infuzi 1krát za 2 týdny. Kožní toxicita postihuje asi 90 % nemocných léčených panitumumabem, mezi ostatní udávané nežádoucí účinky patří průjem, bolesti břicha, únava, reakce po infuzi (horečka, třesavka), hypomagnezemie, hypokalcemie, hypokalemie a dehydratace. Ve studii z roku 2007 [24] byl hodnocen panitumumab v porovnání s podpůrnou terapií u nemocných po selhání chemoterapie (progrese po fluoropyrimidinech, irinotekanu, oxaliplatině). Prodloužení doby přežití bylo patrné pouze u nemocných s nemutovaným typem KRAS, medián přežití byl 12,3 vs. 7,3 týdne (HR 0,45; p = 0,0001), u mutované formy KRAS byly výsledky v obou ramenech srovnatelné (7,4 vs. 7,3 týdne; HR 0,99; NS). Panitumumab je indikován v monoterapii k léčbě pacientů s mCRC exprimujícím EGFR, který vykazuje expresi nemutovaného typu onkogenu KRAS, u kterých selhala léčba chemoterapeutickými režimy zahrnujícími fluoropyrimidin, oxaliplatinu a irinotekan. Klinická studie PRIME hodnotila panitumumab v první linii v léčbě metastatického kolorektálního karcinomu [25]. Celkem 1183 nemocných bylo randomizováno do dvou ramen. V prvním rameni byli nemocní léčeni režimem FOLFOX4, ve druhém rameni byl přidán ke stejné chemoterapii panitumumab. Původně měla být analýza prováděna u neselektované populace nemocných, posléze však bylo rozhodnuto o prospektivním stanovení stavu genu KRAS. U nemutovaného typu genu KRAS bylo zaznamenáno vyšší procento léčebných odpovědí v režimu s panitumumabem (48 % vs. 55 %), dále nevýznamně delší přežití bez známek progrese onemocnění (8 měsíců vs. 9,6 měsíce). Celkové přežití bylo signifikantně delší v rameni s panitumumabem (19,7 vs. 23,9 měsíce). U populace s mutovaným genem KRAS bylo přežití bez známek progrese nemoci v rameni s panitumumabem horší, celkové přežití bylo horší dokonce statisticky významně (19,3 vs. 15,5 měsíce). Terapeutický přínos bevacizumabu je na rozdíl od cetuximabu i panitumumabu nezávislý na stavu mutace KRAS [29].
Léčebná strategie
Asi u 50 % nemocných s kolorektálním karcinomem dojde v průběhu onemocnění k diseminaci se vznikem vzdálených metastáz. Systémová chemoterapie při použití cytostatik nové generace (oxaliplatina, irinotekan) a cílené terapie prodloužily celkové přežití za hranici dvou let. Nicméně jedinou nadějí pro dlouhodobé víceleté přežití nebo úplné vyléčení je chirurgické odstranění metastáz. Nejčastěji vznikají metastázy u kolorektálního karcinomu v játrech. Po kurativní resekci jaterních metastáz přežívá 5 let kolem 33–50 % nemocných. Asi 75 % nemocných s jaterními metastázami je primárně hodnoceno jako neresekabilních. Podle Konsenzu Evropské pracovní skupiny pro oblast jaterních metastáz kolorektálního karcinomu lze rozlišit tři skupiny nemocných: resekabilní, optimálně neresekabilní a neresekabilní jaterní metastázy [30]. Nemocní by měli být posuzováni v rámci multidisciplinárního týmu, který dokáže objektivně zvážit možnosti chirurgického odstranění metastáz. V rámci léčebné strategie by měly být vzaty v úvahu všechny možnosti protinádorové léčby (chirurgická léčba, systémová onkologická léčba, intervenční radiologické léčebné metody). Základní multidisciplinární tým by měl zahrnovat klinického onkologa, radiačního onkologa, onkochirurga a radiodiagnostika. Dále by v týmu měl být přítomen invazivní radiolog a gastroenterolog. Podle potřeby je vhodná i přítomnost patologa a specialisty v oboru nukleární medicíny.
Terapie nemocných s primárně resekabilními metastázami
Asi 20 % nemocných, u kterých se dosáhne kompletní resekce primárního tumoru i vzdálených metastáz, přežívá dlouhodobě. Nutnou podmínkou úspěšné resekce metastáz je nepřítomnost zbytkové neresekabilní metastázy. Zbytková metastáza ale může být ošetřena některou ablační metodou (např. radiofrekvenční ablace). Další nutnou podmínkou je také kompletní odstranění primárního nádoru i postižených spádových lymfatických uzlin. Častým praktickým problémem je otázka primárního resekčního výkonu nebo zařazení neadjuvantní systémové léčby u nemocných s primárně resekabilním jaterním postižením. V krátkosti zmíníme výhody a nevýhody neadjuvantní terapie. Výhodou je otestování senzitivity nádoru, dále zničení mikrometastatické nedetekovatelné nemoci. Dále může regrese jaterních metastáz zmenšit rozsah resekce při léčebné odpovědi. Nevýhodou je necitlivost na systémovou onkologickou terapii s následnou progresí onemocnění, která může vyústit v chirurgicky neřešitelný stav [31]. Dalším problémem je úplné vymizení jaterních ložisek dle zobrazovacích klinických metod. Bylo prokázáno, že až v 80 % zůstávají v místě původních ložisek nádorové buňky [32]. S tím úzce souvisí otázka ohledně širší resekce „zdravého“ jaterního parenchymu. Dalším možným nezanedbatelným rizikem je vznik hepatopatie vyvolané podanou chemoterapií. Při použití 5-FU, irinotekanu a oxaliplatiny v cytostatickém režimu lze pozorovat výskyt steatohepatitidy a endoteliálních změn hepatálních sinusoidů [33]. Proto by léčba neměla trvat déle než 3 měsíce. Přínos indukční chemoterapie u nemocných s resekabilními jaterními metastázami hodnotila studie EORTC. U 364 nemocných bylo provedeno srovnání samotné resekce jaterních metastáz v porovnání s perioperační léčbou. Nemocní byli léčeni režimem FOLFOX4, celkem 6 režimy předoperačně a následně 6 režimy postoperačně. Redukce metastáz byla popsána ve 33 % případů, patologická kompletní remise v 3,8 %, parciální remise ve 40 %. Progrese onemocnění byla pozorována v 6,6 % případů. Míra přežívání bez progrese onemocnění po 3 letech se zvýšila u nemocných léčených perioperační chemoterapií (42 % vs. 33 %). Pooperační neletální komplikace se vyskytovaly častěji v rameni s perioperační chemoterapií (25 % vs. 16 %) [34]. Další otázkou je indikace adjuvantní chemoterapie po resekci metastáz. Bude potřeba vyčkat výsledků klinických studií. Nicméně léčebné postupy doporučují nejvíce známou účinnou adjuvantní kombinaci, režim FOLFOX.
Terapie nemocných s optimálně neresekabilními metastázami
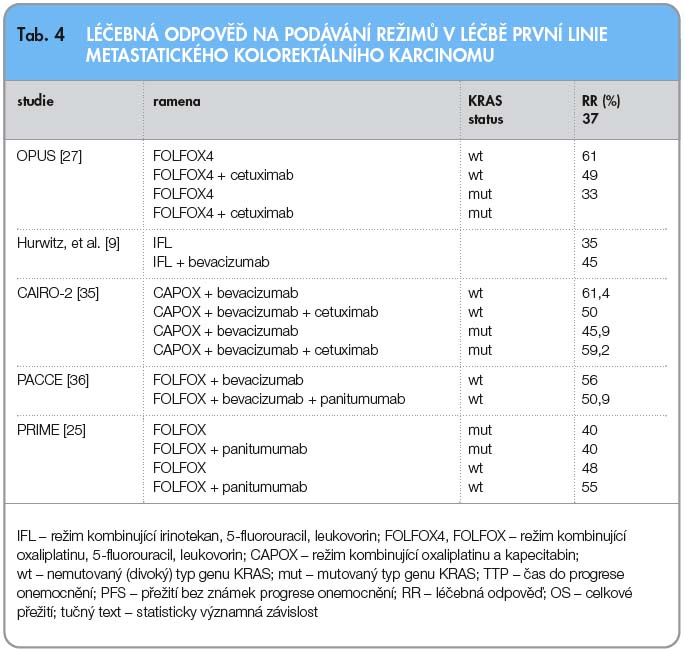 U této početné skupiny pacientů je základem léčby systémová chemoterapie v kombinaci s cílenou léčbou. Základním ukazatelem této indikace je léčebná odpověď (RR, response rate). Léčba dosahující vysoké léčebné odpovědi zvyšuje počet kurativních resekcí jaterních metastáz. V rámci chemoterapie se volí režimy obsahující kombinace oxaliplatiny (FOLFOX, XELOX, CAPOX) nebo irinotekanu (FOLFIRI, XELIRI, FOLFOXIRI), které mají srovnatelnou léčebnou odpověď, i když sekundární operabilita se zdá být relativně vyšší u režimů založených na oxaliplatině. Ohledně indikace cílené léčby je nutno znát stav mutace genu KRAS. V případě nemutované formy by měl být indikován režim FOLFOX nebo FOLFIRI v kombinaci s cetuximabem nebo panitumumabem. V případě mutované formy lze zvážit kombinaci výše zmíněných cytostatických režimů s bevacizumabem. Výsledky klinických studií s výčtem celkové léčebné odpovědi uvádí tab. 4.
U této početné skupiny pacientů je základem léčby systémová chemoterapie v kombinaci s cílenou léčbou. Základním ukazatelem této indikace je léčebná odpověď (RR, response rate). Léčba dosahující vysoké léčebné odpovědi zvyšuje počet kurativních resekcí jaterních metastáz. V rámci chemoterapie se volí režimy obsahující kombinace oxaliplatiny (FOLFOX, XELOX, CAPOX) nebo irinotekanu (FOLFIRI, XELIRI, FOLFOXIRI), které mají srovnatelnou léčebnou odpověď, i když sekundární operabilita se zdá být relativně vyšší u režimů založených na oxaliplatině. Ohledně indikace cílené léčby je nutno znát stav mutace genu KRAS. V případě nemutované formy by měl být indikován režim FOLFOX nebo FOLFIRI v kombinaci s cetuximabem nebo panitumumabem. V případě mutované formy lze zvážit kombinaci výše zmíněných cytostatických režimů s bevacizumabem. Výsledky klinických studií s výčtem celkové léčebné odpovědi uvádí tab. 4.
Terapie nemocných s neresekabilními metastázami
Cílem terapie u této bohužel početné skupiny pacientů již není vyléčení. Indikace je paliativní. Při rozhodování indikace léčby je nutno zvážit různé faktory na podkladě charakteristiky nádorového postižení (agresivní typ histologie, rychlá progrese onemocnění), charakteristiky nemocného (celkový stav, klinické projevy, preference nemocného). Na základě těchto skutečností lze volit mezi kombinovanou chemoterapií nebo monoterapií. Nutno vždy zvažovat i kombinaci s cílenou léčbou. V rámci terapie mCRC lze využít více linií systémové léčby. Nutným doplňkem je samozřejmě i léčba podpůrná.
První linie paliativní léčby
Rozhodnutí o výběru léčebného režimu se provádí podle agresivity nemoci, léčebného cíle, klinického stavu a dle očekávaného přežití pacienta při vyšším věku nebo komorbiditách. Při agresivní nemoci a dobrém klinickém stavu pak lze začít režimem obsahujícím oxaliplatinu nebo irinotekan. Bylo hodnoceno sekvenční užití režimů FOLFIRI-FOLFOX6, respektive FOLFOX6-FOLFIRI [37]. Celkové přežití bylo bez signifikantního rozdílu v obou sekvencích (medián celkového přežití 21,5 měsíce vs. 20,6 měsíce). Ve prospěch první sekvence mluví vyšší počet léčebných odpovědí po selhání úvodního režimu (15 % vs. 4 %), pro druhou sekvenci mluví lepší profil nežádoucích účinků. Léčba by měla být doplněna po zvážení i cílenou léčbou bevacizumabem, cetuximabem nebo panitumumabem. Výsledky klinických studií hodnotících kombinaci chemoterapie a cílené léčby byly již zmíněny. Režim FOLFOXIRI (kombinace 5-FU, oxaliplatiny, irinotekanu) dokáže zvýšit četnost klinické odpovědi až na 60 %. Problémem je však vysoká toxicita léčby [38]. Dalším problémem je identifikace cytostatického režimu v další linii. Proto standardně nelze danou kombinaci v paliativní indikaci doporučit.
Další možnou otázkou je délka trvání cytostatické léčby. Byly provedeny dvě studie, které se touto problematikou zabývaly. Studie OPTIMOX1 srovnávala režim FOL-FOX4 podávaný do progrese onemocnění s ramenem, kde bylo podáno 6 cyklů režimu FOLFOX7, následně byla podána udržovací léčba kombinací FUFA (5-FU, leukovorin), při progresi byla zahájena reindukce režimem FOLFOX7. Výsledky byly porovnatelné, lepší bezpečnostní profil vykázala intermitentní terapie režimem FUFA. Ve studii OPTIMOX2 byli nemocní sledováni po aplikaci 6 cyklů režimu FOLFOX7, při progresi onemocnění byla zahájena reindukce. Na podkladě nepřímého porovnání se jeví výhodnější pokračovat v udržovací léčbě fluoropyrimidiny než léčbu přerušit [39, 40]. Při progresi onemocnění je vhodné zahájit léčbu původním kombinovaným režimem. Na ASCO 2011 prezentoval Yalcin a kol. práci, která hodnotila udržovací terapii bevacizumabem v rámci aktualizované fáze III klinické studie. Práce porovnávala nemocné v rameni léčeném kombinací XELOX + bevacizumab podávanou do progrese onemocnění s nemocnými, u nichž byla po 6 cyklech výše zmíněného režimu zahájena udržovací terapie bevacizumabem s kapecitabinem. Výsledky obou ramen byly porovnatelné včetně toxicity léčby, proto udržovací terapie kombinací bevacizumab a kapecitabin je vhodnou léčebnou možností po předešlém indukčním kombinovaném režimu. Byla provedena i řada klinických studií (PACCE, CAIRO2) hodnotících kombinovanou léčbu inhibitorem VEGF a anti-EGFR [35, 36]. Celkové přežití bylo ale horší, proto není vhodné tuto kombinaci podávat. U nemocných s celkově horším zdravotním stavem lze zvážit monoterapii fluoropyrimidiny, eventuálně v kombinaci s cílenou léčbou.
Léčba druhé a vyšší linie
Po selhání první linie léčby je u nemocných v dobrém celkovém klinickém stavu indikována systémová léčba druhé linie. Po selhání režimu obsahujícího irinotekan lze indikovat režim s oxaliplatinou a opačně. Výsledky sekvence FOLFOX-FOLFIRI a FOLFIRI-FOLFOX byly již výše uvedeny. U nemocných s nemutovanou formou genu KRAS lze zvážit po předchozí léčbě bevacizumabem anti-EGFR terapii. U nemocných s progresí onemocnění při podávání anti-EGFR látek lze indikovat kombinaci s bevacizumabem. Léčebné odpovědi dosahuje menší počet pacientů a délka trvání léčebné odpovědi je kratší než v linii první. Po selhání druhé linie systémové léčby je další léčba zvažována přísně individuálně. Léčba třetí linie již nebývá příliš účinná. Lze zvážit monoterapii irinotekanem, cetuximabem nebo panitumumabem, pokud nebyly aplikovány v předchozích liniích [24]. Bevacizumab použitý v monoterapii nevykazuje klinický efekt. Někdy lze pozorovat mírný účinek při podání monoterapie kapecitabinem, nicméně studie neprokázaly výraznější účinnost této léčby. Po vyčerpání kauzální terapie jsou nemocní léčeni symptomatickou léčbou. Další možností je účast pacientů v klinických studiích.
Regionální chemoterapie
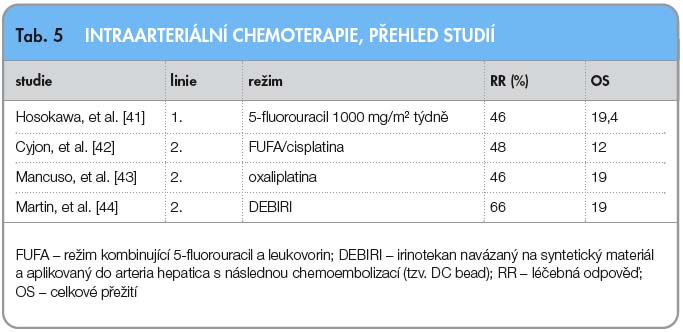 Jinou možnost farmakoterapie metastatického kolorektálního karcinomu představuje využití intraarteriální chemoterapie cestou arteria hepatica. Obecnou indikací k této léčbě jsou vaskularizované jaterní metastázy, jež nejsou z nějakého důvodu vhodné k primární chirurgické léčbě. Při této léčbě je zaváděn katétr do a. hepatica a pumpou je následně aplikováno cytostatikum. Před zahájením intraarteriální chemoterapie je nutné ověřit, zda jsou perfundována celá játra a jestli nedochází z arteria hepatica k úniku cytostatika mimo jaterní tkáň. Provádí se proto předoperační angiografie. Farmakoterapeutickým podkladem je využití tzv. first pass efektu extrakce cytostatika v játrech. Výhodou je nízká systémová zátěž. Možností je rovněž kombinace intraarteriálního a intravenózního podání chemoterapie. V intraarteriální chemoterapii dosáhly největšího uplatnění 5-FU, oxaliplatina, irinotekan, doxorubicin, mytomycin C a jiné. V dnešní době je intraarteriální chemoterapie indikována hlavně ve třetí a vyšších liniích léčby. Příklady režimů i léčebné výsledky uvádí tab. 5.
Jinou možnost farmakoterapie metastatického kolorektálního karcinomu představuje využití intraarteriální chemoterapie cestou arteria hepatica. Obecnou indikací k této léčbě jsou vaskularizované jaterní metastázy, jež nejsou z nějakého důvodu vhodné k primární chirurgické léčbě. Při této léčbě je zaváděn katétr do a. hepatica a pumpou je následně aplikováno cytostatikum. Před zahájením intraarteriální chemoterapie je nutné ověřit, zda jsou perfundována celá játra a jestli nedochází z arteria hepatica k úniku cytostatika mimo jaterní tkáň. Provádí se proto předoperační angiografie. Farmakoterapeutickým podkladem je využití tzv. first pass efektu extrakce cytostatika v játrech. Výhodou je nízká systémová zátěž. Možností je rovněž kombinace intraarteriálního a intravenózního podání chemoterapie. V intraarteriální chemoterapii dosáhly největšího uplatnění 5-FU, oxaliplatina, irinotekan, doxorubicin, mytomycin C a jiné. V dnešní době je intraarteriální chemoterapie indikována hlavně ve třetí a vyšších liniích léčby. Příklady režimů i léčebné výsledky uvádí tab. 5.
Perspektivy systémové léčby
Systémová léčba mCRC dosáhla v posledních letech významného prodloužení života nemocných pacientů. Bohužel většina nemocných ale stále umírá na diseminovaný kolorektální karcinom, i přes agresivní léčebné postupy. Proto je nutnou podmínkou dalšího zkvalitňování léčby vývoj nových léčiv, léčebných strategií, zavádění metod molekulární biologie do klinické praxe atd. Takzvaná onkologie 21. století zahrnuje dva pojmy: targeted therapy (cílená léčba na podkladě biologické charakteristiky nádoru) a tailored therapy (individualizovaná léčba). Hlavními trendy současnosti jsou personalizovaná medicína (adresná onkologická péče), prediktivní onkologie, nejlépe zaměřená na hledání časné predikce léčebné odpovědi. Další důležitou součástí terapie je široká dostupnost multidisciplinárních týmů. V rámci systémové léčby kolorektálního karcinomu se uplatňuje cílená anti- EFGR léčba, predikce její účinnosti pomocí stavu mutace KRAS byla již mnohokrát zmíněna výše. V roce 2010 prezentoval Van Cutsem v rámci studie CRYSTAL finální data ohledně exprese genu BRAF. Ten je součástí kaskády tyrozinkinázových enzymů podílejících se na přenosu genetické informace do jádra buňky s následnou proliferací. Podobně jako u KRAS lze i u genu BRAF rozlišit mutovanou a nemutovanou (divokou) formu. U nemocných s nemutovaným typem genu KRAS a současně BRAF byly výsledky léčby režimem FOLFIRI s cetuximabem signifikantně lepší než bez použití cetuximabu. U nemocných s divokým typem KRAS a současně s mutovaným genem BRAF byly výsledky v obou zmíněných léčebných ramenech bez statisticky signifikantních rozdílů. Další práce budou ale muset objasnit výše zmíněnou signální cestu. Podobně i na ASCO 2011 Weichardt prezentoval zjištění, že vysoká exprese VEGF D (typ vaskulárního endoteliálního růstového faktoru) předpovídá rezistenci vůči bevacizumabu, zejména z hlediska přežití bez známek progrese onemocnění. Nicméně bude zapotřebí mnoha dalších prací. Kromě hledání predikcí se výzkum zaměřuje i na hledání nových účinných látek. Mnoho preparátů prokázalo úspěch in vitro, ale klinický efekt ve studiích I.–III. fáze prokázán nebyl. Další otázkou je, zda při progresi při kombinované chemoterapii a cílené léčbě změnit pouze režim chemoterapie, nebo naopak jen typ cílené léčby (např. studie probíhající FEB a mnoho jiných).
Závěr
Kolorektální karcinom představuje významný medicínský problém s trvale rostoucí incidencí. Bohužel asi 50 % všech nemocných s kolorektálním karcinomem dospěje do stadia generalizace, kde je dosahováno šestiměsíčního přežití při užití symptomatické terapie. S vývojem poznatků dochází postupně k zařazování cytostatik a hlavně monoklonálních protilátek do léčebné strategie. Ve farmakoterapii metastatického kolorektálního karcinomu je k dispozici relativně široké spektrum různých účinných látek. Mnoho klinických studií prokázalo účinnost cytostatik i monoklonálních protilátek. Při užití kombinované chemoterapie s cílenou terapií lze dosáhnout prodloužení celkového přežití za horizont přesahující 24 měsíců. Další možností je chirurgické odstranění hlavně jaterních metastáz. Důležitou skupinou jsou nemocní s optimálně neresekabilními metastázami, kde v kombinaci s neoadjuvantní kombinovanou léčbou lze u velké části z nich provést resekční výkon. Nedílnou součásti je stanovení multidisciplinárního týmu k rozhodování o nejideálnější léčebné strategii. Další vývoj směřuje ke hledání dalších prediktorů systémové léčby. V současné době také probíhá řada studií hodnotících nová léčiva.
Seznam použité literatury
- [1] Software pro vizualizaci onkologických dat (SVOD). www.svod.cz
- [2] Diasio RB, Johnson MR. Dihydropyrimidine dehydrogenase: its role in 5-fluorouracil clinical toxicity and tumor resistance. Clin Cancer Res 1999; 5: 2672–2673.
- [3] de Gramont A, Bosset JF, Milan C, et al. Randomized trial comparing monthly low-dose leucovorin and fluorouracil bolus with bimonthly high-dose leucovorin and fluorouracil bolus plus continuous infusion for advanced colorectal cancer: a French intergroup study. J Clin Oncol 1997; 15: 808–815.
- [4] Douillard JY, Cunningham D, Roth AD, et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. Lancet 2000; 355: 1041–1047.
- [5] de Gramont A, Figer A, Seymour M, et al. Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol 2000; 18: 2938–2947.
- [6] Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med 2003; 9: 669–676.
- [7] Ferrara N. Role of vascular endothelial growth factor in regulation of physiological angiogenesis. Am J Physiol Cell Physiol 2001; 280: C1358–C1366.
- [8] Lowery M, Power D, Behbehani A, et al. Hypertension is a significant adverse effect of bevacizumab treatment. J Clin Oncol 2007; 25: 622s.
- [9] Hurwitz H, Fehrenbacher L, Novotny W, et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004; 350: 2335–2342.
- [10] Hochster HS, Welles L, Hart L, et al. Safety and efficacy of bevacizumab (Bev) when added to oxaliplatin/fluoropyrimidine (O/F) regimens as first-line treatment of metastatic colorectal cancer: TREE 1&2 Studies. J Clin Oncol 2005; 23: 16S Abstract 3515.
- [11] Fuchs CS, Marshall J, Mitchell E, et al. Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC-C Study. J Clin Oncol 2007; 25: 4779–4786.
- [12] Fuchs CS, Marshall J, Barrueco J. Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: updated results from the BICC-C study. J Clin Oncol 2008; 26: 689–690.
- [13] Eng C, Maurel J, Scheithauer L, et al. Impact on quality of life of adding cetuximab to irinotecan in patients who are have failed prior oxaliplatin-based therapy: The EPIC trial. J Clin Oncol 2007; 25: Abstract 4003.
- [14] Raymond E, Faivre S, Armand JP. Epidermal growth factor receptor tyrosine kinase as a target for anticancer therapy. Drugs 2000; 60: 15–23.
- [15] Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351: 337–345.
- [16] Van Cutsem E, Nowacki M, Lang I, et al. Randomized phase III study of irinotecan and 5-FU/FA with or without cetuximab in the first-line treatment of patients with metastatic colorectal cancer (mCRC): The CRYSTAL trial. J Clin Oncol 2007; 25:18S Abstract 4000.
- [17] Bokemeyer C, Bondarenko I, Makhson A, et al. Cetuximab plus 5-FU/FA/oxaliplatin (FOLFOX-4) versus FOLFOX-4 in the first-line tratment of metastatic colorectal cancer (mCRC): OPUS, a randomized phase II study. J Clin Oncol 2007; 25: 18S Abstract 4035.
- [18] Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351: 337–345.
- [19] Au HJ, Karapetis CS, Jonker D, et al. Quality of life in patients with advanced colorectal cancer treated with cetuximab: Results of the NCIC CTG and AGITG CO.17 trial. J Clin Oncol 2007; 25: 18S Abstract 4002.
- [20] Finocchiaro G, Capuzzo F, Jänne PA, et al. EGFR, HER2, and Kras as predictive factors for cetuximab senzitivity in colorectal cancer. J Clin Oncol 2007; 25: 18S Abstract 4021.
- [21] Capuzzo F, Finocchiaro G, Rossi E, et al. EGFR FISH assay predicts for response to cetuximab in chemotherapy refractory colorectal cancer patients. Ann Oncol 2008; 19: 717–723.
- [22] Sartore-Bianchi A, Moroni M, Veronese S, et al. Epidermal growth factor receptor gene copy number and clinical outcome of metastatic colorectal cancer treated with panitumumab. J Clin Oncol 2007; 25: 3238–3245.
- [23] Karapetis CS, Khambata-Ford S, Jonker DJ, et al. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med 2008; 359: 1757–1765.
- [24] Van Cutsem E, Peeters M, Siena S, et al. Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 2007; 25: 1658–1664.
- [25] Douillard JY, Siena S, Cassidy J, et al. Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol 2010; 28: 4697–4705.
- [26] Van Cutsem E, Lang I, D’Haens G, et al. KRAS status and efficacy in the first-line treatment of patients with metastatic colorectal cancer (mCRC) treated with FOLFIRI with or without cetuximab: The CRYSTAL experience. J Clin Oncol 2008; 26: 20S Abstract 2.
- [27] Bokemeyer C, Bondarenko I. Makhson A, et al. Fluorouracil, leucovorin, and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer. J Clin Oncol 2009; 27: 663–671.
- [28] Sobrero AF, Maurel J, Fehrenbacher L, et al. EPIC: phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26: 2311–2319.
- [29] Hurwitz HI, Yi J, Ince W, et al.The clinical benefit of bevacizumab in metastatic colorectal cancer is independent of K-ras mutation status: analysis of a phase III study of bevacizumab with chemotherapy in previously untreated metastatic colorectal cancer. Oncologist 2009; 14: 22–28.
- [30] Nordlinger B, Van Cutsem E, Gruenberger T, et al. Combination of surgery and chemotherapy and the role of targeted agents in the treatment of patients with colorectal liver metastases: recommendations from an expert panel. Ann Oncol 2009; 20: 958–992.
- [31] Adam R, Pascal G, Castaing D, et al. Tumor progression while on chemotherapy: a contraindication to liver resection for multiple metastases? Ann Surg 2004; 240: 1052–1061.
- [32] Benoist S, Bouquet A, Penna c, et al. Complete response of colorectal liver metastases after chemotherapy: does it mean cure? J Clin Oncol 2006; 24: 3939–3945.
- [33] Field KM, Michael M. Part II: Liver function in oncology: towards safer chemotherapy use. Lancet Oncol 2008; 9: 1181–1190.
- [34] Nordlinger B, Sorbye H, Glimelius B, et al. Perioperative chemotherapy with FOLFOX4 with surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet 2008; 371: 1007–1016.
- [35] Tol J, Koopman M, Cats A, et al. Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal cancer. N Engl J Med 2009; 360: 563–572.
- [36] Hecht JR, Mitchell E, Chidiac T, et al. A randomized phase IIIB trial of chemotherapy, bevacizumab, and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer. J Clin Oncol 2009; 27: 672–680.
- [37] Tournigand C, Andre T, Achille E, et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 2004; 22: 229–237.
- [38] Falcone A, Ricci S, Brunetti I, et al. Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first-line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol 2007; 25: 1670–1676.
- [39] Tournigand C, Cervantes A, Figer A, et al. OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer – a GERCOR study. J Clin Oncol 2006; 24: 394–400.
- [40] Chibaudel B, Maindrault-Goebel F, Lledo G, et al. Can chemotherapy be discontinued in unresectable metastatic colorectal cancer? The GERCOR OPTIMOX2 Study. J Clin Oncol 2009; 27: 5727–5733.
- [41] Hosokawa A, Yamada Y, Shimada Y, et al. Weekly hepatic arterial infusion of 5-fluorouracil and subsequent systemic chemotherapy for liver metastases from colorectal cancer. Jpn J Clin Oncol 2003; 33: 132–135.
- [42] Cyjon A, Neuman-Levin M, Rakowsky E, et al. Liver metastases from colorectal cancer: regional intra-arterial treatment following failure of systemic chemotherapy. Br J Cancer 2001; 85: 504–508.
- [43] Mancuso A, Giuliani R, Accettura C, et al. Hepatic arterial continuous infusion (HACI) of oxaliplatin in patients with unresectable liver metastases from colorectal cancer. Anticancer Res 2003; 23: 1917–1922.
- [44] Martin RC, Joshi J, Robbins K, et al. Hepatic intra-arterial injection of drug-eluting bead, irinotecan (DEBIRI) in unresectable colorectal liver metastases refractory to systemic chemotherapy: results of multi-institutional study. Ann Surg Oncol 2011; 18: 192–198.
- [45] Project ACCM. Modulation of fluorouracil by leucovorin in patients with advanced colorectal cancer: evidence in terms of response rate. Advanced Colorectal Cancer Meta-Analysis Project. J Clin Oncol 1992; 10: 896–903.
- [46] Twelves C, Wong A, Nowacki MP, et al. Capecitabine as adjuvant treatment for stage III colon cancer. N Engl J Med 2005; 352: 2696–2704.
- [47] Schmoll HJ, Cartwright T, Tabernero J, et al. Phase III trial of capecitabine plus oxaliplatin as adjuvant therapy for stage III colon cancer: a planned safety analysis in 1,864 patients. J Clin Oncol 2007; 25: 102–109.
- [48] Giantonio BJ, Catalano PJ, Meropol NJ, et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007; 25: 1539–1544.