Farmakoterapie sarkomů měkkých tkání dle aktualizovaných doporučení ESMO‑EURACAN
Souhrn:
Adámková Krákorová D, Halámková J, Kozáková Š, Tuček Š. Farmakoterapie sarkomů měkkých tkání dle aktualizovaných doporučení ESMO‑EURACAN. Remedia 2018; 28: 340–345.
Sarkomy měkkých tkání (soft tissue sarcomas, STS) patří mezi nádory raritní. Dne 28. května 2018 byla online publikována v časopise Annals of Oncology aktualizovaná doporučení ESMO‑EURACAN (European Society for Medical Oncology – European Reference Network for rare adult solid cancer) pro diagnostiku, léčbu a sledování pacientů s měkkotkáňovými sarkomy. Chirurgická léčba doplněná v indikovaných případech ozářením je u STS dospělých léčbou standardní ve většině případů. Postavení systémové léčby lokalizovaného onemocnění není jasně definováno. Jinak je tomu v případě relabující nebo metastatické nemoci. Sdělení shrnuje současný pohled na indikace a možnosti farmakoterapie v léčbě měkkotkáňových sarkomů vyjma gastrointestinálních stromálních tumorů (GIST).
Summary:
Adamkova Krakorova D, Halamkova J, Kozakova S, Tucek S. Pharmacotherapy of soft tissue sarcomas according to updated ESMO‑EURACAN guidelines. Remedia 2018; 28: 340–345.
Soft Tissue Sarcomas (STS) represent a heterogenous group of rare malignancies. Updated soft tissue and visceral sarcomas ESMO‑EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow‑up (from the European Society for Medical Oncology – European Reference Network for rare adult solid cancer) were published online on the 28th May 2018 in the Annals of Oncology. Surgery (+ radiation therapy in selected cases) is the standard treatment for adult‑type localized soft tissue sarcomas in the majority of cases. Systemic therapy is not a standard treatment of localized STS yet. They have their place in the treatment of advanced, relapsed or metastatic STS. The article provides a brief description of pharmacotherapeutic options for STS, except for gastrointestinal stromal tumors (GIST).
Key words: clinical practice guidelines ,soft tissue sarcoma, medical therapy
Úvod
Za sarkomy je označována skupina velmi různorodých vzácných nádorů vycházejících z mezenchymálních buněk, které se za normálních okolností diferencují ve svalovou nebo tukovou tkáň, vazivo, kost, chrupavku a další tkáně. Bylo dosud definováno více než 80 histologických subjednotek [1]. Asi 75 % sarkomů představují měkkotkáňové sarkomy jako takové (nejčastěji liposarkomy a leiomyosarkomy), 15 % pak gastrointestinální stromální tumory (GIST) a asi 10 % primární nádory kostí. Vyskytují se napříč všemi věkovými skupinami. Vyrůstat mohou kdekoliv, nejčastěji v oblasti končetin, končetinových pletenců a dutiny břišní. Incidence se v Evropské unii pohybuje kolem 4–5 nových případů na 100 000 obyvatel ročně [2]. V roce 2015 bylo v ČR dle údajů Národního onkologického registru (NOR) nově diagnostikováno 512 měkkotkáňových sarkomů a 78 sarkomů kostních [3].
Chirurgická léčba jako jediná má v léčbě sarkomů kurativní potenciál. Terapie zářením se používá v indikovaných případech ke zvýšení lokální kontroly nádoru (před operací/po operaci), má nezastupitelnou roli v léčbě paliativní. Vyjma embryonálního/alveolárního rhabdomyosarkomu, Ewingova sarkomu a vysoce maligních osteogenních sarkomů není u ostatních subtypů sarkomů postavení systémové léčby v perioperačním období jasně definováno. Svoji roli má farmakoterapie v léčbě pokročilé, rekurentní nebo metastatické nemoci. I přes schválení nových farmak v posledních letech však zatím zásadní zvrat v léčbě pokročilých stadií nemoci nenastal. Základním předpokladem úspěchu tedy zůstává včasná a kvalitní diagnostika a optimálně naplánovaná léčba na pracovišti s dobře fungujícím mezioborovým týmem. Zásadní jsou zkušenosti s komplexní léčbou tohoto raritního onemocnění.
Doporučení ESMO EURACAN 2018
Recentně byla v časopise Annals of Oncology publikována aktualizovaná verze diagnosticko terapeutických doporučení pro diagnostiku a léčbu sarkomů měkkých tkání. Tato doporučení byla připravena odborníky napříč Evropou – uváděna jako ESMO EURACAN (European Society for Medical Oncology − European Reference Network for rare adult solid cancers) [4]. Vyčleněn byl Kaposiho sarkom, pro GIST bylo vytvořeno separátní doporučení [5]. Léčba extraskeletálního Ewingova a Ewing like sarkomu je vedena dle stejných doporučení jako při kostním postižení touto histopatologickou jednotkou. Léčba alveolárního a embryonálního rhabdomyosarkomu má být vedena dle specifických protokolů, naopak pleiomorfní rhabdomyosarkom u dospělých je považován za tzv. high grade STS a podléhá obecným doporučením stejně jako extraskeletální osteogenní sarkom.
Léčba lokalizovaného onemocnění
Standardní léčbou lokalizovaného onemocnění je léčba chirurgická, tedy R0 resekce s dostatečným lemem zdravé tkáně všemi směry, provedená zkušeným operatérem. Předchozí nebo následná radioterapie je standardem u high grade tumorů (GII−III), větších než 5 cm, hluboce uložených, také v jiných případech indikovaných po doporučení mezioborové komise. Předoperační léčbu (radioterapie, chemoterapie nebo kombinace) lze zvažovat u nádorů s rizikem mutilujícího výkonu nebo tam, kde se jeví radikalita možného výkonu jako nejistá. Stále není konsenzus pro indikaci adjuvantní systémové chemoterapie, neboť dosavadní výsledky studií byly konfliktní a dosud publikované metaanalýzy zatím signifikantní přínos pro celkové přežití (overall survival, OS) nezaznamenaly [6,7]. Adjuvantní chemoterapii lze zvažovat přísně individuálně, vždy po podrobné diskusi s pacientem, a to u vysoce rizikových tumorů (větších než 5 cm, hluboce uložených, vysokého stupně, především v oblasti končetin). V adjuvantním případě by mělo jít vždy o kombinaci nejvíce účinných cytostatik. Obecně nutno zdůraznit, že žádná adjuvantní chemoterapie nemůže nikdy nahradit R0 resekci. Adjuvantní chemoterapie nemá být podávána u histotypů, u kterých je známá chemorezistence nebo velmi nízká chemosenzitivita.
Vznik lokální recidivy neznamená pro pacienta obvykle zásadní limitaci, i když samozřejmě při jejím záchytu hrozí i vyšší riziko vzniku vzdálených metastáz. Pro další osud pacienta je zásadní vznik systémového relapsu, kterého se statisticky dočká v průběhu 3−5 let po léčbě až 40 % nemocných. Logicky tedy trvá snaha o ovlivnění prognózy přidáním perioperační systémové léčby. Na tomto poli je dlouhodobě aktivní především Italská sarkomová skupina. Multicentrická klinická studie fáze III srovnávala podání tří proti pěti cyklům kombinační chemoterapie u pacientů s lokalizovanými vysoce rizikovými sarkomy končetin nebo trupu [8]. V prvním rameni (n = 164) byli pacienti léčeni třemi cykly předoperační chemoterapie epirubicinem 120 mg/m2 + ifosfamidem 9 g/m2 ve třítýdenních intervalech, ve druhém rameni (n = 164) pacienti dostávali tři cykly předoperační a po operaci ještě dva cykly stejné léčby. Lokální ozáření bylo možné předoperačně nebo pooperačně. Výsledky dlouhodobého přežití potvrdily non inferioritu 3 cyklů oproti 5 cyklům systémové léčby (desetileté OS v 64 % v prvním rameni vs. v 59 % v rameni druhém).
V následné mezinárodní studii fáze III u pacientů s vysoce rizikovými lokalizovanými operabilními sarkomy byl srovnáván předoperační dvojkombinační režim epirubicin/ifosfamid s tzv. histologií řízenou chemoterapií (gemcitabin/dakarbazin u leiomyosarkomu, trabektedin u myxoidního kulatobuněčného liposarkomu, ifosfamid/etoposid u maligního tumoru z periferních nervových pochev a gemcitabin/docetaxel u nediferencovaných pleiomorfních sarkomů), vždy tři série předoperačně s adjuvantním ozářením pooperačně [9]. Primárním cílem studie bylo testovat superioritu histologií řízené chemoterapie proti epirubicinu/ifosfamidu. Po provedení třetí průběžné analýzy s mediánem sledování 12,3 měsíce byla studie předčasně uzavřena, neboť kombinační režim epirubicin/ifosfamid prokázal lepší výsledky nežli režimy volené dle histologie (přežití bez příhody, event free survival [EFS] – p = 0,007, OS – p = 0,034). Pouze u myxoidního kulatobuněčného liposarkomu měl trabektedin obdobné výsledky jako epirubicin/ifosfamid (poměr rizik, hazard ratio [HR] 1,03). I když primární cíl nebyl splněn a studie byla uzavřena předčasně, téměř 300 zařazených pacientů umožňuje statistické zhodnocení OS, které bylo až sekundárním cílovým ukazatelem studie. Velmi předběžná data naznačují jeho zlepšení, proto jsou finální výsledky s možným dopadem do klinické praxe s napětím očekávány. Již nyní však mohou být tři cykly předoperační chemoterapie epirubicin/ifosfamid léčebnou možností u vysoce rizikových sarkomů především tam, kde lze chemosenzitivitu předpokládat. Samozřejmostí musí být důsledné sledování v průběhu předoperační léčby k vyloučení časné progrese.
Léčba pokročilého/metastatického onemocnění
Terapeutický postup u každého nemocného je třeba volit individuálně, v režii zkušeného mezioborového týmu. Jsou li metachronní (doba přežití bez známek nemoci, disease free survival [DFS] delší než 12 měsíců) plicní metastázy resekabilní, pak je po vyloučení extrapulmonálního postižení (CT břicha a kostní sken nebo PET/CT) thorakochirurgický výkon metodou volby, pokud je možné jejich úplné odstranění [10]. Po resekci plicních metastáz lze zvažovat přidání systémové chemoterapie s ohledem na rizikové faktory (bezpříznakové období, počet ložisek, věk, celkový stav, histologický subtyp, chemonaivní pacient), i když jasná data o přínosu přidání chemoterapie nejsou. Je možné a také preferované podání chemoterapie před hrudním výkonem. Cílem je zhodnocení léčebné odpovědi, a tím i možnost modifikace léčby po operaci. Získaný čas také umožní vyloučit početní progresi, tedy mikroskopická ložiska, která by v době operace ještě nemusela být detekovatelná.
V případě synchronních plicních metastáz je systémová léčba metodou volby, v ideálním případě s následným dosažením chirurgické kompletní remise. Izolovaná extrapulmonální metastatická choroba je méně častá, metodou volby je většinou systémová léčba. Přísně individuálně lze zvažovat resekční výkon, alternativou může být ošetření radiochirurgické nebo radioablační.
Systémová léčba první linie
Standardní systémovou léčbu tvoří stále doxorubicin a ifosfamid, které se používají především v případě potřeby rychlé léčebné odpovědi u chemosenzitivních histotypů (tumor shrinkage), nebo je li zásadním cílem paliativní léčby prodloužení intervalu bez progrese nemoci, zlepšení kvality života a celkového stavu. Dle dostupných dat kombinační režim sice vykazuje vyšší léčebnou odpověď za cenu vyšší toxicity, avšak bez signifikantního vlivu na OS [7,11]. V randomizované studii EORTC 62012 fáze III byli pacienti léčeni doxorubicinem 75 mg/m2 nebo kombinací doxorubicin 75 mg/m2 plus ifosfamid 10 g/m2 s podporou růstovými faktory. I přes vyšší léčebnou odpověď v kombinačním rameni (response rate [RR] 26 % vs. 14 %, p < 0,0006) nebyl zaznamenán signifikantní rozdíl v parametru OS (12,8 měsíce vs. 14,3 měsíce, HR 0,83). Autoři doporučují ponechat kombinační režim pro ty případy, kde je cílem zásadní zmenšení nádorové masy.
Nadějně se jeví výsledky studie
fáze Ib/II, která prokázala signifikantní přínos v OS
u pacientů léčených kombinací doxorubicin/olaratumab
proti doxorubicinu samotnému (OS 26,5 měsíce vs. 14,3 měsíce, HR
0,46, p = 0,0003,
přežití bez progrese, progression free survival [PFS] 6,6 měsíce
vs. 4,1 měsíce; HR 0,672, p = 0,0615)
[12], graf 1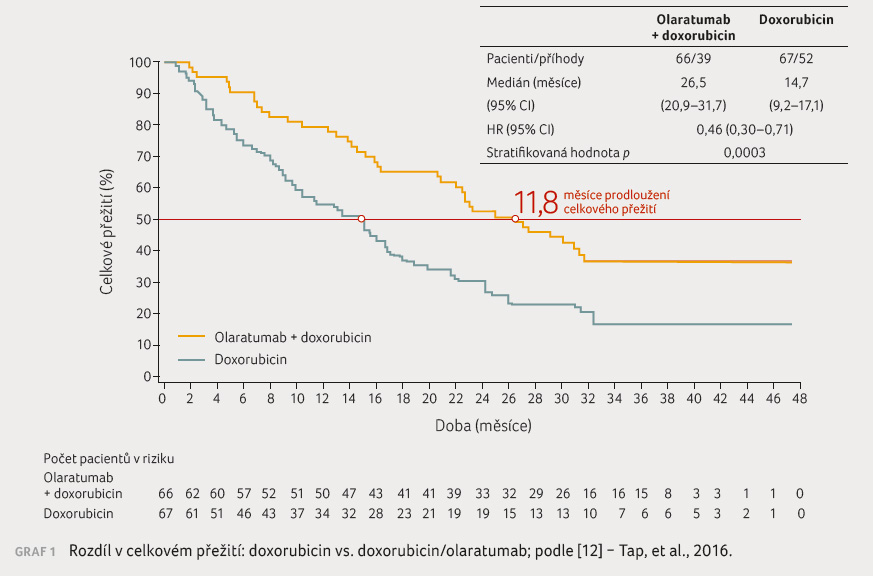 , tabulka 1.
, tabulka 1.
Olaratumab je plně humánní IgG1
monoklonální protilátka, antagonista receptoru α růstového
faktoru odvozeného z trombocytů (platelet derived growth
factor receptor alpha, PDGFRα) exprimovaného na nádorových
a stromálních buňkách, která se specificky váže na PDGFRα
a in vitro
inhibuje signalizaci prostřednictvím dráhy PDGFRα v nádorových
a stromálních buňkách [13], obr. 1. Mechanismus synergie s doxorubicinem však není
zcela jasný.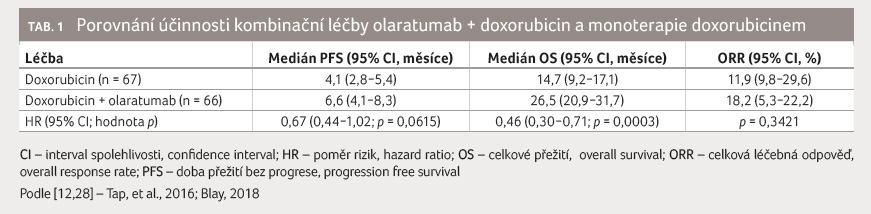
V klinické studii fáze Ib/II
[12] bylo léčeno 133 dospělých pacientů s pokročilým
inoperabilním metastatickým sarkomem měkkých tkání
a výkonnostním stavem 0−2 dle ECOG (Eastern
Cooperative Oncology Group), kteří neměli kontraindikace
pro léčbu antracykliny, ale dosud nebyli antracykliny léčeni.
Přípustné bylo předléčení jakýmkoliv počtem režimů
systémové léčby vyjma antracyklinů. Pacienti byli v poměru
1 : 1 randomizováni do skupin s kombinační léčbou
olaratumabem v dávce 15 mg/kg i.v. v d en 1 a 8
každého třítýdenního cyklu a doxorubicinem v dávce
75 mg/m2 v den 1 každého třítýdenního
cyklu, nebo do skupiny se standardní léčbou monoterapií
doxorubicinem do tolerovatelné kumulativní toxicity. Pacienti
v experimentálním rameni s kombinační léčbou
pokračovali v monoterapii olaratumabem do progrese nebo
neakceptovatelné toxicity. Pacienti v kontrolním rameni
s monoterapií doxorubicinem měli možnost při progresi
po ukončení léčby doxorubicinem přejít na monoterapii
olaratumabem do progrese či neakceptovatelné toxicity.
en 1 a 8
každého třítýdenního cyklu a doxorubicinem v dávce
75 mg/m2 v den 1 každého třítýdenního
cyklu, nebo do skupiny se standardní léčbou monoterapií
doxorubicinem do tolerovatelné kumulativní toxicity. Pacienti
v experimentálním rameni s kombinační léčbou
pokračovali v monoterapii olaratumabem do progrese nebo
neakceptovatelné toxicity. Pacienti v kontrolním rameni
s monoterapií doxorubicinem měli možnost při progresi
po ukončení léčby doxorubicinem přejít na monoterapii
olaratumabem do progrese či neakceptovatelné toxicity.
Olaratumab byl na základě výsledků studie fáze Ib/II na podzim roku 2016 zrychlenou procedurou podmínečně registrován jako tzv. breakthrough therapy americkým Úřadem pro kontrolu potravin a léčiv v USA a následně 9. listopadu 2016 byl taktéž zrychlenou procedurou registrován pro systémovou léčbu pokročilého sarkomu měkkých tkání i Evropskou lékovou agenturou v členských státech EU. Probíhají již studie fáze II s dalšími cytostatiky, olaratumab má být zkoušen i s radioterapií. Nabízí se rovněž potřeba provedení srovnávací studie doxorubicin/olaratumab vs. doxorubicin/ifosfamid.
S napětím jsou tedy očekávány výsledky klinického hodnocení fáze III (NCT02451943) kombinace doxorubicin/olaratumab vs. doxorubicin monoterapie v první linii paliativní léčby [15]. Nábor pacientů do studie byl uzavřen na podzim 2017, výsledky lze očekávat nejdříve s příchodem jara 2019.
Multicentrická studie fáze III GeDDis
srovnávala kombinační režim gemcitabin 675 mg/m2
a docetaxel 75 mg/m2 proti monoterapii
doxorubicine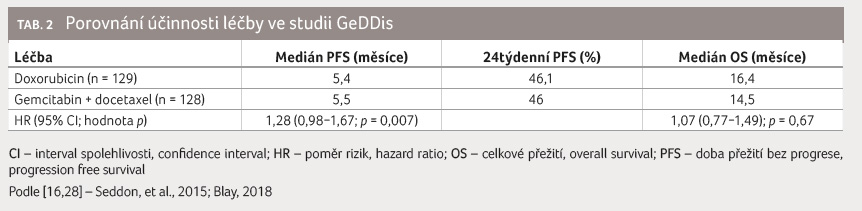 m 75 mg/m2 v první linii (identický
medián PFS 5,4 měsíce, resp. 5,5 měsíce, OS 14,5 měsíce
vs. 16,4 měsíce) [16], tabulka 2. Kombinační režim tedy není účinnější nežli
doxorubicin v monoterapii a všeobecně není pro první
linii systémové léčby doporučován.
m 75 mg/m2 v první linii (identický
medián PFS 5,4 měsíce, resp. 5,5 měsíce, OS 14,5 měsíce
vs. 16,4 měsíce) [16], tabulka 2. Kombinační režim tedy není účinnější nežli
doxorubicin v monoterapii a všeobecně není pro první
linii systémové léčby doporučován.
Ve studii fáze II byl v první linii srovnáván aldoxorubicin (n = 86) proti doxorubicinu (n = 40). I přes prodloužení PFS (5,6 měsíce vs. 2,7 měsíce, p = 0,02) a vyšší léčebnou odpověď nebyl zaznamenán vliv na OS (15,8 měsíce vs. 14,3 měsíce, p = 0,21) [17].
Systémová léčba druhé a další linie
Druhá či další linie paliativní systémové léčby by se měla řídit histologií. V ideálním případě byl měl být každý již předléčený pacient kandidátem léčby dle některé z mezinárodních klinických studií, což je v podmínkách malé České republiky velmi obtížné. Nejlepší symptomatická terapie může být alternativou pro pacienty v nedobré kondici (unfit) či u pacientů již značně předléčených. Je třeba nezapomínat na možnost eskalace dávky ifosfamidu (až 14 g/m2) u pacientů ifosfamidem dříve léčených (vyjma leiomyosarkomu), pokud při této léčbě nedošlo k progresi.
Multicentrická studie fáze III srovnávala trabektedin s dakarbazinem u pacientů s lipo a leiomyosarkomy (PFS 4,2 měsíce vs. 1,5 měsíce, HR 0,55, p < 0,001; OS 12,9 měsíce vs. 12,4 měsíce, HR 0,87, p = 0,37) [18]. Nejvýraznější efekt prokázal trabektedin v podskupině myxoidního kulatobuněčného liposarkomu s PFS 5,6 měsíce vs. 1,5 měsíce u dakarbazinu (HR 0,41).
Randomizovaná studie fáze III srovnávala eribulin proti dakarbazinu v léčbě lipo a leiomysarkomů [19]. Rozdíl v mediánu OS činil dva měsíce ve prospěch eribulinu (13,5 měsíce vs. 11,5 měsíce, HR 0,77, p = 0,0169), největší efekt prokázal eribulin u podskupiny pacientů s liposarkomy (15,6 měsíce vs. 8,4 měsíce, HR 0,51).
Studie fáze II srovnávala kombinační režim gemcitabin/dakarbazin (n = 57) s monoterapií gemcitabinem (n = 52) u pacientů předléčených antracyklinem a ifosfamidem [20]. Kombinační režim prokázal zlepšení obou sledovaných parametrů (PFS 4,2 měsíce vs. 2,0 měsíce a OS 16,8 měsíce vs. 8,2 měsíce, p = 0,014). I přes malý počet léčených pacientů prokázala multivariační analýza efekt především u leiomyosarkomů.
Terapeutický režim kombinací doxorubicinu s dakarbazinem je léčebnou možností pro první linii léčby leiomyosarkomu (retrospektivní prokázání nízké odpovědi leiomysarkomu na ifosfamid) nebo u solitárního fibrózního tumoru [21].
U angiosarkomů mohou být lékem volby taxany [22], alternativou pak gemcitabin, případně jeho kombinace s docetaxelem [23].
V multicentrické klinické studii
fáze III PALETTE byl srovnáván pazopanib proti placebu
u předléčených pacientů (vyjma liposarkomu). I když
prodloužení PFS (4,6 měsíce vs. 1,6 měsíce) bylo statisticky
signifikantní (p < 0,0001),
rozdíl v OS byl méně výrazný (12,5 měsíce vs. 10,7
měsíce, p = 0,25
[24], tabulka 3.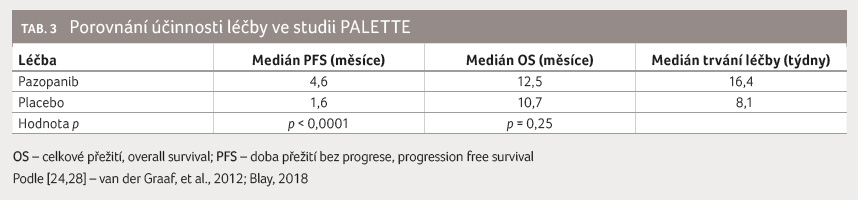
V menší randomizované studii fáze II byl srovnáván regorafenib proti placebu u čtyř histologických podskupin (liposarkom, leiomyosarkom, synoviální sarkom a ostatní) [25], tabulka 4. Výsledky byly obdobné jako u pazopanibu, největší efekt byl zaznamenán ve skupině leiomyosarkomů.
Předběžné výsledky studie fáze
III srovnávající u předléčených pacientů aldoxorubicin
s léčbou dle volby zkoušejícího lékaře vykazují rozdíly
v PFS pouze u subpopulace lipo a leiomyosarkomů
(P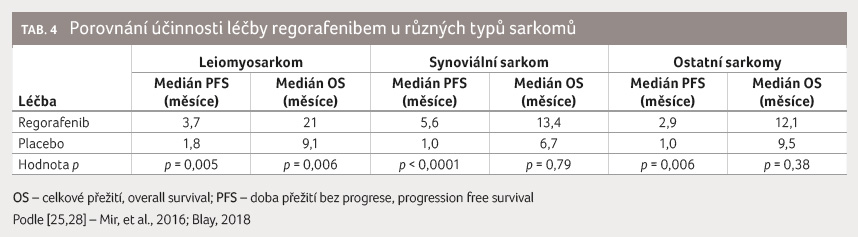 FS 5,3 měsíce vs. 3,0 měsíce) [26].
FS 5,3 měsíce vs. 3,0 měsíce) [26].
Imatinib je standardní léčbou rekurentních nebo metastatických protuberujících dermatofibrosarkomů s průkazem translokace t17/22 [27]. Podobně imatinib a nilotinib jsou aktivní látky v léčbě symptomatické progresivní pigmentované vilonodulární synovitidy. Léčba dalších velmi raritních subtypů (např. inflamatorní myofibroblastický tumor, alveolární sarkom měkkých tkání, maligní perivaskulární epiteloidní tumor a další), stejně jako desmoidních fibromatóz je nad rámec tohoto sdělení.
Závěr
Sarkomy měkkých tkání představují velmi heterogenní skupinu nádorů, které se liší svým biologickým chováním i odpovědí na systémovou léčbu. Chirurgická léčba doplněná v indikovaných případech ozářením je u sarkomů dospělých léčbou standardní ve většině případů. Postavení farmakologické léčby lokalizovaného onemocnění není jasně definováno. Očekávány jsou výsledky studie fáze III s předoperační chemoterapií lokalizovaných sarkomů vysokého rizika [9]. V případě relabující nemoci je obvykle systémová léčba metodou volby. Doxorubicin (± ifosfamid) je standardní farmakoterapií v první linii, i když se objevují nová léčiva s ambicemi zlepšit léčebné výsledky. V multicentrické studii fáze II vedlo přidání olaratumabu k doxorubicinu k signifikantnímu zlepšení OS [12]. Pokud tyto slibné výsledky skutečně potvrdí probíhající studie fáze III, může se tento kombinační režim stát v budoucnu novým „zlatým standardem“ [15]. Očekávaná data však budou dostupná nejdříve v polovině roku 2019.
Léčba ve druhé a další linii paliativní systémové terapie by měla být přísně individuální, se zohledněním celkového stavu, rozsahu onemocnění, doby do progrese, předléčení a jeho efektu, histologického subtypu a v neposlední řadě preference pacienta. Léčba by se měla řídit histologií, tedy za použití léku, u kterého lze přepokládat u daného histologického subtypu nejpříznivější efekt. Pokud nedošlo k progresi při podávání ifosfamidu, lze ho v další linii použít znovu s eskalací dávky až na 14 g/m2 (avšak s očekávanou vyšší toxicitou u dospělých pacientů). Stejně tak lze použít trabektedin, který je schopen dosáhnout dlouhodobé stabilizace při velmi dobré toleranci a kvalitě života. Kombinační režim gemcitabin/docetaxel může vést k výrazné klinické odpovědi, avšak s vyšším rizikem nežádoucích účinků. Alternativou je gemcitabin v monoterapii nebo dakarbazin. Taxany, gemcitabin i dakarbazin jsou účinné u angiosarkomů. Eribulin vykazuje efekt u liposarkomu (doporučená sekvence pro liposarkom: doxorubicin – trabektedin – eribulin, ev. inhibitor cyklin dependentni kinázy CDK4). Také pazopanib, aldoxorubicin a regorafenib patří mezi farmaka používaná v léčbě měkkotkáňových sarkomů [4,28,29].
Dle dostupných výsledků se jeví, že sarkomy jsou nádory neimunogenní, dosavadní výsledky imunoterapie u kostních sarkomů jsou nepříznivé, u sarkomů měkkotkáňových jsou zatím výsledky konfliktní (fenomén hyperprogrese např. u sarkomů s MDM2/MDM4 amplifikací nebo s EGFR alterací) [30,31]. V současné době platí obecné doporučení, že imunoterapií mají být pacienti léčeni pouze v rámci klinických studií.
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Seznam použité literatury
- [1] Fletcher CDM, Bridge JA, Hogendoorn PCW, et al. World Health Organization classification of tumours of soft tissue and bone, 4th ed. Lyon, IARC Press 2013.
- [2] Stiller CA, Trama A, Serraino D, et al., for the RARECARE Working Group. Descriptive epidemiology of sarcomas in Europe: report from the RARECARE project. Eur J Cancer 2013; 49: 684–695.
- [3] Ústav zdravotnických informací a statistik ČR, Národní onkologický registr (NOR), http://www.uzis.cz/registry‑nzis/nor, stránka navštívena 26. 5. 2018.
- [4] Casali PG, Abecassis N, Bauer S, et al. Soft tissue and visceral sarcomas: ESMO‑EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow‑up. Ann Oncol 2018, May 28, https://doi.org/10.1093/annonc/mdy096.
- [5] Casali PG, Abecassis N, Bauer S, et al. Gastrointestinal stromal tumours: ESMO‑EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow‑up. Ann Oncol 2018; 29(Suppl 4): iv68–iv78.
- [6] Woll PJ, Reichardt P, Le Cesne A, et al. Adjuvant chemotherapy with doxorubicin, ifosfamide, and lenograstin for resected soft‑tissue sarcoma (EORTC 62931): a multicentre randomised controlled trial. Lancet Oncol 2012; 13: 1045–1054.
- [7] Pervaiz N, Colterjohn N, Farrokhyar F, et al. Systematic meta‑analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft‑tissue sarcoma. Cancer 2008; 113: 573–581.
- [8] Gronchi A, Stacchiotti S, Verderio P, et al. Short, full‑dose adjuvant chemotherapy (CHT) in high‑risk adult soft tissue sarcomas (STS): long term follow‑up a randomized clinical trial from the Italian Sarcoma Group and the Spanish Sarcoma Group. Ann Oncol 2016; 27: 2283–2288.
- [9] Gronchi A, Ferrari S, Quaqliuolo V, et al. Histotype‑tailored neoadjuvant chemotherapy versus standard chemotherapy in patients with high‑risk soft‑tissue sarcomas (ISG‑STS 1001): an international, open‑label, randomised, controlled, phase 3, multicentre trial. Lancet Oncol 2017; 18: 811–822.
- [10] Blackmon SH, Shah N, Roth JA, et al. Resection of pulmonary and extrapulmonary sarcomatous metastases is associated with long‑term survival. Ann Thorac Surg 2009; 88: 877–884, discussion 884–885.
- [11] Judson I, Verweij J, Gelderblom H, et al. Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first‑line treatment of advanced or metastatic soft tissue sarcoma: a randomised controlled phase 3 trial. Lancet Oncol 2014; 15: 415–423.
- [12] Tap WD, Jones RL, Van Tine BA, et al. Olaratumab and doxorubicin versus doxorubicin alone for treatment of soft‑tissue sarcoma: an open‑label phase 1b and randomised phase 2 trial. Lancet Oncol 2016; 338: 488–497.
- [13] Souhrn údajů o přípravku Lartruvo. Dostupné na: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/004216/human_med_002036.jsp&mid=WC0b01ac058001d124
- [14] OncoPrescribe. Dostupné na: https://www.oncoprescribe.com/oncoprescribe.com/newsletter.php?top=603
- [15] Clinical Trials Database: NCT02451943. https://clinicaltrials.gov/cr2/show/NCT02451943
- [16] Seddon B, Whelan J, Strauss SJ. GeDDiS: A prospective randomised controlled phase III trial of gemcitabine and docetaxel compared with doxorubicin as first‑line treatment in previously untreated advanced unresectable or metastatic soft tissue sarcomas (EudraCT 2009‑014907‑29). J Clin Oncol 2015; 33 (Suppl 15): Abstr. 10500.
- [17] Chawla SP, Papai Z, Mukhametschina G, et al. First‑line aldoxorubicin vs doxorubicin in metastatic or locally advanced unresectable soft‑tissue sarcoma: a Phase 2b randomized clinical trial. JAMA Oncol 2015; 1: 1272–1280.
- [18] Demetri GD, von Mehren M, Jones RL, et al. A randomized phase III study of trabectedin (T) or dacarbazine (D) for the treatment of patients (pts) with advanced liposarcoma (LPS) or leiomysarcoma (LMS). J Clin Oncol 2016; 34: 786–793.
- [19] Schoffski P, Chawla S, Maki EG, et al. Eribulin versus dacarbazine in previously treated patients with advanced liposarcoma or leiomyosarcoma: a randomised, open‑label, multicentre, phase 3 trial. Lancet 2016; 387: 1629–1637.
- [20] García‑Del‑Muro X, López‑Pousa A, Maurel J, et al. Randomized phase II study comparing gemcitabin plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma. A Spanisch Group for research on Sarcoma study. J Clin Oncol 2011: 29: 2528–2533.
- [21] Lorigan P, Verweij J, Papai Z, et al. Phase III trial of two investigational schedules of ifosfamide compared with standard‑dose doxorubicin in advanced or metastatic soft tissue sarcoma: a EORTC of Cancer Soft Tissue and Bone Sarcoma Group Study. J Clin Oncol 2007; 25: 3144–3150.
- [22] Penel N, Bui BN, Bay JO, et al. Phase II trial of weekly paclitaxel for unresectable angiosarcoma: the ANGIOTAX Study. J Clin Oncol 2008; 26: 5269–5274.
- [23] Stacchiotti S, Palasini E, Sanfilippo R, et al. Gemcitabine in advanced angiosarcoma: a retrospective case series analysis from the Italian Rare Cancer network. Ann Oncol 2012; 23: 501–508.
- [24] van der Graaf WT, Blay JY, Chawla SP, et al. Pazopanib for metastatic soft‑tissue sarcoma (PALETTE): a randomised, double‑blind, placebo‑controlled phase 3 trial. Lancet Oncol 2012; 379: 1879–1886.
- [25] Mir O, Brodowicz T, Italiano A, et al. Safety and efficacy of regorafenib in patients with advanced soft tissue sarcoma (REGOSARC): a placebo‑controlled, Phase 2 trial. Lancet Oncol 2016; 17: 1732–1742.
- [26] Chawla SP, Ganjoo KN, Schuetze S, et al. Phase III study of aldoxorubicin vs investigators’choise as treatment for relapsed/refractory soft tissue sarcomas. J Clin Oncol 2017; 35(Suppl): Abstract 11000.
- [27] Rutkowski P, Klimczak A, Lugowska I, et al. Long‑term results of treatment of advanced dermatofibrosarcoma protuberans (DFSP) with imatinib mesylate – The impact of fibrosarcomatous transformation. Eur J Surg Oncol 2017; 43: 1134–1141.
- [28] Blay JY. Getting up‑to‑date in the management of soft tissue sarcoma. Futur Oncol 2018; 14: 3–13.
- [29] Modrá kniha, Zhoubný novotvar měkkých tkání (C 36, C 38, 47–49), http://www.linkos.cz/informace‑pro‑praxi/modra‑kniha/9‑zhoubny‑novotvar‑mekkych‑tkani‑c36‑c38‑47‑49/, navštíveno 13. 7. 2018.
- [30] Tawbi HA, Burgess M, Bolejack V, et al. Pembrolizumab in advanced soft‑tissue sarcoma nad bone sarcoma (SARC028): a multicentre, two‑cohort, single‑arm, open‑lable, phase 2 trial. Lancet Oncol 2017; 18: 1493−1501.
- [31] D’Angelo SP, Mahoney MR, Van Tine BA, et al. Nivolumab with or without ipilimumab treatment for metastatic sarcoma (Alliance A091401): two open‑label, non‑comparative, randomised, controlled, phase 2 trials. Lancet Oncol 2018; 19: 416–426.