Farmakoterapie u chronického srdečního selhání
Souhrn:
V přehledovém článku je stručně shrnuta farmakoterapie nemocných s chronickým srdečním selháním, jak ji uvádějí současné Doporučené postupy Evropské kardiologické společnosti z roku 2012. Všichni symptomatičtí nemocní s příznaky retence tekutin, ať již v malém, či velkém krevním oběhu, by měli být léčeni diuretiky. Základem farmakoterapie chronického srdečního selhání se sníženou ejekční frakcí levé komory jsou léčiva, která příznivě ovlivňují prognózu nemocných – inhibitory angiotensin konvertujícího enzymu (ACE) a beta blokátory. Tyto léky by měly být podány každému nemocnému, který nemá kontraindikace, bez ohledu na závažnost srdečního selhání. Blokátory receptorů AT1 pro angiotensin II (sartany) jsou pouze alternativou pro nemocné, u nichž jsou známy kontraindikace nebo kteří netolerují inhibitory ACE. Nemocnému, který zůstává při výše uvedené léčbě stále symptomatický, by měl být navíc přidán k uvedené léčbě ještě blokátor mineralokortikoidních receptorů – spironolacton nebo eplerenon. Jako nový lék se objevil ivabradin. Tato léčba může být přínosná u nemocných, kteří jsou stále symptomatičtí, mají sinusový rytmus a klidovou srdeční frekvenci ≥ 75/min. Úloha digoxinu je dnes velmi sporná. Používá se převážně ke kontrole komorové frekvence u nemocných se srdečním selháním a fibrilací síní. Nedávno publikované výsledky studie PARADIGM HF naznačují, že inhibitor ACE by mohl být v budoucnosti nahrazen duálním inhibitorem LCZ696. Pro nemocné se srdečním selháním se zachovanou ejekční frakcí levé komory žádná „evidence based“ léčiva nemáme a léčba těchto pacientů zůstává empirická.
Key words: heart failure, pharmacotherapy, ACE inhibitors, beta blockers, mineralocorticoid receptor antagonists, ivabradine, digoxin.
Summary:
This review article deals with pharmacotherapy of patients with chronic heart failure summarised according to Guidelines of the European Society of Cardio-logy 2012. All symptomatic patients with signs and symptoms of fluid retention, either in pulmonary or systemic circulation, should be treated by diuretics. The pharmacotherapy of chronic heart failure with reduced ejection fraction is based on drugs with positive influence on the patients’ prognosis – ACE inhibitors and beta blockers. These drugs should be administered to all patients without contraindications, regardless of the severity of heart failure. Angio-tensin receptor blockers (sartans) are an alternative treatment suitable only for patients with contraindications or not tolerating ACE inhibitors. Patients remaining symptomatic despite the above listed therapy should also be treated with a mineralocorticoid receptor antagonist – spironolactone or eplereno-ne – as an add on therapy. Ivabradin was introduced as a new drug. It may be useful in patients who remain symptomatic, have sinus rhythm, and resting heart rate ≥ 75/min. The role of digoxin is considered controversial nowadays. It is used mainly for rate control in patients with heart failure and atrial fibril-lation. Recently published results of PARADIGM HF trial are promising in the sense that ACE inhibitors could be substituted by dual inhibitor LCZ696 in future. At present, we have no evidence based drugs for patients with heart failure with preserved ejection fraction, their treatment thus remaining an empiric one.
Úvod
Vývoj léčby chronického srdečního selhání probíhal v několika etapách, které byly podmíněny jednak stavem poznání a jednak léčivy a léčebnými prostředky, jež byly v dané době k dispozici. Obojí se pochopitelně vzájemně ovlivňovalo a podmiňovalo. V první etapě, která trvala do konce osmdesátých let minulého století, byl v patofyziologii srdečního selhání kladen důraz na hemodynamické změny a také léčba byla zaměřena na zlepšení hemodynamických ukazatelů. Dominovaly v ní pozitivně inotropní léky, zejména digoxin, diure-tika a později i vazodilatancia. Tato léčba nemocným nepochybně symptomaticky ulevovala, ale nebyla schopna ovlivnit jejich neblahý osud.
V patofyziologii srdečního selhání se pak přesunul důraz od hemodynamických změn na význam dlouhodobé patologické neurohu-morální aktivace zejména systému renin angiotensin aldosteron (RAAS) a sympatoadrenálního systému (SAS). V podobě inhibitorů angiotensin konvertujícího enzymu (ACE) se objevily první farmakologické prostředky, které umožňovaly patologickou aktivaci RAAS mitigovat. Výsledky klinické studie CONSENSUS s enalaprilem přinesly přesvědčivý doklad o tom, že je možné nemocným ulevit od potíží nejenom symptomaticky, ale příznivě ovlivnit jejich špatnou prognózu také farmakologicky [1]. Toto revoluční zjištění pak bylo potvrzeno v řadě dalších studií i pro další inhibitory ACE [2,3]. Do léčby chronického srdečního selhání tak mohly vstoupit inhibi-tory ACE, později také blokátory mineralokortikoidních receptorů (mineralocorticoid receptor antagonists, MRA) a blokátory receptorů AT1 pro angiotensin II (angiotensin receptor blockers, ARB), tzv. sartany. Ve fázi „hemodynamické léčby“ byly beta blokátory považo-vány u nemocných se srdečním selháním za přísně kontraindikované. Znělo to logicky – vždyť přece mají negativně inotropní účinek, a navíc nás v tom utvrzovaly mnohočetné zkušenosti s akutním zhoršením srdečního selhání, často až do klinického obrazu plicního edému po zahájení léčby beta blokátorem. Teprve nový koncept zahájení léčby velmi malou iniciální dávkou beta blokátoru s její poma-lou titrací až do dávky cílové, který byl prověřen velkými mortalitně morbiditními klinickými studiemi, prokázal, že biologické důsledky snížení patologicky aktivovaného SAS jednoznačně převáží negativně inotropní účinky beta blokátorů. Výsledkem je zvýšení ejekční frakce levé komory a významný pokles mortality o zhruba jednu třetinu [4,5].
Další prognostické zlepšení s významným poklesem mortality i morbidity přineslo přidání MRA spironolactonu do léčby u nemocných s těžším srdečním selháním [6] nebo přidání eplerenonu u nemocných se systolickou dysfunkcí levé komory či srdečním selháním po prodělaném infarktu myokardu [7].
V následující etapě bouřlivě vstoupila do komplexní terapie chronického srdečního selhání léčba přístrojová. Nejprve to byly implan-tabilní kardiovertery/defibrilátory u nemocných s vysokým rizikem náhlé srdeční smrti, později systémy pro biventrikulární kardiostimu-laci určené pro srdeční resynchronizační léčbu (cardiac resynchronization therapy, CRT) u nemocných s výraznou mechanickou dyssyn-chronií obou komor, která se projevuje výrazným rozšířením komplexu QRS na křivce elektrokardiogramu. Dnes jsou většinou obě tyto funkce integrovány v jednom přístroji. U nemocných s pokročilým srdečním selháním došlo také k nevídanému rozvoji mechanických podpor levé komory, nejprve v podobě pulsatilních, později kontinuálních pump, které se pozvolna stávají z prostředku pro krátkodobé překlenutí doby do zlepšení funkce levé komory (bridge to recovery) nebo do srdeční transplantace (bridge to transplantation) i definitivní léčbou terminálního srdečního selhání (destination therapy).
Co říkají doporučené postupy?
Současné komplexní léčebné možnosti jak pro chronické, tak i akutní srdeční selhání, podložené důkazy z randomizovaných morbidit-ně mortalitních klinických studií, shrnují současná doporučení Evropské kardiologické společnosti, která byla publikov![Obr. 1 Algoritmus léčby (farmakologické i nefarmakologické) chronického srdečního selhání se sníženou ejekční frakcí levé komory; podle [8] – McMurray, et al., 2012. ACE – angiotensin konvertující enzym; ARB – blokátor receptorů AT1 pro angiotensin II; NYHA – klasifi - kace srdečního selhání podle New York Heart Association; MR – mineralokortikoidní receptor; EF LK – ejekční frakce levé komory; SF – srdeční frekvence; CRT-D – srdeční resynchronizační léčba s defi brilací; CRT-P – srdeční resynchronizační léčba s kardiostimulací; ICD – implantabilní kardioverter/defi brilátor; LVAD – mechanická podpora levé komory](https://www.remedia.cz/photo-a-30128---.jpg) ána v roce 2012 [8]. Přehled komplexní léčby chronického srdečního selhání je uveden na obr. 1. Tyto doporučené postupy převzala i Česká kardiologická společnost [9]. Stávající doporučené postupy se týkají výhradně léčby nemocných s chronickým srdečním selháním se sníženou ejekční frakcí levé komory (tzv. systolického srdečního selhání). U nemocných s chronickým srdečním selháním a zachovanou ejekční frakcí levé komory (tzv. diastolickým srdečním selháním) zatím úplně chybějí důkazy o prospěšnosti některých léčiv, provedené klinické studie do-padly neutrálně, a léčba je proto jen empirická – viz níže.
ána v roce 2012 [8]. Přehled komplexní léčby chronického srdečního selhání je uveden na obr. 1. Tyto doporučené postupy převzala i Česká kardiologická společnost [9]. Stávající doporučené postupy se týkají výhradně léčby nemocných s chronickým srdečním selháním se sníženou ejekční frakcí levé komory (tzv. systolického srdečního selhání). U nemocných s chronickým srdečním selháním a zachovanou ejekční frakcí levé komory (tzv. diastolickým srdečním selháním) zatím úplně chybějí důkazy o prospěšnosti některých léčiv, provedené klinické studie do-padly neutrálně, a léčba je proto jen empirická – viz níže.
Inhibitory ACE a beta blokátory
Základem léčby chronického srdečního selhání jsou léčiva, která příznivě ovlivňují prognózu nemocných – inhibitory ACE a beta blokátory. Přehled léčiv ovlivňujících prognózu a jejich dávkování je uveden v tab. 1. Každý nemocný, u něhož tyto léky nejsou kontraindikovány, by je měl dostávat v doporučených cílových dávkách; pokud tyto doporučené dávky netoleruje, pak by se léky měly podávat v maximálních tolerovaných dávkách. Pořadí, ve kterém jsou obě skupiny léčiv zaváděny do t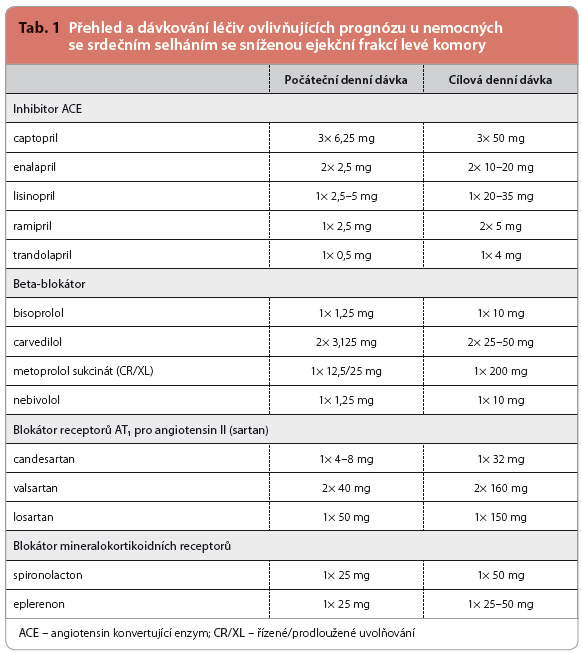 erapie, vzniklo historicky. Do léčby byly nejprve zavedeny inhibitory ACE a beta blokátory pak byly o několik let později zkoušeny v klinických studiích u nemocných, kteří již užívali inhibitor ACE. Toto pořadí se tradičně dodržuje dodnes, ale zřejmě nehraje větší roli. Existuje naprostý konsensus, že tyto dvě lékové skupiny jsou komplementární a že jak léčba beta blokátory, tak i léčba inhibitory ACE má být zahájena co nejdříve po stanovení diagnózy srdečního selhání. Důvodem je, že inhibitory ACE mají mírný účinek na remodelaci levé komory, zatímco léčba beta blokátory často vede k významnému zlepšení ejekční frakce levé komory. Beta blokátory mají navíc antiischemické účinky a výrazně snižují riziko náhlé srdeční smrti; to vše vede k časnému a výraznému snížení celkové mortality.
erapie, vzniklo historicky. Do léčby byly nejprve zavedeny inhibitory ACE a beta blokátory pak byly o několik let později zkoušeny v klinických studiích u nemocných, kteří již užívali inhibitor ACE. Toto pořadí se tradičně dodržuje dodnes, ale zřejmě nehraje větší roli. Existuje naprostý konsensus, že tyto dvě lékové skupiny jsou komplementární a že jak léčba beta blokátory, tak i léčba inhibitory ACE má být zahájena co nejdříve po stanovení diagnózy srdečního selhání. Důvodem je, že inhibitory ACE mají mírný účinek na remodelaci levé komory, zatímco léčba beta blokátory často vede k významnému zlepšení ejekční frakce levé komory. Beta blokátory mají navíc antiischemické účinky a výrazně snižují riziko náhlé srdeční smrti; to vše vede k časnému a výraznému snížení celkové mortality.
U nemocného, který je symptomatický, se léčba obvykle zahajuje inhibitorem ACE a teprve pak se začíná s titrací dávky be-ta blokátoru. Naopak u nemocného, který je ohrožen náhlou smrtí, je možné a zřejmě i výhodnější zahájit léčbu beta blokátorem a teprve po vytitrování cílové dávky přidat inhibitor ACE.
Z inhibitorů ACE uvádějí evropská doporučení následující léčiva: captopril, enalapril, lisinopril, ramipril a trandolapril. Tedy ta, kte-rá byla vyzkoušena v randomizovaných klinických studiích. Podle analýzy farmakoterapie zhruba 600 českých nemocných s chronickým srdečním selháním, kteří byli zařazeni do evropského registru EORP Heart Failure Long Term Registry, je v České republice nejpouží-vanějším inhibitorem ACE v léčbě chronického srdečního selhání perindopril [10]. Podle mého názoru to není chyba, protože o prospěšném účinku perindoprilu u nemocných se srdečním selháním svědčí důkazy, byť z menších studií, jako je PEP CHF nebo PREAMI; podávání perindoprilu navíc navrhovaly i starší české doporučené postupy.
Léčba inhibitory ACE občas vede ke zhoršení renálních funkcí, k hyperkalemii, symptomatické hypotenzi, kašli a zřídka ke vzniku angioedému. Inhibitory ACE by měly být použity pouze u nemocných s adekvátní renální funkcí (plazmatická koncentrace kreatini-nu ≤ 220 µmol/l nebo odhadovaná glomerulární filtrace, eGFR, ≥ 30 ml/min/1,73 m2) a s normální kalemií.
Z beta blokátorů jsou pro léčbu chronického srdečního selhání doporučeny pouze ty, jejichž účinek byl testován v klinických studiích. Tři klíčové studie s bisoprololem, karvedilolem a metoprolol sukcinátem CR/XL (controlled release/extended release) prokázaly, že léčba beta blokátory významně snižuje mortalitu (relative risk reduction, RRR, cca 34 %) a počet hospitalizací pro zhoršení srdečního selhání (RRR 28–36 %) v průběhu jednoho roku od jejího zahájení. Účinky nebivololu na snížení mortality byly v klinické studii méně výrazné. Prospěch z léčby beta blokátory je přídatný ke konvenční léčbě včetně inhibitorů ACE. Léčba beta blokátorem by měla být zahájena u stabilizovaného nemocného velmi nízkou iniciální dávkou, která se pak zvolna titruje (obvykle jejím zdvojnásobením ve dvoutýdenních intervalech) do dávky cílové, či alespoň maximálně tolerované. U nedávno dekompenzovaných nemocných je třeba opatrnosti. Ukázalo se, že pokračování léčby beta blokátorem je bezpečné i v průběhu epizod dekompenzace. U nemocných v šoku nebo s těžkou hypoperfuzí se doporučuje podávání beta blokátoru přechodně ukončit a léčbu znovu zahájit (nebo se o to alespoň pokusit) před propuštěním z nemocnice.
Sartany
Blokátory receptorů AT1 pro angiotensin II zůstávají alternativními léky pro nemocné, kteří jsou intolerantní k inhibitorům ACE. V klinických studiích byly zkoušeny losartan, valsartan a candesartan. Naděje, které byly vkládány do kombinace inhibitorů ACE a sartanů, se nevyplnily. Dvě randomizované klinické studie kontrolované placebem, které tuto kombinaci u srdečního selhání testovaly, ukázaly, že přidání sartanů k léčbě sice snižuje počet hospitalizací pro srdeční selhání, ale nikoliv počet hospitalizací ze všech příčin [11,12]. Obě studie také prokázaly, že kombinace zmírňuje symptomy a zlepšuje kvalitu života. Přednost ale dostala kombinace inhibitorů ACE s MRA, která dodatečně významně snižuje mortalitu.
Blokátory mineralokortikoidních receptorů
Blokátory mineralokortikoidních receptorů jsou další skupinou blokátorů RAAS příznivě ovlivňujících nejenom symptomy srdečního selhání, ale také prognózu nemocných. Patří mezi ně spironolacton a eplerenon. Spironolacton je neselektivní blokátor, kromě receptorů pro aldosteron blokuje také receptory pro jiné steroidní hormony, zejména pohlavní. Z toho vyplývají jeho nepříjemné nežádoucí účinky (gynekomastie, mastodynie, ztráta sexuální apetence, impotence), které ho činí nepoužitelným asi u 10 % mužů. Eplerenon je selektivní blokátor mineralokortikoidních receptorů a tyto nežádoucí účinky proto nemá. Výsledky předčasně ukončené klinické studie EMPHASIS HF [13] rozšířily indikaci MRA na všechny nemocné se systolickým srdečním selháním, kteří zůstávají i přes léčbu kombi-nací inhibitorů ACE (eventuálně sartanů) a beta blokátorů stále symptomatičtí, tedy ve funkční třídě II–IV podle NYHA (New York Heart Association).
Spironolacton i eplerenon mohou způsobit hyperkalemii a zhoršení renálních funkcí, což sice nebylo v klinických studiích časté, ale v klinické praxi v reálném životě se může objevovat častěji, zejména u starších nemocných. Obě léčiva by proto měla být používána pouze u nemocných s adekvátní renální funkcí a normální kalemií. Po zahájení jejich podávání je nezbytné pravidelné monitorování renálních funkcí a sérových koncentrací elektrolytů.
Ivabradin
Jako novinka se v současných doporučeních objevil ivabradin. Je to lék, který inhibuje kanály If v sinusovém uzlu. Jeho jediným známým farmakologickým účinkem je zpomalení srdeční frekvence u nemocných se sinusovým rytmem. Ve studii SHIFT u nemocných se srdečním selháním, ve funkční třídě II–IV podle NYHA, se sinusovým rytmem, srdeční frekvencí ≥ 70/min a ejekční frakcí levé komory ≤ 35 % vedl ivabradin ke snížení výskytu primárního cílového ukazatele složeného z kardiovaskulárních úmrtí a hospitalizací pro srdeční selhání o 18 % (p < 0,0001); snížení kardiovaskulární ani celkové mortality nebylo významné. Počet hospitalizací pro srdeční selhání byl snížen o 26 % [14]. Ivabradin také zlepšil funkci levé komory a kvalitu života. U většiny nemocných byl ivabradin ve studii SHIFT kombinován s beta blokátory a tato kombinace se jevila jako bezpečná, je ovšem nutné pečlivé monitorování srdeční frekvence. Dodatečná analýza vztahu bazální srdeční frekvence a účinků ivabradinu ukázala, že u pacientů s počáteční srdeční frekvencí 75/min a vyšší snižuje ivabradin významně kardiovaskulární, a dokonce i celkovou mortalitu. Na základě toho doporučila Evropská léková agentura podávat ivabradin u nemocných se systolic-kým srdečním selháním se sinusovým rytmem v kombinaci s beta blokátory v nejvyšší tolerované dávce nebo – při jejich intoleran-ci či při kontraindikacích – samotný, dosahuje li klidová srdeční frekvence 75/min a více. Toto doporučení převzal do indikačního omezení ivabradinu i Státní ústav pro kontrolu léčiv.
Digoxin
Digoxin, který byl v době léčby zaměřené na hemodynamické ukazatele spolu s diuretiky dominantním lékem srdečního selhání, je dnes lékem až třetí či čtvrté volby. Využívá se především jeho antiarytmického účinku, spíše než účinku pozitivně inotropního. Vý-znam má zejména u srdečního selhání s fibrilací síní, kde může být použit ke snížení rychlé komorové frekvence. Ale i v této situaci upřednostňujeme beta blokátory a digoxin je až lékem druhé volby do kombinace s nimi. Na základě výsledků jediné velké morbidit-ně mortalitní klinické studie DIG, která byla provedena u nemocných se symptomatickým srdečním selháním, může být digoxin podáván také nemocným se sinusovým rytmem, kteří mají systolickou dysfunkci levé komory a zůstávají symptomatičtí i přes ade-kvátní léčbu. Studie DIG však byla provedena v době, kdy se v léčbě srdečního selhání ještě rutinně nepoužívaly beta blokátory. Léčba digoxinem neovlivnila celkovou mortalitu, ale vedla v průběhu tří let od zahájení ke snížení relativního rizika hospitalizací pro zhoršení srdečního selhání o 28 % [15]. Tyto nálezy jsou podpořeny metaanalýzou menších studií, jejíž výsledky naznačují, že digo-xin může zmírnit symptomy a zabránit hemodynamickému zhoršení. Digoxin se dnes podává v nízkých denních dávkách 0,125–0,25 mg, terapeutické plazmatické koncentrace jsou 0,6–1,1 nmol/l.
Diuretika
Diuretika by měla být podávána každému symptomatickému nemocnému se srdečním selháním. Na rozdíl od inhibitorů ACE, be-ta blokátorů a MRA (a jiných léčebných postupů) nebyly účinky diuretik na mortalitu a morbiditu u nemocných se srdečním selháním studovány. Nicméně diuretika ulevují od dušnosti, odstraňují otoky, a proto jsou doporučena u nemocných s příznaky a známkami reten-ce tekutin, ať již v plicním (dušnost), nebo v systémovém (periferní otoky) krevním oběhu, bez ohledu na hodnotu ejekční frakce levé komory. Kličková diuretika vyvolávají intenzivnější a kratší diurézu než thiazidy, jejichž účinek je mírnější a protrahovanější. U nemocných se sníženými renálními funkcemi však mohou být thiazidová diuretika méně účinná. U srdečního selhání se sníženou ejekční frakcí levé komory jsou kličková diuretika obvykle preferována, i když působí synergisticky s thiazidy a k léčbě rezistentních otoků může být použita i jejich vzájemná kombinace (obvykle po přechodnou dobu). Cílem diuretické léčby je dosažení a udržení euvo-lemie („suché váhy“ nemocného) při podávání co možná nejnižší denní dávky. To znamená, že dávka musí být titrována zejména po dosažení „suché“ tělesné hmotnosti, aby se předešlo riziku dehydratace, která by vedla k hypotenzi a renální dysfunkci. Mnozí ne-mocní mohou být edukováni, aby si sami přizpůsobovali dávku diuretika podle monitorování příznaků a známek retence tekutin a výsledků denní kontroly tělesné hmotnosti.
Léčba srdečního selhání se zachovanou ejekční frakcí levé komory
Pro srdeční selhání se zachovanou ejekční frakcí levé komory (diastolické srdeční selhání) prozatím nebyla nalezena žádná léčba, která by přesvědčivě vedla ke snížení mortality a morbidity. Léčba tohoto syndromu proto zůstává víceméně empirická. Podobně jako u srdečního selhání se sníženou ejekční frakcí levé komory jsou používána diuretika ke kontrole retence sodíkových iontů a vody, vypla-vení periferních otoků a zmírnění dušnosti. Diuretická léčba však musí být opatrná, aby nedošlo k prudkému snížení preloadu a tím k akcentaci diastolické dysfunkce levé komory. Za důležitou je považována důsledná léčba hypertenze a myokardiální ischemie, což jsou faktory, které hrají v patogenezi diastolické dysfunkce významnou roli. Důležité je také zachování sinusového rytmu a zabránění vzniku tachykardie, která vede ke zkrácení diastoly a zhoršení diastolické dysfunkce. Při fibrilaci síní je nutné dobře kontrolovat komorovou frekvenci, a to buď beta blokátory nebo bradykardizujícími blokátory kalciových kanálů, eventuálně v kombinaci s digoxinem. Existují malé studie, které naznačily, že bradykardizující blokátor kalciových kanálů verapamil může u těchto nemocných zmírnit symptomy a zlepšit toleranci zátěže.
U nemocných se srdečním selháním se zachovanou ejekční frakcí levé komory bylo zatím provedeno jen několik málo randomizova-ných mortalitně morbiditních klinických studií, žádná z nich však neprokázala prospěch z testovaného léčiva. Studie CHARM Preserved u 3023 nemocných neprokázala, že by candesartan snížil výskyt primárního cílového ukazatele složeného z kardiovaskulárních úmrtí a hospitalizací pro srdeční selhání [16]. Podobně ve studii PEP CHF nevedlo podávání perindoprilu u 850 nemocných ke snížení primární-ho kompozitního ukazatele složeného z úmrtí a hospitalizací pro srdeční selhání [17]. A konečně, ani největší studie I PRESERVE nepro-kázala, že by podávání irbesartanu snížilo u 4 128 nemocných výskyt úmrtí nebo kardiovaskulárních hospitalizací (specificky pro srdeční selhání, infarkty myokardu, nestabilní anginu pectoris, arytmie a mozkové cévní příhody), což byl v této studii sledovaný primární cílový ukazatel [18].
Velké očekávání vzbudila studie TOPCAT, která testovala účinky spironolactonu ve srovnání s placebem u 3 445 nemocných se sr-dečním selháním a ejekční frakcí ≥ 0,45 sledovaných po průměrnou dobu 3,3 roku. Zhruba polovina nemocných byla do této studie zařazena v Americe (v USA, Kanadě, Brazílii a Argentině) a druhá polovina v Rusku a Gruzii. Výsledky studie byly zklamáním. Výskyt primárního složeného klinického ukazatele (kardiovaskulární úmrtí + hospitalizace pro srdeční selhání + zresuscitované srdeční zástavy) sice byl při podávání spironolactonu o 11 % méně častý (poměr rizik [hazard ratio, HR]: 0,89; interval spolehlivosti [confidence interval, CI]: 0,77–1,04) a počet hos![Graf 1 Výskyt primárního složeného klinického ukazatele (kardiovaskulární úmrtí + hospitalizace pro srdeční selhání + zresuscitované srdeční zástavy) ve studii TOPCAT podle geografi ckých oblastí, ve kterých byli pacienti zařazeni do studie; podle [19] – Pitt, et al., 2014. HR – hazard ratio, poměr rizik](https://www.remedia.cz/photo-a-30130---.jpg) pitalizací pro srdeční selhání byl ve skupině se spironolactonem nižší dokonce o 17 % (HR: 0,83; CI: 0,69–0,99), ale ani v jednom případě rozdíl nedosáhl statistické významnosti [19]. Pozoruhodné je, že výskyt primárního cílového ukazatele v placebové větvi byl u nemocných zařazených v Americe skoro šestkrát vyšší než u nemocných zařazených v Rusku a Gruzii (12,6 %/rok vs. 2,3 %/rok). Zdá se, že v obou zeměpisných regionech byly do studie zařazeny úplně jiné populace nemocných. Při explorativní post hoc analýze byl pokles primárního cílového ukazatele u amerických nemocných při podávání spironolactonu o 18 % nižší (HR: 0,82), zatímco u nemocných zařazených v Rusku a Gruzii se o 10 % zvýšil (HR: 1,10), viz graf 1. Zdá se, že MRA mají v léčbě srdeční-ho selhání se zachovanou ejekční frakcí levé komory stále ještě šanci, ale zřejmě to bude vyžadovat další klinickou studii.
pitalizací pro srdeční selhání byl ve skupině se spironolactonem nižší dokonce o 17 % (HR: 0,83; CI: 0,69–0,99), ale ani v jednom případě rozdíl nedosáhl statistické významnosti [19]. Pozoruhodné je, že výskyt primárního cílového ukazatele v placebové větvi byl u nemocných zařazených v Americe skoro šestkrát vyšší než u nemocných zařazených v Rusku a Gruzii (12,6 %/rok vs. 2,3 %/rok). Zdá se, že v obou zeměpisných regionech byly do studie zařazeny úplně jiné populace nemocných. Při explorativní post hoc analýze byl pokles primárního cílového ukazatele u amerických nemocných při podávání spironolactonu o 18 % nižší (HR: 0,82), zatímco u nemocných zařazených v Rusku a Gruzii se o 10 % zvýšil (HR: 1,10), viz graf 1. Zdá se, že MRA mají v léčbě srdeční-ho selhání se zachovanou ejekční frakcí levé komory stále ještě šanci, ale zřejmě to bude vyžadovat další klinickou studii.
Co se ještě do doporučených postupů nedostalo?
Po několika letech se v léčbě chronického srdečního selhání objevil nový lék. Zatím nemá generický název, klinické zkoušení prodělává pod kódovým označením LCZ696. Jedná se o novou molekulu složenou z blokátoru receptorů AT1 pro angiotensin II valsartanu a inhibitoru neutrální endopeptidázy (NEP) neprilysinu, která má duální inhibiční účinek. Používá se pro ni zkratka ARNI (angiotensin receptor neprilysin inhibitor). Účinky LCZ696 při chronickém srdečním selhání se sníženou ejekční frakcí levé komory byly testovány proti účinkům enalaprilu ve velké randomizované dvojitě zaslepené klinické studii PARADIGM HF. Výsledky této studie byly poprvé prezentovány na konci srpna 2014 na Evropském kardiologickém kongresu v Barceloně a současně publikovány v prestižním medicínském časopise [20] a vzbudily velkou pozornost. Do studie bylo zařazeno 8 442 nemocných s chronickým srdečním selháním ve funkční třídě NYHA II–IV a s ejekční frakcí levé komory ≤ 0,40 (později změněno na ≤ 0,35), kteří byli randomizováni buď k užívání LCZ696 (v denní dávce 2 × 200 mg), nebo k užívání enalaprilu (v denní dávce 2 × 10 mg), samozřejmě navíc ke standardní léčbě podle současných doporu-čených postupů. Primárním sledovaným složeným ukazatelem byl součet kardiovaskulárních úmrtí a hospitalizací pro srdeční selhání. Studie byl![Graf 2 Výskyt primárního složeného klinického ukazatele (kardiovaskulární úmrtí + hospitalizace pro srdeční selhání) ve studii PRADIGM-HF; podle [20] – McMurray, et al., 2014. HR – poměr rizik; n – počet pacientů, kteří v čase ukončení studie v dané větvi dosáhli primárního složeného cílového ukazatele; NNT – number needed to treat, počet nemocných, které je nutno léčit, aby se zabránilo jedné příhodě](https://www.remedia.cz/photo-a-30131---.jpg) a ukončena předčasně, poté co bylo dosaženo protokolem předem stanovených hranic svědčících pro jednoznačný prospěch z léčby LCZ696. V době ukončení studie se primární cílový ukazatel vyskytl u 21,8 % nemocných užívajících LCZ696 a u 26,5 % nemoc-ných užívajících enalapril (HR: 0,80; CI: 0,73–0,87; p < 0,001). Celková mortalita se při užívání LCZ696 snížila o 16 % (p < 0,001) a kardiovaskulární mortalita dokonce o 20 % (p < 0,001), graf 2. V porovnání s enalaprilem snížilo podávání LCZ696 také riziko hospitali-zací pro srdeční selhání o 21 % (p < 0,001), zmírnilo symptomy a zvýšilo toleranci zátěže. Na druhou stranu při léčbě LCZ696 byla u většího počtu nemocných zjištěna hypotenze a nevýznamné epizody angioedému, ale byl zaznamenán nižší výskyt zhoršení renálních funkcí, hyperkalemie a kašle než při podávání enalaprilu.
a ukončena předčasně, poté co bylo dosaženo protokolem předem stanovených hranic svědčících pro jednoznačný prospěch z léčby LCZ696. V době ukončení studie se primární cílový ukazatel vyskytl u 21,8 % nemocných užívajících LCZ696 a u 26,5 % nemoc-ných užívajících enalapril (HR: 0,80; CI: 0,73–0,87; p < 0,001). Celková mortalita se při užívání LCZ696 snížila o 16 % (p < 0,001) a kardiovaskulární mortalita dokonce o 20 % (p < 0,001), graf 2. V porovnání s enalaprilem snížilo podávání LCZ696 také riziko hospitali-zací pro srdeční selhání o 21 % (p < 0,001), zmírnilo symptomy a zvýšilo toleranci zátěže. Na druhou stranu při léčbě LCZ696 byla u většího počtu nemocných zjištěna hypotenze a nevýznamné epizody angioedému, ale byl zaznamenán nižší výskyt zhoršení renálních funkcí, hyperkalemie a kašle než při podávání enalaprilu.
Experimentální lék LCZ696 a studie PARADIGM HF nejsou první zkušeností s tzv. duálními inhibitory. Máme ještě v živé paměti duální inhibitor ACE a NEP omapatrilát a výsledky studií OCTAVE a OVERTURA, které vedly k zastavení jeho dalšího klinického vývoje. Důvody byly bezpečnostní, při podávání omapatrilátu se ve zvýšené míře vyskytoval život ohrožující angioedém. Proto byl výskyt tohoto nežádoucího účinku ve studii PARADIGM HF sledován mimořádně pečlivě. Naštěstí se bezpečnostní obavy nepotvrdily. Angioedém se objevil u 19 nemocných užívajících LCZ696 a u 10 nemocných užívajících enalapril (p = 0,13). Žádný z těchto nemoc-ných netrpěl dechovými obtížemi a nevyžadoval mechanickou podporu dýchání. Větší bezpečnost LCZ696 je vysvětlována tím, že tato látka neinhibuje ACE ani kininázu II, tedy dva enzymy odpovědné za degradaci bradykininu, substance P a jiných kininů.
Pozoruhodné a cenné je, že LCZ696 dokázal snížit celkovou mortalitu (o 16 %) a kardiovaskulární mortalitu (o 20 %) více než léčiva ovlivňující prognózu (inhibitory ACE, beta blokátory a MRA), která uvádějí současná doporučení [8,9]. Tento nový lék nepochybně ovlivní podobu příštích doporučených postupů pro léčbu chronického srdečního selhání. Bude to poprvé, kdy nebudeme nemocným ke stávající terapii přidávat další lék, ale nahradíme jeden ze současných léků lékem novým, účinnějším.
Seznam použité literatury
- [1] The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survi-val Study (CONSENSUS). N Engl J Med 1987; 316: 1429–1435.
- [2] The SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fraction and congestive heart failure. N Engl J Med 1991; 325: 293–302.
- [3] Garg R, Yusuf S. Overview of randomized trials of angiotensin converting enzyme inhibitors on mortality and morbidity in patients with heart failure. Collaborative Group on ACE Inhibitor Trials. JAMA 1995; 273: 1450–1456.
- [4] CIBIS II Investigators and Committees. The Cardiac Insufficiency Bisoprolol Study II (CIBIS II): a randomised trial. Lancet 1999; 353: 9–13.
- [5] MERIT HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT HF). Lancet 1999; 353: 2001–2007.
- [6] Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999; 341: 709–717.
- [7] Pitt B, Remme WJ, Zannad F, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348: 1309–1321.
- [8] McMurray JJ, Adamopoulos S, Anker SD, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Eur Heart J 2012; 33: 1787–1847.
- [9] Hradec J, Vítovec J, Špinar J. Souhrn doporučených postupů pro diagnostiku a léčbu akutního a chronického srdečního selhání – 2012. Připraven Českou kardiologickou společností. Cor Vasa 2013; 55: 532–547.
- [10] Krupička J, Andrusková A, Hegarová M, et al. Comparison of hospitalized and ambulatory patients with heart failure in Czech Republic and Europe. Data from the ESC Heart Failure Long Term Registry. Cor Vasa 2015; 57: 14–20.
- [11] Cohn JN, Tognoni G. A randomized trial of the angiotensin receptor blocker valsartan in chronic heart failure. N Engl J Med 2001; 345: 1667–1675.
- [12] McMurray JJ, Ostergren J, Swedberg K, et al. Effects of candesartan in patients with chronic heart failure and reduced left ventricular systolic function taking angio-tensin converting enzyme inhibitors: the CHARM Added trial. Lancet 2003; 362: 767–771.
- [13] Zannad F, McMurray JJ, Krum H, et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011; 364: 11–21.
- [14] Swedberg K, Komajda M, Böhm M, et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo controlled study. Lancet 2010; 376: 875–885.
- [15] The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336: 525–533.
- [16] Yusuf S, Pfeffer MA, Swedberg K, et al. Effects of candesartan in patients with chronic heart failure and preserved left ventricular ejection fraction: the CHARM Preserved Trial. Lancet 2003; 362: 777–781.
- [17] Cleland JG, Tendera M, Adamus J, et al. The perindopril in elderly people with chronic heart failure (PEP CHF) study. Eur Heart J 2006; 27: 2338–2345.
- [18] Massie BM, Carson PE, McMurray JJ, et al. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008; 359: 2456–2467.
- [19] Pitt B, Pfeffer MA, Assmann SA, et al. Spironolactone for heart failure with preserved ejection fraction. N Engl Med 2014; 370: 1383–1392.
- [20] McMurray JJ, Packer M, Desai AS, et al. Angiotensin Neprilysin inhibition versus Enalapril in Heart Failure. N Engl J Med 2014; 371: 993–1004.