Fenotypy chronické obstrukční plicní nemoci a jejich léčba
V přehledovém článku je popsán vývoj hodnocení chronické obstrukční plicní nemoci (CHOPN). Od jednoduchého hodnocení (tíže, stupně CHOPN i léčby) dle usilovně vydechnutého objemu vzduchu za první sekundu přes klasifikaci rozšířenou o dušnost a/nebo symptomy a počet akutních exacerbací v uplynulém roce (od roku 2011) až po fenotypickou diferenciaci nemocných. Fenotypem se rozumí jeden rys nebo kombinace rysů nemoci, které popisují rozdíly mezi jedinci s CHOPN a ovlivňují její klinicky významné důsledky, jako jsou symptomy, exacerbace, odpověď na léčbu, rychlost progrese nemoci či mortalita. Není jednoty v tom, kolik fenotypů CHOPN lze považovat za prokázané, např. ve španělských doporučeních se uvádějí čtyři fenotypy, v našem doporučení z roku 2013 jich nalezneme šest, v doporučení GOLD z roku 2014 není o fenotypech ani zmínka. Metodologie určování není jednotná (multifaktoriální i clusterové analýzy), jejich prověření v prospektivních studiích je nezbytné. Nicméně fenotypizace nemocných s CHOPN skýtá i možnost nasadit cílenou léčbu na úrovni současného poznání, která se odlišuje od léčby paušální. Rozdíly v léčbě jednotlivých u nás etablovaných fenotypů jsou rovněž předmětem sdělení.
CHOPN a fenotypy
Po desetiletí se chronická obstrukční plicní nemoc (CHOPN) klasifikovala podle hodnot ventilačního vyšetření a opírala se především o hodnotu usilovně vydechnutého objemu za první sekundu (forced expiratory volume in one second, FEV1). Jednotlivé charakteristiky CHOPN však s tímto parametrem souvisejí jen málo, což vedlo ke snaze o jiný, zevrubnější a přesnější popis nemocných s CHOPN.
Nemocní s CHOPN se stejným stupněm obstrukce hodnoceným dle FEV1 mají různé symptomy – dušnost, kašel, produkci sputa, jiný počet exacerbací, jinou toleranci fyzické zátěže a různý celkový zdravotní stav. Je rovněž známo, že nemocní s CHOPN mohou mít současně velký počet doprovodných nemocí (komorbidit), jako jsou kardiovaskulární nemoci, psychické poruchy (anxieta, deprese), metabolické poruchy (diabetes mellitus, hyperlipoproteinemie, metabolický syndrom aj.), rakovina. Snaha zpřesnit diagnostiku CHOPN vede ke změně její klasifikace uveřejněné poprvé v GOLD (Global Initiative for Chronic Obstructive Lung Disease) Report 2011 [1], která rozděluje CHOPN do čtyř kategorií dle symptomů, hodnoty FEV1 a dle počtu akutních exacerbací (AE) v uplynulém roce. Další upřesnění diagnostiky, zlepšení odhadu prognózy a podání cílené léčby CHOPN vedlo k vytvoření fenotypických skupin nemocných s určitými charakteristickými rysy nemoci. Fenotypem mají autoři mnohých sdělení na toto téma na mysli pozorovatelné strukturální a funkční vlastnosti organismu určené jak jeho genotypem, tak modulované životním stylem a prostředím. Je to v podstatě výsledek interakce mezi „vrozenými vlohami“ a jejich „ovlivněním“ během života. Fenotyp se skládá ze znaků nebo vlastností. Některé znaky jsou zcela odvislé od individuální genetické výbavy, některé jsou významně ovlivněny vlivy životního prostředí a další jsou výsledkem interakce mezi geny a faktory životního prostředí. Tato interakce je navíc ovlivněna individuální schopností bránit se působení vlivů na genetickou výbavu, či je usnadňovat.
V klinickém významu chápeme pojem fenotyp CHOPN jako kombinaci znaků, které určují odlišnosti jedinců s touto nemocí a mají významný vliv na průběh nemoci, jako jsou symptomy, počty exacerbací, odpověď na léčbu, rychlost progrese či úmrtí. Pojem fenotyp nemoci s sebou ale nese i několik problémů. Nemůže jím být univerzální rys nemoci (např. obstrukční ventilační porucha), protože by neměl diskriminační „sílu“ odlišit od sebe skupiny nemocných. Dalším úskalím je to, že by každý klinický fenotyp měl mít svoji klinicky významnou odezvu, která musí být prospektivně zhodnocena (validována). Nelze připustit, aby vznikal bezpočet fenotypů CHOPN opírajících se pouze o určité společné znaky nemocných, ale bez významu pro klinickou praxi.
Problémem může být také to, že některé klinické charakteristiky (např. dušnost, počet AE CHOPN) patří i mezi hlavní znaky fenotypů, a dále poznání, že se jednotlivé fenotypy mohou v průběhu nemoci měnit, ať už v důsledku progrese nemoci, nebo pod vlivem léčby. Navíc je známo, že znaky určitého fenotypu nemusejí být při rutinním vyšetření nemocných ihned patrné, např. při běžném vyšetření nelze poznat známky perzistujícího zánětu.CHOPN je definována existující „perzistující obstrukční ventilační poruchou, která není plně reverzibilní a je provázena abnormální zánětlivou reakcí na zevní škodliviny (kouř aj.)“ [1]. Při striktním dodržení této definice by CHOPN neměli mít lidé se známkami emfyzému na zobrazení počítačovou tomografií (CT), ale bez prokázané obstrukční ventilační poruchy (obstrukce), ani kuřáci s chronickou bronchitidou, jejichž spirometrické hodnoty jsou v normě, ani celoživotní nekuřáci s ne zcela reverzibilní obstrukcí (chronické astma). Nejasnosti panují i v hodnocení komorbidit. Není sporu o tom, že zhoršují průběh i prognózu nemoci, ale není známo, zda se vyskytují pouze jako náhodně doprovodné nemoci, nebo jsou výsledkem působení škodlivin (kouření) na více orgánů, nebo zda jsou integrální součástí CHOPN, tedy jejími systémovými důsledky. Navíc není ani jasné, zda v centru „komorbidomu“ (souboru nejčastějších průvodních nemocí CHOPN, tedy kardiovaskulárních nemocí, osteoporózy, plicního karcinomu, depresí, slabostí svalů, metabolického syndromu) je skutečně CHOPN, nebo stárnutí organismu (aging).
V uplynulých letech se mnoho odborníků začalo problematikou určení různých fenotypů CHOPN hlouběji zabývat s cílem zpřesnit diagnostiku, zlepšit odhad jejich prognózy i zkvalitnit jejich léčbu. Vytváření těchto fenotypů s sebou nese i rizika plynoucí jak z přesného vymezení určitého fenotypu (např. deficience α1-antitrypsinu, který někteří autoři mezi samostatné fenotypy nezařazují [2]), tak z neurčitého vymezení, kdy jeden nemocný může mít znaky několika fenotypů. Nicméně i s vědomím těchto rizik je diferenciace CHOPN na jednotlivé fenotypy chápána jako krok správným směrem, za mezistupeň k budoucí personalizované léčbě nemocných s CHOPN. Pokud budeme v budoucnu schopni určit pro každého nemocného „jeho“ optimální léčbu, lze předpokládat, že dělení na fenotypy nebude již více nutné a tento koncept bude opuštěn. Zjednodušeně řečeno, jsme na cestě od všemocného určujícího faktoru FEV1 (diagnostika, klasifikace, léčba a prognóza) přes stratifikaci nemocných do podskupin se společnými znaky (fenotypy) k individuálnímu zhodnocení nemoci a nasazení cílené optimální terapie [3].
Jak a jaké fenotypy CHOPN lze vytvořit
Historie vzniku fenotypového členění CHOPN je popsána v několika sděleních [4]. Věřím, že poznání vývoje této relativně nové „superklasifikace“ pomůže k většímu využívání fenotypů CHOPN v praxi. Historie vzniku fenotypů CHOPN není zcela nová. Termín CHOPN poprvé použil v roce 1960 Karon v publikaci Proceedings of Mayo Clinic [5]. Již v roce 1966 publikovali Burrows a Fletcher [6] studii rozlišující dvě hlavní komponenty CHOPN, emfyzém a chronickou bronchitidu. V roce 1968 na 9. konferenci o emfyzému v Aspenu v americkém Coloradu definovali stejní autoři dva subtypy jedné nemoci (CHOPN), a sice: emfyzematický (typ A, pink puffer) a bronchitický (typ B, blue bloaters) subtyp [7]. Tak byly položeny základy k hledání a formulování fenotypů CHOPN.
V následujících téměř padesáti letech se označení subtypů A a B z popisů CHOPN téměř vytratilo, pravděpodobně kvůli malým odlišnostem v klinickém průběhu uvedených subtypů nemoci. Nicméně hledání společných charakteristik podskupin nemocných s CHOPN začalo být opět aktuální. Impulzem k tomu byla opět konference o emfyzému v Aspenu (48. v pořadí) v roce 2006 [8]. V následujících letech vytvořil a publikoval Han a kol. [9] dodnes užívanou definici fenotypů CHOPN: jde o jeden rys nebo o kombinaci rysů nemoci, které popisují rozdíly mezi jedinci s CHOPN a ovlivňují klinicky významné důsledky nemoci, jako jsou symptomy, exacerbace, odpověď na léčbu, rychlost progrese nemoci či mortalita.
Přestože bylo na toto téma publikováno mnoho sdělení a tuto definici lze nalézt skoro v každém z nich, přetrvávají v chápání fenotypů nejasnosti. Nelze zaměňovat fenotyp za označení tíže či úrovně aktivity nemoci. Tak např. nemocní s CHOPN se stejně ohodnoceným rizikem např. dle BODE Indexu mohou patřit k různým fenotypům. Nová klasifikace CHOPN zavedená dle GOLD 2011 rozděluje nemocné do čtyř kategorií označených jako A, B, C, D. Na první pohled by se mohlo zdát, že jde o fenotypické dělení (málo symptomů/nízké riziko, hodně symptomů/nízké riziko, vysoké riziko/málo symptomů a vysoké riziko/hodně symptomů). Avšak při vědomí, že spíše než o výsledek statistického zpracování výsledků studií souborů nemocných s CHOPN jde o názor panelu expertů, že toto nové rozdělení ne zcela přesně predikuje mortalitu (o nic lépe než dříve zavrhované FEV1), nezahrnuje do klasifikace věk ani komorbidity, a navíc jeho význam pro léčbu není dosud zcela jasný, nelze tyto čtyři kategorie považovat za „plnohodnotné“ fenotypy.
Burgel a kol. ve svém sdělení [4] popisují metodu statistické analýzy, kterou využili při formulování fenotypických skupin CHOPN. Do této analýzy zahrnuli: klinické znaky nemoci (rizikové faktory, klinickou manifestaci, komorbidity), výsledky zobrazovacích metod (stupeň emfyzému, ztluštění stěny dýchacích cest, bronchiektazie), plicní funkce a výsledky zátěžových testů a biomarkery. Ke zpracování takových údajů o nemocných se tradičně používají multivariantní analýzy, nověji tzv. shlukové (clusterové) analýzy.
Metoda clusterové analýzy
Při multivariantní analýze se zvažuje obvykle jen jeden rys nemoci a jeho klinický význam; např. eozinofilie v bronchoalveolární laváži (BAL) či ve sputu predikuje dobrou odpověď na inhalační kortikosteroidy (IKS), častější hospitalizace zase zvyšují riziko úmrtí nemocných s CHOPN. Tento typ analýzy se opíral jen o několik málo proměnných, a proto hrozilo nebezpečí, že nerozpozná více komplexní fenotyp.
Proto se Burgel a kol. rozhodli vyzkoušet metodu clusterové analýzy. Ta je založena na hypotéze, že skupina nemocných s podobnými znaky nemoci může být vřazena pod určitý fenotyp. Statistická analýza může sama vygenerovat různý počet „shluků“ (clusterů), tedy skupin s podobnými vlastnostmi, anebo je počet clusterů předem dán a nemocní jsou do nich dle svých charakteristik přiřazováni. Důležitým faktorem tohoto statistického zpracování je pak počet proměnných, které jsou zadány. Slabinou této metody je, že k sobě mohou být „přiřazeni“ i nemocní se znaky, jež jsou pro určitý fenotyp irelevantní. Toto riziko může být zmenšeno tím, že pro zvolení určitého fenotypu (např. fenotyp vyššího rizika mortality) jsou do analýzy vřazeny proměnné, o kterých je z dřívějších studií známo, že ovlivňují mortalitu. Možné je také dopředu zadat, kolik clusterů analýza vygeneruje.
Tak například ve studii provedené v Leuvenu byly do analýzy zadány tři clustery, které se od sebe lišily v prognóze úmrtí. Pokud se zadalo rozdělení nemocných do pěti skupin, tato prognostická vlastnost se vytratila [10]. Pro zpracování dat různých souborů nemocných lze tedy zvolit různé strategie, jiné zařazení proměnných i jinak nastavené výsledné uspořádání clusterů. I přes relativní dokonalost této metody musejí být výsledky shlukových analýz zhodnoceny v následných studiích s dostatečně dlouhou dobou sledování tak, aby byl potvrzen jejich klinický význam pro jednotlivé skupiny (fenotypy) nemoc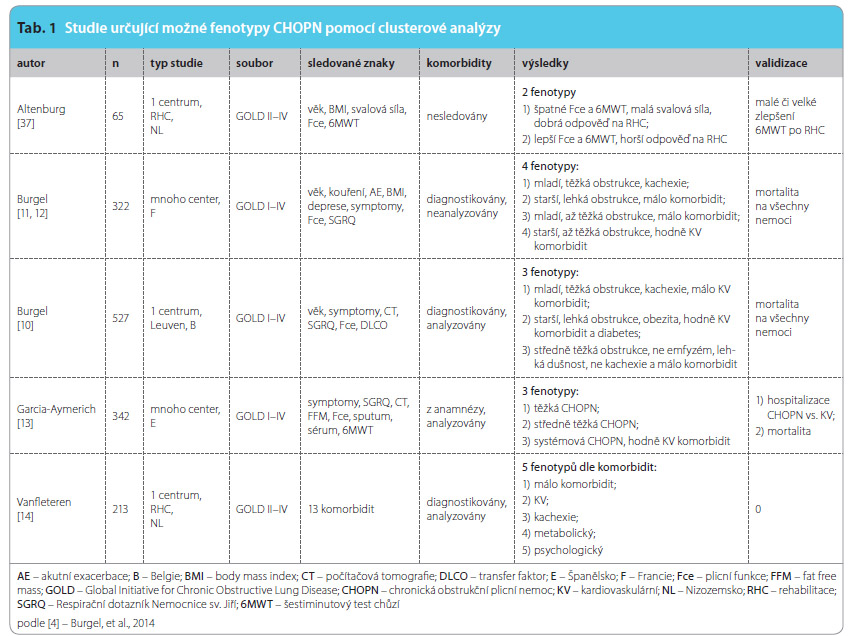 ných. V uplynulých přibližně pěti letech bylo publikováno množství studií ověřujících rozdělení nemocných s CHOPN do podskupin, fenotypů, jak jsou uvedeny v tab. 1. Jejich obecný přínos je limitován tím, že tyto studie zahrnuly málo účastníků, byly uskutečněny jen v jednom centru, nebo ve více centrech, ale jen v jedné zemi, zahrnovaly často nereprezentativní vzorek populace nemocných s CHOPN. Někteří autoři získávali pacienty do studií ze selektovaných skupin nemocných, například se jednalo o účastníky rehabilitačních programů, jiní je získali při hospitalizaci pro exacerbace CHOPN apod. (viz také tab. 1). Dalším problémem bylo, že nemocní nebyli podrobeni stejnému vyšetření, někdy úplně chybějí nálezy na skiagramu hrudníku či na CT hrudníku, jen v některých studiích byly vyšetřeny i biomarkery a sledovány komorbidity. Výsledky jsou dále limitovány tím, že jen v jedné studii byly navržené a „vygenerované“ fenotypy následně zhodnoceny další studií se sledováním mortality [11, 12].
ných. V uplynulých přibližně pěti letech bylo publikováno množství studií ověřujících rozdělení nemocných s CHOPN do podskupin, fenotypů, jak jsou uvedeny v tab. 1. Jejich obecný přínos je limitován tím, že tyto studie zahrnuly málo účastníků, byly uskutečněny jen v jednom centru, nebo ve více centrech, ale jen v jedné zemi, zahrnovaly často nereprezentativní vzorek populace nemocných s CHOPN. Někteří autoři získávali pacienty do studií ze selektovaných skupin nemocných, například se jednalo o účastníky rehabilitačních programů, jiní je získali při hospitalizaci pro exacerbace CHOPN apod. (viz také tab. 1). Dalším problémem bylo, že nemocní nebyli podrobeni stejnému vyšetření, někdy úplně chybějí nálezy na skiagramu hrudníku či na CT hrudníku, jen v některých studiích byly vyšetřeny i biomarkery a sledovány komorbidity. Výsledky jsou dále limitovány tím, že jen v jedné studii byly navržené a „vygenerované“ fenotypy následně zhodnoceny další studií se sledováním mortality [11, 12].
Počet fenotypů
Z uskutečněných clusterových analýz vzešel různý počet fenotypů s nejrůznějšími názvy. Tak například Burgel a kol. [11] na souboru 322 pacientů s CHOPN posuzoval společný výskyt 8 charakteristik CHOPN. Z jeho analýzy vyplynuly 4 relevantní fenotypy. První fenotyp představovali mladší nemocní (věk 58 let) s těžkou obstrukcí, nízkým BMI (body mass index), četnými symptomy, špatnou kvalitou života a častými exacerbacemi. Druhý fenotyp zahrnoval starší nemocné (medián věku 68 let) s mírnou obstrukcí, minimální symptomatologií, kteří ale měli velký počet komorbidit (diabetes mellitus, ischemická choroba srdeční – ICHS, hypertenze). Nemocní ve třetím a čtvrtém fenotypu trpěli středně těžkou až těžkou obstrukcí, ale lišili se věkem, výskytem komorbidit, BMI a stupněm dušnosti. Autoři prokázali, že pro klasifikaci CHOPN jsou důležité i jiné charakteristiky než FEV1. V dalším sledování následně Burgel a kol. hodnotili, jak fenotypové rozdělení souvisí s mortalitou nemocných. Zjistili, že nemocní v prvním clusteru (mladší, s nízkým BMI, těžkou obstrukcí a častými exacerbacemi) měli mortalitu největší, zatímco nemocní ve druhém clusteru (starší s komorbiditami) umírali nejméně [12].
Garcia-Aymerich a kol. popsali nově fenotyp tzv. systémové CHOPN [13]. Nemocní s CHOPN a tímto fenotypem měli vysoký BMI, často se u nich vyskytoval diabetes mellitus, ICHS se srdečním selháváním, byli často hospitalizovaní, trpěli větší dušností než nemocní s CHOPN se stejnou tíží obstrukční ventilační poruchy, ale bez těchto komorbidit. Vanfleteren a kol. [14] popsali podobné znaky u nemocných s CHOPN a současnými kardiovaskulárními nemocemi, avšak s normálním BMI a považovali tuto skupinu za odlišnou od dříve popsaného fenotypu metabolické CHOPN u nemocných s obezitou, s dyslipidemií, aterosklerózou a infarktem myokardu. Zda se skutečně jedná o dva fenotypy, není jasné, jisté je, že výše uvedené komorbidity zhoršují prognózu CHOPN.
Burgel a kol. ve výše zmíněné studii v Leuvenu [10] prokázali podobnosti mezi skupinou nemocných s CHOPN, kteří měli těžkou obstrukci již v mladším věku. Typickými znaky u nich byly nízký BMI, těžký emfyzém, časté exacerbace CHOPN, svalová slabost, osteoporóza, ale nízký počet kardiovaskulárních komorbidit a vysoká mortalita v relativně mladém věku. I jiný autor [14] popsal stejný cluster nemocných s CHOPN, kteří byli kachektičtí. Oba autoři považovali tyto projevy (emfyzém v kombinaci se svalovou slabostí a osteoporózou) za důsledek jednoho patofyziologického mechanismu. Zajímavé může být, že ve všech třech souborech, kde byl tento fenotyp kachexie popsán, se vyskytovalo více žen než mužů.
Dalším popsaným fenotypem byla skupina nemocných bez komorbidit, u kterých bylo i při stejně závažné obstrukci zaznamenáno méně exacerbací než u srovnatelných pacientů s komorbiditami [14].Do řady studií stanovujících možné fenotypy CHOPN se řadí i známá studie ECLIPSE [15].Jedním z jejích výsledků bylo definování fenotypů častý exacerbátor (2 a více AE v uplynulém roce) a fenotyp s perzistujícím systémovým zánětem. Fenotyp chronické bronchitidy je některými autory akceptován jako fenotyp CHOPN, jinými je považován za možnou komplikaci jiných fenotypů, např. ve studii ECLIPSE nebyla prokázána souvislost mezi stupněm dušnosti a počtem AE a chronickým kašlem.
Ověření fenotypů
Aby byly výše uvedené fenotypy akceptovány, musejí projít dalším zhodnocením (validizací), tedy ověřením, zda skutečně ovlivňují průběh CHOPN stejným způsobem. Navíc jsou navrženy další studie, které by měly pokud možno zahrnout nejspíše preklinické formy nemocných s CHOPN (např. osoby s obstrukční ventilační poruchou zjištěnou při screeningu) tak, aby u nich mohly být komplexně studovány všechny znaky a průvodní jevy nemoci, tedy věk, tíže nemoci, pohlaví, komorbidity, rizikové faktory, sociální úroveň aj. Studie fenotypů by rovněž měly proběhnout v různých zemích světa tak, aby se mohly posoudit odlišnosti znaků nemoci, vliv zevního prostředí i dědičnosti. Nezbytné je i ověření, jestli mají fenotypy pro své nositele klinicky významné konsekvence. Zajímavé mohou být i výsledky dlouhodobého sledování vývoje fenotypů, tedy posouzení stability fenotypů v čase, stejně jako dlouhodobé sledování vývoje CHOPN u mladších pacientů, s poznáním, jak se uplatní vliv stárnutí a přibývání komorbidit. Do budoucna je třeba vytvořit přehledný klasifikační systém tak, aby lékař mohl dle jednoduchého doporučení zařadit nemocné do určitých fenotypů.
Pokud se fenotypové diferenciace CHOPN uplatní a projdou řádnou validizací, lze v budoucnu očekávat i změnu klasifikace CHOPN tak, aby lépe reflektovala heterogenitu CHOPN. Každý fenotyp může mít různou patofyziologii a mohou se nalézt nové biomarkery umožňující včasnou diagnózu fenotypu a včasné nasazení optimální léčby. Fenotypy se i v budoucnu budou určovat dvojím způsobem: buď se nejprve stanoví klinické odlišnosti CHOPN určující fenotyp a poté se budou k tomuto fenotypu hledat biologické podklady a odlišnosti, anebo se budou klinické a biologické znaky odlišností podrobovat clusterové analýze a z ní pak vzejdou fenotypy. Lze předpokládat, že fenotypy budou alternativou anebo „nadstavbou“ dosavadní klasifikace CHOPN založené na FEV1, symptomech a počtu exacerbací.
Vyšetřovací metody k určení fenotypů
Podle jiných autorů [16] přispěla k vymezení fenotypů CHOPN i dosud málo účinná terapie ovlivňující jen málo symptomy, toleranci fyzické námahy a četnost AE. Ve snaze zvýšit účinnost léčby je tak třeba přesněji vymezit cílové skupiny nemocných, které navíc spojuje i podobná prognóza. Toto nové dělení je podmíněno výzkumem mnoha „úrovní“ nemoci, od genetických podkladů přes změny na úrovni buněk, tkání, orgánů až k hodnocení symptomů a znaků nemoci u jednotlivých nemocných. Tyto nové poznatky spolu s vytvořením biostatistických modelů vedly k identifikaci nových „cílů“ léčby, návrhu nových studií prověřujících správnost navržených postupů a současně k určení efektivní cílené léčby vhodné pro určité skupiny nemocných.
Fenotypy CHOPN by tedy měly rozdělovat nemocné do přesných podskupin s určitými klinickými vlastnostmi, podobnou prognózou, které prověří následné prospektivní studie. Při určování fenotypů CHOPN by měly být vzaty v potaz výsledky klinického vyšetření (symptomy – dušnost, kašel aj.) i vyšetření orgánů (CT plic – emfyzém nebo rozšíření stěny bronchů), vyšetření známek zánětu (přítomnost zánětlivých buněk ve sputu) a genetické vyšetření. Typickým příkladem jednoduchého určení fenotypu je deficience α1-antitrypsinu. Při určování jiných podskupin nemocných (fenotypů) je situace mnohem obtížnější. Spojení biologické podstaty nemoci s klinickou expresí je klíčem k pochopení celé nemoci a jen takové multidimenzionální hodnocení dovoluje správné dělení CHOPN na jednotlivé fenotypy.
V tomto multidimenzionálním určování fenotypů má významnou úlohu vyšetření pomocí CT, eventuálně pomocí magnetické rezonance (MRI). Tyto zobrazovací metody dokáží blíže specifikovat, zda se jedná převážně o poruchu plicního parenchymu (emfyzém, intersticiální procesy), nebo o postižení dýchacích cest, např. o bronchiektazie. Prokáží tak patologické změny (nebo jejich kombinace), které nejsou zjistitelné funkčním vyšetřením plic. Technika CT se vyvíjí a již dnes lze kvantitativně i kvalitativně hodnotit rozsah a vývoj plicního emfyzému; CT denzitometrie určí rozsah „gas trappingu“ (abnormální retence vzduchu v plicích) a v poznání progrese emfyzému je přesnější než funkční vyšetření plic. To bylo prokázáno ve studii s 22 nemocnými s deficiencí α1-antitrypsinu, kteří byli dlouhodobě sledováni (30 měsíců) pomocí funkčního vyšetření plic (FEV1, difuzní kapacita plic pro CO – DLCO), kvality života dle Respiračního dotazníku Nemocnice sv. Jiří (SGRQ) a dle CT plic (plicní denzita). S kvalitou života nejlépe korelovaly údaje o plicní denzitě dle CT, obě tyto hodnoty však nekorelovaly s FEV1 ani s DLCO [17].
Dále bylo prokázáno, že CT změny korelují s funkčními abnormitami. Tak např. postižení bazálních partií plic emfyzémem je provázeno výraznějším snížením FEV1 a menší poruchou respirace než při větším postižení apikálních částí plic. Objevily se snahy o etablování CT fenotypů „airway predominant“ a „emphysema predominant“, což bylo zkoumáno v několika studiích včetně známé ECLIPSE [15] se závěrem, že vřazení CT obrazu bezpochyby zlepší porozumění této nemoci. Nevýhodou CT vyšetření je doprovodná radiační zátěž nemocných. Tuto nevýhodu se snaží vyřešit MRI při současné inhalaci hyperpolarizovaného helia (3He). Několik malých studií prokázalo, že tato metoda je schopna stanovit rozsah emfyzému i ventilační inhomogenitu [18].
Dalšími parametry, které mohou ovlivnit vznik fenotypů, jsou biomarkery. Vedle dlouho známé dysbalance mezi proteinázami a antiproteinázami se stále hledají další biomarkery poškození plic. Ze zmnožených makrofágů a neutrofilů se uvolňují elastolytické proteinázy, jako např. matrix metaloproteinázy (MMPs), katepsiny a kolagenázy poškozující intercelulární matrix. V patologických procesech při rozvoji emfyzému hraje roli i vaskulární endoteliální růstový faktor (VEGF); snížení jeho hladiny přispívá ke zvýšení apoptózy plicních buněk a k rozšíření dýchacích cest typickému pro plicní rozedmu. Studují se změny plicního surfaktantu, produktu pneumocytů II. typu. Ve studii s 1888 nemocnými s plicním emfyzémem byla koncentrace surfaktantového proteinu (SP-D) v krvi vyšší než u kontrolní skupiny kuřáků bez emfyzému. Vysoká hladina tohoto proteinu byla rizikovým faktorem AE, nicméně nebyla prokázána korelace mezi jeho hladinou a snižováním (decline) FEV1 [19]. Biomarkerových studií je celá řada, žádná z molekul však zatím nebyla uvedena do rutinního použití a stále je v této oblasti mnoho nejasností.
Genetické základy fenotypů
Pro jednotlivé fenotypy se předpokládají i různé genetické podklady ovlivňující CHOPN. Studovalo se mnoho genových polymorfismů asociovaných s CHOPN pomocí GWAS (Genome-Wide Association Studies), které prokázaly asociaci mnohých polymorfismů se vznikem CHOPN a s kuřáckým chováním. Tyto polymorfismy se týkaly enzymů metabolizujících nikotin, dopamin, cytochrom P450 a jiné. Nicméně stále čekáme na validaci jejich klinických přínosů. Slibné jsou i studie (sekvenování) celého genomu pro objasnění biologických a klinických projevů CHOPN [20].
Hledají se i genetické změny určující klinické fenotypy CHOPN [21]. Z dosud provedených studií vyplynulo, že lokusy zvyšující citlivost ke vzniku CHOPN jsou na chromozomu 4 u tzv. Hedgehog interacting protein (HHIP) a FAM13A a na chromozomu 15 (CHRNA3/5 a IREB2). Hypotéza, že s klinickými fenotypy souvisejí i změny genů HHIP, FAM13A a CHRNA3/5, byla ověřována ve studii ECLIPSE a v populaci International COPD Genetics Network (ICGN) [21]. Lokus CHRNA3/5 byl signifikantně spojen s údajem o množství vykouřených cigaret, emfyzémem zhodnoceným podle CT a stupněm obstrukce (p = 0,004). Varianty genu IREB2 byly významně asociovány s hodnotou FEV1. Lokus HHIP nekoreloval s intenzitou kouření, ale koreloval s hodnotou FEV1/FVC (forced vital capacity, usilovná vitální kapacita; p = 0,004), s tzv. fat-free body mass (p = 0,007) a s počtem exacerbací CHOPN (p = 0,024); SNP (single-nucleotide polymorphisms) FAM13A byl asociován s plicními funkcemi. Autoři soudí, že CHRNA3/5 byl asociován se zvýšeným kouřením a s rozvojem emfyzému u nemocných s CHOPN, zatímco HHIP a FAM13A nesouvisely s intenzitou kouření; HHIP souvisel se systémovými komponentami CHOPN a s četností exacerbací, lokus FAM13A byl asociován s plicními funkcemi.Již dříve byla prokázána úzká souvislost vzniku CHOPN s rodinnou predispozicí. Ve studii na dvojčatech [22] bylo prokázáno významně vyšší riziko onemocnění CHOPN u sourozenců nemocných, z nichž 31,5 % mělo rovněž CHOPN. Nicméně zatím je nepochybně prokázána pouze dědičnost defektu α1-antitrypsinu, který je zjištěn asi u 1 % nemocných s CHOPN.
Fenotypy a léčba ve světě
Jak je to s vývojem léčby CHOPN? Od hypotézy, že na jednu nemoc je účinná jedna léčba, se upustilo již dávno. Mezníkem byl asi rok 1995, kdy American Thoracis Society (ATS) zařadila Vennův diagram do doporučení managamentu stabilní CHOPN. Tím byl dán základ pojímání CHOPN jako heterogenní nemoci s různou klinickou manifestací. Během vývoje doporučení GOLD se přešlo od léčby určené jedním faktorem (stupeň obstrukce – FEV1) k multidimenzionálnímu modelu zahrnujícímu stupeň dušnosti dle modifikované škály mMRC (Medical Research Council) nebo dle intenzity symptomů podle hodnocení CAT (COPD Assesment Test) při současném zhodnocení budoucího rizika dle tíže obstrukce (FEV1) a frekvence AE. Nicméně ani v posledních doporučeních GOLD není dosud léčba odlišována dle klinických fenotypů CHOPN.
Vývoj studia CHOPN v uplynulém desetiletí prokázal, že ne všechny „staré“ léky jsou vhodné pro všechny nemocné s CHOPN. To byl jeden z důvodů hledání tzv. respondérů a formulování podskupin (fenotypů) nemocných, pro které již existuje cílená léčba. Přesto, že byly činěny mnohé pokusy určit fenotypy CHOPN, podle dosavadních výsledků studií provedených v různých zemích a u různých populací nemocných s CHOPN (různá „tíže“ nemoci), není dosud v počtu, prevalenci ani v označení klinických fenotypů jednoty. Je zřejmé, že při jejich vytváření musí dojít ke kompromisu mezi snahou o definování jen několika skupin pacientů (s podobnou klinikou) a snahou popsat odlišnosti u každého jednotlivce s CHOPN. Hlavním cílem popisu fenotypických skupin pacientů tak nemůže být jen biologická podstata nemoci, ale i prognóza a odpověď na léčbu.
V současnosti jsou všeobecně akceptovány fenotypy chronické bronchitidy, častých exacerbací a fenotyp overlapu (překryvu) astma-CHOPN, v poslední době označovaný jako ACOS syndrom (Astma-COPD Overlap Syndrome).
Frekventní exacerbátoři jsou definováni dvěma a více exacerbacemi v uplynulém roce (určenými dle zdravotnické dokumentace nebo anamnézou), mají horší prognózu a jsou vhodní k protizánětlivé léčbě přidané k bronchodilatanciím [23].
Typickými pacienty s fenotypem overlapu astmatu a CHOPN jsou mladší kuřáci, u nichž byla stanovena diagnóza astmatu na základě pískotů, alergické rýmy, hyperreaktivity dýchacích cest a zvýšené hodnoty IgE před 40. rokem věku. Pacienti s tímto fenotypem mají ne zcela reverzibilní obstrukční ventilační poruchu, často jsou u nich přítomny eozinofily ve sputu nebo zvýšený počet eozinofilů v periferní krvi a znaky obou nemocí (astmatu i CHOPN). Jejich zastoupení v celé populaci nemocných s CHOPN se liší v různých studiích i v různých zemích. Do velké studie s názvem COPDGene Study byli zařazeni nemocní s CHOPN ve věku 45–80 let s minimálně deseti balíčkoroky (packyears) kouření a s hodnotou FEV1/FVC < 0,7 a FEV1 < 80 %. Z analyzovaných 915 nemocných jich mělo 119 před diagnózou CHOPN diagnostikováno i asthma bronchiale (13 %) ve věku pod 40 let. Tato podskupina nemocných se od ostatních pacientů s CHOPN lišila nižším věkem (61,3 vs. 64,7 roku, p = 0,0001), nižší kuřáckou zátěží (43,7 vs. 55,1 balíčkoroků, p = 0,0001). Nemocní s overlapem CHOPN a astmatu měli horší kvalitu života, významnější známky gas trappingu dle CT hrudníku, častěji trpěli těžkými AE v uplynulém roce a byli častěji frekventními exacerbátory (odds, ratio, OR: 3,55; konfidenční interval – 95% CI: 2,19,–5,75; p < 0,0001) [24]. Jiní autoři odhadují, že tento fenotyp představuje až 23 % nemocných s CHOPN ve věku 50–59 let a že jeho výskyt s narůstajícím věkem stoupá [25].
Existují i dosud pouze navržené fenotypy, u kterých zatím nebyla stanovena specifická „fenotypická“ léčba. Tak se hovoří o fenotypu „rychlých deklinátorů“, tedy nemocných, u nichž je během tří let sledování prokázán větší než průměrný pokles hodnot FEV1 (> 60 ml/rok), aniž by byl prokázán efekt „specifické“ léčby.
Podobně je tomu se „zánětlivým“ fenotypem. Ve studii Alvara Agustího a kol. [26] sledovali 6 biomarkerů (leukocyty, CRP – C-reaktivní protein, interleukiny IL-6, IL-8, fibrinogen a TNF-α – tumor nekrotizující faktor alfa) u 1755 nemocných s CHOPN z celkové populace 2164 nemocných ze studie ECLIPSE, u kterých byly vyšetřeny uvedené biomarkery, a současně u 297 kuřáků s normální spirometrií a 202 nekuřáků po dobu tří let. Zjistili, že 30 % nemocných s CHOPN nemělo výše uvedené parametry zvýšené, zatímco u 16 % byly přítomny trvalé známky systémového zánětu. Obě skupiny se nelišily v dalších ukazatelích CHOPN. Nemocní s perzistentním systémovým zánětem však měli signifikantně vyšší mortalitu ze všech příčin (13 % vs. 2 %, p < 0,001) a vyšší počet exacerbací (1,5 vs. 0,9 na rok, p < 0,001) než nemocní s CHOPN bez známek zánětu. Autoři závěrem soudí, že jejich výsledky podporují vznik nového fenotypu CHOPN nazvaného systémový zánět, který by měl být dále studován a specificky léčen.
Jiní autoři [13] navrhují vyčlenit fenotyp s podobným názvem (systémová CHOPN s četnými komorbiditami) charakterizovaný existencí komorbidit. Pro tuto podskupinu nemocných by měl být charakteristický vysoký BMI, existence diabetu mellitu, ICHS s kardiální insuficiencí, vyšší stupeň dušnosti při stejném stupni ventilační poruchy jako u nemocných bez komorbidit. Ani pro tento typ však nebyla určena specifická léčba a i nadále platí, že CHOPN se léčí stejně u osob s komorbiditami a bez komorbidit. Dalšími popsanými fenotypy jsou CHOPN s kachexií a fenotyp CHOPN bez komorbidit [13].
Indikace léčby dle fenotypů
Ve španělském doporučení pro léčbu CHOPN jsou uvedeny 4 základní fenotypy [27]: 1) infrekventní exacerbátor v kombinaci buď s chronickou bronchitidou, nebo s emfyzémem, 2) overlap astma a CHOPN, 3) častý exacerbátor s predominancí emfyzému a 4) častý exacerbátor s predominancí chronické bronchitidy.
Nemocní s častými exacerbacemi a bronchitidou trpí nadprodukcí bronchiálního sekretu, zvýšenými markery zánětu, častými infekcemi. Dle španělských autorů je u nich indikovaná bronchodilatační léčba nebo podávání IKS, dobrý efekt má selektivní inhibitor fosfodiesterázy 4 (PDE4) roflumilast. Selektovaní pacienti s frekventními exacerbacemi mohou mít prospěch i z opakovaného podání makrolidů [28] nebo z podání mukolytik, např. karbocysteinu [29].
Pokud mají nemocní s častými exacerbacemi známky plicního emfyzému, jsou indikovaní k podání dlouhodobě účinných bronchodilatancií, u některých nemocných spolu s IKS. U infrekventních exacerbátorů (ať už s bronchitidou, nebo s emfyzémem) nejsou protizánětlivé léky indikované, doporučují se bronchodilatační léky (samostatně nebo v kombinaci), u těžšího průběhu nemoci v kombinaci s theofyliny.
U fenotypu překryvu astmatu a CHOPN s existujícím eozinofilním zánětem jsou plně indikovány IKS (v kombinaci s bronchodilatancii) bez ohledu na tíži obstrukce.V článku publikovaném v European Respiratory Journal v roce 2013 navrhli autoři M. Miravitlles a kol. [23] jednoduché schéma fenotypické léčby, viz obr. 1. Jelikož však nevymezili tzv. paušální léčbu (dlouhodobě působící β2-mimetika, long-acting beta2-agonists – LABA a dlouhodobě působící anticholinergika, long-acting muscarinic antagonists – LAMA), dochází v popisu jednotlivých léčebných postupů k překrývání doporučených léků. Jiní autoři (Rabe, Wedzicha) v roce 2011 v Lancetu doporučují [30] zahájit ![Obr. 1 Návrh fenotypické léčby; podle [23] – Miravitlles, et al., 2013. CHOPN – chronická obstrukční plicní nemoc; PDE4 – fosfodiesteráza 4](https://www.remedia.cz/photo-a-29818---.jpg) u pacientů s častými exacerbacemi bronchodilatační a protizánětlivou (roflumilast) léčbu včas, tím zmenšit riziko urychlení declinu FEV1 i vzniku komorbidit. Dle výsledků studie ECLIPSE [15] mají i nemocní se středně těžkou CHOPN časté exacerbace. Ve stadiu CHOPN II podle klasifikace GOLD bylo zjištěno 22 % častých exacerbátorů a tato „fenotypová charakteristika“ zůstala neměnná během trvání studie (3 roky). Z jiných studií vyplynulo [31], že nemocní s fenotypem chronické bronchitidy, nadprodukcí sputa a častými exacerbacemi mají prospěch z podání inhibitorů PDE4, zatímco nemocní bez uvedených znaků přínos z této léčby neměli. Takové post hoc analýzy velkých prospektivních studií kontrolovaných placebem představují cestu, jak nejlépe definovat klinicky relevantní podskupiny nemocných. Následně u nich lze určit optimální léčebnou intervenci. Lze tedy předpokládat, že tento přístup pomůže vyřešit mnohá dilemata či kontroverze managementu léčby u pacientů s touto chronickou a dosud obtížně léčitelnou nemocí.
u pacientů s častými exacerbacemi bronchodilatační a protizánětlivou (roflumilast) léčbu včas, tím zmenšit riziko urychlení declinu FEV1 i vzniku komorbidit. Dle výsledků studie ECLIPSE [15] mají i nemocní se středně těžkou CHOPN časté exacerbace. Ve stadiu CHOPN II podle klasifikace GOLD bylo zjištěno 22 % častých exacerbátorů a tato „fenotypová charakteristika“ zůstala neměnná během trvání studie (3 roky). Z jiných studií vyplynulo [31], že nemocní s fenotypem chronické bronchitidy, nadprodukcí sputa a častými exacerbacemi mají prospěch z podání inhibitorů PDE4, zatímco nemocní bez uvedených znaků přínos z této léčby neměli. Takové post hoc analýzy velkých prospektivních studií kontrolovaných placebem představují cestu, jak nejlépe definovat klinicky relevantní podskupiny nemocných. Následně u nich lze určit optimální léčebnou intervenci. Lze tedy předpokládat, že tento přístup pomůže vyřešit mnohá dilemata či kontroverze managementu léčby u pacientů s touto chronickou a dosud obtížně léčitelnou nemocí.
Podobně byly získány i poznatky o efektivitě chirurgické léčby emfyzematiků pomocí resekční redukce objemu plic (LVRS, lung volume reduction surgery) i z výsledků studie NETT (National Emphysema Treatment Trial) [32]. Vyplynulo z nich, že LVRS příznivě ovlivnila přežití jen u osob s heterogenním predominantně kraniálním emfyzémem a nízkou tolerancí fyzické zátěže. Podobně se zjistilo, že nechirurgická redukce objemu plic pomocí zavedení endoluminálních chlopní je účinná pouze u osob s heterogenním emfyzémem, se zachovanou interlobární fisurou a bez kolaterální ventilace [33].Miravitlles a kol. v roce 2012 [2] uvádí, že všechny studie posuzující možnosti rozdělení pacientů s CHOPN do fenotypů došly k podobným závěrům: dělení je smysluplné, obvykle byli nemocní rozděleni do 3 až 5 podskupin (fenotypů) různou metodologií. Autor sám uzavírá, že nepochybné jsou tři fenotypy: overlap CHOPN s astmatem, fenotyp častých exacerbátorů a emfyzému s hyperinflací. Zajímavé je, že o rok později (2013) v článku [34] uvádí týž autor již 4 fenotypy: (A) infrekvenční exacerbátor s chronickou bronchitidou nebo s emfyzémem, (B) overlap CHOPN-astma, (C) frekventní exacerbátor s predominancí emfyzému a (D) frekventní exacerbátor s predominancí chronické bronchitidy. Ostatní navržené fenotypy mají své slabiny. Například rychlý deklinátor (má větší snižování FEV1/rok, než je průměr sledovaného souboru) musí být sledován minimálně dva roky (později se hovoří o třech letech), aby se mohl „decline“ správně zhodnotit, a navíc pro něj byl navržen-nalezen specifický léčebný program. Jiným možným fenotypem je chronická bronchitida. Tento fenotyp je obvykle spojen s onemocněním dýchacích cest, což může být prokázáno na CT vyšetření s vysokým rozlišením (HRCT, high-resolution computed tomography), avšak je zřejmé, že může být přítomen u všech tří „základních“ fenotypů. Proto Miravitlles a kol. považuje chronickou bronchitidu spíše za „modifikující“ faktor základních fenotypů. K navrženému „systémovému“ fenotypu (obezita, ICHS, diabetes, systémové známky zánětu) se staví rovněž skepticky. Ačkoli jistě ovlivňuje prognózu nemocných, nebylo zatím prokázáno, že uvedené komorbidity jsou přímým důsledkem či manifestací CHOPN.
Až 19–23 % velkých souborů nemocných s CHOPN patří k fenotypu overlapu astma-CHOPN. Nemocní mají větší reverzibilitu obstrukce a často eozinofilní zánětlivou infiltraci, v anamnéze lze nalézt astma/atopii a časté exacerbace, na rozdíl od pacientů s ireverzibilní obstrukcí, kde převažuje neutrofilní typ zánětu (viz výše). Významné je, že u prvně jmenovaných existují důkazy o efektivitě léčby IKS.Podle autorů tohoto sdělení není pochyb o existenci fenotypu častých exacerbátorů. Jako vhodný léčebný postup navrhují v první linii podat LABA, pokud exacerbace přetrvávají, pak přidat kombinaci LABA a IKS. Nejvíce studií posuzovalo pozitivní kombinace LABA/IKS u osob s těžkou obstrukcí s hodnotami FEV1 < 60 %, ale existují i menší studie prokazující jejich pozitivní efekt i u osob s lehčí obstrukcí [35]. Posledním nepochybným fenotypem dle Miravitllese je fenotyp emfyzému s hyperinflací. Hyperinflace může být léčebně ovlivněna bronchodilatačními léky, v případě tohoto fenotypu Miravitlles doporučuje použít oba typy dlouhodobě působících léků, tedy např. kombinaci formoterolu a tiotropia, jež je účinnější než monoterapie i než kombinace LABA/IKS. Roflumilast je indikován pouze tehdy, pokud je tento fenotyp komplikován i chronickou bronchitidou. U těchto nemocných je samozřejmě doporučována i rehabilitace zvyšující toleranci fyzické zátěže a zmírňující dušnost. U nemocných s převažujícím emfyzémem v horních částech plic s nízkou fyzickou výkonností prokázala chirurgická léčba emfyzému metodou LVRS snížení mortality.
Fenotypy a léčba CHOPN u nás
Podle českého doporučení diagnostiky a léčby stabilní CHOPN [36] rozlišujeme níže uvedené fenotypy, viz tab. 2. V českém doporučení pro léčbu stabilní CHOPN je uveden postup rozdělený do čtyř logických kroků, viz obr. 2. Prvním krokem je odstranění rizikových faktorů (zejména kouření). Druhým je tzv. léčba paušální, která je určena všem symptomatickým nemocným. Vedle léčby plicního onemocnění (LAMA, LABA a jejich kombinace a rehabilitace)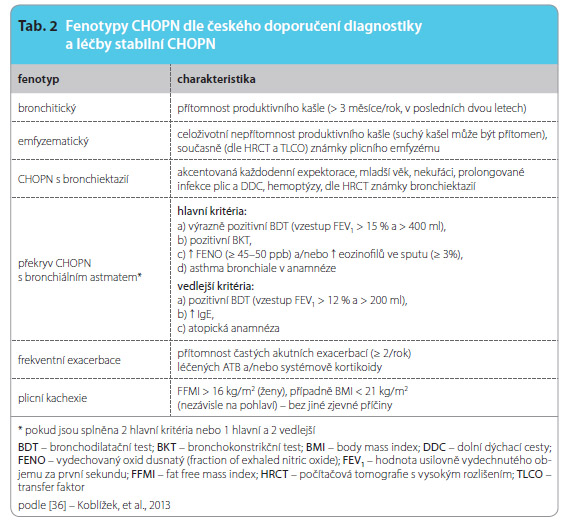 zahrnuje i léčbu veškerých přítomných komorbidit, z nichž jsou nejčastější nemoci kardiovaskulární, osteoporóza, vředová choroba gastroduodenální, deprese a syndrom spánkové apnoe. Teprve třetí krok si všímá odlišností fenotypů a odlišností léčby u nich. Do čtvrtého kroku patří léčba respirační insuficience a terminálních stadií onemocnění. Fenotypickou léčbu (krok 3) dle doporučení pro diagnostiku a léčbu
zahrnuje i léčbu veškerých přítomných komorbidit, z nichž jsou nejčastější nemoci kardiovaskulární, osteoporóza, vředová choroba gastroduodenální, deprese a syndrom spánkové apnoe. Teprve třetí krok si všímá odlišností fenotypů a odlišností léčby u nich. Do čtvrtého kroku patří léčba respirační insuficience a terminálních stadií onemocnění. Fenotypickou léčbu (krok 3) dle doporučení pro diagnostiku a léčbu ![Obr. 2 Paušální léčba CHOPN dle Českého doporučení diagnostiky a léčby stabilní CHOPN; podle [36] – Koblížek, et al., 2013. FEV1 – hodnota usilovně vydechnutého objemu za první sekundu; CHOPN – chronická obstrukční plicní nemoc; LABA – dlouhodobě působící β2-mimetika; LAMA – dlouhodobě působící anticholinergika; mMRC – modifikovaná stupnice dle Medical Research Council; SABA – krátkodobě působící β2-mimetika; SAMA – krátkodobě působící anticholinergika](https://www.remedia.cz/photo-a-29820---.jpg) stabilní CHOPN České pneumologické a ftizeologické společnosti [36] shrnuje tab. 3.
stabilní CHOPN České pneumologické a ftizeologické společnosti [36] shrnuje tab. 3.
Pro nemocné s častým výskytem AE je vhodné do léčby zahrnout kombinační léčbu LABA s IKS, např. fixní kombinace salmeterol/flutikason, formoterol/budesonid nebo formoterol/beklomethason a další možné kombinace dostupných přípravků, tzv. volné kombinace, včetně využití ultradlouze působících LABA (U-LABA).
Druhým fenotypem s prokazatelným přínosem kombinační léčby (LABA + IKS) je překryv CHOPN s br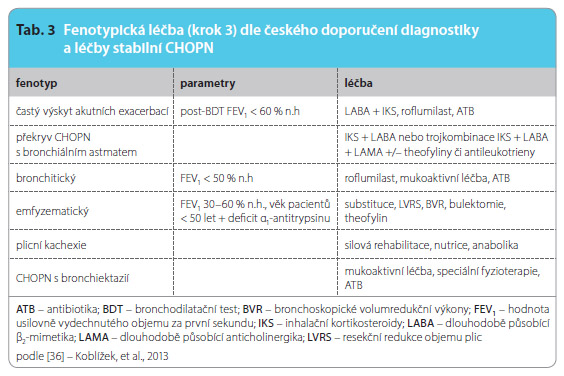 onchiálním astmatem – kombinace LABA a IKS je zde léčbou první volby. Léčebné doporučení pro tento klinický fenotyp pak jako další léčbu následně doporučuje trojkombinaci IKS + LABA + LAMA. Dále může být farmakoterapie overlapu CHOPN a bronchiálního astmatu doplněna rovněž o theofyliny s dlouhodobým účinkem, případně antileukotrieny.
onchiálním astmatem – kombinace LABA a IKS je zde léčbou první volby. Léčebné doporučení pro tento klinický fenotyp pak jako další léčbu následně doporučuje trojkombinaci IKS + LABA + LAMA. Dále může být farmakoterapie overlapu CHOPN a bronchiálního astmatu doplněna rovněž o theofyliny s dlouhodobým účinkem, případně antileukotrieny.
U pacientů se současnou přítomností bronchitického fenotypu spolu s fenotypem frekventních exacerbací se v případě poklesu FEV1 na 50 % n.h. a méně ukazuje jako vhodná perorální léčba roflumilastem – selektivním inhibitorem PDE4. Mladší nemocní (obvykle < 50 let) trpící emfyzematickým fenotypem s FEV1 s hodnotou FEV1 30–60 % n.h. a prokazatelně bez aktivního nikotinismu s těžkou formou deficitu proteinázového inhibitoru α1-antitrypsinu podmíněnou homozygotní mutací Pi*ZZ, případně Pi*null, by měli být léčeni pravidelnou (intravenózní) substituční léčbou.
U nemocných s pokročilým fenotypem plicní kachexie je doporučena nutriční podpora (nejčastěji perorální). Vhodné je kombinovat podání nutriční podpory současně s plicní rehabilitací. Anabolika jsou vyhrazena pro případy snížené sérové koncentrace testosteronu. Terapie emfyzematických nemocných s přítomností velkých bul (pokud souhrnný rozsah bulózního postižení dosahuje jedné třetiny objemu hemithoraxu) je možná pomocí provedení resekce těchto bul – tzv. bulektomie.
Pacienti s heterogenním typem plicního emfyzému postihujícím apikální partie plic jsou indikováni k provedení LVRS, a to zejména v přítomnosti plicní hyperinflace o hodnotě reziduálního objemu, RV > 200 % n.h. Indikační kritéria pro LVRS jsou následující: věk ≤ 75 let, symptomy dušnosti mMRC 3–4, absence aktivního nikotinismu, emfyzematický fenotyp CHOPN s horní predominancí (jednostranně či oboustranně), nízká tolerance zátěže, avšak nikoliv úplná inaktivita (předoperační 6minutový test chůzí k hodnocení fyzické zdatnosti nemocných, 6-minute walk distance – 6MWD ≥ 140 m), FEV1 20–45 % n.h., TLCO ≥ 20 % n.h., arteriální parciální tlak CO2, resp. O2 PaCO2 ≤ 8 kPa, PaO2 ≥ 6 kPa, BMI 16–31 kg/m2. LVRS je efektivní metoda, která zlepšuje funkční parametry, příznivě ovlivňuje kvalitu života, zvyšuje toleranci zátěže, a dokonce (u pacientů s nízkou tolerancí zátěže) prodlužuje život. U pacientů s fenotypem plicního emfyzému, kteří nejsou schopni a/nebo ochotni podstoupit výše zmíněné chirurgické metody léčby (bulektomii či LVRS), můžeme indikovat bronchoskopické volumredukční výkony (BVR).
Paušální dlouhodobé podávání antibiotik u nemocných s CHOPN zatím nemá podporu velkých randomizovaných studií a stále vyvolává obavy mikrobiologů z nárůstu rezistence. Terapie antibiotiky však může být přínosná u tří fenotypů: u nemocných s nadměrnou produkcí hlenu – bronchitický fenotyp, u osob s častými exacerbacemi a také u fenotypu CHOPN s bronchiektaziemi. Pozitivní data máme ze studií s použitím makrolidů, zejména azithromycinu, méně klarithromycinu. Existují i práce s použitím respiračních chinolonů – moxifloxacinu.
Podobná nejistota panuje v podávání mukoaktivní medikace (erdostein, N-acetylcystein, karbocystein). Zatím lze dlouhodobou aplikaci mukoaktivní medikace zvážit pro symptomatické osoby se stejnými fenotypy, jako byly uvedeny v předchozím odstavci: bronchitický fenotyp, frekventní exacerbace, CHOPN s bronchiektaziemi. Zejména pro fenotyp CHOPN s bronchiektaziemi je nutná pravidelná domácí fyzioterapie s použitím pomůcek typu flutter. Pacienti s bronchiektaziemi také často trpí hemoptýzou, v případě významnějšího krvácení je metodou první volby provádění angiografické léčby pomocí embolizace bronchiálních tepen v postižené lokalitě.
Závěr
Z výše uvedeného vyplývá, že jsme svědky změny v chápání CHOPN. Od monolitu jediné nemoci hodnocené a léčené podle jednoduchého parametru FEV1 přecházíme k uznání heterogenity „syndromu CHOPN“ se všemi důsledky této změny. Jde o poznání a respektování různých genetických základů, různých schopností (či neschopností) jedince ubránit se rizikovým faktorům i vlivům zevního prostředí, či na ně patologicky reagovat. Jde o adekvátní reflexi všech odlišností mezi nemocnými s CHOPN a vytvoření sofistikovaných postupů (analýz) vedoucích k přesnému vymezení množin nemocných (fenotypů) s CHOPN. Cílem, ostatně jako vždy v medicíně, musí být zlepšení komplexní péče o pacienty s touto nemocí. Vedle zpřesnění a zrychlení diagnostiky a upřesnění prognózy je hlavním úkolem poskytnout podskupinám nemocných cílenou optimální léčbu dle úrovně současného poznání a dosaženého stupně vývoje léčebných metod. Lze si jen přát, aby vývoj pokračoval a tento „mezistupeň“, tedy fenotypické dělení nemocných s určováním fenotypické léčby, se dále rozvíjel a postupně přecházel na ještě více personalizovanou, cílenou léčbu.
Práce byla podpořena projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL).
Seznam použité literatury
- [1] Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease, revised 2011, dostupné na http://www.goldcopd.org/ (navštíveno 20. 7. 2014)
- [2] Miravitlles M, Calle M, Soler-Cataluña JJ. Clinical Phenotypes of COPD: Identification, Definition and Implications for Guidelines. Arch Bronchopneumol 2012; 48: 86–98.
- [3] Agustí A. Phenotypes and Disease Characterization in Chronic Obstructive Pulmonary Disease Toward the Extinction of Phenotypes? Ann Am Thorac Soc 2013; 10 (Suppl.) S125–S130.
- [4] Burgel PR, Paillasseur JL, Roche N. Identification of Clinical Phenotypes Using Cluster Analyse in COPD Patients with Multiple Comorbidities. BioMed Research International Volume 2014, Article ID 420134, 9 pages http://dx.doi.org/10.1155/2014/420134
- [5] Burrows B, Fletcher CM, Heard BE, et al. The emphysematous and bronchial types of chronic airways obstruction. A clinicopathological study of patients in London and Chicago. Lancet 1966; 287: 830–835.
- [6] Karon EH, Koeslche GA, Fowler WS. Chronic obstructive pulmonary disease in young adults. Proceedings of the Staff Meetings of the Mayo Clinic 1960; 35: 307–316.
- [7] Burrows B. The bronchial and emphysematous types of chronic obstructive lung disease in London and Chicago. Aspen Emphysema Conference 1968; 9: 327–338.
- [8] Petty TL. The history of COPD. Int J Chron Obstruct Pulm Dis 2006; 1: 3–14.
- [9] Han MK, Agustí A, Calverley PM, et al. Chronic obstructive pulmonary disease phenotypes: the future of COPD. Am J Respir Crit Care Med 2010; 182: 598–604.
- [10] Burgel PR, Paillasseur JL, Peene B, et al. Two distinct Chronic Obstructive Pulmonary Disease (COPD) phenotypes are associated with high risk of mortality. PLoS ONE 2012; 7: Article IDe51048.
- [11] Burgel PR, Paillasseur JL, Caillaud D, et al. Clinical COPD phenotypes: a novel approach using principal component and cluster analyse. Eur Respir J 2010; 36: 531–539.
- [12] Burgel PR, Roche N, Paillasseur JL, et al. Clinical COPD phenotypes identified by cluster analysis: validation with mortality. Eur Respir J 2012; 40: 495–496.
- [13] Garcia-Aymerich J, Gómez FP, Benet M, et al. Identification and prospective validation of clinically relevant Chronic Obstructive Pulmonary Disease (COPD) subtypes. Thorax 2011; 66: 430–437.
- [14] Vanfleteren LE, Spruit MA, Groenen M, et al. Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2013; 187: 728–735.
- [15] Vestbo J, Anderson W, Coxson HO, et al. Evaluation of COPD longitudinally to identify predictive surrogate end-points (ECLIPSE). Eur Respir J 2008; 31: 869–873.
- [16] Barker BL, Brightling ChE. Phenotyping the heterogeneity of chronic obstructive pulmonary disease. Clin Sci 2013; 124: 371–387.
- [17] Stolk J, Putter Bakker HM, et al. Progression parameters for emphysema: a clinical investigation. Respir Med 2007; 101: 1924–1930.
- [18] Mathew L, Kirby M, Etemad-Rezai R, et al. Hyperpolarized 3He magnetic resonance imaging: preliminary evaluation of phenotyping potential in chronic obstructive pulmonary disease. Eur J Radiol 2011; 79: 140–146.
- [19] Lomas DA, Silverman EK, Edwards LD, et al. Serum surfactant protein D is steroid sensitive and associated with exacerbations of COPD. Eur Respir J 2009; 34: 95–102.
- [20] Goh F, Shaw JG, Santiagu M, et al. Personalizing and targeting therapy for COPD – the role of molecular and clinical biomarkers. Expert Rev Respir Med 2013; 7: 593–605.
- [21] Pillai GS, Kong X, Edwards LD, et al., and ECLIPSE and ICGN Investigators: Loci Identified by Genome-wide Association Studies Influence Different Disease-related Phenotypes in Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2010; 182: 1498–1505.
- [22] McCloskey SC, Pate BD, Hinchliffe SJ, et al. Siblings of patients with severe chronic obstructive pulmonary disease have a significant risk of airflow obstruction. Am J Respir Crit Care Med 2001; 164: 1419–1424.
- [23] Miravitlles M, Soler-Cataluña JJ, Calle M, Soriano JB. Treatment of COPD by clinical phenotypes: putting old evidence into clinical practice. Eur Respir J 2013; 41: 1252–1256.
- [24] Hardin M, Silverman EK, Barr RG, et al. The clinical features of the overlap between COPD and asthma. Respir Res 2011; 12: 127.
- [25] Soriano JB, Davis KJ, Coleman B, et al. The proportional Venn diagram of obstructive lung disease: two approximations from the United States and the United Kingdom. Chest 2003; 124: 474–481.
- [26] Agustí A, Edwards LD, Rennard SI, et al. Persistent systemic inflammation is associated with poor clinical outcomes in COPD: a novel phenotype. PLoS ONE 2012; 7: e37483.
- [27] Miravitlles M, Soler-Cataluña JJ, Calle M, et al. Spanish COPD guidelines (GesEPOC). Pharmacological treatment of stable COPD. Arch Bronchopneumol 2012; 48: 247–257.
- [28] Albert RK, Connett J, Bailey WC, et al. Azithromycin for prevention of exacerbations of COPD. N Engl J Med 2011; 365: 689–698.
- [29] Zheng JP, Kang J, Juany SG. Effect of carbocisteine on acute exacerbation of chronic obstructive pulmonary disease (PEACE Study): a randomized placebo-controlled study. Lancet 2008; 371: 2013–2018.
- [30] Rabe KF, Wedzicha JA. Chronic Obstructive Pulmonary Disease, Controversies in treatment of chronic obstructive pulmonary disease. Lancet 2011; 378: 1038–1047.
- [31] Fabbri LM, Calverley PM, Izquierdo-Alonso JL, et al., for the M2-127 and M2-128 study groups. Roflumilast in moderate-to-severe chronic obstructive pulmonary disease treated with longacting bronchodilators: two randomised clinical trials. Lancet 2009; 374: 695–703.
- [32] Criner GJ, Cordova F, Sternberg AL, Martinez FJ. The National Emphysema Treatment Trial (NETT) Part II: Lessons learned about lung volume reduction surgery. Am J Respir Crit Care Med 2011; 184: 881–893.
- [33] Sciurba FC, Ernst A, Herth FJ, et al. A randomized study of endobronchial valves for advanced emphysema. N Engl J Med 2010; 363: 1233–1244.
- [34] Miravitlles M, Soler-Cataluña JJ, Calle M, et al. A new approach to grading and treating COPD based on clinical phenotypes: summary of the Spanish COPD. Prim Care Respir J 2013; 22: 117–121.
- [35] Calverley PM, Anderson JA, Celli B, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007; 356: 775–789.
- [36] Koblížek V, Chlumský J, Zindr V, et al. Doporučený postup ČPFS pro diagnostiku a léčbu stabilní CHOPN. aktualizováno 3. 6. 2013, dostupné na www.pneumologie.cz.
- [37] Altenburg WA, de Greef MH, ten Hacken NH, Wempe JB. A better response in exercise capacity after pulmonary rehabilitation in more severe COPD patients. Respir Med 2012; 106: 694–700.