Glukuretika (inhibitory SGLT2, glifloziny) v léčbě diabetu
Inhibice renálního transportu glukózy vedoucí k indukci glykosurie je terapeutickým přístupem, který se datuje již do období počátku 80. let minulého století. Teprve v posledních letech dochází s vývojem a zkoumáním nových selektivních inhibitorů glukózových transportérů SGLT2 k renesanci tohoto způsobu léčby. Využití glykosurie v léčbě diabetu prostřednictvím inhibice transportérů SGLT2 (sodium glucose co-transporter) představuje zcela nový přístup k léčbě diabetu 2. typu. Přitažlivost nové farmakologické skupiny glukuretik či gliflozinů využívající tohoto mechanismu spočívá v jednoduchosti a univerzálnosti. Léčba účinkuje bez ohledu na vyvolávající příčinu hyperglykemie, tedy bez ohledu na míru inzulinové rezistence či poruchy sekrece inzulinu. Článek přináší shrnutí fyziologie a patofyziologie renálního transportu glukózy, přehled vyvíjených inhibitorů SGLT2 a výsledků dosud zveřejněných experimentálních a klinických studií.
Antidiabetická neboli antihyperglykemická léčba se často z didaktických důvodů dělí na inzulin substituující (sekretagoga a inzulin) a inzulin senzitizující terapii (metformin a glitazony). S nedávným příchodem inkretinové léčby (agonistů GLP-1 a inhibitorů DPP-4 – dipeptidylpeptidáza 4) se spektrum působení antidiabetik navíc rozšířilo o terapeutickou možnost regulace pocitu sytosti, zpomalení vstřebávání sacharidů ze zažívacího traktu a inhibici sekrece glukagonu z α-buněk pankreatu. Role ledvin v regulaci glukózové homeostázy, či dokonce renální uplatnění v léčbě diabetu dlouhá léta nebyly zmiňovány. Přesto nová, perspektivní léková skupina gliflozinů čili inhibitorů transportérů SGLT2 (sodium glucose co-transporter) s sebou přináší zcela unikátní a dosud nepoužívaný léčebný princip, který staví ledviny do centra pozornosti.
Glifloziny (podle hlavních představitelů dapagliflozinu, sergliflozinu, canagliflozinu a dalších) totiž neovlivňují insuficientní sekreci inzulinu ani jeho oslabené působení na periferii. Tato glukuretika, která zbavují organismus nadbytečné glukózy prostřednictvím močových cest (podobně jako to činí diuretika v případě vody a minerálů), a sice zamezením aktivní reabsorpce glukózy v ledvinách, vyvolávají arteficiální glykosurii a redukují tak hlavní nežádoucí symptom diabetu – hyperglykemii.
![Obr. 1 Zlověstný oktet patofyziologických mechanismů diabetu; podle [74] – DeFronzo, 2009.](https://www.remedia.cz/photo-a-28277---.jpg) S ohledem na škodlivé působení glukotoxicity se přesto lze domnívat, že i „pouhé“ snížení glykemie, které v tomto případě není primárně provázeno modulací patofyziologických příčin (inzulinové deficience a rezistence), zlepší výkonnost β-buňky a zvýší inzulinovou senzitivitu. Vždyť snížení hyperglykemie, a tím léčba a prevence akutních symptomů i chronických cévních komplikací je klíčovým cílem a snažením celé diabetologie.
S ohledem na škodlivé působení glukotoxicity se přesto lze domnívat, že i „pouhé“ snížení glykemie, které v tomto případě není primárně provázeno modulací patofyziologických příčin (inzulinové deficience a rezistence), zlepší výkonnost β-buňky a zvýší inzulinovou senzitivitu. Vždyť snížení hyperglykemie, a tím léčba a prevence akutních symptomů i chronických cévních komplikací je klíčovým cílem a snažením celé diabetologie.
V roce 2009 profesor DeFronzo rozšířil tradiční triumvirát patofyziologických mechanismů, které byly tvořeny β-buňkou, játry a svalem a vedly k rozvoji diabetu, na zlověstný oktet; ten kromě dalších faktorů (viz obr. 1) zahrnuje i zvýšenou reabsorpci glukózy v ledvinách [74]. DeFronzo už tehdy dobře věděl, že se světlo světa chystá uzřít právě tato skupina antidiabetik, jejímž cílovým orgánem působení jsou právě ledviny, vždyť sám stál v 80. letech dvacátého století u zrodu myšlenky na využití tohoto orgánu při léčbě diabetu.
Glykosurie jako léčba?
Na první pohled se může jevit myšlenka cíleného indukování glykosurie přinejmenším jako podivná. Glykosurie, která až dosud byla jen nespolehlivým diagnostickým markerem a symptomem neléčeného či dekompenzovaného diabetu, má nyní být léčebným prostředkem? Není divu, že tento terapeutický princip vyvolává rozpaky v řadách nefrologů i diabetologů obávajících se zejména důsledků chronické glykosurie na incidenci mykotických infekcí močových cest a genitálního ústrojí a na progresi chronického renálního selhání. Dosavadní výsledky klinického testování však naštěstí tyto obavy nepotvrzují.
Zodpovědět otázky potenciální škodlivosti chronické glykosurie může pomoci i přirozeně se vyskytující model inhibice renální reabsorpce glukózy způsobený mutací genu pro glukózové transportéry SGLT2, který se obvykle označuje jako familiární renální glykosurie. Mezi základní charakteristiky tohoto asymptomatického onemocnění patří přítomnost glykosurie (v rozmezí několika gramů až více než 100 g denně) při normálních plazmatických koncentracích glukózy, nepřítomnost tubulární dysfunkce a fakt, že postižení jedinci jsou obvykle štíhlí, hypovolemie a hypoglykemie se vyskytují ojediněle, histologický nález i funkční parametry ledvin jsou normální. Nedochází zde ani ke zvýšené incidenci chronické renální insuficience, uroinfekcí či diabetu.
Renální glukostat
Za normálních okolností reabsorbují ledviny veškerou glukózu přefiltrovanou do primární moči, což je vzhledem k nepostradatelnému postavení glukózy v intermediárním metabolismu logické. V ledvinách ovšem chybí regulační mechanismus, který by umožnil zbavit se glukózy v případě, že je přebytečná.
![Obr. 2 Reabsorpce glukózy prostřednictvím SGLT v ledvinách; podle [48] – Wilding, 2008.](https://www.remedia.cz/photo-a-28278---.jpg) Množství glukózy, které se denně reabsorbuje z primární moči, do níž volně prochází glomerulární filtrací, činí u zdravého jedince obvykle 160–180 gramů. Většina glukózy (90 %) je následně reabsorbována v segmentu S1 proximálního tubulu ledvin prostřednictvím transportéru SGLT2 s vysokou kapacitou a nízkou afinitou. Reabsorpci zbylých 10 % glukózy obstarává v segmentu S3 transportér SGLT1 s nízkou kapacitou a vysokou afinitou (obr. 2). Oba zmíněné transportéry pracují na principu kotransportu sodíku a glukózy z moči do buňky, na který navazuje glukózový transportér typu GLUT-2, jenž zabezpečuje návrat glukózy do krevního oběhu. Sodík přefiltrovaný do buněk společně s glukózou je odváděn pomocí Na+/K+ pumpy závislé na ATP (obr. 3). Rozdíl mezi SGLT1 a SGLT2 spočívá kromě rozdílné kapacity a afinity k substrátu i v lokalizaci a specificitě vůči glukóze (viz tab. 1). Zatímco transportér SGLT2 se nachází výlučně v ledvinách a transportuje pouze glukózu, vyskytují se transportéry SGLT1 i v oblasti střeva a umožňují transportovat kromě glukózy i galaktózu.
Množství glukózy, které se denně reabsorbuje z primární moči, do níž volně prochází glomerulární filtrací, činí u zdravého jedince obvykle 160–180 gramů. Většina glukózy (90 %) je následně reabsorbována v segmentu S1 proximálního tubulu ledvin prostřednictvím transportéru SGLT2 s vysokou kapacitou a nízkou afinitou. Reabsorpci zbylých 10 % glukózy obstarává v segmentu S3 transportér SGLT1 s nízkou kapacitou a vysokou afinitou (obr. 2). Oba zmíněné transportéry pracují na principu kotransportu sodíku a glukózy z moči do buňky, na který navazuje glukózový transportér typu GLUT-2, jenž zabezpečuje návrat glukózy do krevního oběhu. Sodík přefiltrovaný do buněk společně s glukózou je odváděn pomocí Na+/K+ pumpy závislé na ATP (obr. 3). Rozdíl mezi SGLT1 a SGLT2 spočívá kromě rozdílné kapacity a afinity k substrátu i v lokalizaci a specificitě vůči glukóze (viz tab. 1). Zatímco transportér SGLT2 se nachází výlučně v ledvinách a transportuje pouze glukózu, vyskytují se transportéry SGLT1 i v oblasti střeva a umožňují transportovat kromě glukózy i galaktózu.
![Obr. 3 Princip reabsorpce glukózy transportéry SGLT1 a SGLT2; volně podle [18] – Hediger, Rhoads, 1994.](https://www.remedia.cz/photo-a-28279---.jpg) V případě diabetu dochází k dosažení a překročení tzv. renálního prahu, což je glykemie, při níž je již dosaženo maximální tubulární reabsorpční kapacity ledvin pro glukózu (TmG) a objevuje se glykosurie. Hodnota TmG je u jedince konstantní a činí průměrně 375 mg/min u mužů (1,73 m2) a 300 mg/min u žen (1,73 m2), což odpovídá plazmatické glykemii 16,7 mmol/l. Ve skutečnosti je renální práh vysoce variabilní a glykosurie se může objevit už
V případě diabetu dochází k dosažení a překročení tzv. renálního prahu, což je glykemie, při níž je již dosaženo maximální tubulární reabsorpční kapacity ledvin pro glukózu (TmG) a objevuje se glykosurie. Hodnota TmG je u jedince konstantní a činí průměrně 375 mg/min u mužů (1,73 m2) a 300 mg/min u žen (1,73 m2), což odpovídá plazmatické glykemii 16,7 mmol/l. Ve skutečnosti je renální práh vysoce variabilní a glykosurie se může objevit už 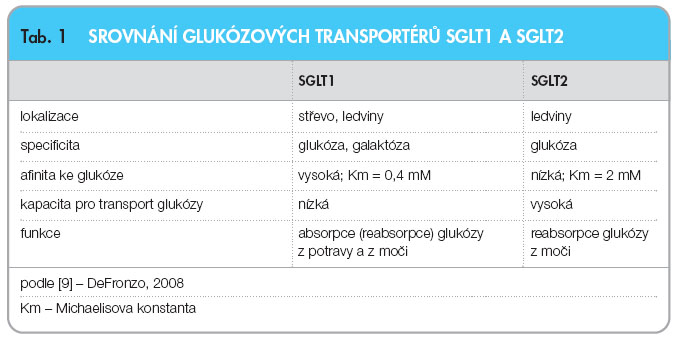 při hodnotách glykemie 10–12 mmol/l. Příčinou tohoto jevu je heterogenita jednotlivých nefronů (rozdíl mezi povrchově a hlouběji uloženými nefrony ve funkčnosti, afinitě ke glukóze apod.). Neexistuje tedy exaktní zlomový bod, kdy tzv. pohár přeteče, ale určitá přechodná fáze – zkosení křivky vyjadřující závislost glykemie na míře reabsorpce glukózy a její exkrece do moči (graf 1).
při hodnotách glykemie 10–12 mmol/l. Příčinou tohoto jevu je heterogenita jednotlivých nefronů (rozdíl mezi povrchově a hlouběji uloženými nefrony ve funkčnosti, afinitě ke glukóze apod.). Neexistuje tedy exaktní zlomový bod, kdy tzv. pohár přeteče, ale určitá přechodná fáze – zkosení křivky vyjadřující závislost glykemie na míře reabsorpce glukózy a její exkrece do moči (graf 1).
![Graf 1 Závislost renální reabsorpce/exkrece glukózy na hladině plazmatické glukózy; podle [9] – DeFronzo, 2008.](https://www.remedia.cz/photo-a-28281---.jpg) Pozoruhodné bylo zjištění, že u zvířecích modelů diabetu 1. i 2. typu, ale i u lidí s diabetem dochází paradoxně ke kompenzačnímu zvýšení renálního prahu pro glukózu (k nárůstu TmG), přestože je glukózy v těle nadbytek. Příčinou tohoto jevu je zvýšené množství mRNA kódující glukózové transportéry SGLT1/SGLT2 a GLUT-2 i zmnožení samotných transportérů, které poprvé prokázal Mogensen u diabetiků 1. i 2. typu v kulturách buněk proximálních tubulů ledvin získaných z moči. Naopak se zdá, že aktivita transportního systému SGLT1/2 nesouvisí s mírou glukoneogeneze probíhající v ledvinách.
Pozoruhodné bylo zjištění, že u zvířecích modelů diabetu 1. i 2. typu, ale i u lidí s diabetem dochází paradoxně ke kompenzačnímu zvýšení renálního prahu pro glukózu (k nárůstu TmG), přestože je glukózy v těle nadbytek. Příčinou tohoto jevu je zvýšené množství mRNA kódující glukózové transportéry SGLT1/SGLT2 a GLUT-2 i zmnožení samotných transportérů, které poprvé prokázal Mogensen u diabetiků 1. i 2. typu v kulturách buněk proximálních tubulů ledvin získaných z moči. Naopak se zdá, že aktivita transportního systému SGLT1/2 nesouvisí s mírou glukoneogeneze probíhající v ledvinách.
Inhibitory SGLT2
Florizin
Prvním známým přirozeně se vyskytujícím neselektivním inhibitorem SGLT1 a SGLT2 je florizin, který byl již v roce 1835 izolován z kořene ovocných stromů (jabloň a třešeň) chemiky ve Francii. Chemický strukturní vzorec viz obr. 4. Původně se látka využívala jako tonikum a antimalarikum, později zejména experimentálně v biochemii a fyziologii. Florizin představuje neselektivní inhibitor glukózových transportérů SGLT, způsobuje tedy blokádu reabsorpce glukózy v proximálních tubulech ledvin i v tenkém střevě. Vzhledem k této neselektivitě je farmakoterapeutické využití florizinu u lidí 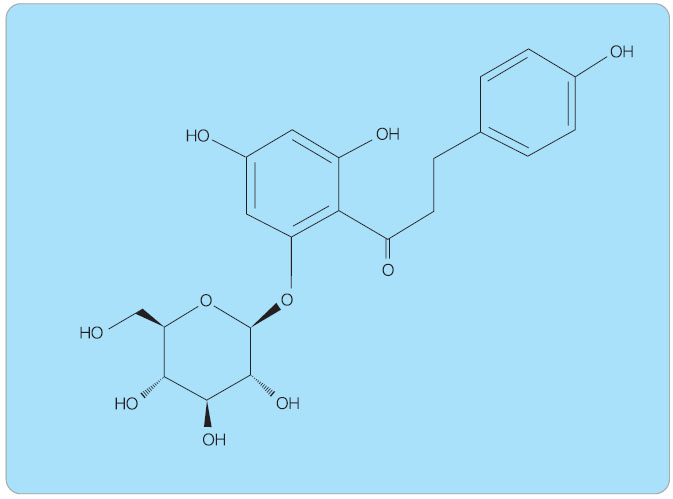 limitováno (způsobuje malabsorpci glukózy a galaktózy), jeho aktivní metabolit floretin navíc inhibuje glukózový transportér GLUT-1.
limitováno (způsobuje malabsorpci glukózy a galaktózy), jeho aktivní metabolit floretin navíc inhibuje glukózový transportér GLUT-1.
Experimenty z počátku 20. století prokázaly normalizaci glykemie po podání florizinu u zvířat, jimž byla provedena 90% pankreatektomie. Teprve až práce DeFronza a Rossettiho [41, 42] z 80. let 20. století položily základní kámen, „proof of concept“, myšlenky využití inhibice SGLT2 v léčbě diabetu. V těchto clampových studiích došlo po 4–5týdenním podávání florizinu pankreatektomovaným diabetickým potkanům k normalizaci jak lačné, tak postprandiální glykemie, přičemž po ukončení substituce florizinem se oba parametry znovu vrátily k původním hodnotám. Zanedbatelná není ani skutečnost, že florizin prokázal příznivý účinek i na inzulinovou senzitivitu (zvýšená translokace glukózových transportérů GLUT-4 k buněčné membráně), snížil jaterní produkci glukózy a vedl ke zlepšení sekreční funkce β-buňky (obnovení první i druhé fáze sekrece inzulinu) posuzované na základě infuze argininu následované hyperglykemickým clampem. V 90. letech 20. století se na základě klonování a biochemického modelování molekuly florizinu objevilo hned několik nadějných analog této látky (dapagliflozin, canagliflozin, ASP1941, BI10773, YM-543), z nichž některá se zdárně posunula do stadia klinického testování.
Dapagliflozin
Dapagliflozin, selektivní inhibitor SGLT2, vykazuje až 1000násobně vyšší selektivitu k SGLT2 než k SGLT1. Je prvním ze skupiny gliflozinů, který se může opřít o publikované výsledky z klinických studií fáze II a III. Chemický 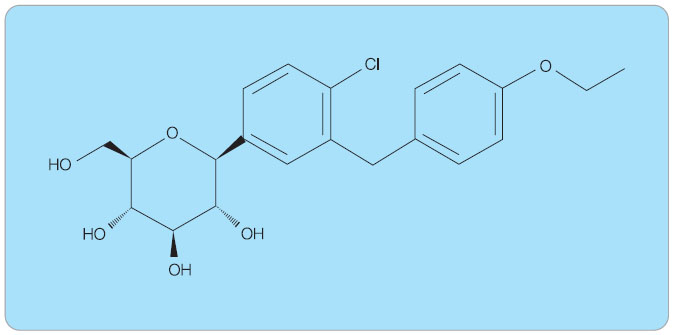 strukturní vzorec viz obr. 5.
strukturní vzorec viz obr. 5.
Již v roce 2007 byly prezentovány výsledky krátkodobých klinických studií, jež prokázaly schopnost dapagliflozinu v dávce 5–100 mg/den zvýšit exkreci glukózy ledvinami u zdravých jedinců a osob s diabetem 2. typu na hodnotu 45–80 g za 24 hodin. Krátkodobé 14denní podávání všech testovaných dávek dapagliflozinu vedlo k signifikantnímu poklesu glykemie nalačno (FPG – fasting plasma glucose) o 14,5 % (p < 0,05; 5 mg dapagliflozinu), 17,3 % (p < 0,05; 25 mg dapagliflozinu), resp. 21,9 % (p < 0,001; 100 mg dapagliflozinu). Ve skupině léčené placebem a/nebo metforminem činil pokles glykemie nalačno 6,3 % [30–33].
V další tříměsíční studii byla srovnávána monoterapie dapagliflozinem s placebem i s dávkou 1,5 g metforminu denně u 389 dosud neléčených pacientů s diabetem 2. typu. Zařazení pacienti měli recentně diagnostikovaný diabetes 2. typu, průměrný věk 58 let a vstupní glykovaný hemoglobin 7,7–8,0 % (DCCT – Diabetes Control and Complications Trial). Během 12 týdnů trvání studie byl ve skupině léčené dapagliflozinem zaznamenán na dávce závislý pokles glykemie nalačno o 0,6–1,4 mmol/l i snížení HbA1c o 0,37–0,72 %. Dle očekávání vedla léčba dapagliflozinem k významné glykosurii (51,8–85 g/den) ve srovnání s placebem (5,7 g/den) nebo s metforminem (5,6 g/den). I přes značný vzestup exkrece glukózy a s tím spojený zvýšený denní objem moči (o 107 ml při podávání 2,5 mg dapagliflozinu a o 470 ml při dávce 50 mg dapagliflozinu) se pouze u 1,4 % pacientů vyskytla polyurie a u žádné ze sledovaných osob nebyla zaznamenána nykturie. Ve všech větvích studie, kde byli pacienti léčeni prostřednictvím dapagliflozinu, bylo navíc dosaženo snížení tělesné hmotnosti o 2,5–3,4 kg, zatímco při podávání placeba činila redukce hmotnosti 1,2 kg a při terapii metforminem 1,7 kg [34–36].
Další studie zkoumala účinek dapagliflozinu po jeho přidání ke stávající léčbě inzulinem (dávka inzulinu byla redukována na 50 %). Během 12 týdnů vedlo podávání 10 nebo 20 mg dapagliflozinu ke zlepšení HbA1c o 0,70 %, resp. o 0,78 %, a k poklesu FPG o 0,83 mmol/l, resp. o 1,5 mmol/l. Bez zajímavosti není ani snížení hmotnosti při jednotlivých dávkách dapagliflozinu o 4,5 kg, resp. o 4,3 kg. Nežádoucí účinky byly srovnatelné s placebem, přesto bylo ve skupině léčené 20 mg dapagliflozinu zaznamenáno více genitálních infekcí [48].
Jiná studie testovala dapagliflozin u 534 dospělých pacientů s diabetem 2. typu neuspokojivě kompenzovaných pomocí metforminu podávaného v dávce nejméně 1500 mg. Po 24 týdnech podávání dapagliflozinu v dávce 2,5–10 mg 1krát denně došlo ve srovnání s placebem v závislosti na dávce k poklesu HbA1c o 0,37–0,54 %. Výskyt hypoglykemie se v placebové ani dapagliflozinové větvi nelišil. Výskyt genitálních infekcí byl opět mírně vyšší v dapagliflozinové skupině ve srovnání s placebem (8–13 % vs. 5 %). Na druhé straně nedošlo během sledování k žádným změnám renálních funkcí ani k závažným nežádoucím příhodám. Opět byl pozorován v závislosti na dávce dapagliflozinu pokles hmotnosti, a to o 2,2–2,9 kg (vs. pokles o 0,9 kg v placebové skupině) [1].
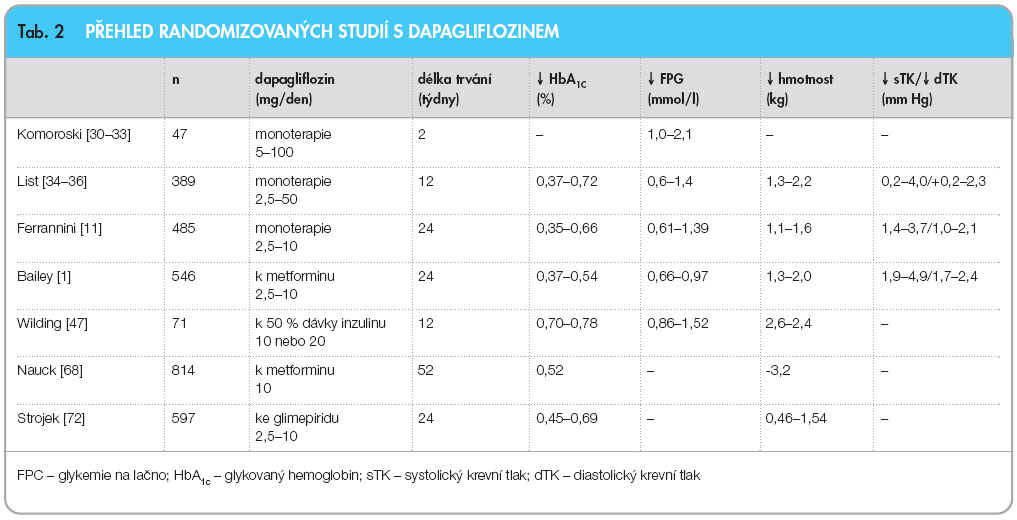 Prozatím největší a nejdéle probíhající studie s dapagliflozinem trvala 52 týdnů a srovnávala účinnost tohoto inhibitoru SGLT2 v dávce 10 mg/den s derivátem sulfonylurey glipizidem (20 mg/den) po přidání ke stávající léčbě metforminem. V tomto head-to-head srovnání došlo v obou porovnávaných skupinách k průměrnému snížení HbA1c o -0,52 %. Rozdíl byl ale patrný s ohledem na tělesnou hmotnost – podávání dapagliflozinu vedlo k poklesu o 3,2 kg, kdežto léčba gliklazidem přispěla ke zvýšení hmotnosti o 1,4 kg. Ve skupině léčené dapagliflozinem byl rovněž zaznamenán pokles krevního tlaku a zvýšení hladiny HDL cholesterolu. Výskyt hypoglykemických příhod byl pochopitelně mnohem vyšší ve skupině léčené sulfonylureou (40,8 % vs. 3,5 %) [68]. Souhrnný přehled randomizovaných studií provedených s dapagliflozinem uvádí tab. 2.
Prozatím největší a nejdéle probíhající studie s dapagliflozinem trvala 52 týdnů a srovnávala účinnost tohoto inhibitoru SGLT2 v dávce 10 mg/den s derivátem sulfonylurey glipizidem (20 mg/den) po přidání ke stávající léčbě metforminem. V tomto head-to-head srovnání došlo v obou porovnávaných skupinách k průměrnému snížení HbA1c o -0,52 %. Rozdíl byl ale patrný s ohledem na tělesnou hmotnost – podávání dapagliflozinu vedlo k poklesu o 3,2 kg, kdežto léčba gliklazidem přispěla ke zvýšení hmotnosti o 1,4 kg. Ve skupině léčené dapagliflozinem byl rovněž zaznamenán pokles krevního tlaku a zvýšení hladiny HDL cholesterolu. Výskyt hypoglykemických příhod byl pochopitelně mnohem vyšší ve skupině léčené sulfonylureou (40,8 % vs. 3,5 %) [68]. Souhrnný přehled randomizovaných studií provedených s dapagliflozinem uvádí tab. 2.
Canagliflozin a další
Dapagliflozin sice dospěl ve svém vývoji od laboratorních testů ke klinickému používání nejdál, není ale jediným zástupcem této slibně se rozvíjející skupiny perorálních antidiabetik. V roce 2010 byly prezentovány výsledky tříměsíční studie prováděné s canagliflozinem v dávce 50–600 mg, která srovnávala tuto léčivou látku s placebem i inhibitorem DPP-4 sitagliptinem. Canagliflozin v jednotlivých větvích snížil HbA1c o 0,7–0,9 %. Příznivý účinek na tělesnou hmotnost, krevní tlak a nízký výskyt hypoglykemií byl obdobný jako u dapagliflozinu [71]. Stejně tak další molekuly (ASP1941, BI10773, LX4211, AVE2268, RG 7201, TS 071, BI44847 a ISIS 388626) se nacházejí v různých stadiích klinického testování. Vývoj slibných molekul sergliflozinu a remogliflozinu byl pozastaven pravděpodobně kvůli nedostatečné selektivitě vůči SGLT2.
Glifloziny a tělesná hmotnost
Průvodním jevem všech zmíněných klinických studií bylo konstantní snížení hmotnosti, které dosáhlo během poměrné krátké doby podávání (3–6 měsíců) obvykle kolem 2–3 kg. Tento hmotnostní úbytek lze dát do souvislosti s negativní energetickou bilancí dosaženou pomocí akcentované glykosurie (50–85 g glukózy v moči představuje 200–340 kcal denně). Tato hodnota není zanedbatelná, u většiny osob představuje až desetinu celkového denního energetického příjmu.
Glifloziny a krevní tlak
 Ať už v monoterapii, nebo po přidání k metforminu – podávání dapagliflozinu vedlo během 3–6měsíční periody k signifikantnímu snížení krevního tlaku. Systolický tlak poklesl při dávce 10 mg dapagliflozinu denně o 3–5 mm Hg, diastolický tlak o 2 mm Hg bez patrných změn srdeční frekvence či výskytu kolapsových stavů. Tento nepatrný, ale zjevný antihypertenzní efekt lze dát do souvislosti se zvýšenou exkrecí natria provázející glykosurii. Zároveň zde může být patrný i efekt redukce hmotnosti, již dříve popsaný ve studiích zaměřených na hubnutí.
Ať už v monoterapii, nebo po přidání k metforminu – podávání dapagliflozinu vedlo během 3–6měsíční periody k signifikantnímu snížení krevního tlaku. Systolický tlak poklesl při dávce 10 mg dapagliflozinu denně o 3–5 mm Hg, diastolický tlak o 2 mm Hg bez patrných změn srdeční frekvence či výskytu kolapsových stavů. Tento nepatrný, ale zjevný antihypertenzní efekt lze dát do souvislosti se zvýšenou exkrecí natria provázející glykosurii. Zároveň zde může být patrný i efekt redukce hmotnosti, již dříve popsaný ve studiích zaměřených na hubnutí.
Souhrnný přehled účinků inhibitorů SGLT2 shrnuje tab. 3.
Nežádoucí účinky gliflozinů
Glukuretická léčba je asociována s mírně akcentovanou diurézou. Průměrný objem moči se po 12 týdnech léčby glifloziny zvýšil o 107–375 ml, což z praktického hlediska pravděpodobně není nijak zásadní změna, i když souvislost zvýšeného objemu moči s potenciálním rizikem dehydratace či elektrolytové dysbalance nebyla prozatím hodnocena. Při léčbě inhibitory SGLT2 bude namístě poučit pacienty o případných symptomech dehydratace a potřebě dodržovat pitný režim. Osmotická diuréza je rovněž příčinou nepatrného zvýšení hematokritu (1–2 %).
Glykosurie je považována za potenciální rizikový faktor infekcí močového a pohlavního ústrojí. Ve studiích s dapagliflozinem byl skutečně zaznamenán nepatrně zvýšený výskyt močových infekcí, který ovšem nebyl konzistentní, a všechny případy měly mírný a nekomplikovaný průběh. Obvykle došlo ke spontánní remisi, případně byla postačující běžná antibiotická léčba. Stejně tak tomu bylo i v případě genitálních infekcí (nejčastěji vulvovaginitidy kandidového původu). Problematika tohoto jevu bude jistě v dalších studiích předmětem podrobného zkoumání.
Podstatným faktem týkajícím se bezpečnosti léčby každým antidiabetikem je v současné době jeho potenciál vyvolávat hypoglykemie. Zde se jeví skupina inhibitorů SGLT2 jako mimořádně bezpečná, s rizikem výskytu hypoglykemických příhod srovnatelným s placebem.
Závěr
Inhibice SGLT2 představuje zcela nový přístup k léčbě diabetu 2. typu. I přesto, že tímto terapeutickým působením neovlivňujeme žádný z patofyziologických podkladů diabetu, lze prostřednictvím indukce glykosurie pomocí blokády SGLT2 transportérů v ledvinách snižovat hyperglykemii a sekundárně tak pozitivně ovlivnit funkci β-buňky, citlivost na inzulin a jaterní metabolismus glukózy. Nezanedbatelným účinkem léčby je i snížení hmotnosti. Co se týče bezpečnosti tohoto léčebného přístupu, lze se prozatím opřít o přirozeně se vyskytující „model“ inhibice glukózových transportérů. Ten poskytují osoby s benigní familiární glykosurií, které nevykazují žádné chronické komplikace související s protrahovanou excesivní glykosurií.
Přitažlivost glukuretické terapie spočívá v její jednoduchosti a univerzálnosti, nezávisle na vyvolávající příčině hyperglykemie. Léčba účinkuje bez ohledu na stav inzulinové rezistence či poruchy sekrece inzulinu. Své místo by inhibitory SGLT2 mohly najít v jakékoliv fázi rozvoje a průběhu diabetu, zejména v kombinaci s dalšími antidiabetiky včetně inzulinu, jak prokázala recentní práce srovnávající dapagliflozin použitý u pacientů v časném a pozdním stadiu diabetu. Zvláště u starších pacientů s delším trváním diabetu, u nichž je v průběhu let stále náročnější dosáhnout požadované kontroly glykemie, může být zařazení inhibitoru SGLT2 do kombinační léčby vhodnou a bezpečnou terapeutickou možností. Opatrnost při volbě těchto antidiabetik však bude namístě u osob s anamnézou dehydratace či rekurentních infekcí močových cest. Pro adekvátní účinek léčby samotné je rovněž nezbytná neporušená filtrační funkce ledvin.
Mezi nesporné výhody použití gliflozinů bude jistě patřit nízké riziko hypoglykemie, která je zvláště po zveřejnění studie ACCORD výrazným varováním pro bezpečné, rozvážné a smysluplné dosahování cílových hodnot HBA1c hlavně u pacientů se zvýšeným kardiovaskulárním rizikem. Ani redukce tělesné hmotnosti a snad i mírný antihypertenzní účinek nejsou zanedbatelnými výhodami inhibitorů SGLT2, zejména jako protipól antidiabetik působících spíše opačně (inzulin, deriváty sulfonylurey a thiazolidindiony). Do budoucna bude zajisté vhodné zjistit vztah inhibitorů SGLT2 k výskytu kardiovaskulárních příhod, případně prozkoumat jejich schopnost oddálit nástup prediabetu či metabolického syndromu.
Seznam použité literatury
- [1] Bailey CJ, Gross JL, Pieters A, et al. Effect of dapagliflozin in patients with type 2 diabetes who have inadequate glycaemic control with metformin: a randomised, double-blind, placebo-controlled trial. Lancet 2010; 375: 2223–2233.
- [2] Bailey CJ, Day C. SGLT2 Inhibitors: Glucuretic Treatment for Type 2 Diabetes. Br J of Diabetes Vasc Dis 2010; 4: 193–199.
- [3] Bautista R, Manning R, Martinez F, et al. Angiotensin II-dependent increased expression of Na+-glucose cotransporter in hypertension. Am J Physiol Renal Physiol 2004; 286: F127–F133.
- [4] Bickel M, Brummerhop H, Glombik H, et al. Effects of the SGLT2-inhibitor AVE2268 on urinary glucose excretion (UGE) and blood glucose in mice, rats and dogs. Diabetologia 2006; 49: 358–359.
- [5] Calado J, Sznajer Y, Metzger D. et al. Twenty-one additional cases of familial renal glucosuria: absence of genetic heterogeneity, high prevalence of private mutations and further evidence of volume depletion. Nephrol Dial Transplant 2008; 23: 3874–3879.
- [6] Calado J, Loeffler J, Sakallioglu O, et al. Familial renal glucosuria: SLC5A2 mutation analysis and evidence of salt-wasting. Kidney Int 2006; 69: 852–855.
- [7] Calado J, Soto K, Clemente C, et al. Novel compound heterozygous mutations in SLC5A2 are responsible for autosomal recessive renal glucosuria. Hum Genet 2004; 114: 314–316.
- [8] Chen XL, Conway BR, Ericson E, et al. RWJ 394718 (T-1095), an inhibitor of sodium-glucose cotransporters increases urinary glucose excretion in Zucker diabetic fatty (ZDF) rats. Diabetes 2001; 50: A511–A512.
- [9] DeFronzo R. Pharmacotherapeutic SGLT2 Inhibition: A Novel Mechanism To Improve Glycemic Control. Medscape Education 2008. http://www. medscape. com
- [10] Ehrenkranz JR, Lewis NG, Kahn CR, Roth J. Phlorizin: a review. Diabetes Metab Res Rev 2005; 21: 31–38.
- [11] Ferrannini E, Ramos SJ, Salsali A, et al. Dapagliflozin monotherapy in type 2 diabetic patients with inadequate glycemic control by diet and exercise: a randomized, double-blind, placebo-controlled, phase 3 trial. Diabetes Care 2010; 33: 2217–2224.
- [12] Fujimori Y, Katsuno K, Ojima K, et al. Sergliflozin etabonate, a selective SGLT2 inhibitor, improves glycemic control in streptozotocin-induced diabetic rats and Zucker fatty rats. Eur J Pharmacol 2009; 609: 148–154.
- [13] Fujimori Y, Katsuno K, Nakashima I, et al. Remogliflozin etabonate, in a novel category of selective low-affinity sodium glucose cotransporter (SGLT2) inhibitors, exhibits antidiabetic efficacy in rodent models. J Pharmacol Exp Ther 2008; 327: 268–276.
- [14] Ganong WF, et al. Formation and excretion of urine. Review of Medical Physiology. 22 ed. New York: Lange Medical Publishing: 2005; v699–734.
- [15] Gerich JE, Meyer C, Woerle HJ, et al. Renal gluconeogenesis: its importance in human glucose homeostasis. Diabetes Care 2001; 24: 382–391.
- [16] Han S, Hagan DL, Taylor JR, et al. Dapagliflozin a selective SGLT2 inhibitor, improves glucose homeostasis in normal and diabetic rats. Diabetes 2008 Jun; 57: 1723–1729.
- [17] Harrington WW, Milliken NO, Binz JG, et al. Remogliflozin etabonate, a potent and selective sodium-dependent glucose transporter 2 antagonist, produced sustained metabolic effects in Zucker diabetic fatty rats. Program and abstracts of the 68th Scientific Sessions of the American Diabetes Association; June 6–10: 2008; San Francisco, California. Abstract 529–P.
- [18] Hediger MS, Rhoads DB. Molecular Physiology of Sodium-Glucose Cotransporters. Physiol Rev 1994; 74: 993–1026.
- [19] Heller S, et al. Weight gain during insulin therapy in patients with type 2 diabetes mellitus. Diabetes Res Clin Pract 2004; 65: S23–27.
- [20] Holman RR, Paul SK, Bethel A, et al. Long-term follow-up after tight control of blood pressure in type 2 diabetes. N Engl J Med 2008; 359: 1565–1576.
- [21] http: //en.wikipedia.org/wiki/Sodium-glucose_transport_proteins
- [22] http://www.isispharm.com
- [23] Hussey EK, Clark RV, Amin DM, et al. Early clinical studies to assess the safety, tolerability, pharmacokinetics and pharmacodynamics of single doses of sergliflozin, a novel inhibitor of renal glucose reabsorption, in healthy volunteers and subjects with type 2 diabetes mellitus. Diabetes 2007; 56: A49.
- [24] Hussey EK, Dobbins RL, Stolz RR, et al. A Double-Blind Randomized Repeat Dose Study to Assess the Safety, Tolerability, Pharmacokinetics and Pharmacodynamics of Three Times Daily Dosing of Sergliflozin, a Novel Inhibitor of Renal Glucose Reabsorption, in Healthy Overweight and Obese Subjects. Presented at: American Diabetes Association’s 67th Scientific Sessions; June 22–26, 2007; Chicago, IL. Abstract 491-P.
- [25] Jabbour SA, Goldstein BJ, et al. Sodium glucose co-transporter 2 inhibitors: blocking renal tubular reabsorption of glucose to improve glycaemic control in patients with diabetes. Int J Clin Pract 2008; 62: 1279–1284.
- [26] Janssen SWJ, Martens GJM, Sweep CGJ, et al. Phlorizin treatment prevents the decrease in plasma insulin levels but not the progressive histopathological changes in the pancreatic islets during aging of Zucker diabetic fatty rats. J Endocrinol Invest 2003; 26: 508–515.
- [27] Kahn SE, Hull RL, Utzschneider KM, et al. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature 2006; 444: 840–846.
- [28] Kahn BB, Shulman GI, DeFronzo RA, et al. Normalization of blood-glucose in diabetic rats with phlorizin treatment reverses insulin-resistant glucose-transport in adipose-cells without restoring glucose transporter gene expression. J Clin Invest 1991; 87: 561–570.
- [29] Katsuno K, Fujimori Y, Takemura Y, et al. Sergliflozin, a novel selective inhibitor of low-affinity sodium glucose cotransporter (SGLT2), validates the critical role of SGLT2 in renal glucose reabsorption and modulates plasma glucose level. J Pharmacol Exp Ther 2007; 320: 323–330.
- [30] Komoroski B, Vachharajani N, Boulton D, et al. Dapagliflozin, a novel SGLT2 inhibitor, improved glycemic control in patients with type 2 diabetes. Clin Pharmacol Ther 2009; 85: 513–519.
- [31] Komoroski B, Brenner E, Li L, et al. Dapagliflozin (BMS-512148), a selective SGLT2 inhibitor, inhibits glucose resorption and reduces fasting glucose in patients with type 2 diabetes mellitus. Diabetologia 2007; 50: S315.
- [32] Komoroski B, Brenner E, Li L, et al. Dapagliflozin (BMS-512148), a selective inhibitor of the sodium-glucose uptake transporter 2 (SGLT2), reduces fasting serum glucose and glucose excursion in type 2 diabetes mellitus patients over 14 days. Diabetes 2007; 56: A49.
- [33] Komorski B, Brenner E, Li L, et al. Dapagliflozin (BMS-512148), a Selective Inhibitor of the Sodium-Glucose Uptake Transporter 2 (SGLT2), Reduces Fasting Serum Glucose and Glucose Excursion in Type 2 Diabetes Mellitus Patients Over 14 Days. Presented at: American Diabetes Association's 67th Scientific Sessions; June 22–26, 2007; Chicago, IL. Abstract 188–OR.
- [34] List JF, Woo V, Morales E ET AL. Sodium-glucose cotransport inhibition with dapagliflozin in type 2 diabetes. Diabetes Care 2009; 32: 650–657.
- [35] List JF, Woo VC, Villegas EM, et al. Efficacy and safety of dapagliflozin in a dose-ranging monotherapy study of treatment-naive patients with type 2 diabetes. Program and abstracts of the 68th Scientific Sessions of the American Diabetes Association; June 6-10, 2008; San Francisco, California. Abstract 329–OR.
- [36] List JF, Woo VC, Villegas EM, et al. Dapagliflozin-induced glucosuria is accompanied by weight loss in type 2 diabetes patients. Program and abstracts of the 68th Scientific Sessions of the American Diabetes Association; June 6-10, 2008; San Francisco, California. Abstract 461–P.
- [37] Magen D, Sprecher E, Zelikovic I, et al. A novel missense mutation in SLC5A2 encoding SGLT2 underlies autosomal-recessive renal glucosuria and aminoaciduria. Kidney Int 2005; 67: 34–41.
- [38] Meng W, Ellworth BA, Nirschl AA, et al. Discovery of Dapagliflozin: A Potent, Selective Renal Sodium-Dependent Glucose Cotransporter2 (SGLT2) Inhibitor for the Treatment of Type 2 Diabetes. J Med Chem 2008; 51: 1145–1149.
- [39] Mogensen CE, et al. Maximum tubular reabsorption capacity for glucose and renal hemodynamcis during rapid hypertonic glucose infusion in normal and diabetic subjects. Scand J Clin Lab Invest 1971 Sep; 28: 101–109.
- [40] Rossetti L, Papachristou D, Shulman G, et al. Insulin resistance in partially pancreatectomized rats – reversal with phlorizin therapy. Diabetologia 1986; 29: A587–A588.
- [41] Rossetti L, Smith D, Shulman GI, et al. Correction of hyperglycemia with phlorizin normalizes tissue sensitivity to insulin in diabetic rats. J Clin Invest 1987; 79: 1510–1515.
- [42] Santer R, Kinner M, Lassen CL, et al. Molecular Analysis of the SGLT2 Gene in Patients with Renal Glucosuria. J Am Soc Nephrol 2003; 14: 2873–2882.
- [43] Shankel SW, Robson AM, Bricker NS. On the mechanism of the splay in the glucose titration curve in advanced experimental renal disease in the rat. J Clin Invest 1967; 46: 164–172.
- [44] Stiles PG, Lusk G. On the action of phlorizin. Am J Physiol 1903; 10: 61–79.
- [45] Wancewicz EV, Siwkowski A, Meibohm B, et al. Long term safety and efficacy of ISIS 388626, an optimized SGLT2 antisense inhibitor, in multiple diabetic and euglycemic species. Program and abstracts of the 68th Scientific Sessions of the American Diabetes Association; June 6-10, 2008; San Francisco, California. Abstract 334–OR.
- [46] Whaley J, Hagan D, Taylor J, et al. Dapagliflozin, a selective SGLT2 inhibitor, improves glucose homeostasis in normal and diabetic rats. Diabetes 2007; 56: A149.
- [47] Wilding JPH, Norwood P, T’joen C, et al. A study of dapagliflozin in patients with type 2 diabetes receiving high doses of insulin plus insulin sensitizers. Applicability of a novel insulin-independent treatment. Diabetes Care 2009; 32: 1656–1662.
- [48] Wilding JPH. SGLT2 Inhibitors for the Treatment of Diabetes; Medscape Education 2008. http:// www.medscape.com
- [49] Wing RR, Hill JO. Successful weight loss maintenance. Ann Rev Nutrition 2001; 21: 323–341.
- [50] Wright EM, Hirayama BA, Loo DF. Active sugar transport in health and disease. J Intern Med 2007; 261: 32–43.
- [51] Yamamoto K, Kumeda S, Io F, et al. Novel SGLT inhibitors (SGL5083 and SGL5085), acting on both suppressing intestinal glucose absorption and increasing urinary glucose excretion, improve postprandial hyperglycemia in diabetic model rats. Diabetes 2007; 56: A136.
- [52] Nomura S, Sakamaki S, Hongu M, et al. Discovery of canagliflozin, a novel C-glucoside with thiophene ring, as sodium-dependent glucose cotransporter 2 inhibitor for the treatment of type 2 diabetes mellitus. J Med Chem 2010; 53: 6355–6360.
- [53] Skyler JS, Bergenstal R, Bonow RO, et al. American Diabetes Association, American College of Cardiology Foundation, American Heart Association. Intensive glycemic control and the prevention of cardiovascular events: implications of the ACCORD, ADVANCE, and VA diabetes trials: a position statement of the American Diabetes Association and a scientific statement of the American College of Cardiology Foundation and the American Heart Association. Circulation 2009; 119: 351–357.
- [54] List JF, Woo V, Morales E, et al. Sodium-glucose cotransport inhibition with dapagliflozin in type 2 diabetes. Diabetes Care 2009; 32: 650–657. Abstrakt.
- [55] Bailey CJ, Gross JL, Bastone L, et al. Dapagliflozin as an add-on to metformin lowers hyperglycaemia in type 2 diabetes patients inadequately controlled with metformin alone. Program and abstracts of the European Association for the Study of Diabetes (EASD) 45th Annual Meeting; September 29-October 2, 2009; Vienna, Austria. Abstract 169.
- [56] Fujimori Y, Katsuno K, Nakashima I, et al. Remogliflozin etabonate, in a novel category of selective low-affinity sodium glucose cotransporter (SGLT2) inhibitors, exhibits antidiabetic efficacy in rodent models. J Pharmacol Exp Ther 2008; 327: 268–276. Abstrakt.
- [57] Hediger MA, Rhoads DB. Molecular physiology of sodium-glucose cotransporters. Physiol Rev 1994; 74: 993–1026. Abstrakt.
- [58] Abdul-Ghani MA, DeFronzo RA. Inhibition of renal glucose reabsorption: a novel strategy for achieving glucose control in type 2 diabetes mellitus. Endocr Pract 2008; 14: 782–790. Abstrakt.
- [59] Francis J, Zhang J, Farhi A, et al. A novel SGLT2 mutation in a patient with autosomal recessive renal glucosuria. Nephrol Dial Transplant 2004; 19: 2893–2895. Abstrakt.
- [60] Han S, Hagan DL, Taylor JR, et al. Dapagliflozin, a selective SGLT2 inhibitor, improves glucose homeostasis in normal and diabetic rats. Diabetes 2008; 57: 1723–1729. Abstrakt.
- [61] Dobbins RL, Kapur A, Kapitza C, et al. Remogliflozin etabonate, a selective inhibitor of the sodium-glucose transporter 2 (SGLT2) reduces serum glucose in type 2 diabetes mellitus (T2DM) patients. Program and abstracts of the American Diabetes Association 69th Scientific Sessions; June 5-9, 2009; New Orleans, Louisiana. Abstract 573–P.
- [62] Ferrannini E, Ramos SJ, Tang W, et al. Dapagliflozin monotherapy in T2DM patients with inadequate glycemic control by diet and exercise: a multicenter phase 3 trial. Program and abstracts of the 20th World Diabetes Congress of the International Diabetes Federation (IDF); October 18–22, 2009; Montreal, Quebec, Canada. Abstract O–0536.
- [63] Bastien A, Woo V, Wilding JP, et al. Efficacy of dapagliflozin in three populations of patients on different treatment regimens for various stages of T2DM. Program and abstracts of the 20th World Diabetes Congress of the International Diabetes Federation (IDF); October 18–22, 2009; Montreal, Quebec, Canada. Abstract D–0765.
- [64] Bastien A, Caminero AG, Ying L, et al. Incidence of urinary tract infections and of genital infections in two T2DM populations cotreated with dapagliflozin and oral antidiabetics +/- insulin. Program and abstracts of the 20th World Diabetes Congress of the International Diabetes Federation (IDF); October 18–22, 2009; Montreal, Quebec, Canada. Abstract D–0766.
- [65] Bakris GL, Fonseca VA, Sharma K, et al. Renal sodium-glucose transport: role in diabetes mellitus and potential clinical implications. Kidney Int 2009; 75: 1272–1277.
- [66] Gerstein HC, Miller ME, Byington RP, et al; Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358: 2545–2559.
- [67] Buse JB, Bigger JT, Byington RP, et al; ACCORD Study Group. Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial: design and methods. Am J Cardiol 2007; 99: 21i–33i.
- [68] Nauck M, Del Prato S, Rohwedder K, et al. Dapagliflozin vs glipizide in patients with Type 2 diabetes mellitus inadequately controlled on metformin: 52-week results of a double-blind, randomized, controlled trial. Diabetologia 2010; 53 (Suppl. 1): Abstract 241.
- [69] Sha S, Devineni D, Ghosh A, et al. Canagliflozin, a novel inhibitor of sodium-glucose co-transporter 2, improved glucose control in subjects with Type 2 diabetes and was well tolerated. Diabetes 2010; 59 (Suppl. 1): A155.
- [70] Rosenstock J, Arbit D, Usiskin K, et al. Canagliflozin, an inhibitor of sodium-glucose co-transporter 2 (SGLT2), improves glycemic control and lowers body weight in subjets with Type 2 diabetes (T2D) on metformin. Diabetes 2010; 59 (Suppl. 1): A2 Abstract 0077–OR.
- [71] Wilding JPH, Woo V, Soler NG, et al. Sustained effectiveness of dapagliflozin over 48 weeks in patients with Type 2 diabetes poorly controlled with insulin. Diabetes 2010; 59 (Suppl. 1): Abstract 0021–LB.
- [72] Strojek K, Hruba V, Elze M, et al. Efficacy and safety of dapagliflozin in patients with Type 2 diabetes mellitus and inadequate glycaemic control on glimepiride monotherapy. Diabetologia 2010; 53 (Suppl. 1): Abstract 870 S347.