Hereditární angioedém a jeho léčba
Souhrn:
Hereditární angioedém je autosomálně dominantně dědičné onemocnění, které je charakterizováno opakujícími se atakami potenciálně život ohrožujících nesvědivých otoků v dermis a v submukóze. K nejzávažnějším důsledkům vede otok v oblasti hrtanu.Léčbu lze rozdělit na léčbu akutních atak a na profylaxi: krátkodobou (před invazivním výkonem) či dlouhodobou (s cílem dlouhodobého snížení počtu atak). Při farmakoterapii se v České republice používá především léčba suplementační (přirozený či rekombinantní koncentrát inhibitoru C1‑esterázy) a blokáda bradykininových receptorů B2. Léčba je prováděna ve specializovaných centrech a vychází z platných doporučení.
Key words: hereditary angioedema – C1-esterase inhibitor – bradykinin – prophylaxis – acute attack.
Summary:
Hereditary angioedema is an autosomal dominant hereditary disease characterized by recurrent acute attacks of non-itching swellings localized subcutaneously or submucosally. The most serious manifestation of HAE is represented by laryngeal edema. Treatment strategy can be divided into treatment of acute attacks and prophylaxis: short-term (preceding an invasive intervention) or long-term (the aim of which is reduction of the frequency of attacks). In the Czech Republic, substitution therapy (natural or recombinant C1-esterase inhibitor concentrate) or a blockade of bradykinin B2 receptors are particularly popular. The treatment is provided in the specialized centers and respects the current recommendations.
Hereditární angioedém (HAE) je autosomálně dominantně (autosomal dominant, AD) dědičné onemocnění, pro něž je charakteristická tvorba nebolestivých, nesvědivých otoků podkoží a sliznic. Ve většině případů je příčinou genová mutace, která způsobuje absolutní či relativní nedostatek (tvorba afunkčního proteinu) inhibitoru C1‑esterázy (C1‑INH). V populaci se vyskytuje s frekvencí 1 : 50 000 až 1: 150 000 bez závislosti na rase či pohlaví [1,2]. V Národním registru primárních imunodeficiencí v České republice bylo ke konci roku 2015 hlášeno celkem 142 nemocných.
Inhibitor C1‑esterázy je multifunkční inhibitor serinových proteáz, které se
vyskytují v plazmě. Je tvořen hepatocyty, aktivovanými makrofágy a dalšími buňkami. Je jediným známým inhibitorem aktivovaných proteáz klasické dráhy komplementu (C1r a C1s) a serinových proteáz (MASP‑1 a MASP‑2) aktivovaných lektinovou cestou. Dále významně inhibuje aktivovaný faktor XI, XII, kalikrein a trombin v koagulač-
ním systému a tkáňový aktivátor plasminogenu (tPA) a plasmin ve fibrinolytickém systému [3].
Inhibicí přeměny prekalikreinu na kalikrein reguluje tvorbu bradykininu, který je u pacientů s hereditárním angioedémem zásadní pro vznik klinických příznaků. Deficit inhibitoru C1‑esterázy vede ke spontánní aktivaci C1 složky komplementu za současného spotřebovávání C2 a C4 složek komplementu. Výsledkem je produkce anafylaktických, chemotaktických a vazoaktivních mediátorů. Dochází ke zvýšení permeability cév a k tvorbě otoků [4].
Klinická klasifikace hereditárního angioedému
Hereditární angioedém je možné klinicky rozdělit do tří typů:
- I. typ se vyznačuje sníženou koncentrací inhibitoru C1‑esterázy za současného snížení hodnoty C4 složky komplementu;
- II. typ charakterizují normální či zvýšené koncentrace inhibitoru C1‑esterázy, který je dysfunkční;
- III. typ nemá vazbu na deficit inhibitoru C1‑esterázy. U části nemocných byla zjištěna mutace v genu kódujícím koagulační faktor XII.
Klinický obraz HAE typu I a II
Ke klinickým projevům onemocnění může dojít v jakémkoli věku. V České republice dochází k první atace průměrně kolem 17. roku života (1–40 let) [5]. Typické je zvýšení frekvence atak v peripubertálním období. Spouštěcími mechanismy pro vznik otoků bývají: lokální fyzikální působení (mechanické trauma či iatrogenně – stomatologický výkon, endoskopické vyšetření, intubace), infekce, psychické vlivy (stres), farmaka (hormonální léčba s obsahem estrogenů, inhibitory ACE). Otoky se rozvíjejí během několika hodin, přetrvají obvykle déle než 12 hodin, často 2–3 dny, a poté spontánně vymizejí. Nejčastěji postihují podkoží v oblasti obličeje, končetin a genitálu. Jsou bělavého charakteru a nesvědí. Postižení gastrointestinálního traktu vede k vyčerpávajícím krutým křečovitým bolestem, které bývají provázeny zvracením a vodnatými průjmy. Nejvíce rizikový je vznik otoku v oblasti laryngu, uvuly, měkkého patra či jazyka, které mohou bez adekvátní pomoci končit úmrtím. Může se jednat i o první projev onemocnění, riziko zůstává celoživotní. Klinicky může docházet k manifestaci v řadě dalších orgánů (CNS, urogenitální trakt, svaly, klouby apod.) [1,4].
HAE typu III
V letech 2006–2013 byly objeveny celkem čtyři příčinné mutace v genu kódujícím koagulační faktor XII (objasňuje pouze 25 % případů). Typ dědičnosti je autosomálně dominantní s nekompletní penetrancí. Mezi postiženými převažují jednoznačně ženy nad muži (68 : 1). S ohledem na to, že koncentrace FXII je zásadním způsobem regulována estrogeny, dochází často ke klinické manifestaci v průběhu těhotenství či v souvislosti s užíváním estrogenní hormonální léčby. Klinicky se projevy neliší od hereditárního angioedému typu I či II, včetně silných abdominálních bolestí provázených ascitem. V ojedinělých případech vede hereditární angioedém i k úmrtí plodu [6,7].
U zbytku postižených s rodinným výskytem nebyla genetická příčina doposud nalezena. Jedná se taktéž o typ s autosomální dědičností. Predominance žen je vyjádřena méně (6,3 : 1), s menším podílem vlivu estrogenů na klinickou manifestaci [6].
Farmakoterapie
Léčba hereditárního angioedému a dostupnost jednotlivých přípravků v České republice shrnuje tab. 1.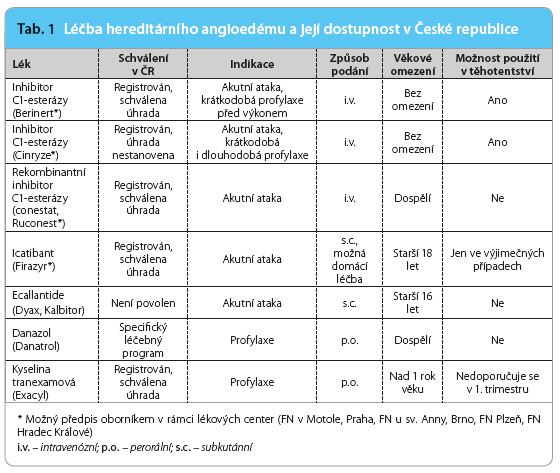
Náhrada chybějícího funkčního proteinu inhibitoru C1‑esterázy (lidský, rekombinantní)
V současné době jsou registrovány dva přirozené koncentráty inhibitoru C1‑esterázy – Berinert (CSL Behring, Německo) a Cinryze (Shire, Belgie).
Berinert je vyráběn z lidské plazmy. Je pasterizovaný a nanofiltrovaný. Studie IMPACT 1 potvrdila vysokou účinnost přípravku Berinert v léčbě abdominálních a obličejových atak v dávce 20 IU/kg se zkrácením doby do první úlevy 0,5 h vs. 1,5 h oproti placebu; při podání dávky 10 IU/kg nedosáhlo zkrácení statistické významnosti (1,2 h vs. 1,5 h). Další studie však potvrdily významnou úlevu i při dávce 500 IU [8]. Na základě těchto zjištění je doporučováno u laryngeálních a obličejových atak s potenciálním rizikem vzniku otoku hrtanu používat zvýšenou dávku 20 IU/kg. V případě ostatních atak lze léčbu individualizovat. V řadě zemí je Berinert registrován k domácímu intravenóznímu (i.v.) používání [9]. V České republice (ČR) tomu tak doposud není.
Cinryze je další nanofiltrovaný inhibitor inhibitoru C1‑esterázy izolovaný z lidské plazmy s ověřenou účinností, včetně podání v dětském věku. Rovněž je v některých zemích určen i k podávání v domácím prostředí [10]. V ČR doposud nebyla stanovena jeho úhrada.
Rekombinantní inhibitor C1‑esterázy conestat alfa je získáván z mléka geneticky modifikovaných králíků, k průměrné úlevě od příznaků spojených s hereditárním angioedémem dochází přibližně za 90 minut po podání přípravku [11]. Možné nežádoucí účinky představují alergické reakce s vazbou na králičí alergen. Proto je conestat alfa kontraindikován u všech nemocných s prokázanou či suspektní alergií na králičí srst. Ve studii u 12 % nositelů specifických IgE protilátek proti králičí srsti došlo k rozvoji alergické reakce. Doporučené dávkování u lidí s tělesnou hmotností do 84 kg je 50 j./kg, u osob těžších pak jedna injekce s obsahem 4 200 jednotek (dvě injekční lahvičky). Během 24 hodin se nemají podávat více než dvě dávky přípravku. Zatím nejsou zkušenosti s podáním u dětí ve věku do 12 let. Ve Spojených státech amerických je conestat alfa schválen pro domácí použití [12].
Inhibice funkce bradykininu (blokáda bradykininového receptoru B2)
Icatibant je kompetitivní selektivní antagonista bradykininových receptorů B2 určený pro subkutánní podávání. Jeho účinnost a bezpečnost byla ověřena ve studiích FAST‑1 a FAST‑2 [13,14]. Medián doby do klinicky významné úlevy byl ve srovnání s kyselinou tranexamovou dvě hodiny oproti 12 hodinám. Další multicentrická randomizovaná studie FAST‑3, která zahrnula 43 nemocných ve skupině s léčbou icatibantem a 45 nemocných ve skupině s podáváním placeba, zaznamenala významnou úlevu průměrně za dvě hodiny při aktivní léčbě oproti 19,8 hodiny při podávání placeba [15]. Pro léčbu ataky je icatibant podáván v dávce 30 mg aplikované do podkoží břicha. Nejčastějšími nežádoucími účinky jsou mírné lokální reakce typu erytému či svědění. Icatibant je v ČR schválen pro domácí užívání. Nutnost aplikace druhé injekce při nedostatečném účinku první dávky je popisována přibližně u 10 % atak [16]. V těhotenství je doporučováno podat icatibant jen v odůvodněných případech život ohrožujících atak, především laryngeálních. Byly však již publikovány případy s opakovaným podáním icatibantu v průběhu těhotenství bez negativního dopadu na vývoj dítěte [17].
Zásah do kalikrein‑kininového systému
Ecallantid, inhibitor plazmatického kalikreinu, je rekombinantní protein složený z 60 aminokyselin produkovaných kvasinkami Pichia pastoris. Jeho biologický poločas eliminace je přibližně 70 minut při podání intravenózním a 120 minut při podkožní (subkutánní, s.c.) aplikaci. Účinnost a bezpečnost ecallantidu byla ověřena ve studiích EDEMA‑3 a EDEMA‑4 [18]. U 2,7 % ze 187 nemocných léčených ecallantidem s.c. došlo k rozvoji anafylaktické reakce. U části nemocných byla detekována tvorba protilátek zvyšujících pravděpodobnost vzniku anafylaxe. Nejčastějšími nežádoucími účinky jsou bolest hlavy, nevolnost, únava, průjem. Ecallantid je podáván v dávce 30 mg (rozdělené do tří oddělených dávek) do podkoží břicha, do oblasti stehen či horních končetin mimo místo ataky. Při nedostatečném účinku může být stejná dávka opakovaně aplikována do 24 hodin (popsáno u 12 % případů) [19].
Inhibice fibrinolytického systému (kyselina tranexamová)
Do skupiny antifibrinolytik je řazena kyselina tranexamová, která inhibuje aktivaci plasminogenu a tím snižuje intenzitu a frekvenci atak. V porovnání s ostatními uvedenými léky je její účinnost významně nižší, nicméně i dnes lze najít cílovou skupinu nemocných, u kterých je dostatečně účinná, zejména na končetinové ataky. Bývá užívána při dlouhodobé profylaxi onemocnění při nevhodnosti či kontraindikaci atenuovaných androgenů (dětská populace, fertilní ženy, období těhotenství). Léčba je zahajována vysokými dávkami až 1,0–1,5 g kyseliny tranexamové 2–3krát denně, s následným postupným snižováním dávky. Jako udržovací léčba často stačí dávka 0,5 g 1–2krát denně. Mezi nejzávažnější nežádoucí účinky je třeba počítat dyspeptické obtíže a průjmy, které mohou vést k ukončení léčby. Riziko trombózy není výrazně zvýšeno, přesto je však vhodné před zahájením léčby provést screening hyperkoagulačních stavů [20].
Atenuované androgeny
Atenuované androgeny zvyšují expresi mRNA (mediátorové kyseliny ribonukleové) inhibitoru C1‑esterázy a biosyntézu inhibitoru C1‑esterázy v játrech. Jedná se o lék používaný při profylaxi atak. Danazol je podáván v počáteční dávce 400–600 mg/den, v další léčbě lze vystačit s udržovací dávkou 100 mg denně nebo i obden. Androgeny není možné podávat v těhotenství, opatrnosti je třeba u žen ve fertilním věku. Léčba atenuovanými androgeny bývá doprovázena řadou nežádoucích účinků, jako jsou virilizace, vzestup tělesné hmotnosti, poruchy menstruace, akné, zhrubění hlasu, ale také bolesti ve svalstvu s křečemi, bolesti hlavy, nauzea, vzestup hodnot jaterních testů, poruchy metabolismu lipidů s akcentací aterosklerózy, cholestáza, hypertenze, hemoragická cystitida, nádorové bujení jater. Je doporučována monitorace krevního obrazu a biochemických ukazatelů, eventuálně ultrazvukové vyšetření jater [20].
Léčebné strategie
V léčbě HAE existují dvě základní strategie, léčba profylaktická a léčba akutní ataky.
Dlouhodobá profylaxe je indikována u klinicky závažných případů. Nezbytné je vyvinout maximální snahu o minimalizaci výskytu spouštěčů atak. V dlouhodobé profylaxi se v ČR uplatňují především antifibrinolytika nebo atenuované androgenní steroidy.
U vysoce symptomatických nemocných lze využít i profylaktické podávání koncentrátu inhibitoru C1‑esterázy několikrát týdně. Pro tento účel byl doposud schválen pouze přípravek Cinryze, který má být podáván v dávce 1 000 U intravenózně každé 3–4 dny [21]. V otevřené observační studii byl podáván conestat alfa v dávce 50 U/kg jedenkrát týdně s poklesem počtu atak na polovinu [22]. Tento nález byl překvapivý s ohledem na biologický poločas eliminace přípravku – pouze 1,6 hodiny, pravděpodobně se zde uplatňují i další, ne zcela jasné faktory.
Před plánovaným rizikovým výkonem (stomatologické ošetření, endoskopické vyšetření, operace, porod) je využívána profylaxe krátkodobá. Dominantní postavení v této indikaci má koncentrát inhibitoru C1‑esterázy Berinert, dle Souhrnu údajů o přípravku (SPC) má být podána dávka 15 IU/kg až 30 IU/kg méně než 6 hodin před plánovaným výkonem, stomatologickým nebo chirurgickým zákrokem. Dávka by měla být zohledněna podle dalších klinických faktorů [23]. U méně rizikových případů lze opět použít kyselinu tranexamovou či deriváty androgenů podle zcela individuálního posouzení [24].
Léčba akutní ataky
Akutní ataka HAE by měla být řešena v tak krátké době, jak je to jen možné. Při rozvoji obstrukce laryngu či při akutních gastrointestinálních potížích je v České republice na základě platné legislativy používán blokátor bradykininového receptoru či substituce přirozeným anebo rekombinantním koncentrátem inhibitoru C1-esterázy. Pacient je pro tento případ obvykle vybaven léky zajišťujícími léčbu dvou atak s individuálním přihlédnutím. Léčba nekomplikovaných atak pomocí blokátoru bradykininového receptoru je možná samotným pacientem v domácím prostředí.
Těhotenství, porod a laktace
Frekvence atak HAE během těhotenství není predikovatelná ani podle průběhu minulých gravidit. Lékem první volby je přirozený koncentrát inhibitoru C1‑esterázy. Těhotná žena by měla mít po celou dobu těhotenství u sebe k dispozici minimálně 20 U/kg inhibitoru C1‑esterázy. V případě četných atak je namístě dlouhodobá profylaxe, opět koncentrátem inhibitoru C1‑esterázy, neboť byly popsány spontánní aborty a předčasné porody u žen trpících častými atakami. Antiandrogeny jsou kontraindikovány s ohledem na riziko virilizace plodu a s kyselinou tranexamovou nejsou dostatečné zkušenosti.
V průběhu porodu per vias naturales není profylaxe nezbytná, záleží na charakteru onemocnění u dané ženy. Riziko otoků rodidel je nejvyšší do 72 hodin po porodu. Při použití kleští, vakuumextrakce či císařského řezu je profylaxe nutná vždy. Upřednostňována je jednoznačně epidurální anestezie [25].
Výhledové způsoby léčby
V současnosti se nachází v závěrečné fázi studie III. fáze COMPACT sponzorovaná firmou CSL Behring, která je zaměřena na použití nové koncentrované formy inhibitoru C1‑esterázy pro podkožní aplikaci. V obdobné studii sponzorované firmou Shire je taktéž ověřována podkožně podávaná forma přípravku Cinryze v prevenci atak.
Další studie se věnují např. perorálně podávaného inhibitoru kalikreinu, inhibitoru prekalikreinu či rekombinantní, plně humánní protilátky proti faktoru XII [26].
Seznam použité literatury
- [2] Longhurst H, Cicardi M. Hereditary angio oedema. Lancet 2012; 379: 474–481.
- [3] Cugno M, Zanichelli A, Foieni F, et al. C1 inhibitor deficiency and angioedema: molecular mechanisms and clinical progress. Trends Mol Med 2009; 15: 69–78.
- [4] Kuklínek P, Hanzlíková J. Hereditární angioedém. Praha: Medical Tribune, 1. vydání, 2013.
- [5] Hakl R, Kuklinek P, Kadlecova P, Litzman J. Hereditary angio oedema with C1 inhibitor deficiency: Characteristics and diagnostic delay of Czech patients from one centre. Allergol Immunopathol (Madr) 2016; 44: 241–245.
- [6] Bork K, Wulff K, Witzke G, Hardt J. Hereditary angioedema with normal C1 INH with versus without specific F12 gene mutations. Allergy 2015; 70: 1004–1012.
- [7] Picone O, Donnadieu AC, Brivet FG, et al. Obstetrical Complications and Outcome in Two Families with Hereditary Angioedema due to Mutation in the F12 Gene. Obstet Gynecol Int 2010; 2010: 957507.
- [8] Craig TJ, Levy RJ, Wasserman RL, et al. Efficacy of human C1 esterase inhibitor concentrate compared with placebo in acute hereditary angioedema attacks. J Allergy Clin Immunol 2009; 124: 801–808.
- [9] Bork K. Pasteurized and nanofiltered, plasma derived C1 esterase inhibitor concentrate for the treatment of hereditary angioedema. Immunotherapy 2014; 6: 533–551.
- [10] Lunn M, Santos C, Craig T. Cynrize as the fist approved C1 inhibitor in the USA for the treatment of hereditary angioedema: approval, efficacy and safety. J Blood Med 2010; 1: 163–170.
- [11] Zuraw B, Cicardi M, Levy RJ, et al. Recombinant human C1 inhibitor for the treatment of acute angioedema attacks in patients with hereditary angioedema. J Allergy Clin Immunol 2010; 126: 821–827.
- [12] Riedl M. Recombinant human C1 esterase inhibitor in the management of hereditary angioedema. Clin Drug Investig 2015; 35: 407–417.
- [13] Malbran A, Riedl M, Ritchie B, et al. Repeat treatment of acute hereditary angioedema attacks with open label icatibant in the FAST 1 trial. Clin Exp Immunol 2014; 177: 544–553.
- [14] Bas M, Greve J, Hoffmann TK, et al. Repeat treatment with icatibant for multiple hereditary angioedema attacks: FAST 2 open label study. Allergy 2013; 68: 1452–1459.
- [15] Lumry WR, Farkas H, Moldovan D, et al. Icatibant for Multiple Hereditary Angioedema Attacks across the Controlled and Open Label Extension Phases of FAST 3. Int Arch Allergy Immunol 2015; 168: 44–55.
- [16] Longhurst HJ, Aberer W, Bouillet L, et al. Analysis of characteristics associated with reinjection of icatibant: Results from the icatibant outcome survey. Allergy Asthma Proc 2015; 36: 399–406.
- [17] Farkas H, Kohalmi KV, Veszeli N, et al. First report of icatibant treatment in a pregnant patient with hereditary angioedema. J Obstet Gynaecol Res 2016; doi: 10.1111/jog.13003.
- [18] Lewis LM, Graffeo C, Crosley P, et al. Ecallantide for the acute treatment of angiotensin converting enzyme inhibitor induced angioedema: a multicenter, randomized, controlled trial. Ann Emerg Med 2015; 65: 204–213.
- [19] Li HH, Campion M, Craig TJ, et al. Analysis of hereditary angioedema attacks requiring a second dose of ecallantide. Ann Allergy Asthma Immunol 2013; 110: 168–172.
- [20] Krčmová I, Králíčková P. Hereditární a získaný angioedém. Postgrad Med 2015; 17: 252–259.
- [21] Zuraw BL, Kalfus I. Safety and efficacy of prophylactic nanofiltered C1 inhibitor in hereditary angioedema. Am J Med 2012; 125: 938–947.
- [22] Reshef A, Moldovan D, Obtulowicz K, et al. Recombinant human C1 inhibitor for the prophylaxis of hereditary angioedema attacks: a pilot study. Allergy 2013; 68: 118–124.
- [23] Gavigan G, Yang WH, Santucci S, et al. The prophylactic use of C1 inhibitor in hereditary angioedema patients undergoing invasive surgical procedures: a retrospective study. Allergy Asthma Clin Immunol 2014; 10: 17.
- [24] Farkas H, Zotter Z, Csuka D, et al. Short term prophylaxis in hereditary angioedema due to deficiency of the C1 inhibitor – a long term survey. Allergy 2012; 67: 1586–1593.
- [25] Caballero T, Farkas H, Bouillet L, et al. International consensus and practical guidelines on the gynecologic and obstetric management of female patients with hereditary angioedema caused by C1 inhibitor deficiency. J Allergy Clin Immunol 2012; 129: 308–320.
- [26] Bork K. A Decade of Change: Recent Developments in Pharmacotherapy of Hereditary Angioedema (HAE). Clin Rev Allergy Immunol 2016; DOI: 10.1007/s12016 016 8544 9.