Historie a perspektivy antiretrovirové terapie infekce HIV/AIDS
Vývoj nových antiretrovirových léčiv je závratný a rychlost, s jakou FDA (US Food and Drug Administration) schvaluje nová léčiva pro klinické použití, je nebývalá. Po uvedení zidovudinu, prvního nukleosidového inhibitoru reverzní transkriptázy, do klinické praxe v roce 1987 následovala další léčiva této skupiny, dále nenukleosidové inhibitory reverzní transkriptázy, proteázové inhibitory a inhibitory fúze. Vývoj nových antiretrovirových léčiv pokračuje nejen v již existujících skupinách, ale zahrnuje i antiretrovirová léčiva nové třídy, jako jsou inhibitory vstupu, inhibitory integrázy a inhibitory maturace, které demonstrují především vysokou virologickou účinnost v léčbě multirezistentních pacientů. I přes obrovské terapeutické pokroky nejsme dosud schopni dosáhnout eliminace viru HIV z infikovaného organismu.
Antiretrovirová terapie významně změnila klinický průběh infekce HIV – onemocnění dříve jednoznačně fatální se stalo onemocněním chronickým.
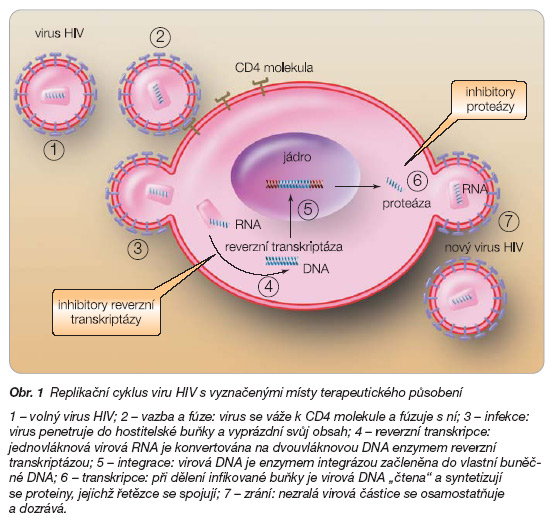
Díky obrovskému pokroku v oblastech základního výzkumu došlo postupně k většímu pochopení kinetiky replikace viru HIV, a tím i k identifikování míst, kde lze zasáhnout účinnou terapií (obr. 1). Na základě těchto poznatků se podařilo podstatně rozšířit terapeutické spektrum o nové protiretrovirové léky. Dalším důležitým výsledkem výzkumu bylo zjištění, že účinnost těchto léčiv lze monitorovat pomocí virové nálože RNA HIV v krvi pacienta. Následné klinické studie jasně prokázaly, že léčba kombinací antiretrovirotik je daleko účinnější a úspěšnější než monoterapie [1].
Historické mezníky v terapii infekce HIV
V letech 1981–1986 umírala většina pacientů infikovaných virem HIV do dvou let na oportunní infekce. Dobré klinické výsledky a etické důvody vedly v roce 1987 k předčasnému ukončení klinických studií a první antiretrovirové léčivo zidovudin bylo uvolněno pro léčbu infekce HIV. Efekt monoterapie tímto nukleosidovým inhibitorem reverzní transkriptázy byl ale limitován, úmrtí mladých lidí bohužel i nadále přibývalo. Velkým úspěchem podání zidovudinu bylo významné snížení neonatálního přenosu infekce HIV (z 25,5 % na necelých 8 %) [2]. Preventivní programy s léčbou zidovudinem u gravidních HIV pozitivních žen byly zavedeny již v roce 1994 ve všech zemích s vyspělým zdravotnictvím.
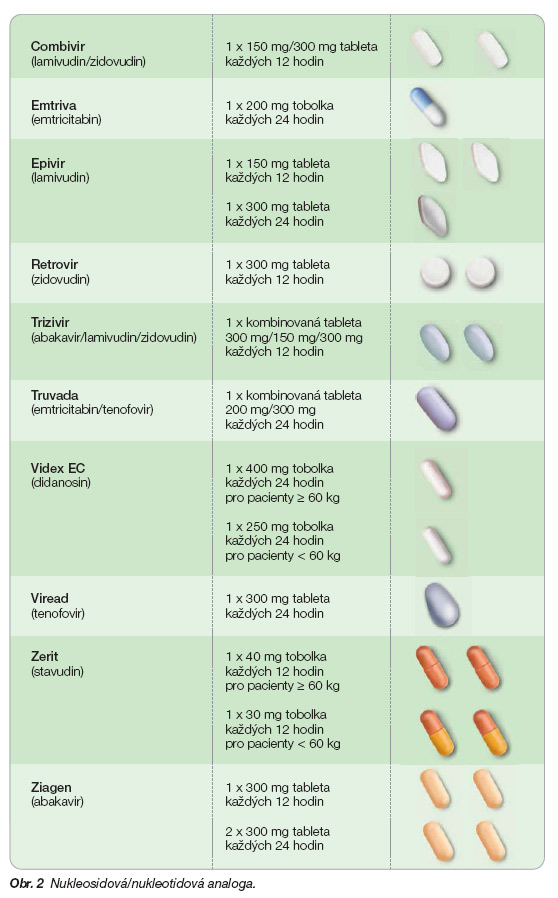
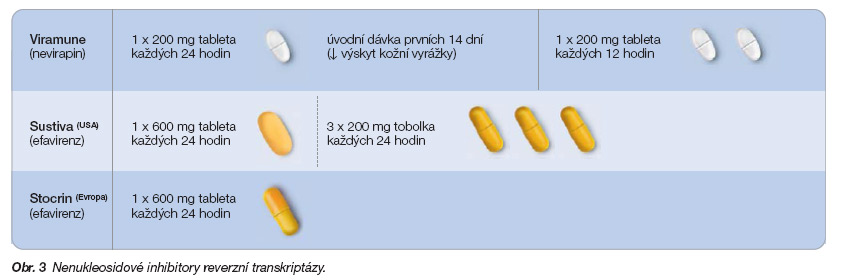
Vedle nukleosidových (NRTI) a nenukleosidových (NNRTI) inhibitorů reverzní transkriptázy (obr. 2 a 3) vstoupily na terapeutickou scénu v roce 1995 proteázové inhibitory (PI) (obr. 4).
V roce l996 se pro trojkombinaci antiretrovirových léčiv zavádí termín HAART (Highly Active Antiretroviral Therapy – vysoce účinná antiretrovirová terapie) [3]. HAART významně snížila morbiditu i mortalitu pacientů infikovaných virem HIV, ale již v roce l997 jsou popisovány první nežádoucí efekty terapie – lipodystrofie, řada metabolických komplikací a postupně dochází k rozvoji rezistence [4]. Vedle dalšího vývoje léků v již známých skupinách se uvažuje o zintenzivnění HAART pomocí imunoterapie (např. interleukin-2, interferon-a, faktor stimulující kolonie granulocytů) či pomocí některých onkologických léčiv (např. cytostatikum hydroxyurea).
Od roku 2000 vystupuje do popředí snaha o zlepšení adherence k léčbě prostřednictvím kombinace účinných látek v jedné tabletě (abakavir + lamivudin + zidovudin, zidovidin + lamivudin, lopinavir + ritonavir) [5].
V roce 2001 bylo schváleno klinické použití nukleosidového inhibitoru reverzní transkriptázy – tenofoviru. Jeho objevitelem je český vědec prof. RNDr. Antonín Holý, DrSc., z Ústavu organické chemie a biochemie Akademie věd ČR.
V roce 2003 schvaluje FDA (Food And Drug Administration) další léčivo – emtricitabin, který také pochází z „dílny" prof. Holého. Z nových proteázových inhibitorů byl rovněž v roce 2003 schválen fosamprenavir, při jehož podávání je vhodné využít booster efektu ritonaviru, podobně jako u jiných PI. Dalším léčivým přípravkem, který schválila FDA v roce 2003, byl enfuvirtid (obr. 5), který zabraňuje fúzi viru s hostitelskou buňkou. Jeho velkou nevýhodou je injekční aplikace 2krát denně a vysoká cena. Jde o léčivý přípravek, který je zařazen do kategorie záchranných léků.
Tipranavir – nový proteázový inhibitor – byl uveden do klinické praxe v roce 2005, je řazen mezi PI druhé generace, používá se spolu s ritonavirem, má jiné spektrum vzniku rezistence a je řazen také mezi léky záchranné terapie.
Přínos terapeutických antiretrovirových programů
Zlepšením imunitního profilu pacienta pomocí antiretrovirové terapie se tak daří oddálit výskyt oportunních infekcí, které jsou důsledkem těžké poruchy imunitního systému a byly jednou z hlavních příčin morbidity a mortality pacientů s onemocněním HIV/AIDS. U některých oportunních infekcí došlo k významnému snížení incidence, jiné v důsledku antiretrovirové terapie změnily svůj průběh, a dokonce se vyskytla i nová onemocnění spojená s oživením zánětlivé odpovědi (IRIS – Immuno Restitution Syndrom). Průběh dalších oportunních infekcí (např. kryptosporidióza) a nádorů (Kaposiho sarkom), dříve velmi špatně léčitelných, se nyní při léčbě kombinací antiretrovirotik velmi často podstatně zmírní [6].
Léčba je obvykle zahajována podáním kombinace dvou léčiv ze skupiny NRTI a jednoho PI nebo dvou NRTI a jednoho NNRTI. HAART režimy tvořené třemi NRTI nejsou v současné době považovány za dostatečně účinné. Terapii indikujeme:
1. u symptomatických pacientů (klinické stadium B a C), dále při zachycení akutního antiretrovirového syndromu;
2. při zhoršení laboratorních parametrů imunologických či virologických;
3. vždy v rámci profylaxe vertikálního přenosu infekce u gravidních žen a jejich novorozenců;
4. při postexpoziční profylaxi – při poranění HIV negativní osoby nástrojem kontaminovaným HIV pozitivním biologickým materiálem.
Nebývá obvykle problém zahájit léčbu některou z doporučených kombinací. Současný počet 23 léčivých přípravků nebo jejich kombinací nám umožňuje vytvořit stovky terapeutických režimů. Problém nastává u dlouhodobě léčených pacientů, kdy výběr použitelných léčiv je velmi omezen. Některá nelze podávat pro vysoké riziko závažných nežádoucích účinků, jiná pro rozvoj rezistence či špatnou adherenci pacienta. V rámci skupiny antiretrovirotik dochází k řadě možných interakcí, které mohou pacienta poškodit poklesem účinnosti léčby nebo zvýšením toxicity [7]. Některá jsou dokonce cíleně využívána v terapii – např. farmakokinetický boosting PI pomocí malých dávek ritonaviru.
Současným trendem je především zlepšení adherence k léčbě, která má pro úspěch léčebného postupu prvořadý význam. Pokud není možno zajistit adherenci > 95 %, může se velmi rychle vyvinout rezistence. Proto pokračuje snaha kombinovat více účinných látek v jedné tabletě (např. tenofovir + emtricitabin, lamivudin + abakavir, emtricitabin + tenofovir + efavirenz – v EU není dosud schváleno použití) a pokud možno snížit počet užívaných tablet a upravit jejich dávkování na maximálně 2krát denně.
Kontrola progrese infekce HIV u pacientů, kteří byli exponováni již řadě antiretrovirových léčiv, je jedním z nejdůležitějších aspektů HIV medicíny. Dlouhodobá HAART vede k široce rozšířenému výskytu multirezistence HIV na antiretrovirová léčiva, důsledkem je pak nekompletní suprese virové replikace. Častá je i zkřížená rezistence mezi jednotlivými antiretrovirovými skupinami. Uplatňují se i další faktory ovlivňující účinnost léčby, ať dané biologickými vlastnostmi samotného viru HIV či farmakologickými vlastnostmi konkrétní medikace [8]. Strategie mega-HAART, která byla propagována před několika lety, se ukázala jako nepříliš vhodná pro vysokou toxicitu léků a špatnou adherenci k léčbě [9]. A toto vše jsou podstatné důvody, proč jsou do stávajícího tak širokého terapeutického spektra zařazovány stále nové antiretrovirové látky.
Nová antiretrovirová léčiva
Vývoj nových antiretrovirových léčiv se děje v rámci již existujících tříd (NRTI, NNRTI, PI) nebo se dostávají do klinického zkoušení antiretrovirová léčiva nové třídy (jako jsou inhibitory integrázy, inhibitory maturace, inhibitory vstupu). Nové antiretrovirové léky demonstrují především vysokou virologickou účinnost u multirezistentních pacientů.
Nové proteázové inhibitory (PI) II. generace
Tipranavir byl schválen FDA k užívání v červnu 2005, v EU pak o rok později, v červnu 2006 [10]. V kombinaci s ritonavirem je doporučován u viremických pacientů, kteří mají již dlouhodobou zkušenost s HAART nebo u nemocných se zjištěnou multirezistencí k PI. Podává se 2krát denně s jídlem v dávce 500 mg v kombinaci s ritonavirem (200 mg). Může být kombinován s NRTI i NNRTI (ke kombinaci není vhodný efavirenz). Nepříznivým vedlejším účinkem je kožní rash, nedoporučuje se u pacientů s koinfekcí hepatitidy. Tipranavir se zkoušel také u pacientů dosud neléčených, ale v současnosti jsou klinické studie zastaveny. Tipranavir je již k dispozici i v našich AIDS centrech.
Darunavir (TMC 114) je nonpeptidický PI, jehož užívání bylo povoleno FDA v červnu 2006 [11]. Je indikován v kombinaci s ritonavirem u pacientů, jejichž infekce HIV kvůli multirezistenci již neodpovídá na léčbu jinými antiretrovirovými léčivy [12]. Je stejně jako tipranavir řazen do „záchranné terapie". Výsledky studií in vitro potvrdily relativně vysokou odolnost ke vzniku rezistence. Podává se 2krát denně 600 mg + 100 mg ritonaviru. Z vedlejších účinků jsou popisovány průjem, bolesti břicha, nauzea, laboratorně zvýšení hladiny jaterních enzymů, amylázy a zvýšení hladiny lipidů. Byly zahájeny i studie s podáváním tohoto léčiva v časné fázi infekce v kombinaci s tenofovirem a emtricitabinem ve snížené jedné denní dávce 800 mg/100 mg ritonaviru.
Brecanavir (GW 640385) je také nonpeptidický PI ve II.b fázi klinického zkoušení [13]. V časných studiích in vitro byla prokázána 10–100krát vyšší účinnost než u PI první generace. Byl signifikantně účinný proti kmenům HIV, které jsou multirezistentní k léčbě ostatními PI. Bude proto určen především k terapii pacientů se selháním HAART v důsledku multirezistence. Podává se 2krát denně s ritonavirem (300 mg/100 mg). Nepříjemným vedlejším účinkem jsou dyspeptické obtíže a únava, laboratorně bylo zaznamenáno zvýšení hladiny kreatinkinázy a jaterních enzymů, hypertriglyceridémie. Vzhledem k vysoké účinnosti probíhají další studie, které by měly objasnit eventuální použití brecanaviru v iniciální terapii či jeho použití u pacientů dosud neléčených. Zkoušejí se kombinace se dvěma NRTI (např. s didanosinem, lamivudinem, zidovudinem, stavudinem, emtricitabinem).
Nové nenukleosidové inhibitory reverzní transkriptázy (NNRTI)
Etravirin (TMC 125). Prozatímní slibná data ze studií in vitro i in vivo prokazují vysokou aktivitu tohoto diarylpyrimidinového derivátu NNRTI vůči divokému typu HIV-1 a variantám viru rezistentním k NNRTI. Lék má i dobrý a bezpečný počáteční profil. Podává se 2krát denně v dávce 200 mg. Zajímavé budou jistě výsledky studie DUET (darunavir + etravirin + NRTI) u pacientů s dokumentovanou rezistencí k NNRTI a nejméně se třemi primárními PI mutacemi. Rovněž dodatečné studie o lékové interakci etravirin-enfuvirtid a etravirin-ostatní boostované PI budou důležité pro určení úlohy TMC 125 v antiretrovirové terapii [14].
Látka TMC 278 je dalším představitelem NNRTI, se kterým zatím probíhají studie, klinická data však nebyla dosud prezentována [15]. Předpokládá se dobrá účinnost na rezistentní varianty viru. Srovnávací studie různých dávek TMC 278 oproti efavirenzu v kombinaci s NNRTI by měly proběhnout u dosud neléčených pacientů. Výhodou bude podávání léčiva 1krát denně oproti TMC 125, který je podáván ve dvou denních dávkách.
Nové nukleosidové inhibitory reverzní transkriptázy (NRTI)
Ve vývoji je řada nových komponent, nejvíce poznatků je zatím o elvucitabinu a amdoxoviru.
Elvucitabin (L-Fd4c) má i signifikantní účinek vůči viru hepatitidy B (HBV). V časném klinickém zkoušení byla limitujícím faktorem suprese kostní dřeně. Proto při dalším zkoušení tohoto léčiva u dobrovolníků byla snížena dávka. Plánuje se jeho použití především u pacientů dosud neléčených, ale není vyloučeno i zařazení elvucitabinu do terapeutického programu pacientů se zkušeností s antiretrovirovou léčbou [16]. Pravděpodobné bude i využití léčiva u koincidence infekcí HIV a HBV (podobně jako v současnosti u lamivudinu).
Amdoxovir (DAPD) je nový dioxalan-purinový analog, který rychle konvertuje pomocí adenosin deaminázy na D-dioxalan guanin, metabolit, který je aktivní vůči HIV, ale i HBV [17]. Jeho vývoj není ještě zcela jasný, stejně jako u AVX 754, který sice projevuje antivirovou aktivitu, ale teprve budoucnost a vyhodnocení zkoušek ukážou, jaké bude jeho místo.
Antiretrovirová léčiva s novým mechanismem působení
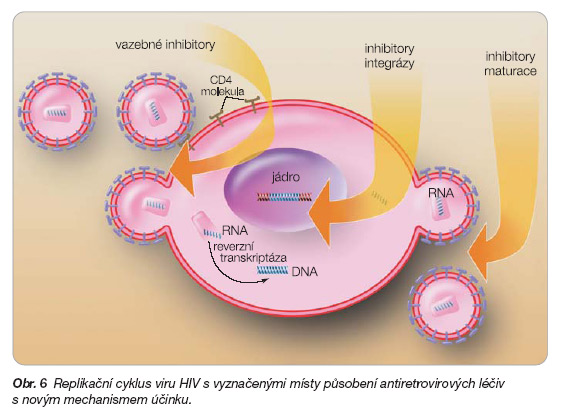
Místa terapeutického působení antiretrovirových léčiv s novým mechanismem účinku ukazuje obr. 6.
Inhibitory vstupu
Vstup HIV-1 do cílové buňky je první fází replikačního cyklu viru. Jde o vícestupňový proces, který zahrnuje interakci virového obalového proteinu se specifickým receptorem hostitelské buňky. Vývoj nových inhibitorů vstupu představuje možnost léčby novou skupinou chemicky odlišných komponent, jejichž cílem jsou proteiny a receptory buněk hostitele [18].
Prvním krokem při vstupu HIV-1 do buňky je vazba virového obalu na molekulu CD4 na povrchu makrofágů nebo T lymfocytů. Vedle molekuly CD4 jsou dále ke vstupu využívány chemokinové koreceptory CXCR4 (pro kmeny virů, které produkují syncytia) a CCR5 (pro kmeny, které neprodukují syncytia). Většina kmenů HIV-1 používá ke vstupu do buňky koreceptor CCR5, který je exprimován hlavně na paměťových CD4+ T buňkách. Tyto buňky mají schopnost odpovídat na již dříve rozpoznaný patogen. CCR5 je rovněž exprimován na dendritických buňkách, které se nalézají v mukóze, a je možné, že právě tyto buňky jsou prvním cílem pro HIV při sexuálním kontaktu. Důležitou úlohu zde hraje zřejmě i genotyp HIV. Homozygotní jedinci s delecí d-32 na genu pro CCR5 postrádají funkční receptor, a jsou tudíž rezistentní k infekci HIV. Incidence této CCR5-d-32 homozygozity je v severoevropské populaci asi 1 %.
Aplavirok, maravirok a vicriviroc jsou nízkomolekulární inhibitory CCR5, které jsou vysoce účinné in vitro proti širokému počtu kmenů HIV-1 všech dosud známých subtypů [19]. Nejsou účinné proti virům, které využívají receptor CXCR4 pro vstup do CD4+ T buněk. Nebyl popsán antagonismus s ostatními antiretrovirovými léčivy in vitro, synergie s enfuvirtidem zjištěná in vitro by jistě významně rozšířila možnost záchranné terapie. Výsledky počátečních klinických zkoušek se zdravými dobrovolníky uváděly především posturální hypotenzi, později byly další klinické zkoušky přerušeny pro hepatotoxicitu s výskytem hepatocelulární nekrózy (především u léčiv maravirok a aplavirok). Léčba vicrivirocem byla v některých případech spojována s výskytem lymfomu. Klinické studie nyní pokračují s použitím nižších dávek.
Inhibitory CCR5 („mikrobicidy") jsou určeny jako účinná agens pro prevenci transmise HIV na úrovni vaginální nebo rektální sliznice. Měly by být aplikovány lokálně. Studie jsou zatím prováděny s opičími modely a dosavadní výsledky jsou slibné.
AMD3100 a AMD11070 jsou inhibitory molekuly CXCR4. Toxikologické studie u zvířecích modelů prokázaly dobré výsledky a umožnily přípravu klinických studií. Nicméně předběžné výsledky ukazují prolongaci úseku QT na EKG. Dalším nepříznivým účinkem je vzestup počtu leukocytů.
Vývoj inhibitorů vstupu HIV do hostitelské buňky je ve slibných počátcích, ale vyžádá si ještě řadu náročných studií. Uvedení do praktického využití je pravděpodobně ještě otázkou několika let.
Inhibitory integrázy
Integráza je enzym, který integruje dvouvláknovou virovou DNA do DNA hostitelského chromozomu [20]. Již v minulosti byla učiněna řada pokusů s inhibicí integrázy, ale příčinou nezdaru byla vysoká toxicita, která byla zaznamenána u zvířecích modelů. Od roku 2005 je vedoucím kandidátem této nové skupiny MK 0518, který prokazuje in vitro vysokou aktivitu proti HIV u multirezistentních pacientů [21, 22]. Neočekává se ani zkřížená rezistence s ostatními antiretrovirovými třídami. Předpokládá se indikace v „záchranné léčbě" u multirezistentních pacientů (rezistence k terapii nejméně jedním léčivem z každé základní skupiny – NRTI, NNRTI i PI). Významné nežádoucí účinky zatím nebyly zveřejněny. Podobně i druhý integrázový inhibitor GS-9137 (JTK-303) bude zařazen do „záchranné terapie" [23]. Studie potvrdily potenciální synergii s ostatními antiretrovirovými léčivy a dobrou snášenlivost. Byl představen poprvé v roce 2006.
Inhibitory maturace
PA-457 je první v této nové třídě antiretrovirových léčiv [24]. Zkouší se u dosud neléčených pacientů i u pacientů s dlouhou léčebnou zkušeností. PA-457 zasahuje do průběhu tvorby Gag proteinu inhibicí konverze kapsidového prekurzoru (p25) na zralý kapsidový protein (p24). Výsledkem je defektní jádrová kondenzace a uvolnění neinfekčních virových partikulí z buněk infikovaných HIV-1, a tím zablokování šíření infekce do nových hostitelských buněk. Vzhledem k novému mechanismu účinku se očekává, že toto léčivo bude účinné proti multirezistentním variantám viru.
Závěr
Teprve budoucnost ukáže, do jaké míry mají tyto nové komponenty kontrolu nad virovou replikací, rozvojem rezistence a vývojem závažných nežádoucích účinků. HAART je zcela nepochybně jedním z největších úspěchů posledních let, ale je třeba si uvědomit, že tato terapie má i své vážné nedostatky. Stále častěji se setkáváme a budeme se setkávat s nejrůznějšími problémy spojenými s dlouhodobým podáváním antiretrovirotik. Bude se zvyšovat výskyt závažných nežádoucích účinků antiretrovirové terapie, bude narůstat rezistence HIV k léčbě jednotlivými antiretrovirotiky i celými skupinami a pravděpodobně se u některých pacientů nepodaří dosáhnout účinné hladiny antiretrovirotika v plazmě – ať už pro nedodržování léčebného režimu či v důsledku interakce s jinými léky. Velkým problémem zůstává vysoká cena této léčby.
Základním a nejpodstatnějším úskalím HAART – i přes neustálé zařazování nových, stále účinnějších léčiv – zůstává především nemožnost kompletní eliminace viru z organismu. Kauzální lék na infekci HIV neexistuje, infekci HIV dovedeme sice léčit, ale ne vyléčit. Výchova a preventivní programy by měly zůstat i nadále prioritou.
Seznam použité literatury
- [1] Staňková M, Skokanová V. Problematika HIV/AIDS – ohlédnutí a perspektivy. Klin Mikrobiol Inf Lék 2004; 10: 56–60.
- [2] Connor EM, Sperling RS, Gelber R, et al. Reduction of maternal-infant transmission of human immunodeficiency virus type 1 with zidovudine treatment. N Engl J Med 1994; 331: 1173–1180.
- [3] Hammer SM, Squires KE, Hughes MD, et al. A controlled trial of two nucleoside analogues plus indinavir in persons with human immunodeficiency virus infection And CD4 cell counts of 200 per cubic milimeter or less. AIDS Clinical Trials Group 320 Study Team. N Engl J Med 1997; 337: 725–733.
- [4] Carr A, Samaras K, Thorisdottir A, et al. Diagnosis prediction and natural sourse of HIV-1 protease-inhibitor-associated lipodystrophy, hyperlipidemia and diabetes mellitus: a cohort study. Lancet 1999; 353: 2093–2099.
- [5] Pomerantz RJ, Horn DL. Twenty years of therapy for HIV-1 infection. Natur Med 2003; 7: 867–873.
- [6] Staňková M. Změna klinického obrazu HIV infekce při současných možnostech HAART. Trendy v medicíně 2001; 3: 17–20.
- [7] Machala L, Černý R. Nevhodné kombinace antiretrovirotik. Klin Mikrobiol Inf Lék 2004; 10: 241–243.
- [8] Department of Health and Human Services. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. May 6, 2006. Available at http://aidsinfo.nih.gov/guidelines, Accessed June 22, 2006.
- [9] Montaner JS, Harrigan PR, Jahne N, et al. Multiple drug rescue therapy for HIV-infected individuals with prior virologic failure to multiple regiment. AIDS 2001; 15: 61–69.
- [10] Parkin N, Chappey C. Protease mutations associate with high or lower than expected tipranavir susceptibility based on the TPV mutation score. Program and abstracts of the 13th Conference on Retroviruses and Opportunistic Infections; February 5–8, 2006; Denwer, Colorado. Abstract 637.
- [11] Koh Y, Nakata H, Maeda K, et al. Novel bis-tetrahydrofuranylurethane-containing nonpeptidic protease inhibitor (PI) UIC-94017 (TMC114) with potent activity against multi-PI-resistant human immunodeficiency virus in vitro. Antimicrob Agents Chemother 2003; 47: 3123–3129.
- [12] Demeyer S, Hill A, Debaere I, et al. Effect of baseline susceptibility and on-treatment mutations on TMC 114 and control PI efficacy: preliminary analysis of data from PI-experienced patients from POWER 1 and POWER 2. Program and abstracts of the 13th Conference on Retroviruses and Opportunistic Infections; February 5–8, 2006; Denwer, Colorado. Abstract 157.
- [13] Ford SL, Shelton MJ, Murray SC, et al. A study to investigate the interaction betwen 640385/ritonavir (640835/r) and tenofovir (TDF) in healthy subjects. Program and abstracts of the 45th Interscience Conference on Antimicrobial Agents and chemotherapy; December 16–19, 2005; Washington, DC. Abstract A-1198.
- [14] Tibotec. TMC125. Available at: http//www.tibotec.com/bgdisplay.jhtml?itemname=HIV_tmc125. Accessed April 13, 2006.
- [15] Tibotec. TMC278. Available at: http//www.tibotec.com/bgdisplay.jhtml?itemname=HIV_tmc278. Accessed April 13, 2006.
- [16] Dunkle LM, Gathe JC, Pedevillano DE, et al. Elvucitabine: potent antiviral activity demonstrated in multidrug-resistant HIV infection. Program and abstracts of the 12th International HIV Drug Resistance Workshop; June 10–14, 2003; Los Cabos, Mexico. Abstract 2.
- [17] Gripshover B, Santana J, Ribaudo H, et al. A randomized, placebo-controlled trial of amdoxovir vs placebo with enfuvirtide plus optimized back-ground therapy for HIV-infected subjects failing current therapy (AACTG 5118). Program and Abstracts of the 12th Conference on Retroviruses and Opportunistic Infections; February 22–25, 2005; Boston Massachusetts. Abstract 553.
- [18] Kuritzkes DR. Progress of entry inhibitors: Where are we now and where are we going. 26–45. In HIV/AIDS Annual update 2006 edited by Phair JP, Poppa A, King E. Published by Clinical Care Options HIV 2006.
- [19] Fatkenheuer G, Pozniak AL, Johnson MA, et al. Efficacy of short-therm monotherapy with maraviroc, a new CCR5 antagonist, in patients infected with HIV-1. Nat Med 2005;11:1170–1172.
- [20] Little S, Drusano G, Schooley E, et al. Antiretroviral effect of L-000870810, a novel HIV-1 integrase inhibitor, in HIV-1 infected patients. Program and Abstracts of the 12th Conference on Retroviruses and Opportunistic Infections; February 22–25, 2005; Boston Massachusetts. Abstract 161.
- [21] Morales-Ramirez JO, Teppler H, Kovacs C, et al. Antiretroviral effect of MK-0518, a novel HIV-1 integrase inhibitor, in ART-naive HIV-1 infected patients. Program and Abstracts of the 10th European AIDS Conference; November 17–20, 2005; Dublin, Ireland. Abstract LBPS1/6.
- [22] Grinsztejn B, Nguyen BY, Katlama C, et al. Potent antiretroviral effect of MK-0518, a novel HIV-1 integrase inhibitor, in patients with triple-class resistant virus. Program and abstracts of the 13th Conference on Retroviruses and Opportunistic Infections, February 5–8, 2006; Denver, Colorado. Abstract 159LB.
- [23] DeJesus E, Berger D, Markowitz M, et al. The HIV integrase inhibitor GS-9137 (JTK-303) exhibits potent antiviral activity in treatment-naive and experienced patients. Program and abstracts of the 13th Conference on Retroviruses and Opportunistic Infections, February 5–8, 2006; Denver, Colorado. Abstract 160LB.
- [24] Beaty G, Lalezari J, Eron J, et al. Safety and antiviral activity of PA-457, the first-in-class maturation inhibitor, in a 10-day monotherapy study in HIV-1 infected patients. Program and abstracts of the 45th Interscience Conference on Antimicrobial Agents and chemotherapy; December 16–19, 2005; Washington, DC. Abstract H-416d.