HPV asociované gynekologické léze v dospělém věku
Infekce ženského genitálního traktu lidskými papilomaviry (HPV) patří k nejrozšířenějším sexuálně přenosným onemocněním. Některé typy HPV mohou způsobit vznik dysplastických slizničních změn a následných malignit urogenitálního traktu (karcinom děložního čípku, anální karcinom, karcinom penisu a vulvy). U pacientů léčíme pouze viditelné léze, subklinické stavy neléčíme a ani se nesnažíme o eradikaci virů ze tkání. Prevencí proti získání HPV infekce je očkování.
HPV infekce je považována za nejrozšířenější pohlavně přenosnou chorobu. Některé studie odhadují, že většina sexuálně aktivní dospělé populace (odhaduje se dokonce, že se jedná až o 75–80 %) je v průběhu života vystavena jednomu nebo více typům HPV virů (avšak infekce často proběhne bezpříznakově). Lidský papilomavirus patří mezi DNA viry (obr. 1). Jedná se o běžný virus, který postihuje jak muže, tak i ženy. Existuje více než 100 typů HPV, které mohou působit na různé oblasti těla. 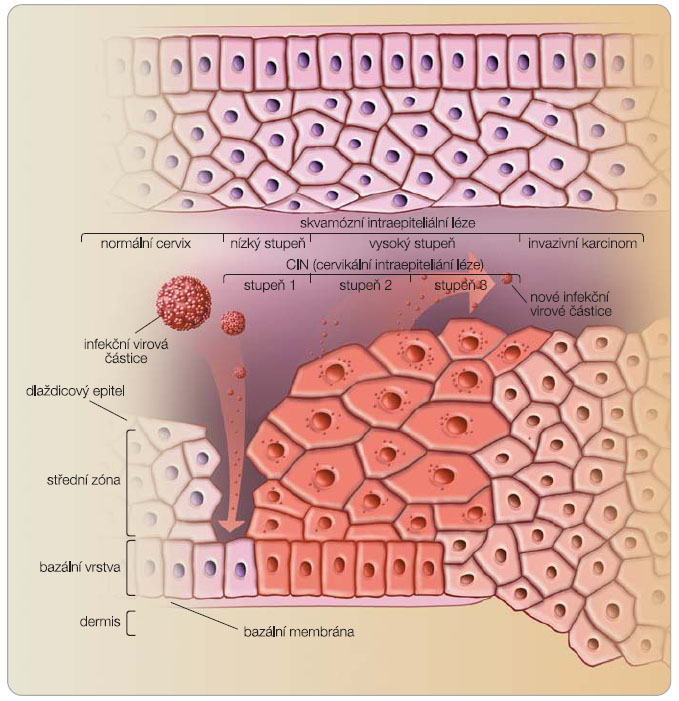 Asi 30 typů HPV postihuje oblast genitálií a jsou známé jako genitální lidské papilomaviry.
Asi 30 typů HPV postihuje oblast genitálií a jsou známé jako genitální lidské papilomaviry.
Vysoce rizikové typy humánního papilomaviru (HR HPV; high risk HPV) jsou kauzální příčinou celé řady karcinomů a prekanceróz. Jasně dominují gynekologické zhoubné nádory; HPV viry jsou nejčastější sexuálně přenášenou infekcí a v průběhu života se s nimi setká až 80 % populace. Nákaza HR HPV však ještě neznamená následný vznik zhoubného nádoru. V mnoha případech (např. rakovina děložního hrdla) se jedná o podmínku nezbytnou k jeho rozvoji. Schematické znázornění nákazy HPV virem ukazuje obr. 2.
V následujícím přehledu je uvedena prevalence HR HPV v jednotlivých podskupinách gynekologických zhoubných nádorů a průměrný absolutní počet těchto nádorů v ČR za poslední roky:
- 98–99 % karcinomů děložního hrdla (1100/rok)
- 90 % prekanceróz vulvy
- 40 % karcinomů vulvy (180/rok)
- 100 % kondylomat vulvy
- 90 % prekanceróz pochvy
- 50 % karcinomů pochvy (40/rok).
Graf 1 uvádí procentuální výskyt karcinomů asociovaných s onkogenními typy HPV virů.
![Graf 1 Procentuální výskyt karcinomů asociovaných s onkogenními typy HPV virů; podle [10, 11] – Herrero, et al., 2003; WHO, 1999.](https://www.remedia.cz/photo-a-28076---.jpg)
Současné znalosti o patogenezi HPV infekce jsou dynamicky modifikovány nově příchozími studiemi a poměrně radikálně mění dosavadní názory na kritéria vzniku skupin rizikových z hlediska nádorových onemocnění, včetně změn v klinické praxi a ve screeningových modelech. Prospektivní follow-up studie u středoškolaček ve Spojených státech nalezla u primárně HPV negativních žen po zahájení pohlavního života 30% HPV pozitivitu do 12 měsíců, do 48 měsíců bylo HPV pozitivních už 54 % žen [1]. Jiné studie dokumentovaly až 80% pozitivitu po pěti letech od zahájení pohlavního života. Naprostá většina HPV infekcí je ale zvládnuta vlastní buněčnou imunitou hostitele. U mladých žen je prokázána eliminace HPV infekce v 60 % do 12 měsíců a v 80 % v období 23 měsíců od průniku viru do těla hostitelky [2]. V jiné studii – prezentoval ji Moscicki a kol. v roce 2004 – bylo prokázáno spontánní vymizení lehkých prekanceróz děložního hrdla u mladých žen v 91 % případů v období 36 měsíců [3, 4].
Nejvyšší prevalence HPV infekce je pozorována ve věku 20–25 let. Ve věku 35 let je prevalence HPV udávána na úrovni 5 %. Jiná studie popisuje prevalenci HR HPV ve věku vyšším než 45 let jako stabilizovanou na úrovni 5 % a u žen stejné věkové kategorie s negativní cytologií popisuje tato práce HR HPV prevalenci na hladině 3 %. Celý tento proces je dán vlastní buněčnou imunitou. Ženy se však většinou vyrovnávají se specifickou HPV infekcí vázanou na konkrétní typ, ale i přesto tato dlouhodobá, možná i celoživotně vybudovaná imunita nezabrání infekci jiným HPV typem. Existoval teoretický předpoklad, že ženy v dospělém věku s normálním gynekologickým vyšetřením a HPV negativitou jsou v minimálním riziku pro rozvoj cervikálního karcinomu. Aktuálně publikované práce tento názor opravují. Studie na kolumbijských ženách prokázala riziko nově získané HPV infekce v průběhu 5 let pro kohortu žen ve věku 30–44 let na úrovni 20 % a ve věku nad 45 let se pětileté riziko pohybuje stále na hladině 11 %. Jiná práce prokázala kumulativní prevalenci HPV infekce u 45–64letých žen ve výši 34 % a 24 % pro HR HPV. V této věkové kohortě byl nejčastěji detekován HPV HR typ 16 (v 72 % případů) [5].
Nové informace pro nás znamenají, že ženy jsou ohroženy celoživotním rizikem nákazy HPV infekcí. Toto riziko je u starších žen menší v porovnání s dívkami v období adolescence. Oproti tomu u starších žen dominuje perzistentní infekce a tento moment je klíčovým pro vznik HPV asociovaných prekanceróz a karcinomů [6].
Prekancerózy a zhoubné nádory vulvy
Zhoubné nádory vulvy nepatří k častým onemocněním. Jejich incidence se však v ČR dlouhodobě postupně zvyšuje a nyní se pohybuje na úrovni 5 případů ze 100 000. S tímto onemocněním je poměrně významně asociována HPV infekce. HR HPV detekujeme zhruba u 90 % prekanceróz, samotné karcinomy vulvy jsou s HR HPV asociovány přibližně ve 40 % případů. Vulvární karcinomy jsou doménou hlavně pokročilého věku (sedmé a osmé decennium), nicméně celosvětově se setkáváme s nárůstem vulvárních prekanceróz a HPV asociovaných karcinomů v nižším věku (čtvrté až šesté decennium). V rozvinutých zemích se udává roční nárůst těchto lézí o 2,4 %. Velmi obtížně se hledají v literatuře data o zvyšování počtu prekanceróz vulvy (vulvar intraepithelial neoplasia – VIN; vulvární intraepiteliální neoplazie). Problém spočívá v tom, že tato data nepodléhají povinné statistice, v roce 2004 došlo ke změně klasifikace VIN a většinou se v publikacích jedná o tzv. single institution studies. Nicméně data dostupná při aproximaci na aktuální klasifikaci ukazují vzestup výskytu VIN v USA v období 1973–2000 o 411 %, ve stejném období byl zaznamenán nárůst počtu vulvárních karcinomů o 20 %. Norský registr ukazuje na nárůst incidence VIN u žen do 40–49 let věku s následným poklesem. Obráceně výskyt invazivních nádorů vulvy v tomto registru stoupá po 50. roce života bez jasného vrcholu.
V roce 2004 došlo ke změně klasifikace prekanceróz vulvy. Aktuálně rozlišujeme typický HPV asociovaný VIN a VIN diferencovaný non-HPV asociovaný. HPV asociované VIN jsou doménou mladšího věku, klinicky se prezentují většinou multifokálními lézemi a představují až 90 % všech diagnostikovaných případů VIN. Non-HPV asociované prekancerózy se označují jako diferencovaný VIN. Tyto léze vznikají převážně na podkladě lichenózních trofických změn u starších žen. Většinou se jedná o léze unilokulární s velmi agresivním potenciálem k růstu a přeměně v invazivní karcinom. Představují přibližně 10 % diagnostikovaných prekanceróz vulvy. Na základě typických HPV asociovaných VIN vzniká cca 30–40 % HPV asociovaných invazivních karcinomů vulvy. Ve skupině prekanceróz dominuje HPV 16 v 72 % případů. V kohortě všech invazivních karcinomů detekujeme HPV 16 v 30 % případů. Zhruba 70 % karcinomů vulvy vzniká na základě diferencovaných VIN, pravděpodobně kvůli jejich vyšší agresivitě a nižší možnosti detekce prekanceróz u starší populace.
Kondylomata vulvy
Kondylomata představují benigní sexuálně přenosné afekce zevního genitálu, perinea a anální oblasti žen a mužů, jež jsou způsobeny málo rizikovými typy humánního papilomaviru (LR HPV; low risk HPV). Dominantními typy jsou HPV 6 a HPV 11 (94 % případů). Ve 3 % infekcí můžeme diagnostikovat kombinaci LR HPV a HR HPV, ve 3 % případů jsou prezentovány jiné typy HPV. Nejvyšší výskyt spadá do období 20–24 let věku, a to u obou pohlaví stejně. Aktuálně dostupná data jsou podobná datům vztahujícím se k HR HPV. I ve vyšším věku stále přetrvává riziko nákazy novou LR HPV infekcí asociovanou se vznikem kondylomat zevního genitálu.
Prekancerózy a zhoubné nádory děložního hrdla
Incidence zhoubných nádorů děložního hrdla se v ČR dlouhodobě pohybuje na úrovni 19–20 případů ze 100 000, což představuje v našich podmínkách cca 1100 nově diagnostikovaných onemocnění ročně. HR HPV infekce je klíčovým momentem pro rozvoj této nemoci, v 70 % je příčinou typ HPV 16 nebo HPV 18. Jedná se o chorobu plně preventabilní na základě organizovaného screeningu. Přesný počet nově diagnostikovaných a dispenzarizovaných prekanceróz v ČR není znám, odhaduje se ošetření asi 10–13 tisíc prekanceróz děložního hrdla ročně.
Prevalence HPV v jednotlivých věkových kohortách je popsána v úvodu článku. Maximum prekanceróz je ošetřováno v průměrném věku 30–35 let. V ČR je první pík incidence zhoubných nádorů děložního hrdla přibližně ve věku 45 let, v této kategorii se jedná většinou o tzv. časná stadia, kdy je výskyt nádoru omezen na oblast děložního hrdla. Tato stadia jsou primárně indikována k léčbě chirurgické. Druhý vrchol incidence se nachází ve věku 65 let, zde diagnostikujeme většinou stadia pokročilá, primárně nevhodná k operační léčbě. Podobný průběh věkové distribuce je ve všech rozvinutých zemích. Aktuální data o možnosti nově získané infekce ve vyšším věku vysvětlují přetrvávající riziko vzniku neoplazie děložního hrdla i ve vyšších věkových kategoriích [5, 6].
Možnosti prevence
Z epidemiologického hlediska rozlišujeme prevenci primární, sekundární a terciární. Pro prekancerózy děložního hrdla existují screeningové mechanismy založené na pravidelných odběrech cytologických stěrů z děložního hrdla – sekundární prevence. Pokud je screening založen pouze na cytologii, jeho senzitivita se pohybuje na úrovni 60–70 %. Pokud je založen na onkologické cytologii a je kombinován s HR HPV testací, dosahuje 98–100% senzitivity. Aktuálně je od 1. 1. 2009 v ČR zaveden organizovaný, věkem nelimitovaný screening, založený na ročních odběrech onkologické cytologie [7–9].
- Čtyři roky je na trhu k dispozici HPV vakcína, která znamená zcela revoluční krok v onkologické prevenci. Je schopna na úrovni primární prevence zabránit rozvoji vzniku nádoru. Jedná se o vakcínu vysoce efektivní. Na trhu je k dispozici vakcína bivalentní proti HR HPV typu 16 a 18 a vakcína kvadrivalentní proti HR HPV typu 16 a 18 v kombinaci proti LR HPV typu 6 a 11. Účinnost obou vakcín je k aktuálnímu datu 100% proti očkovaným typům virů, díky zkřížené účinnosti a fylogenetické podobnosti mezi jednotlivými typy HPV představuje více než 80% ochranu proti vzniku rakoviny děložního hrdla. Pro kvadrivalentní vakcínu jsou k dispozici i data na ochranu proti prekancerózám a karcinomům vulvy, stejně tak proti kondylomatům zevního genitálu. Data publikovaná v roce 2009 prokázala vysokou efektivitu kvadrivalentní vakcíny v prevenci nádorového onemocnění u žen ve věku 24–45 let.
Pro aktuální gynekologickou praxi a prevenci nádorových onemocnění v roce 2010 lze zdůraznit tři momenty. - Organizovaný screening založený na akreditovaných laboratořích představuje účinný model sekundární prevence. Cílem screeningu je vyhledat přednádorové stavy nebo časná invazivní stadia. Ke screeningovému vyšetření je vhodná metoda, která není invazivní, je reprodukovatelná a zaručuje kontrolu kvality. Cytologické stěry odebrané z děložního hrdla splňují popisovaná kritéria. Pro úspěšný screening je nutno zajistit akreditované laboratoře splňující kritéria kvality a dostatečné pokrytí cílové populace. V ČR byl zahájen aktivní screening k datu 1. 1. 2009, je ustanoven seznam akreditovaných laboratoří a ženy jsou aktivně zvány k odběrům. Tento aktivní systém by měl v následujících letech (jak jsme zaznamenali v jiných zemích) razantně snížit incidenci cervikálního karcinomu. Efektivitu systému lze zvýšit zavedením HR HPV testace do screeningového systému, k čemuž zatím v ČR nedošlo.
- Čtvrtým rokem je k dispozici možnost naprosto ojedinělé primární prevence – HPV vakcinace. Jako nejefektivnější se ukázala vakcinace tzv. HPV naivních dívek, které se ještě nesetkaly s infekcí HPV, nejlépe těsně před zahájením pohlavního života. Z epidemiologického hlediska, abychom mohli vysledovat populační efekt vakcíny na pokles incidence onemocnění, by bylo nutné plošně očkovat opakovaně celé generace mladých dívek. Toto je zatím v našich podmínkách nereálné, proto zůstává úhrada vakcinace na individuální bázi jako zcela unikátní ochrana vlastního zdraví. V tomto smyslu bychom měli informovat naše klientky.
- Důležitou a novou informací je fakt, že přetrvává riziko nově získané HPV infekce do vyššího věku, což spolu s perzistující HR HPV infekcí představuje zcela zásadní riziko pro vznik gynekologické neoplazie. Nově dostupná data prokazují efektivitu kvadrivalentní vakcíny v populaci žen ve věku 24–45 let jako protekci proti vzniku prekanceróz a invazivních nádorů zevního genitálu. Protekce v této skupině je prokázána 92% redukcí perzistentních infekcí a 91% redukcí HPV asociovaných lézí genitálu proti vakcinovaným virům v proočkované populaci oproti populaci neočkované. Vakcína podaná v této věkové skupině vykazuje vysokou protektivní efektivitu a vedle účinného screeningu představuje další významný nástroj moderní lékařské péče v prevenci nádorových onemocnění.
Seznam použité literatury
- [1] Winer RL, Lee SK, Hughes JP, et al. Genital human papillomavirus infection: incidence and risk factors in a cohort of female university students. Am J Epidemiol 2003; 157: 218–226.
- [2] Brown DR, Shew ML, Qadadri B, et al. A longitudinal study of genital human papillomavirus infection in a cohort of closely followed adolescent women. J Infect Dis 2005; 191: 182–192.
- [3] Richardson H, Kelsall G, Tellier P, et al. The natural history of type-specific human papillomavirus infections in female university students. Cancer Epidemiol Biomarkers Prev 2003; 12: 485–490.
- [4] Moscicki AB, Shiboski S, Hills NK, et al. Regression of low-grade squamous intra-epithelial lesions in young women. Lancet 2004; 364: 1678–1683.
- [5] Mu~noz N, Méndez F, Posso H, et al. Instituto Nacional de Cancerologia HPV Study Group. Incidence, duration, and determinants of cervical human papillomavirus infection in a cohort of Colombian women with normal cytological results. J Infect Dis 2004; 190: 2077–2087.
- [6] Smith EM, Johnson SR, Ritchie JM, et al. Persistent HPV infection in postmenopausal age women. Int J Gynecol Obstet 2004; 87: 131–137.
- [7] Kjaer S, Hogdall E, Frederiksen K, et al. The absolute risk of cervical abnormalities in high-risk human papillomavirus-positive, cytologically normal women over a 10-year period. Cancer Res 2006; 66: 10630–10636.
- [8] Naucler P, Ryd W, Törnberg S, et al. HPV type-specific risks of high-grade CIN during 4 years of follow-up: a population-based prospective study. Br J Cancer 2007; 97: 129–132.
- [9] Castle PE, Fetterman B, Poitras N, et al. Five-year experience of human papillomavirus DNA and Papanicolaou test cotesting. Obstet Gynecol 2009; 113: 595–600.
- [10] Herrero R, Castellsagué X, Pawlita M, et al. Human papillomavirus and oral cancer: the International Agency for Research on Cancer multicenter study. J Natl Cancer Inst 2003; 95: 1772–1783.
- [11] World Health Organization. The current status of development of prophylactic vaccines against human papillomavirus infection. Report of a technical meeting; 1999.