Hyperaktivní močový měchýř – možnosti léčby v roce 2012
Syndrom hyperaktivního močového měchýře (OAB) má v celosvětové populaci starší 40 let věku prevalenci okolo 17 %. Se zvyšujícím se věkem jeho prevalence stoupá. Postiženým mužům a ženám signifikantně zhoršuje kvalitu života. Vzhledem k vysoké incidenci, která takřka dvojnásobně převyšuje např. incidenci diabetu mellitu, představuje velký problém nejen medicínský, ale i společensko-ekonomický. Farmakoterapie by měla být zahájena až po komplexním vyšetření a měla by být spojena s úpravou životního stylu a dietními opatřeními. Zlatým standardem farmakoterapie jsou léky s anticholinergním účinkem, dle charakteru obtíží podávané v monoterapii nebo v kombinaci s jiným preparátem. Léčba OAB má stále jisté limity, zejména nežádoucí účinky neselektivních preparátů často vedou k jejímu přerušení. Při nedostatečné odpovědi na farmakologickou léčbu je možno přistoupit k miniinvazivní léčbě aplikací botulotoxinu do stěny detruzoru. Pokud ani tato léčba nezajistí adekvátní efekt, připadá v úvahu terapie chirurgická.
Úvod
Hyperaktivní močový měchýř (overactive bladder, OAB) je syndrom zahrnující soubor multifaktoriálních symptomů poukazujících na dysfunkci dolních cest močových. Mezinárodní společnost pro kontinenci (International Continence Society, ICS) definuje OAB jako soubor příznaků charakterizovaný močovými urgencemi s únikem nebo bez úniku ![Obr. 1 Hyperaktivní močový měchýř je syndrom, který zahrnuje soubor příznaků poukazujících na dysfunkci dolních cest močových; podle [49] – Abrams, et al., 2002.](https://www.remedia.cz/photo-a-29024---.jpg) moči, obvykle spojený s častým nucením na močení (polakisurie) a nočním močením (nykturie) [1]. Za klíčový symptom OAB je považována silná urgence. Ostatní symptomy jako frekvence, inkontinence či nykturie se rozvíjejí většinou až sekundárně v závislosti na urgencích. Frekvence znamená podle definice močení častěji než 8krát za 24 hodin. Urgentní inkontinence je definována jako pocit neodkladného nucení na močení doprovázený následným únikem moči. Za noční močení je považována každá mikční epizoda, která přeruší spánek (obr. 1).
moči, obvykle spojený s častým nucením na močení (polakisurie) a nočním močením (nykturie) [1]. Za klíčový symptom OAB je považována silná urgence. Ostatní symptomy jako frekvence, inkontinence či nykturie se rozvíjejí většinou až sekundárně v závislosti na urgencích. Frekvence znamená podle definice močení častěji než 8krát za 24 hodin. Urgentní inkontinence je definována jako pocit neodkladného nucení na močení doprovázený následným únikem moči. Za noční močení je považována každá mikční epizoda, která přeruší spánek (obr. 1).
Kombinace těchto symptomů může být způsobena urodynamicky prokazatelnou hyperaktivitou detruzoru (detrusor overactivity, DO), ale i možnou jinou dysfunkcí dolních cest močových. Za OAB je stav považován pouze tehdy, je-li vyloučena infekce či jiná možná patologie močového ústrojí (nádor, litiáza, cizí těleso).
Prevalence OAB dosahuje v dospělé populaci nad 40 let věku okolo 17 % a postihuje obě pohlaví bez rozdílu, u žen se symptomy hyperaktivního měchýře začínají projevovat dříve než u mužů. Epidemiologické studie jasně prokazují korelaci prevalence OAB s přibývajícím věkem [2, 3]. Ve věku nad 75 let trpí symptomy spojenými s hyperaktivním měchýřem více než 40 % populace. Incidence tohoto syndromu je až dvojnásobná oproti jiným chronickým onemocněním, jako je např. osteoartritida nebo diabetes mellitus. Právě vysoká prevalence dělá z OAB nejen medicínský, ale i společensko-ekonomický problém.
Etiologie OAB je většinou neurogenní (neadekvátní aktivace mikčního reflexu) či myogenní (patologická reakce svalových buněk detruzoru). Sekundárně se může vyskytovat i u mužů se subvezikální obstrukcí zejména na podkladě benigní hyperplazie prostaty (nebo i karcinomu prostaty či striktury uretry). Značnou roli v patofyziologii OAB zaujímá vedle detruzoru i urotel, jehož metabolický obrat je mnohem vyšší a koncentrace muskarinových receptorů v něm je dvakrát hustší, než je tomu u svalových buněk detruzoru. Urotel uvolňuje řadu mediátorů, které ovlivňují tonus stěny močového měchýře.
Léčba symptomů OAB by měla být započata po důkladném vyšetření s použitím všech diagnostických metod (odběr anamnézy, fyzikální a sonografické vyšetření, laboratorní vyšetření moči včetně močové kultivace, mikční deník se záznamem příjmu a výdeje tekutin, uroflowmetrie se stanovením postmikčního rezidua a eventuálně urodynamika). Stěžejní léčebnou modalitou je farmakoterapie. Cílem léčby je potlačení urgencí snížením nadměrné aktivity detruzoru a zvýšení funkční kapacity močového měchýře.
Blokátory muskarinových receptorů/anticholinergika
Močový měchýř je bohatě zásoben parasympatickými vlákny, jejichž mediátorem na postganglionárních muskarinových receptorech je acetylcholin. Anticholinergní antimuskarinové látky, jež jsou používány k terapii OAB, snižují uvolňování acetylcholinu z uroteliálních buněk blokádou muskarinových receptorů urotelu a suburoteliálních myofibroblastů. Jejich vazba na muskarinové receptory blokuje aktivitu acetylcholinu a tím snižují kontrakční aktivitu detruzoru. Jedná se o nekompletní blokádu, protože inervace části vláken hladké svaloviny je nonadrenergní a noncholinergní. Je známo 5 subtypů muskarinových receptorů (M1–M5), které se vyskytují i v jiných částech těla včetně centrální nervové soustavy. V močovém měchýři jsou přítomny subtypy M2 a M3, které působí synergicky – receptory M2 se podílejí na relaxaci detruzoru, receptory M3 na jeho kontrakci. Cholinergní systém vyvolává blokaci relaxace detruzoru přes receptory M2, aktivace receptorů M3 vede přímo ke kontrakci detruzoru. Tato synergie umožňuje kompletní fyziologické vyprazdňování močového měchýře. Právě selektivita k těmto receptorům má zásadní význam v léčbě OAB [4].
Mezi zástupce léků s antimuskarinovým účinkem patří oxybutynin, tolterodin, fesoterodin, solifenacin, darifenacin, trospium či propiverin. Mnoho klinických studií potvrdilo vysokou účinnost a úspěšnost těchto preparátů v léčbě OAB ve srovnání s placebem. První generace antimuskarinik (oxybutynin, propiverin, trospium chlorid) nevykazuje vazebnou specificitu k jednotlivým podtypům muskarinových receptorů, a proto je při jejich podávání možný vyšší výskyt anticholinergních nežádoucích účinků. Antimuskarinika druhé generace (tolterodin, fesoterodin, darifenacin, solifenacin) mají větší tkáňovou selektivitu k muskarinovým receptorům subtypu M3 a M2 ve stěně detruzoru a v buňkách urotelu. Při srovnatelné účinnosti na symptomy OAB mají méně anticholinergních nežádoucích účinků než přípravky první generace.
Oxybutynin
Oxybutynin je historicky nejstarším účinným lékem na trhu. Patří mezi neselektivní anticholinergika se smíšeným spasmolytickým a parasympatolytickým účinkem. Vazbou na receptory M1, M2 a M3 dosahuje vysoké efektivity v redukci epizod urgencí a urgentní inkontinence, patří ale zároveň mezi léky, jejichž podávání je provázeno nejvyšším výskytem nežádoucích vedlejších efektů [5]. Po perorálním podání se oxybutynin v závislosti na příjmu stravy a trávení vstřebává v žaludku a tenkém střevě. V játrech následuje extenzivní „first-pass“ efekt, při kterém je metabolizován na aktivní N-desethyl-oxybutynin (N-DEO), jehož cirkulující hladina je 4–10krát vyšší než hladina původní látky. Nevýhodou oxybutyninu je jeho až 8krát vyšší afinita ke slinným žlázám než k močovému měchýři, způsobující signifikantní incidenci suchosti v ústech. Dalším úskalím v léčbě oxybutyninem je jeho prostupnost hematoencefalickou bariérou, a tudíž možné negativní ovlivnění kognitivních funkcí u geriatrických pacientů.
Při značných nežádoucích účincích perorální léčby oxybutyninem existuje možnost transdermální, rektální či intravezikální aplikace tohoto léku. Při srovnání perorální a transdermální aplikace nebyl prokázán rozdíl v účinnosti preparátu, ale byl zaznamenán signifikantně nižší výskyt vedlejších nežádoucích účinků [6]. Po nalepení náplasti prostupuje oxybutynin do cévního řečiště a obchází efekt prvního průchodu játry. Tím se snižuje koncentrace cirkulujícího aktivního metabolitu N-DEO a zásadně se mění poměr mezi ním a oxybutyninem. Změna tohoto poměru oproti perorální aplikaci výrazně snižuje výskyt a rozsah nežádoucích účinků.
Propiverin
Propiverin je syntetický terciární amin, který působí jako antagonista acetylcholinu na muskarinových receptorech, jako blokátor kalciového kanálu a zároveň působí spasmolyticky na hladkou svalovinu močového měchýře [7]. Je stejně účinný jako tolterodin, je velmi dobře snášen a signifikantně zlepšuje kvalitu života [8]. Suchost v ústech jako typický anticholinergní nežádoucí vedlejší efekt se vyskytuje asi u jedné třetiny pacientů.
Trospium
Trospium chlorid je neselektivní blokátor muskarinových receptorů s převahou spasmolytického účinku [9]. Od ostatních anticholinergik se liší strukturou své molekuly (kvartérní amin). Trospium je relativně hydrofilní a jeho absorpce je pomalá a neúplná. Proto je nutné podávání na lačno alespoň hodinu před jídlem. Potrava s vysokým obsahem tuku negativně ovlivňuje absorpci trospia. Trospium má velkou afinitu k receptorům M1 a M3, méně pak i k receptorům M2. Trospium neprostupuje přes hematoencefalickou bariéru, a tudíž nemá ani negativní vedlejší účinky na centrální nervový systém, ani neovlivňuje kognitivní funkce. Zejména proto se hodí k léčbě OAB u geriatrických pacientů. Vzhledem k odlišným vlastnostem jeho molekuly jej lze k dosažení většího klinického efektu kombinovat s ostatními antimuskariniky. V kompetitivních klinických studiích byla prokázána minimálně stejná účinnost jako u oxybutyninu nebo tolterodinu [10–12].
Tolterodin
Tolterodin je kompetitivním antagonistou antimuskarinových receptorů s vyváženou selektivitou k receptorům M2 a M3 a s větší afinitou k receptorům močového měchýře než slinných žláz. V těle je vázán na plazmatické bílkoviny, zejména na α1-glykoprotein. Krevním řečištěm se dostává do jater, kde dochází k jeho metabolismu na 5-methyl- a následně na 5-hydroxymethyltolterodin, který je jeho farmakologicky nejaktivnějším metabolitem [13]. Více než 75 % metabolitů je vylučováno močí, 17 % stolicí. Méně než 1 % je eliminováno v nezměněné formě. U pacientů s jaterní a renální nedostatečností je poločas eliminace tolterodinu a jeho metabolitů prodloužen, proto je potřeba u těchto nemocných snížit léčebnou dávku na polovinu [14]. Maximální léčebný účinek tolterodinu se projeví do 4 týdnů. Již po prvním týdnu užívání dochází ke snížení výskytu urgencí o 56 % [15]. Výrazně se prodlužují intervaly bez urgencí a snižuje se počet urgentních úniků moči. Jeho efektivita je dobře srovnatelná s efektivitou oxybutyninu [16].
Fesoterodin
Fesoterodin je po perorálním podání rychle a intenzivně hydrolyzován nespecifickými esterázami na 5-hydroxymethyltolterodin. Tento aktivní metabolit je stejný pro tolterodin i fesoterodin, zásadně se ale liší způsob jeho konverze. Fesoterodin na rozdíl od tolterodinu obchází metabolickou cestu jaterního enzymatického systému a jeho účinnost není závislá na metabolismu pacienta [17]. Jen minimálně prostupuje hematoencefalickou bariérou. Oproti placebu byla ve všech sledovaných doménách prokázána jeho vysoká účinnost [16].
Darifenacin
Darifenacin patří do skupiny vysoce selektivních antagonistů receptoru M3. Je přibližně 60krát selektivnější k podtypu M3 než k podtypu M2 a 5krát selektivnější k podtypu M3 než k M1. Tyto vlastnosti jej výrazně odlišují od většiny ostatních preparátů s analogickým účinkem. Je srovnatelně účinný s neselektivními antimuskariniky, vzhledem ke své uroselektivitě má ale lepší bezpečnostní profil [18]. Jeho afinita ke slinným žlázám je asi 9krát nižší než k močovému měchýři, což vysvětluje jeho velmi dobrou snášenlivost a nízký výskyt sucha v ústech.
Solifenacin
Solifenacin sukcinát má ze všech dostupných anticholinergních léčivých látek nejvyšší selektivní afinitu k receptorům M3 v močovém měchýři [19, 20]. Po perorálním užití je solifenacin dobře absorbován, z velké části metabolizován v játrech a jeho absorpce není ovlivněna současným příjmem a složením potravy. Jeho účinnost je vysoká na všechny symptomy OAB a výskyt suchosti v ústech je velmi nízký [21]. Výsledky klinických studií potvrzují signifikantní redukci epizod urgencí a urgentní inkontinence o 66 %, respektive 100 %, a snížení frekvence mikčních epizod o takřka 20 % [22]. Solifenacin je prvním anticholinergikem, u kterého byla zaznamenána a prokázána statisticky významná redukce nykturií, a to u 36,4 % pacientů [20]. Při léčbě geriatrických pacientů nebyl ve srovnání s oxybutyninem prokázán negativní vliv na kognitivní funkce [23].
Nežádoucí účinky anticholinergik
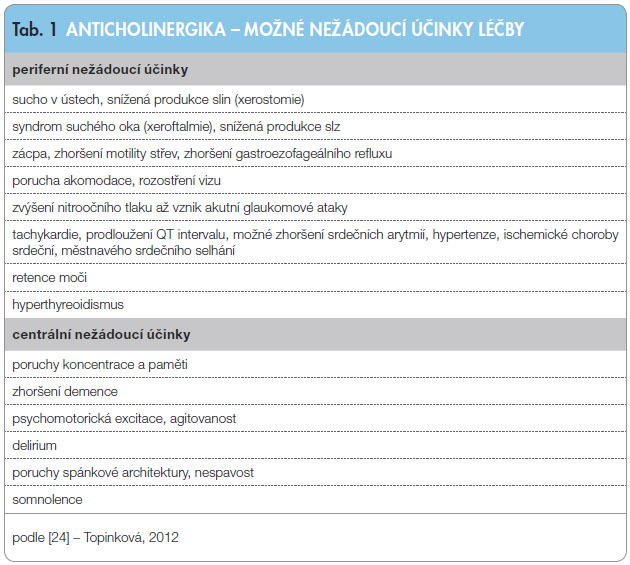 Limitujícím faktorem při léčbě OAB anticholinergními preparáty jsou jejich nežádoucí účinky (tab. 1). Jednotlivá léčiva se liší ve své biologické dostupnosti, schopností procházet hematoencefalickou bariérou a možným zásahem do lékových interakcí. Selektivita a afinita k jednotlivým muskarinovým subtypům a schopnost přechodu hematoencefalickou bariérou ovlivňují a determinují spektrum nežádoucích účinků. Centrální anticholinergní účinky při schopnosti přechodu přes hematoencefalickou bariéru se manifestují závratěmi, zhoršením paměťových funkcí, zmateností, někdy i halucinacemi, poruchami spánku nebo delirantními stavy. Obzvláště závažné mohou být tyto stavy u geriatrických pacientů a pacientů s onemocněním centrálního nervového systému (Parkinsonova choroba, Alzheimerova choroba, demence, stav po cévní mozkové příhodě). Z tohoto pohledu jsou nejrizikovějšími preparáty oxybutynin, propiverin a tolterodin.
Limitujícím faktorem při léčbě OAB anticholinergními preparáty jsou jejich nežádoucí účinky (tab. 1). Jednotlivá léčiva se liší ve své biologické dostupnosti, schopností procházet hematoencefalickou bariérou a možným zásahem do lékových interakcí. Selektivita a afinita k jednotlivým muskarinovým subtypům a schopnost přechodu hematoencefalickou bariérou ovlivňují a determinují spektrum nežádoucích účinků. Centrální anticholinergní účinky při schopnosti přechodu přes hematoencefalickou bariéru se manifestují závratěmi, zhoršením paměťových funkcí, zmateností, někdy i halucinacemi, poruchami spánku nebo delirantními stavy. Obzvláště závažné mohou být tyto stavy u geriatrických pacientů a pacientů s onemocněním centrálního nervového systému (Parkinsonova choroba, Alzheimerova choroba, demence, stav po cévní mozkové příhodě). Z tohoto pohledu jsou nejrizikovějšími preparáty oxybutynin, propiverin a tolterodin.
Receptory M1 jsou zastoupeny zejména v mozku a slinných žlázách. Anticholinergní efekt tedy způsobuje snížení serózní sekrece žláz a tím suchost sliznic, zejména v ústech (xerostomie). Receptory M2 se podílejí na ovlivnění srdečního rytmu a srdečního výdeje a jejich blokace mohou vyvolat poruchy srdečního rytmu (tachyarytmie) a prodloužení QT intervalu. Receptory M3 jsou zastoupeny ve stěně močového měchýře a v gastrointestinálním traktu. Kromě žádoucího efektu, jímž působí na potlačení hyperaktivity močového měchýře, však mohou způsobovat jeho horší vyprazdňování. Zároveň mohou mít i negativní vliv na motilitu střeva a vznik obstipace. Receptory M5 se vyskytují v očních tkáních a ovlivňují kontrakci m. ciliaris. Nežádoucí anticholinergní účinky se projevují jako porucha akomodace s rozostřeným viděním a u pacientů s glaukomem s ostrým úhlem mohou vyvolat glaukomový záchvat. Snížení sekrece slz vede k syndromu suchého oka (xeroftalmie).
Léčba anticholinergiky je kontraindikována u pacientů s glaukomem s uzavřeným úhlem, s onemocněním myasthenia gravis, u pacientů s těžkou jaterní nebo renální insuficiencí, žaludeční retencí, toxickým megacolon, s těžkou ulcerózní kolitidou nebo močovou retencí, u kterých by anticholinergní efekt mohl vést ke zhoršení či k exacerbaci základního onemocnění.
Rozsah a závažnost vedlejších účinků nepříznivě ovlivňuje adherenci pacientů k léčbě a v nemalém procentu vedlejší účinky vedou ke svévolnému ukončení nebo přerušení terapie. V průměru přeruší léčbu po jednom roce užívání medikace 21,4 % mužských pacientů a 13,4 % pacientek [25].
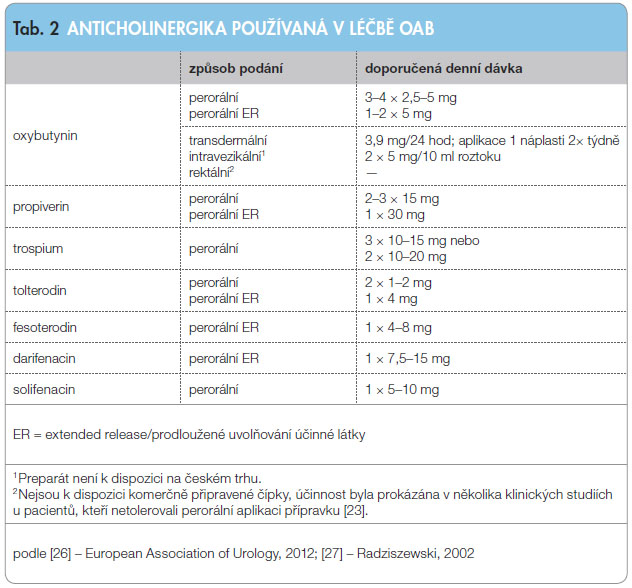 Nežádoucí anticholinergní účinky se dají zredukovat několika způsoby: úpravou užívané dávky léku a tím zlepšením poměru efekt/snášenlivost, změnou lékové formy z perorální na transdermální, rektální nebo intravezikální. Spolu s léky s bezprostředním uvolňováním účinné látky (immediate-release, IR) jsou k dispozici i lékové formy s pomalým (slow-release, SR) nebo prodlouženým (extended-release, ER) uvolňováním účinné látky. Tyto lékové formy zajišťují stabilní 24hodinový efekt v jediné denní dávce oproti lékům s okamžitým uvolňováním léčivé látky, u kterých je potřeba denní dávku rozdělit do několika dílčích dávek (tab. 2). Pomalé nebo prodloužené uvolňování účinné látky částečně redukuje nežádoucí účinky s léčbou spojené a zároveň svým jednoduchým a nenáročným užíváním značně zvyšuje compliance pacientů.
Nežádoucí anticholinergní účinky se dají zredukovat několika způsoby: úpravou užívané dávky léku a tím zlepšením poměru efekt/snášenlivost, změnou lékové formy z perorální na transdermální, rektální nebo intravezikální. Spolu s léky s bezprostředním uvolňováním účinné látky (immediate-release, IR) jsou k dispozici i lékové formy s pomalým (slow-release, SR) nebo prodlouženým (extended-release, ER) uvolňováním účinné látky. Tyto lékové formy zajišťují stabilní 24hodinový efekt v jediné denní dávce oproti lékům s okamžitým uvolňováním léčivé látky, u kterých je potřeba denní dávku rozdělit do několika dílčích dávek (tab. 2). Pomalé nebo prodloužené uvolňování účinné látky částečně redukuje nežádoucí účinky s léčbou spojené a zároveň svým jednoduchým a nenáročným užíváním značně zvyšuje compliance pacientů.
Tricyklická antidepresiva
Imipramin a doxepin jsou tricyklická antidepresiva, jejichž užívání vede ke zmírnění symptomů OAB. Mají centrální a periferní anticholinergní účinek, centrálně vyvolaný sedativní účinek a na presynaptické membráně vychytávající zpětně noradrenalin a serotonin blokují aktivitu transportního systému. Tím napomáhají snižování kontraktility detruzoru a zvyšování výtokové obstrukce. Patří tedy k preparátům zlepšujícím jímací funkci močového měchýře. Limitem léčby těmito preparáty jsou možné anticholinergní vedlejší účinky, sedativní vliv a možnost abstinenčních příznaků po ukončení léčby.
β3-adrenergní agonisté
Jsou známy tři subtypy β-adrenergních receptorů, které jsou přítomny ve svalových vláknech detruzoru. Pokusy in vitro však prokázaly, že pouze aktivita subtypu β3-receptoru je zodpovědná za relaxaci močového měchýře během jímací fáze mikčního cyklu. β3-agonisté zvyšují svým působením kapacitu močového měchýře beze změny mikčního tlaku a objemu reziduální moči [28].
Dne 28. června 2012 oznámil americký úřad FDA (Food and Drug Administration) schválení mirabegronu pro léčbu hyperaktivního močového měchýře u dospělých [29]. Schválení přípravku bylo založeno na bezpečnosti a účinnosti potvrzené třemi dvojitě zaslepenými multicentrickými klinickými studiemi kontrolovanými placebem.
Mirabegron je ze skupiny β3-adrenergních agonistů působících odlišným mechanismem účinku než antimuskarinika [30]. Aktivací β3-adrenergních receptorů relaxuje hladké svalstvo detruzoru během plnící fáze mikčního cyklu. Klinické studie srovnávající mirabegron, tolterodin a placebo potvrdily statisticky signifikantní redukci mikčních frekvencí ve srovnání s placebem. Lepších výsledků bylo dosaženo i u velikosti objemů mikčních porcí, snížení epizod inkontinence, nykturií, urgentní inkontinence a epizod urgencí při léčbě mirabegronem [31]. Tento preparát byl velmi dobře snášen, mezi jeho vedlejší účinky patří bolest hlavy, hypertenze, zánět nosohltanu a gastrointestinální potíže. Během léčby se doporučují pravidelné kontroly krevního tlaku, zvláště u pacientů s hypertenzí. S opatrností by měl být mirabegron podáván u pacientů s klinicky významnou obstrukcí dolních cest močových (bladder outlet obstruction, BOO), byť kontrolované klinické studie neprokázaly zvýšení rizika močové retence u pacientů s BOO. Při současné léčbě digoxinem je třeba monitorovat koncentraci digoxinu v séru a k dosažení požadovaného klinického účinku dávku digoxinu titrovat [32].
Dne 18. října 2012 přijal Výbor pro humánní léčivé přípravky Evropské lékové agentury (Committee for Medicinal Products for Human Use, CHMP) kladné stanovisko doporučující udělení rozhodnutí o registraci preparátu s léčebnou látkou mirabegron [33]. Rozhodnutí o schválení mirabegronu EMA (European Medicines Agency) je netrpělivě očekáváno. Pokud se dočkáme definitivního schválení, bude se po více než třiceti letech od schválení anticholinergně působícího oxybutyninu jednat o léčbu OAB novým mechanismem účinku.
α-adrenergní sympatolytika/alfablokátory
Relaxace vláken hladké svaloviny detruzoru se zvýšením compliance močového měchýře a kontrakce vláken svěrače jsou způsobeny uvolněním noradrenalinu na sympatických nervových zakončeních. Noradrenalin ale také mimo jiné blokuje uvolnění acetylcholinu stimulací α2-adrenergních receptorů na presynaptické membráně. V močovém měchýři převažují za fyziologických okolností β-adrenergní receptory nad receptory a-adrenergními (ob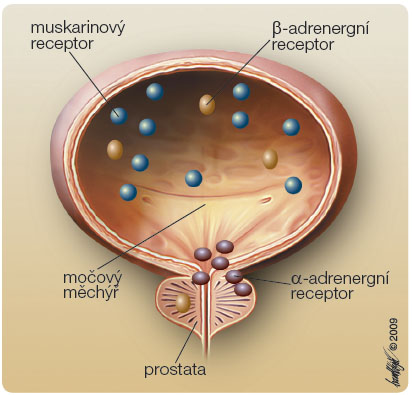 r. 2). U pacientů s hypertrofií detruzoru na podkladě subvezikální obstrukce však dochází ke změně rozložení těchto receptorů – ke snížení výskytu β-adrenergních receptorů způsobujících relaxaci detruzoru a ke zvýšení výskytu α1-adrenoreceptorů vedoucích k hyperaktivitě detruzoru [34]. Adrenergní stimulace může mít proto u takových pacientů paradoxně opačný účinek. Po aktivaci adrenergních receptorů dochází ke kontrakci detruzoru. Alfablokátory užívané k léčbě symptomů dolních cest močových (Lower urinary tract symptoms, LUTS) a benigní hyperplazie prostaty uvolňují obstrukci relaxací buněk hladké svaloviny prostaty a působením v oblasti hrdla měchýře zmírňují potíže s jímáním. Signifikantně zlepšují močový průtok a redukují mikční symptomy [35].
r. 2). U pacientů s hypertrofií detruzoru na podkladě subvezikální obstrukce však dochází ke změně rozložení těchto receptorů – ke snížení výskytu β-adrenergních receptorů způsobujících relaxaci detruzoru a ke zvýšení výskytu α1-adrenoreceptorů vedoucích k hyperaktivitě detruzoru [34]. Adrenergní stimulace může mít proto u takových pacientů paradoxně opačný účinek. Po aktivaci adrenergních receptorů dochází ke kontrakci detruzoru. Alfablokátory užívané k léčbě symptomů dolních cest močových (Lower urinary tract symptoms, LUTS) a benigní hyperplazie prostaty uvolňují obstrukci relaxací buněk hladké svaloviny prostaty a působením v oblasti hrdla měchýře zmírňují potíže s jímáním. Signifikantně zlepšují močový průtok a redukují mikční symptomy [35].
K preparátům dostupným na našem trhu, které našly klinické uplatnění, patří doxazosin, terazosin, alfuzosin, tamsulosin a nejnovější, Evropskou komisí v roce 2010 schválený silodosin. Jejich účinky na dolní cesty močové jsou srovnatelné, zásadně se liší procentem kardiovaskulárních komplikací provázejících léčbu těmito preparáty a výskytem dalších nežádoucích účinků. Mezi uroselektivní blokátory patří alfuzosin, tamsulosin a silodosin, přičemž tamsulosin a silodosin jsou považovány za nejvíce uroselektivní. Účinek léčby se dostavuje za 2–4 týdny a je doporučováno dlouhodobé užívání. Avšak samotná monoterapie alfablokátory u pacientů se sekundární hyperaktivitou detruzoru při obstrukci benigní hyperplazií prostaty vede ke zmírnění symptomů OAB/LUTS jen u jedné třetiny z nich [36].
Z těchto faktů vyplývá, že u pacientů se subvezikální obstrukcí a symptomy OAB je monoterapie alfablokátory málo efektivní a nedostačující. Aktuální terapeutickou modalitou cílenou na oba problémy je kombinace anticholinergik a alfablokátorů. Kombinovanou léčbou dochází ve srovnání s monoterapií ke statisticky signifikantnímu snížení počtu epizod urgencí, urgentní inkontinence a frekvencí při současném zlepšení mikčních parametrů [37, 38]. V kombinované léčbě je možné použít všechny alfablokátory a anticholinergika bez rozdílu jejich lékové formy. Obávané zhoršení vyprazdňovací schopnosti močového měchýře nebo výskyt akutní močové retence jsou minimální.
Použití tamsulosinu v léčbě výrazných symptomů dolních cest močových u žen je po racionálním uvážení možné a bývá i úspěšné. Pozitivní efekt terapie, při níž došlo k signifikantnímu zmírnění udávaných potíží a ke zlepšení kvality života, byl opakovaně popsán [39, 40]. K definitivnímu zhodnocení ale stále chybějí velké randomizované, placebem kontrolované studie.
Inhibitory fosfodiesterázy 5
Látky stimulující tvorbu cyklického guanosinmonofosfátu (cGMP) jsou známy svým účinkem na relaxaci hladkého svalstva včetně detruzoru [41]. Z několika klinických studií hodnotících vliv inhibitorů fosfodiesterázy 5 (PDE5) na jímací, iritační a vyprazdňovací funkce měchýře vyplývá, že část mužů léčených tadalafilem, sildenafilem nebo vardenafilem pro erektilní dysfunkci zaznamenala i zmírnění iritačních a obstrukčních symptomů včetně zlepšení jímací funkce močového měchýře. Zda jsou inhibitory PDE5 efektivní i u žen trpících iritačními symptomy dolních cest močových, není zatím známo.
Estrogeny
U perimenopauzálních a postmenopauzálních pacientek trpících symptomy OAB a urogenitální atrofií je při respektování všech kontraindikací možné léčbu anticholinergiky doplnit o lokálně aplikované estrogeny. Společným embryologickým základem genitálního a uropoetického traktu lze vysvětlit přítomnost ženských steroidních receptorů pro estrogeny i v oblasti močového měchýře a uretry. Jejich koncentrace v dolních močových cestách je mnohonásobně nižší než v endometriu a myometriu uteru, ale i tak je jasná výrazná pozitivní trofická role estrogenu ve stimulaci těchto orgánů. Lokální (vaginální) aplikací estriolu nebo estradiolu dochází ke zlepšení stavu urogenitální sliznice, zlepšení prokrvení v kapilárních plexech kolem uretry a zesílením vrstvy urotelu i ke vzestupu uretrálního uzavíracího tlaku. V rozsáhlých studiích nebyl vliv lokálně aplikovaných estrogenů ve srovnání s placebem jasně prokázán žádnou urodynamickou metodou, subjektivní zmírnění symptomů OAB při jejich dlouhodobém užívání bylo statisticky potvrzeno [42].
Analoga vazopresinu
U pacientů s hyperaktivním močovým měchýřem, které trápí nykturie a u nichž je prokázána primární noční polyurie, je doporučeno léčbu anticholinergiky doplnit i o léčbu desmopresinem. Nykturií trpí zhruba 75 % pacientů s OAB. Obecně se jedná o přerušení spánku z důvodu nucení na močení minimálně dvakrát za noc, čas mezi epizodami močení je vyplněn spánkem. Incidence nykturie je u obou pohlaví stejná, v populaci nad 50 let věku dosahuje asi 50 % [43]. Nutnost nočního močení významně zhoršuje kvalitu života a negativním způsobem narušuje fyziologické procesy organismu. Až ve 40 % případů je příčinou nykturií noční polyurie [44]. O noční polyurii se jedná, vymočí-li pacient více než 30 % celkového denního objemu moči v noci. Základem léčby je úprava denního pitného režimu a farmakoterapie desmopresinem. Desmopresin je syntetický analog fyziologického hormonu vazopresinu. Rozdíl mezi vazopresinem a desmopresinem spočívá ve výrazné afinitě desmopresinu k receptorům V2. Tato afinita zajišťuje selektivitu preparátu v antidiuretických účincích a eliminuje vazokonstrikční efekt na svalové cévy. Perorální aplikace desmopresinu vede ke zvýšené reabsorpci vody ve sběracích kanálcích nefronů bez transportu iontů. Tím dochází k redukci objemu moči a ke zvýšení její osmolarity. Správně načasované podání ve večerních hodinách zaručuje minimalizaci objemu noční diurézy a signifikantní pokles poměru noční a celkové diurézy [45]. Mezi nežádoucí účinky léčby patří bolesti hlavy a hyponatremie, která ale nebývá závažná a není důvodem k přerušení nebo ukončení terapie.
Opatrnosti při léčbě desmopresinem je třeba dbát u pacientů starších 65 let. Při zjištěné hyponatremii u těchto pacientů není vhodné desmopresin podávat. U normonatremických pacientů ve věku nad 65 let se doporučují kontroly sérových hladin iontů 3 dny po zahájení terapie a po každém navýšení dávky. Nejlepší prevencí vzniku hyponatremie je respektování doporučené restrikce objemu tekutin (na cca 0,2 l) jednu hodinu před podáním a 8 hodin po podání desmopresinu.
Limitem léčby je kapacita močového měchýře. U pacientů s kapacitou měchýře menší než 200 ml, nízkou compliance nebo u pacientů postižených sclerosis multiplex nelze očekávat valný efekt léčby [46].
Botulotoxin A
Při selhání veškeré konzervativní a farmakologické léčby OAB lze přistoupit k tzv. miniinvazivní terapii, a to aplikací botulotoxinu do stěny detruzoru [47]. Botulotoxin je produkován anaerobními mikroorganismy rodu Clostridium. Je známo celkem 7 sérotypů botulotoxinů, všechny působí na periferii nervového systému. Na presynaptických nervových zakončeních inhibují uvolňování acetylcholinu, ale i noradrenalinu, serotoninu, dopaminu a GABA. Mají přímý denervační účinek na periferní senzorická vlákna. Proces denervace je reverzibilní postupnou metabolizací neurotoxinu. Botulotoxin patří mezi tzv. AB toxiny. AB neurotoxiny jsou proteiny tvořené dvěma peptidovými řetězci. Tyto řetězce bývají též označovány jako farmakodynamická a farmakokinetická jednotka, jejichž úkolem je zajištění navigace, taxe a následně penetrace přes buněčné membrány k cílovým strukturám. K lékařským účelům se používá čistý botulotoxin A. Podkladem klinické aplikace a jeho využití je dlouhotrvající efekt blokády neuromuskulární junkce a absence cytotoxicity [48].
Cystoskopicky pod kontrolou zraku se submukózně do svalové části močového měchýře tenkou jehlou injikuje 200 (100–300) UI botulotoxinu A, rozdělených do 30–40 dílčích dávek. Efekt této léčby je vysoký. Až 85 % pacientů dosahuje subjektivní spokojenosti s léčbou, u 90 % pacientů je dosaženo kontinence [48]. Objektivně jej lze zdokumentovat snížením počtu mikcí, urgencí či urgentní inkontinence, signifikantním zlepšením sledovaných urodynamických parametrů a v neposlední řadě výrazným zlepšením kvality života dokumentovaným použitím standardizovaných dotazníků. Trvání účinku se pohybuje mezi 4 měsíci a jedním rokem, léčba účinkuje v průměru 9 měsíců, přičemž opakování aplikace je možné bez rizika poklesu účinnosti. Při správné aplikaci je výskyt nežádoucích účinků minimální. Systémové vedlejší účinky jsou zcela výjimečné. Až u jedné třetiny pacientů se může projevit úplná močová inkontinence, která ale netrvá déle než 3 týdny od aplikace. Kontraindikací k aplikaci botulotoxinu A jsou zánět nebo maligní onemocnění močového měchýře, některá plicní onemocnění, tetraplegie, myasthenia gravis a těhotenství nebo kojení.
Elektrostimulace a chirurgická léčba
Do kategorie miniinvazivní terapie OAB spadá i elektrostimulace. Principem elektrostimulace je dráždění nervu zásobujícího určitý sval či svalovou skupinu. Efektivita této metody je zajištěna pouze tehdy, je-li zachována integrita daného nervového zásobení cílové svalové skupiny. Vaginálně či rektálně umístěné elektrody stimulují pomocí elektrických impulzů svalová vlákna ve svém okolí. Stimulací dochází ke stabilizaci hyperaktivní svaloviny detruzoru a zároveň i ke stimulaci kontrakce hladkých svalových vláken uretry. Alternativou k vaginální stimulaci je tzv. Stollerova metoda, kdy je jehlovými elektrodami nad vnitřním kotníkem stimulován n. tibialis z oblasti plexus sacralis, odkud je cestou n. pudendus inervováno svalstvo pánevního dna. Nevýhodou bývá relativně dlouhý interval mezi zahájením terapie a nástupem účinku.
Chirurgická intervence je ireverzibilní a představuje v léčbě OAB krajní možnost. Spočívá buď v augmentaci, nebo v náhradě močového měchýře s příslušnou derivací moči. Při augmentaci je část stěny močového měchýře nahrazena exkludovanou částí střevního segmentu a tím zvětšena kapacita měchýře. Je-li měchýř úplně vyřazen z pasáže moči, je třeba zajistit jinou alternativu derivace. Mezi nejčastější patří ileostomie s vyvedením ureterů do exkludované kličky tenkého střeva, vytvoření neoveziky z exkludované kličky ilea nebo implantace močovodů do rektosigmoidea (ureterosigmoideoanastomóza). Všechny tyto metody mají své limity a znatelně zasahují do života postižených pacientů.
Závěr
Syndrom hyperaktivního močového měchýře a jeho léčba patří vzhledem k celosvětově vysoké prevalenci na přední místo zájmu urologů a urogynekologů. Ke zlatému standardu medikamentózní léčby patří anticholinergika. I přes jejich nízkou uroselektivitu a škálu nežádoucích vedlejších účinků nebyly zatím tyto přípravky na poli farmakoterapeutickém překonány. Jsou očekávány nové preparáty působící uroselektivněji, přes jiné receptory a mediátory nebo na jiné cílové struktury, než je tomu doposud. Zároveň se od nich očekává minimum vedlejších účinků, jednoduché užívání, dobrá snášenlivost a pokud možno žádné interakce s ostatními léky. Budoucnost patří novým, ideálnějším agonistům a antagonistům receptorů tachykininů, vaniloidů, kaliových a kalciových kanálů nebo látek zasahujících do syntézy prostaglandinů. Nejvíce se tomuto horizontu blíží selektivní β3-adrenergní agonista mirabegron. Po jeho definitivním schválení EMA pro evropský trh se tak bude jednat po více než třiceti letech od schválení anticholinergně působícího oxybutyninu o léčbu OAB novým mechanismem účinku.
Seznam použité literatury
- [1] Abrams P, et al. The standardisation of terminology of Lower urinary tract function: Report from the Standardisation Sub-committee of the International Continence Society. Neurourol Urodyn 2002; 21: 167–178.
- [2] Milsom I, et al. How widespread are the symptoms of an overactive bladder and how are they managed? A population-based prevalence study. BJU Int 2001; 87: 760–766.
- [3] Steward WT, et al. Prevalence and burden of overactive bladder in the United States. World J Urol 2003; 20: 327–336.
- [4] Hegde SS. Muscarinic receptors in the bladder: from basic research to therapeutics. Br J Pharmacol 2006; 147 Suppl 2: 80–87.
- [5] Riva O, Casolati E. Oxybutynin chloride in the treatment of female idiopathic bladder instability: results from double blind treatment. Clin Exp Obstet Gynecol 1984; 11: 37–42.
- [6] Davila GW, et al. Transdermal Oxybutynin Study Group. A short-term, multicenter, randomized double-blind dose titration study of the efficacy and anticholinergic side effects of transdermal compared to immediate release oral oxybutynin treatment of patients with urge urinary incontinence. J Urol 2001; 166: 140–145.
- [7] Madersbacher H, et al. Efficacy, tolerability and safety profile of propiverine in the treatment of the overactive bladder (non-neurogenic and neurogenic). World J Urol 2001; 19: 324–335.
- [8] Junemann KP, et al. Propiverine versus tolterodine: efficacy and tolerability in patients with overactive bladder. Eur Urol 2005; 48: 478–482.
- [9] Rovner ES. Trospium chloride in the management of overactive bladder. Drugs 2004; 64: 2433–2446.
- [10] Zinner N, et al. Trospium chloride improves overactive bladder symptoms: a multicenter phase III trial. J Urol 2004; 171: 2311–2315.
- [11] Madersbacher H, et al. Trospium chloride versus oxybutynin: a randomized, double-blind, multicenter trial in the treatment of detrusor hyperreflexia. Br J Urol 1995; 75: 452–456.
- [12] Junemann KP, et al. Efficacy and tolerability of trospium chloride and tolterodine in 234 patients with urge syndrome: a double-blind, placebo--controlled, multicenter, clinical trial. Neurourol Urodyn 2000; 19: 488–490.
- [13] Verner P. Tolterodin. Farmakoterapie 2005; 5: 464–469.
- [14] Pfizer: Tolterodine. Informace firmy Pfizer.
- [15] Siami P, et al. A multicenter, prospective, open label study of tolterodine extended-release 4 mg for overactive bladder: the Speed of Onset of Therapeutic Assessment Trial (STAT). Clin Ther 2002; 24: 616–628.
- [16] Nitti VW, et al. Efficacy and tolerability of tolterodine extended-release in continent patients with overactive bladder and nocturia. BJU Int 2006; 97: 1262–1266.
- [17] Zachoval R. Fesoterodin, nové anticholinergikum pro léčbu hyperaktivního močového měchýře. Urolog pro Praxi 2008; 6: 302–306.
- [18] Chapple CR, et al. The Effects of Antimuscarinic Treatments in Overactive Bladder: An Update of a Systematic Review and Meta-Analysis. Eur Urol 2008; 54: 543–562.
- [19] Nelson CP, et al. Functional selectivity of muscarinic receptor antagonists for inhibition of M3-mediated phosphoinositide responses in guinea pig urinary bladder and submandibular salivatory gland. J Pharmacol Exp Ther 2004; 310: 1255–1265.
- [20] Matoušková M. Solifenacin. Remedia 2009; 19: 170–175.
- [21] Cardozo L, et al. Randomized, double-blind placebo controlled trial of the once daily antimuscarinic agent solifenacin succinate in patients with overactive bladder. J Urol 2004; 172: 1919–1924.
- [22] Chapple CR, et al. Randomised, double-blind placebo- and tolterodine-controlled trial of the once-daily antimuscarinic agent solifenacin in patients with symptomatic overactive bladder. BJU Int 2004; 93: 303–310.
- [23] Wesnes K, et al. Solifenacin is not associated with cognitive impairment or sedation in the elderly: the randomised, double-blind SCOPE study. http://www.icsoffice.org/Abstracts/Publish/46/000185.pdf
- [24] Topinková E. Hyperaktivní měchýř ve stáří a možnosti léčby v primární péči. Med pro Praxi 2012; 9: 20–24.
- [25] Itoh Y, et al. EAU 2010, prezentace na EUREP 2012, Praha, Clarion Hotel.
- [26] European Association of Urology, Pocket Guidelines 2012. Male Lower Urinary Tract Symptoms; 127–128.
- [27] Radziszewski P, et al. Therapeutic effects of intrarectal administration of oxybutynin. Wiad Lek 2002; 55: 691–698.
- [28] Norlen L, et al. Beta-adrenoreceptor stimulation of the human urinary bladder in vivo. Acta Pharmacol Toxicol 1978; 43: 5–10.
- [29] http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm310096.htm
- [30] Yamaguchi O, et al. Antimuscarinics and Overactive Bladder: Other Mechanism of Action. Neurourology and Urodynamics 2010; 29:112–115.
- [31] Chapple CR, et al. Clinical proof of concept study (Blossom) shows novel B3 adrenoreceptor agonist YM178 is effective and well tolerated in the treatment of symptoms of overactive bladder. Eur Urol Suppl 2008; 7 (3, abstract 674): 239.
- [32] Astellas Pharma Inc.: Mirabegron. Informace firmy Astellas.
- [33] http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/002388/ smops/Positive/human_smop_000433.jsp&mid=WC0b01ac058001d127
- [34] Perlberg S, et al. Adrenergic response of bladder muscle in prostatic obstruction. Its relation to detrusor instability. Urology 1982; 20: 524–527.
- [35] Andersson KE. Alpha-adrenoreceptors and benign prostatic hyperplasia: basic principles for treatment with alpha-adrenoreceptor antagonists. World J Urol 2002; 19: 390–396.
- [36] Lee JY, et al. Comparison of doxazosin with or without tolterodine in men with symptomatic bladder outlet obstruction and an overactive bladder. BJU Int 2004; 94: 817–820.
- [37] Kaplan SA, et al. Tolterodine and tamsulosin for treatment of men with lower urinary tract symptoms and overactive bladder: a randomized controlled trial. JAMA 2006; 296: 2319–2328.
- [38] MacDiarmid SA, et al. Efficacy and safety of extended-release oxybutynin in combination with tamsulosin for treatment of lower urinary tract symptoms in men: randomized, double--blind, placebo-controlled study. Mayo Clin Proc 2008; 83: 1002–1010.
- [39] Lee SH, et al. The effect of tamsulosin in female patients with Lower urinary tract symptoms and predictive factors for therapeutic outcome: multicenter, prospective study. http://www.icsoffice.org/Abstracts/Publish/46/000315.pdf
- [40] Chang SJ, et al. The effectiveness of tamsulosin in treating women with voiding difficulty. Int J Urol 2008; 15: 981–985.
- [41] Andersson KE, et al. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiol Rev 2004; 84: 935–986.
- [42] Fantl JA, et al. Estrogen therapy in the management of urinary incontinence in postmenopausal women: a meta-analysis. First report of the Hormones and Urogenital Therapy Comittee. Obstet Gynecol 1994; 83: 12–18.
- [43] Rembratt A, et al. What is nocturnal polyuria? BJU Int 2002; 90 (Suppl 3): 18–20.
- [44] Robinson D. Nocturia in women. Int J Clin Pract Suppl 2007; 155: 23–31.
- [45] Bae JH, et al. The effects of long-term administration of oral desmopressin on the baseline secretion of antidiuretic hormone and serum sodium concentration for the treatment of nocturia: a circadian study. J Urol 2007; 178: 200–203.
- [46] Zahariou A, et al. Maximal bladder capacity is a positive predictor of response to desmopressin treatment in patients with MS and nocturia. Int Urol Nephrol 2008; 40: 65–69.
- [47] Giannantoni A, et al. New therapeutic options for refractory neurogenic detrusor overactivity. Minerva Urol Nefrol 2004; 56: 79–87.
- [48] Leippold T, et al. Botulinum toxin as a new therapy option for voiding disorders: current state of the art. Eur Urol 2003; 44: 165–174.
- [49] Abrams P, et al. The standardisation of terminology of lower urinary tract function: Report from the standardisation sub-commitee of the international continence society. Neurourol Urodyn 2002; 21: 167–168.